- Относительная молекулярная масса P2O5: 141.944524
- Молярная масса P2O5: 141.944524 г/моль (0.14194 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| P (фосфор) | 2 | 30.973762 | 61.947524 |
| O (кислород) | 5 | 15.9994 | 79.997 |
| 141.944524 |
Расчёт молярной и относительной молекулярной массы P2O5
- Mr[P2O5] = Ar[P] * 2 + Ar[O] * 5 = 30.973762 * 2 + 15.9994 * 5 = 141.944524
- Молярная масса (в кг/моль) = Mr[P2O5] : 1000 = 141.944524 : 1000 = 0.14194 кг/моль
Расчёт массовых долей элементов в P2O5
- Массовая доля фосфора (P) = 61.947524 : 141.944524 * 100 = 43.642 %
- Массовая доля кислорода (O) = 79.997 : 141.944524 * 100 = 56.358 %
Калькулятор массы
Лидеры категории
Лена-пена
Искусственный Интеллект
М.И.
Искусственный Интеллект
Y.Nine
Искусственный Интеллект
•••
Вычисление молярной массы
To calculate molar mass of a chemical compound enter its formula and click ‘Compute’. В химической формуле, вы можете использовать:
- Любой химический элемент. Capitalize the first letter in chemical symbol and use lower case for the remaining letters: Ca, Fe, Mg, Mn, S, O, H, C, N, Na, K, Cl, Al.
- Функциональные группы:D, Ph, Me, Et, Bu, AcAc, For, Ts, Tos, Bz, TMS, tBu, Bzl, Bn, Dmg
- круглые () и квадратные [] скобки.
- Общие составные имена.
Примеры расчета молярной массы:
NaCl,
Ca(OH)2,
K4[Fe(CN)6],
CuSO4*5H2O,
water,
nitric acid,
potassium permanganate,
ethanol,
fructose.
Molar mass calculator also displays common compound name, Hill formula, elemental composition, mass percent composition, atomic percent compositions and allows to convert from weight to number of moles and vice versa.
Вычисление молекулярной массы (молекулярная масса)
Для того, чтобы рассчитать молекулярную массу химического соединения, введите её формулу, указав его количество массы изотопа после каждого элемента в квадратных скобках.
Примеры молекулярные вычисления веса:
C[14]O[16]2,
S[34]O[16]2.
Определение молекулярной массы, молекулярный вес, молекулярная масса и молярная масса
- Молекулярная масса ( молекулярной массой ) это масса одной молекулы вещества, выражающаяся в атомных единицах массы (и). (1 и равна 1/12 массы одного атома углерода-12)
- Молярная масса ( молекулярной массой ) является масса одного моля вещества и выражается в г / моль.
Массы атомов и изотопов с NIST статью .
См. также: молекулярные массы аминокислот
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 12 февраля 2021 года; проверки требуют 27 правок.
| Оксид фосфора(V) | |
|---|---|
  |
|
 |
|
| Общие | |
| Систематическое наименование |
Оксид фосфора(V) |
| Традиционные названия | Фосфорный ангидрид; пентаоксид фосфора |
| Хим. формула | P2O5 |
| Рац. формула | P2O5 |
| Физические свойства | |
| Состояние | белый порошок |
| Молярная масса | 141,94 г/моль |
| Плотность | 2.39 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 420оС(Н-форма),569 (О-форма) |
| • кипения | возгоняется при 359 (Н-форма) °C |
| Энтальпия | |
| • образования | -3010,1 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | реагирует |
| Классификация | |
| Рег. номер CAS |
[1314-56-3] (P2O5) [16752-60-6] (P4O10) |
| PubChem | 14812 |
| Рег. номер EINECS | 215-236-1 |
| SMILES |
O=P12OP3(=O)OP(=O)(O1)OP(=O)(O2)O3 |
| InChI |
InChI=1S/O10P4/c1-11-5-12(2)8-13(3,6-11)10-14(4,7-11)9-12 DLYUQMMRRRQYAE-UHFFFAOYSA-N |
| RTECS | TH3945000 |
| ChEBI | 37376 |
| ChemSpider | 14128 и 21428497 |
| Безопасность | |
| Предельная концентрация | 1 мг/м3 |
| ЛД50 | 100-140 мг/кг |
| Токсичность | Класс опасности 2 |
| NFPA 704 |
0 3 3
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Пентаоксид фосфора, также оксид фосфора(V) (фосфорный ангидрид, пятиокись фосфора) — неорганическое химическое соединение класса кислотных оксидов с формулой P2O5. Белый кристаллический порошок, реагирует с водой; ядовит.
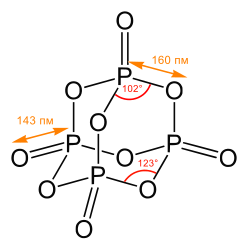
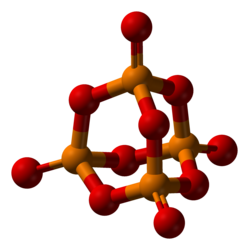
Строение[править | править код]
Пары оксида фосфора(V) имеют состав P2O5. Твёрдый оксид склонен к полиморфизму. Существует в аморфном стекловидном состоянии и кристаллическом. Для кристаллического состояния известны две метастабильные модификации пентаоксида фосфора — гексагональная Н-форма (а = 0,744 нм, = 87°, пространственная группа R3С) и орторомбическая О-форма (а = 0,923 нм, b = 0,718 нм, с = 0,494 нм, пространственная группа Рпат), а также одна стабильная орторомбическая О-форма (а =1,63 нм, b= 0,814 нм, с =0,526 нм, пространственная группа Fdd2). Молекулы P42O105 (Н-форма) построены из 4 групп PO4 в виде тетраэдра, вершины которого занимают атомы фосфора, 6 атомов кислорода располагаются вдоль рёбер, а 4 — по оси третьего порядка тетраэдра. Эта модификация легко возгоняется (360°С) и активно взаимодействует с водой.
Другие модификации имеют слоистую полимерную структуру из тетраэдров PO4, объединённые в 10-членные (О-форма) и 6-членные (О’-форма) кольца. Эти модификации имеют более высокую температуру возгонки (~580°С) и менее химически активны. H-форма переходит в О-форму при 300—360оC.
Свойства[править | править код]
P2O5 очень активно взаимодействует с водой при нагреве (H-форма поглощает воду даже со взрывом), образуя смеси метафосфорных кислот, состав которых зависит от количества воды и других условий:
- При дальнейшем нагреве образует пирофосфорную кислоту:
- На холоде с водой образует метафосфорную кислоту:
При сильном нагревании распадается на:

Он также способен извлекать воду из других соединений, представляя собой сильное дегидратирующее средство:
Оксид фосфора(V) широко применяется в органическом синтезе. Он реагирует с амидами, превращая их в нитрилы:
Карбоновые кислоты переводит в соответствующие ангидриды:
Оксид фосфора(V) также взаимодействует со спиртами, эфирами, фенолами и другими органическими соединениями. При этом происходит разрыв связей P—О—P и образуются фосфорорганические соединения. Реагирует с NH3 и с галогеноводородами, образуя фосфаты аммония и оксигалогениды фосфора:
При сплавлении P4O10 с основными оксидами образует различные твёрдые фосфаты, природа которых зависит от условий реакции.
Оксид активно взаимодействует с водой, поэтому его часто используют в качестве осушителя.
Получение[править | править код]
Оксид фосфора(V) получают сжиганием фосфора в избытке кислорода или воздуха. Технологический процесс происходит в камере сжигания и включает в себя окисление элементарного P предварительно осушенным воздухом, осаждение P2O5 и очистку отходящих газов. Очищают полученный пентаоксид возгонкой.
Технический продукт имеет вид белой снегообразной массы, состоящей из смеси разных форм P4O10.
Основные сферы использования[править | править код]
P2O5 применяют как осушитель газов и жидкостей. Также он является промежуточным продуктом в производстве ортофосфорной кислоты H3PO4 термическим способом.
Широко используется в органическом синтезе в реакциях дегидратации и конденсации.
Физиологическое значение[править | править код]
Пентаоксид фосфора особо токсичен; относится ко второму классу опасности и в высоких концентрациях раздражает кожу и слизистые оболочки глаз.
ПДК в рабочей зоны – 1 мг/м³ (в соответствии с ГОСТ 12.1.005-76).
ЛД50 на крысах и белых мышах при пероральном введении составляет 140 мг/кг.
Литература[править | править код]
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
- Ф. Коттон, Дж. Уилкинсон «Современная неорганическая химия» М.: Мир, 1969
- Зефиров Н.С. и др. т.5 Три-Ятр // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1998. — 783 с. — ISBN 5-85270-310-9.
- Кузьменко, Ерёмин, Попков Начала химии 1 том стр. 364
| п • о • р Оксиды | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H2O | ||||||||||||||||
| Li2O LiCoO2 Li3PaO4 Li5PuO6 Ba2LiNpO6 LiAlO2 Li3NpO4 Li2NpO4 Li5NpO6 LiNbO3 |
BeO | B2O3 | С3О2 C12O9 CO C12O12 C4O6 CO2 |
N2O NO N2O3 N4O6 NO2 N2O4 N2O5 |
O | F | ||||||||||
| Na2O NaPaO3 NaAlO2 Na2PtO3 |
MgO | AlO Al2O3 NaAlO2 LiAlO2 AlO(OH) |
SiO SiO2 |
P4O P4O2 P2O3 P4O8 P2O5 |
S2O SO SO2 SO3 |
Cl2O ClO2 Cl2O6 Cl2O7 |
||||||||||
| K2O K2PtO3 KPaO3 |
CaO Ca3OSiO4 CaTiO3 |
Sc2O3 | TiO Ti2O3 TiO2 TiOSO4 CaTiO3 BaTiO3 |
VO V2O3 V3O5 VO2 V2O5 |
FeCr2O4 CrO Cr2O3 CrO2 CrO3 MgCr2O4 |
MnO Mn3O4 Mn2O3 MnO(OH) Mn5O8 MnO2 MnO3 Mn2O7 |
FeCr2O4 FeO Fe3O4 Fe2O3 |
CoFe2O4 CoO Co3O4 CoO(OH) Co2O3 CoO2 |
NiO NiFe2O4 Ni3O4 NiO(OH) Ni2O3 |
Cu2O CuO CuFe2O4 Cu2O3 CuO2 |
ZnO | Ga2O Ga2O3 |
GeO GeO2 |
As2O3 As2O4 As2O5 |
SeOCl2 SeOBr2 SeO2 Se2O5 SeO3 |
Br2O Br2O3 BrO2 |
| Rb2O RbPaO3 Rb4O6 |
SrO | Y2O3 YOF YOCl |
ZrO(OH)2 ZrO2 ZrOS Zr2О3Сl2 |
NbO Nb2O3 NbO2 Nb2O5 Nb2O3(SO4)2 LiNbO3 |
Mo2O3 Mo4O11 MoO2 Mo2O5 MoO3 |
TcO2 Tc2O7 |
Ru2O3 RuO2 Ru2O5 RuO4 |
RhO Rh2O3 RhO2 |
PdO Pd2O3 PdO2 |
Ag2O Ag2O2 |
Cd2O CdO |
In2O InO In2O3 |
SnO SnO2 |
Sb2O3 Sb2O4 Hg2Sb2O7 Sb2O5 |
TeO2 TeO3 |
I2O4 I4O9 I2O5 |
| Cs2O Cs2ReCl5O |
BaO BaPaO3 BaTiO3 BaPtO3 |
HfO(OH)2 HfO2 |
Ta2O TaO TaO2 Ta2O5 |
WO2Br2 WO2 WO2Cl2 WOBr4 WOF4 WOCl4 WO3 |
Re2O ReO Re2O3 ReO2 Re2O5 ReO3 Re2O7 |
OsO Os2O3 OsO2 OsO4 |
Ir2O3 IrO2 |
PtO Pt3O4 Pt2O3 PtO2 K2PtO3 Na2PtO3 PtO3 |
Au2O AuO Au2O3 |
Hg2O HgO (Hg3O2)SO4 Hg2O(CN)2 Hg2Sb2O7 Hg3O2Cl2 Hg5O4Cl2 |
Tl2O Tl2O3 |
Pb2O PbO Pb3O4 Pb2O3 PbO2 |
BiO Bi2O3 Bi2O4 Bi2O5 |
PoO PoO2 PoO3 |
At | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| La2O2S La2O3 |
Ce2O3 CeO2 |
PrO Pr2O2S Pr2O3 Pr6O11 PrO2 |
NdO Nd2O2S Nd2O3 NdHO |
Pm2O3 | SmO Sm2O3 |
EuO Eu3O4 Eu2O3 EuO(OH) Eu2O2S |
Gd2O3 | Tb | Dy2O3 | Ho2O3 Ho2O2S |
Er2O3 | Tm2O3 | YbO Yb2O3 |
Lu2O2S Lu2O3 LuO(OH) |
||
| Ac2O3 | UO2 UO3 U3O8 |
PaO PaO2 Pa2O5 PaOS |
ThO2 | NpO NpO2 Np2O5 Np3O8 NpO3 |
PuO Pu2O3 PuO2 PuO3 PuO2F2 |
AmO2 | Cm2O3 CmO2 |
Bk2O3 | Cf2O3 | Es | Fm | Md | No | Lr |
Молекулярный вес P2O5
141.9445 g/mol
Молярная масса и молекулярный вес P2O5 равно 141,944.
Структура P2O5
| Элемент | Символ | Атомная масса | # атомов | Процент массы |
|---|---|---|---|---|
| Фосфор | P | 61.9475 g/mol | 2 | 43.6421% |
| Кислород | O | 79.997 g/mol | 5 | 56.3579% |
P2O5 Элемент Процент массыКислород79.997gКислород79.997gФосфор61.9475gФосфор61.9475g
P2O5 # атомовКислород5Кислород5Фосфор2Фосфор2
Инструкции
Эта программа вычислит молекулярную массу вещества. Введите молекулярную формулу вещества. Это вычислит общую массу в соответствии с элементным составом и массой всех элементов в соединении.
- Используйте заглавные символы для начального знака элемента и строчные символы для второго знака. Примеры: Fe, Au, Co, Br, C, O, N, F.
- Вы можете использовать круглые () и квадратные скобки [].
Примеры
- SO9999
- Li2H2SiO4
- C6H6C6H6
- CUO
- Al(No3)3
- C2H2NO2{-}
- C24H46O6
- C9H204
- CUFePO4
- SiLiCONa
- Al2(SO4)3{+}
- 2HPO2
- Последние вычисления молярной массы









