| Сернистая кислота | ||
|---|---|---|
|
||
| Общие | ||
| Систематическое наименование |
Сернистая кислота | |
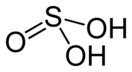
| Хим. формула | H2SO3 | |
| Физические свойства | ||
| Состояние | Жидкость | |
| Молярная масса | 82.07 г/моль | |
| Плотность | 1,03 г/см³ | |
| Химические свойства | ||
Константа диссоциации кислоты  |
1,81 | |
| Растворимость | ||
| • в воде | 14.73 г/100 мл | |
| Классификация | ||
| Рег. номер CAS | 7782-99-2 | |
| PubChem | 1100 | |
| Рег. номер EINECS | 231-973-1 | |
| SMILES |
OS(=O)O |
|
| InChI |
InChI=1S/H2O3S/c1-4(2)3/h(H2,1,2,3) LSNNMFCWUKXFEE-UHFFFAOYSA-N |
|
| ChEBI | 48854 | |
| ChemSpider | 1069 | |
| Безопасность | ||
| Пиктограммы ECB |
|
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Серни́стая кислота́ (химическая формула — H2SO3) — химическая неорганическая кислота средней силы, существующая только в водном растворе. Образуется при растворении диоксида серы в воде.
Её соли и эфиры называются сульфи́тами и ги́дросульфи́тами.
Физические свойства[править | править код]
Сернистая кислота — это двухосновная кислота средней силы. Образуется при растворении диоксида серы в воде. Ввиду неустойчивости не может быть выделена в чистом виде из водных растворов.
Химические свойства[править | править код]
Кислота средней силы:
Существует лишь в разбавленных водных растворах (в свободном состоянии не выделена):
- Баланс реакции лежит далеко слева.
Растворы H2SO3 всегда имеют резкий специфический запах химически не связанного водой SO2.
Двухосновная кислота, образует два ряда солей: кислые — гидросульфиты (в недостатке щёлочи):
и средние — сульфиты (в избытке щёлочи):
Как и сернистый газ, сернистая кислота и её соли являются сильными восстановителями:

При взаимодействии с ещё более сильными восстановителями может играть роль окислителя:
Качественная реакция на сульфит-ионы — обесцвечивание раствора перманганата калия:
Необратимо окисляется кислородом до серной кислоты при +70 °C под давлением и в присутствии сульфата меди (II). Образующийся сульфит меди (II) окисляется кислородом до сульфата меди (II):

Физиологические свойства[править | править код]
Пары сернистой кислоты имеют примерно те же свойства воздействия на организм человека, что и её ангидрид, сернистый газ, — с той только разницей, что концентрация таких паров в случае кислоты будет всегда ниже. Тем не менее, сернистая кислота всегда приводит к стойкому раздражению дыхательных путей, не позволяющему человеку продолжительного пребывания в атмосфере, сколько-нибудь богатой такими парами. При постоянном действии на человека даже разрежённых испарений сернистой кислоты, сразу не производящей заметного раздражения дыхательных органов, всё равно проявляются катаральные воспаления соединительной оболочки глаз, возникают трудности дыхания, расстройство пищеварения, что, в конце концов, приводит к общему упадку сил организма.[1]
Применение[править | править код]
- Восстановитель, для беления шерсти, шелка и других материалов, которые не выдерживают отбеливания с помощью сильных окислителей;
- Консервирование плодов, овощей, винных изделий;
- Осветление фруктовых соков, долгое время производимое при посредстве сернистого газа, на самом деле в своём механизме использует химическое воздействие сернистой кислоты;[2]
Примечания[править | править код]
- ↑ Ф. Ф. Эрисман. «Профессиональная гигиена». Избранные произведения: в 2 т. — М.: Медгиз, 1959 г.
- ↑ И. Н. Вольпер. Сахар: сладкий, горький, соленый — М.: «Химия и жизнь», № 10, 1965 г.
Литература[править | править код]
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4 (Пол-Три). — 639 с. — ISBN 5-82270-092-4.
Random converter
сернистая кислота: состав и молярная масса
Химическая формула
Молярная масса H2SO3, сернистая кислота 82.07908 г/моль
1,00794·2+32,065+15,9994·3
Массовые доли элементов в соединении
| Элемент | Символ | Атомная масса | Число атомов | Массовая доля |
|---|---|---|---|---|
| Hydrogenium | H | 1.00794 | 2 | 2.457% |
| Sulfur | S | 32.065 | 1 | 39.066% |
| Oxygenium | O | 15.9994 | 3 | 58.478% |
Использование калькулятора молярной массы
- Химические формулы нужно вводить с учетом регистра
- Индексы вводятся как обычные числа
- Точка на средней линии (знак умножения), применяемая, например, в формулах кристаллогидратов, заменяется обычной точкой.
- Пример: вместо CuSO₄·5H₂O в конвертере для удобства ввода используется написание CuSO4.5H2O.
Калькулятор молярной массы

Моль
Молярная масса
Молярная масса элементов и соединений
Молекулярная масса
Расчет молярной массы
Моль
Все вещества состоят из атомов и молекул. В химии важно точно измерять массу веществ, вступающих в реакцию и получающихся в результате нее. По определению моль является единицей количества вещества в СИ. Один моль содержит точно 6,02214076×10²³ элементарных частиц. Это значение численно равно константе Авогадро NA, если выражено в единицах моль⁻¹ и называется числом Авогадро. Количество вещества (символ n) системы является мерой количества структурных элементов. Структурным элементом может быть атом, молекула, ион, электрон или любая частица или группа частиц.
Постоянная Авогадро NA = 6.02214076×10²³ моль⁻¹. Число Авогадро — 6.02214076×10²³.
Другими словами моль — это количество вещества, равное по массе сумме атомных масс атомов и молекул вещества, умноженное на число Авогадро. Единица количества вещества моль является одной из семи основных единиц системы СИ и обозначается моль. Поскольку название единицы и ее условное обозначение совпадают, следует отметить, что условное обозначение не склоняется, в отличие от названия единицы, которую можно склонять по обычным правилам русского языка. Один моль чистого углерода-12 равен точно 12 г.
Молярная масса
Молярная масса — физическое свойство вещества, определяемое как отношение массы этого вещества к количеству вещества в молях. Говоря иначе, это масса одного моля вещества. В системе СИ единицей молярной массы является килограмм/моль (кг/моль). Однако химики привыкли пользоваться более удобной единицей г/моль.
молярная масса = г/моль

Горение — высокотемпературная экзотермическая окислительно-восстановительная реакция.
Молярная масса элементов и соединений
Соединения — вещества, состоящие из различных атомов, которые химически связаны друг с другом. Например, приведенные ниже вещества, которые можно найти на кухне у любой хозяйки, являются химическими соединениями:
- соль (хлорид натрия) NaCl
- сахар (сахароза) C₁₂H₂₂O₁₁
- уксус (раствор уксусной кислоты) CH₃COOH
Молярная масса химических элементов в граммах на моль численно совпадает с массой атомов элемента, выраженных в атомных единицах массы (или дальтонах). Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении. Например, молярная масса воды (H₂O) приблизительно равна 1 × 2 + 16 = 18 г/моль.
Молекулярная масса

Молекулярная масса (старое название — молекулярный вес) — это масса молекулы, рассчитанная как сумма масс каждого атома, входящего в состав молекулы, умноженных на количество атомов в этой молекуле. Молекулярная масса представляет собой безразмерную физическую величину, численно равную молярной массе. То есть, молекулярная масса отличается от молярной массы размерностью. Несмотря на то, что молекулярная масса является безразмерной величиной, она все же имеет величину, называемую атомной единицей массы (а.е.м.) или дальтоном (Да), и приблизительно равную массе одного протона или нейтрона. Атомная единица массы также численно равна 1 г/моль.
Расчет молярной массы
Молярную массу рассчитывают так:
- определяют атомные массы элементов по таблице Менделеева;
- определяют количество атомов каждого элемента в формуле соединения;
- определяют молярную массу, складывая атомные массы входящих в соединение элементов, умноженные на их количество.
Например, рассчитаем молярную массу уксусной кислоты
CH₃COOH
Она состоит из:
- двух атомов углерода
- четырех атомов водорода
- двух атомов кислорода
Расчет:
- углерод C = 2 × 12,0107 г/моль = 24,0214 г/моль
- водород H = 4 × 1,00794 г/моль = 4,03176 г/моль
- кислород O = 2 × 15,9994 г/моль = 31,9988 г/моль
- молярная масса = 24,0214 + 4,03176 + 31,9988 = 60,05196 g/mol
Наш калькулятор выполняет именно такой расчет. Можно ввести в него формулу уксусной кислоты и проверить что получится.
Вы затрудняетесь в переводе единицы измерения с одного языка на другой? Коллеги готовы вам помочь. Опубликуйте вопрос в TCTerms и в течение нескольких минут вы получите ответ.
Другие конвертеры
Конвертеры единиц измерения, используемых при измерении скорости передачи данных, в типографике и обработке изображений, для измерения объема лесоматериалов, а также десятичные приставки и калькулятор молярной массы химических соединений
Вычисление молярной массы
Молярная масса — физическое свойство вещества, определяемое как отношение массы этого вещества к количеству вещества в молях, то есть, это масса одного моля вещества.
Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении.
Использование конвертера «Вычисление молярной массы»
На этих страницах размещены конвертеры единиц измерения, позволяющие быстро и точно перевести значения из одних единиц в другие, а также из одной системы единиц в другую. Конвертеры пригодятся инженерам, переводчикам и всем, кто работает с разными единицами измерения.
Пользуйтесь конвертером для преобразования нескольких сотен единиц в 76 категориях или несколько тысяч пар единиц, включая метрические, британские и американские единицы. Вы сможете перевести единицы измерения длины, площади, объема, ускорения, силы, массы, потока, плотности, удельного объема, мощности, давления, напряжения, температуры, времени, момента, скорости, вязкости, электромагнитные и другие.
Примечание. В связи с ограниченной точностью преобразования возможны ошибки округления. В этом конвертере целые числа считаются точными до 15 знаков, а максимальное количество цифр после десятичной запятой или точки равно 10.
Для представления очень больших и очень малых чисел в этом калькуляторе используется компьютерная экспоненциальная запись, являющаяся альтернативной формой нормализованной экспоненциальной (научной) записи, в которой числа записываются в форме a · 10x. Например: 1 103 000 = 1,103 · 106 = 1,103E+6. Здесь E (сокращение от exponent) — означает «· 10^», то есть «…умножить на десять в степени…». Компьютерная экспоненциальная запись широко используется в научных, математических и инженерных расчетах.
Мы работаем над обеспечением точности конвертеров и калькуляторов TranslatorsCafe.com, однако мы не можем гарантировать, что они не содержат ошибок и неточностей. Вся информация предоставляется «как есть», без каких-либо гарантий. Условия.
Если вы заметили неточность в расчётах или ошибку в тексте, или вам необходим другой конвертер для перевода из одной единицы измерения в другую, которого нет на нашем сайте — напишите нам!
Канал Конвертера единиц TranslatorsCafe.com на YouTube
Sulfurous Acid consists of the elements Hydrogen, Sulfur, and Oxygen. Hydrogen is a colorless, odorless, tasteless, and flammable gas. Its atomic number is 1 and is represented with the symbol H. Sulfur is an abundant non-metal present in Group 16 of the periodic table. Its atomic number is 16 and is represented with the symbol S. At room temperature, It appears in bright yellow, crystalline solid form. Oxygen is a highly reactive nonmetal and a good oxidizing agent. It is present in Group 16 of the periodic table. Its atomic number is 8 and is represented by the symbol O.
What is Sulfurous Acid (H2SO3)?
Sulfurous Acid is a colorless, weak inorganic acid with a pungent burning sulfur smell. The chemical formula of Sulfurous Acid is H2SO3.
It is corrosive to metals and tissues. H2SO3 is a sulfur oxoacid, tautomer of a sulfonic acid, and conjugate acid of a Hydrogen sulfite. The other names for Sulfurous Acid are hydrogen thiosulfate, Sulfur dioxide solution, and trioxosulfuric acid. It is an intermediate species to forms Acid rain from SO2 (Sulfur dioxide).
Preparation of Sulfurous Acid (H2SO3)
- Sulfurous Acid (H2SO3) is prepared by dissolving Sulfur dioxide (SO2) in water (H2O). Its chemical reaction of it is given below-
SO2 + H2O ⇢ H2SO3
Structure of Sulfurous Acid (H2SO3)
Sulfurous acid has the chemical formula H2SO3 and a molar mass of 82.07 g/mol. The chemical structure is illustrated in the diagram below. It is made up of one sulfur atom with two single bonds to hydroxyl groups and one double bond to oxygen.

Properties of Sulfurous Acid (H2SO3)
Physical Properties of Sulfurous Acid
- Sulfurous Acid is a colorless liquid.
- The odor of Sulfurous Acid is a pungent odor.
- The molecular weight of Sulfurous Acid is 82.07 g/mol.
- Its Monoisotopic mass is 81.97 g/mol.
- The boiling point of Sulfurous Acid is -60 °C.
- The density of Sulfurous Acid is 1.03 g/mL.
Chemical Properties of Sulfurous Acid
- Sulfurous Acid is unstable and has never been isolated in its pure state. H2SO3 decomposes into Sulfur dioxide and Water. The chemical reaction is given below-
H2SO3 ⇢ SO2+H2O
- Sulfurous Acid when exposed to air turns out to be Sulfuric Acid.
2H2SO3 + O2 ⇢ 2H2SO4
Uses of Sulfurous Acid (H2SO3)
- Sulfurous Acid is used in manufacturing paper products.
- H2SO3 and its salts are used as powerful reducing agents and disinfectants.
- H2SO3 is used as an intermediate in industries.
- Sulfurous Acid is used as a mild bleaching agent for applications having chlorine-sensitive materials.
FAQs on Sulfurous Acid Formula
Question 1: Is Sulfurous Acid a strong acid or weak acid?
Answer:
Unlike sulfuric acid, sulfurous acid is a weak acid because it dissociates partially in water. Here bisulfite ion is comparatively stronger in maintaining a proton when there is a base like water.
Question 2: Determine the molar mass of Sulfurous Acid.
Answer:
Sulfurous Acid consists of 2 Hydrogens, 1 Sulfur and 3 Oxygen atoms.
Atomic weight of each Hydrogen = 1.00784
Atomic weight of sulfur = 32.065
Atomic weight of each Oxygen = 15.999
Molecular weight of H2SO4 = (2 × 1.00784) + 32.065 +(3 × 15.999)
=82.07 g/mol
Question 3: Is Sulfurous Acid hazardous to health?
Answer:
Yes, Sulfurous Acid is dangerous compound. On contact may cause burns and by inhalation it irritate the neck and throat. This compound liberates toxic, corrosive and irritating gases. It also effects reproduction.
Question 4: Sulfurous acid is soluble in water?
Answer:
Sulfurous acid is a colorless liquid soluble in water. It hydrates to sulfuric acid which in turn dissociates into Bisulfite (HSO4–) and sulfite (SO32-) ions.
Question 5: What are the uses of Sulfurous acid?
Answer:
Sulfurous acid is used in manufacturing of paper products. It acts as disinfectant, reducing agent and bleaching agent and also as an electrolyte.
Question 6: Is Sulfurous acid an electrolyte?
Answer:
In Lead acid storage batteries, Sulfurous acid (H2SO3) is used as an electrolyte. It has high electrical conductivity.
Related Article
- Types of Acids
- Sulfuric Acid Formula
- Hyposulfurous Acid Formula
Last Updated :
09 Nov, 2022
Like Article
Save Article
Каждый, кто уже немного продвинулся в изучении химии, сталкивается с понятием «моль». Правда, большинство сразу думает о моли, которая съела за лето шубу в шкафу, но моль в химии – это совсем другая история. И вот сейчас мы в этом разберёмся.
Итак, давайте посмотрим на какую-нибудь химическую реакцию. Например, такую:
Н2+F2=2HF
Здесь 1 молекула водорода H2 реагирует с одной молекулой фтора F2 и получается две молекулы фторида водорода. Напомню, то число молекул или атомов, вступающих в реакцию или получающихся в реакции, определяется коэффициентом, то есть цифрой, стоящей перед формулой вещества. В нашем примере перед водородом не стоит ничего, но на самом деле мы можем поставить здесь единицу, то есть нам нужна 1 молекула водорода. Перед фтором тоже не стоит ничего, значит, нам нужна 1 молекула фтора. А вот перед фторидом водорода HF стоит двойка. Это означает, что у нас получилось 2 молекула фторида водорода. То есть:
Н2 + F2 = 2HF – это то же самое, что и
1 молекула H2 + 1 молекула F2 = 2 молекулы HF.
Но вы знаете, что молекулы так малы, что мы их увидеть не можем. Как же нам считать эти молекулы, вступающие в реакцию? Для этого и ввели понятие МОЛЬ.
Моль – это количество вещества, в котором содержится столько же частиц, сколько атомов содержится в 12 граммах углерода с атомной единицей массы 12.
Это довольно мудрёное определение, но его нужно запомнить. Есть и приятный момент: в одном моле любого вещества содержится число Авогадро частиц. Вот оно, это число:
Такое число представить сложно. Вы только подумайте, миллиард – это 1 000 000 000. А в одном моле частиц 6,02*100 000 000 000 000 000 000 000! (Но чтобы не видеть по ночам кошмаров, просто запомните 6,02*10 в двадцать третьей степени).
Итак, в одном моле любого вещества содержится 6,02*10 в двадцать третьей степени частиц. Но мы же знаем, что атомы разных веществ имеют разное строение, а поэтому и разную массу. Поэтому и массы одного моля у разных веществ различаются. Чтобы разобраться в этом, давайте поедем на дачу и проведём эксперимент.
Мы точно помним, что 1 моль – это всегда одинаковое число частиц (6,02*10 в двадцать третьей степени ). Но в обычной жизни таких чисел нет, поэтому возьмём число поменьше, например, 100. Это будет наш условный экспериментальный моль. Теперь в одну кучу складываем 100 вишен, в другую кучу – 100 груш, в третью – 100 арбузов. Куча – это 1 моль. В каждую кучу мы добросовестно сложили одинаковое число частиц, верно? Но частицы эти разного вида: в одной куче вишни, в другой – груши, в третьей – арбузы. А теперь будем взвешивать. Как вы думаете, будет ли различаться масса 100 вишен, 100 груш и 100 арбузов? Конечно же, будет. При этом обратите внимание: число частиц в каждой куче одинаково, но весят эти кучи по-разному. Почему? Потому что частицы разные!
В химии всё точно так же. Если взять 1 моль водорода, 1 моль кислорода и 1 моль натрия, то масса их будет разной (вспоминаем поездку на дачу). И это важно. Но теперь возникает закономерный вопрос: а как же узнать, какова масса 1 моль водорода, 1 моль кислорода и 1 моль натрия и вообще любого вещества? Для этого вводится понятие молярная масса.
Молярная масса и есть масса 1 моля вещества.
Как её определить? Просто. Это атомная масса или молекулярная масса вещества, которую мы рассчитываем, пользуясь таблицей Менделеева. Молярная масса обозначается буквой М и выражается в г/моль (просто потому, что она показывает сколько граммов вести 1 моль). Примеры из учебника химии.
Пример 1.
Найдите массу одного моля (она же молярная масса) алюминия.
Решаем химию и смотрим в таблицу Менделеева. Видим, что атомная масса алюминия 27. Формула просто вещества алюминия – Al, то есть атом здесь один. Следовательно, молярная масса алюминия совпадает с атомной и равна 27 г/моль.
Пример 2.
Найдите молярную массу фтора.
Фтор у нас в обычных условиях – газ, поэтому молекула фтора состоит из двух атомов и выглядит так: F2. В периодической таблице находим фтор и видим, что его атомная масса 19. Следовательно, молярная масса фтора 2*19=38 г/моль.
Пример 3.
Найдите молярную массу оксида кальция.
Формула оксида кальция СаО. Опять смотрим в таблицу: атомная масса кальция 40, атомная масса кислорода 16. Молярная масса оксида кальция 40+16=56 г/моль.
Пример 4.
Найдите молярную массу оксида кремния.
Формула оксида кремния SiO2. Таблица Менделеева сообщает, что атомная масса кремния 28, кислорода – 16. Будьте внимательны, в этом вопросе подвох! В формуле оксида два атома кислорода, обязательно учтите это, чтобы ответ был верным. И он будет таким: молярная масса оксида кремния 28+16*2=60 г/моль. (16 – масса одного атома кислорода, у нас в формуле их два, поэтому мы и умножили 16 на 2!).
Пример 5.
Сложный пример от репетитора по химии. Но я рекомендую всё-таки вникнуть и разобраться, чтобы прояснить всё окончательно. Итак, ответьте, какова молярная масса серной кислоты.
Здесь придётся сосредоточиться, чтобы не запутаться. Формула серной кислоты H2SO4, то есть у нас имеется:
· 2 атома водорода
· 1 атом серы
· 4 атома кислорода.
Смотрим в периодическую таблицу и определяем атомные массы:
· атомная масса водорода – 1
· атомная масса серы – 32
· атомная масса кислорода – 16.
Переходим к расчёту:
2 атома водорода + 1 атом серы + 4 атома кислорода
2*1 + 1*32 + 4*16
В этом выражении в каждом слагаемом первый множитель – число атомов элемента, второй множитель – атомная масса. Дальше просто математика: 2*1+1*32+4*16=98. И да, молярная масса серной кислоты 98 г/моль.
Уверена, теперь вы различите моль в шкафу и моль в химии. А дальше мы будем разбираться, как взвесить на обычных весах эти моли.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
- Формула: H2O4S или H2SO4
- Относительная молекулярная масса H2O4S: 98.07848
- Молярная масса H2O4S: 98.07848 г/моль (0.09808 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| H (водород) | 2 | 1.00794 | 2.01588 |
| O (кислород) | 4 | 15.9994 | 63.9976 |
| S (сера) | 1 | 32.065 | 32.065 |
| 98.07848 |
Расчёт молярной и относительной молекулярной массы H2O4S
- Mr[H2O4S] = Ar[H] * 2 + Ar[O] * 4 + Ar[S] = 1.00794 * 2 + 15.9994 * 4 + 32.065 = 98.07848
- Молярная масса (в кг/моль) = Mr[H2O4S] : 1000 = 98.07848 : 1000 = 0.09808 кг/моль
Расчёт массовых долей элементов в H2O4S
- Массовая доля водорода (H) = 2.01588 : 98.07848 * 100 = 2.055 %
- Массовая доля кислорода (O) = 63.9976 : 98.07848 * 100 = 65.251 %
- Массовая доля серы (S) = 32.065 : 98.07848 * 100 = 32.693 %