В химии очень часто для расчетов нужно знать молярную массу вещества.
Ничего сложного в ее расчете нет: берется стандартный атомный вес элементов, входящих в молекулу, умножается на количество атомов соответствующего элемента в молекуле и умножается на 1 г/моль, константу молярной массы (это чтобы получить соответствующую размерность (г/моль), так как молярная масса, это, собственно, масса одного моля вещества).
Собственно, стандартные атомные веса можно найти в справочнике Таблица Менделеева. Это и делается в калькуляторе ниже.
Как пользоваться калькулятором? — просто вводим формулу соединения, нажимаем на кнопку «рассчитать» и получаем результат.
Желательно при этом соблюдать стандартную нотацию, например,
C2H5OH,
H2O,
Na2SO4,
причем Na2SO4 надо вводить так, как написано, но не так, как здесь — na2so4, а то появляется неоднозначность при определении элементов.
![]()
Молярная масса соединений
Химическая формула соединения
Точность вычисления
Знаков после запятой: 4
Молярная масса соединения
Файл очень большой, при загрузке и создании может наблюдаться торможение браузера.
Как вычислить молярную массу вещества
Молярная масса вещества – это масса одного моля, то есть такого его количества, в котором находится 6,022*10^23 элементарных частиц – атомов, ионов или молекул. Единица ее измерения – грамм/моль.

Инструкция
Чтобы вычислить молярную массу, вам потребуются лишь таблица Менделеева, элементарные знания по химии и умение производить вычисления, конечно же. Например, широко известное вещество – серная кислота. Оно находит настолько широкое применение в самых разных отраслях промышленности, что по праву носит название «кровь химии». Какова ее молекулярная масса?
Напишите точную формулу серной кислоты: H2SO4. А теперь возьмите таблицу Менделеева и посмотрите, каковы атомные массы всех элементов, входящих в ее состав. Этих элементов три – водород, сера и кислород. Атомная масс водорода равна 1, серы – 32, кислорода – 16. Следовательно, суммарная молекулярная масса серной кислоты, с учетом индексов, равна: 1*2 + 32 + 16*4 = 98 а.е.м (атомных единиц массы).
А теперь давайте вспомним еще одно определение моля: это количество вещества, масса которого в граммах численно равна его массе, выраженной в атомных единицах. Таким образом, получается, что 1 моль серной кислоты весит 98 грамм. Вот такова ее молярная масса. Задача решена.
Предположим, вам заданы такие условия: имеется 800 миллилитров 0,2 молярного раствора (0,2М) какой-то соли, причем известно, что в сухом виде эта соль весит 25 граммов. Требуется вычислить ее молярную массу.
Для начала вспомните определение 1-молярного (1М) раствора. Это раствор, в 1 литре которого содержится 1 моль какого-либо вещества. Соответственно, в 1 литре 0,2М раствора содержалось бы 0,2 моля вещества. Но у вас не 1 литр, а 0,8 литра. Следовательно, фактически вы имеете 0,8*0,2 = 0,16 моля вещества.
А дальше уже все становится проще простого. Если 25 граммов соли по условиям задачи составляют 0,16 моля, какое же количество равно одному молю? Произведя вычисление в одно действие, найдете: 25/0,16 = 156,25 граммов. Молярная масса соли составляет 156,25 грамм/моль. Задача решена.
В подсчетах вы использовали округленные величины атомных весов водорода, серы и кислорода. Если требуется произвести вычисления с большой точностью, округление недопустимо.
Источники:
- молярная масса соли
- Вычисление молярной массы эквивалента
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.

Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).

Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.

Названия солей
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
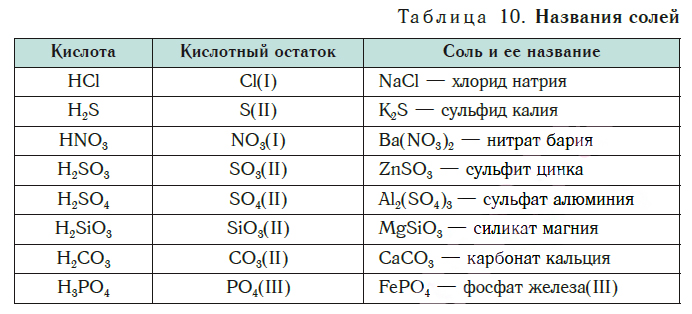
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
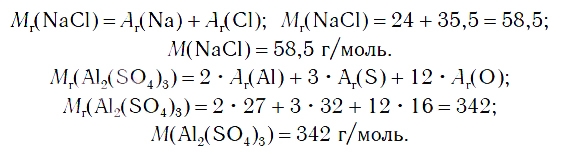
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
МЭ
(соли) = М(соли)/
k .
п,
где М(соли)
– молярная масса соли,
k –
количество атомов металла в молекуле
соли,п – валентность
металла.
Например,
МЭ(Al2SO4)3)
= 342/2 . 3 = 57г /моль.
7.5.Для
определения эквивалента (эквивалентной
массы) элемента необязательно исходить
из его соединения с водородом. Достаточно
знать состав соединения данного элемента
с любым другим, эквивалентная масса
(эквивалент) которого известна, поскольку
– по закону эквивалентов.
7.6.Объем,
занимаемый при данных условиях молярной
эквивалентной массой газообразного
вещества, т.е. 1 молем его
эквивалентов, называетсямолярным
эквивалентным объемом(или кратко
–эквивалентным объемом) этого
вещества, VЭ
(X) = VМ
/k .
п = VМ
/пЭ(X),
где VМ
– объем 1 молялюбого газа
при н.у., равный22,4 л(л/моль);
k
– количество атомов какого-либо
одного элемента в молекуле газа
X;
n –
валентность этого элемента;пЭ(X)
— число эквивалентов газаX
(для молекулы любого газа, как и для
оксидов, пЭ
= k . п,
эквивалентов (Э).
Например, для газообразных
водорода и кислорода: VЭ(Н2)
= 22,4/2 . 1 = 11,2л,пЭ
= 2 эквивалента (Э), Э = ½ моля);
VЭ(О2)
= 22,4/2 . 2 = 5,6 л(пЭ =4Э,
Э = ¼ моля); для углекислого газа:
VЭ(CО2)
= 22,4/4. 1 = 5,6 л/моль (пЭ = 4 Э);
для газа ацетилена: VЭ(C2Н2)
= 22,4/4 . 2 = 2,8 л/моль (пЭ
= 8 Э, Э = 1/8 моля).
3. Закон Авогадро (а. Авогадро, 1811):
В равных
объемах различных газов при одинаковых
условиях (давление, температура)
содержится равное количество молекул:
V1/
V2
= п1/п2
.
3.1.Закон Авогадро постулировалмолекулярныйсостав газов. Известно только шесть
газоватомарногостроения в обычных,
близких к стандартным, условиях – этоблагородные(илиинертные, т.е.нереакционноспособныев таких
условиях) газы, составляющиеVIIIA- подгруппу Периодической
системы: гелий, неон, аргон, криптон,
ксенон и радон.
3.2.В законе
Авогадро, одном из основных законов
идеальных газов и имеющем первостепенное
значение для химии, нашел свое объяснениезакон объемных отношений
(Ж.-Л. Гей-Люссак, 1808):Объемы
вступающих в реакцию газов при одинаковых
давлении и температуре относятся друг
к другу, а также к объемам образующихся
газообразных продуктов как небольшие
целые числа.
3.3.Из закона Авогадро выведено несколько важных следствий:
1. Один моль
любого газа при
одинаковых внешних условиях занимает
один и тот же объем,
называемый молярным объемом
газа, VМ
.
При нормальных
условиях (273,1 К, 101,3 кПа)
VМ
= 22,4 л/моль.
2. В
1 моле любого
газообразного вещества содержится
одинаковое число молекул,
названное числом Авогадро,
NA = 6,022ּ1023моль –1.
В дальнейшем было установлено,
что число Авогадроявляетсяфундаментальной физико-химической
постоянной: эточисло структурных
единиц – частиц (атомов, молекул, ионов,
радикалов, электронов), составляющих
1 моль любого вещества в любом агрегатном
состоянии.
3. Одинаковое
число молекул различных газов
при одинаковых внешних условиях занимает
одинаковый объем: N1/
N2
= V1/
V2.
4. Массы
равных объемов двух газов при
одинаковых внешних условиях относятся
друг к другу как их молярные массы:
m1/m2=M1/
M2 .
Отношение массы
определенного объема одного газа к
массе такого же объема другого газа,
взятых при одинаковых условиях,
называютплотностью первого газа
по второму, D2(1):
D2(1)
= m1/m2
.
Поскольку
m1/m2=M1/
M2
, то иМ1/М2=
D2(1).
Последнее соотношение имеет
большое значение, т.к. позволяетопределить молярную массу
любого газа(М1)
при известной плотности его
по отношению к другому газу, умножив ее
на молярную массу этого газа:
М1=
М2 . D2(1).
Обычно плотность газа определяют
по отношению к водороду (М(Н2)
= 2,016г/моль,) или воздуху (М(возд)
= 29г/моль – это значение считаютсредней молярной массой
воздуха,т.к. воздух является смесью
газов):
М1=
2,016. DН(1)илиМ1 = 29. DВОЗД,(1).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Найдите правильный ответ на вопрос ✅ «Каковы молярные массы поваренной соли NaCL? сульфата меди CuSO4? аммиака NH3? Напишите формулу и объясните, буду признателен! …» по предмету 📘 Физика, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
Главная » Физика » Каковы молярные массы поваренной соли NaCL? сульфата меди CuSO4? аммиака NH3? Напишите формулу и объясните, буду признателен!
