Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 24 апреля 2021 года; проверки требуют 38 правок.
| Угольная кислота | |
|---|---|
  |
|
| Систематическое название | Угольная кислота |
| Химическая формула | H2CO3 |
| Внешний вид | Бесцветный раствор |
| Свойства | |
| Молярная масса | 62,025 г/моль |
| Температура плавления | -80°C |
| Температура кипения | 333,6°C |
| Температура возгонки | ? |
| Температура разложения | ? |
| Температура стеклования | ? |
| Плотность | 1,668 г/см³ |
| Константа диссоциации pKa |
реальные: 1) 3,60; 2) 10,33 кажущаяся[1]: 6,37 |
| Растворимость в воде | 0,21[1] г/100 мл |
| Термодинамические свойства | |
| Стандартная энтальпия образования | −700 кДж/моль |
| Стандартная молярная энтропия | +187 Дж/(К·моль) |
| Стандартная энергия образования Гиббса | −623 кДж/моль |
| Классификация | |
| Регистрационный номер CAS | 463-79-6 |
| PubChem | 463-79-6 |
| Код SMILES | C(=O)(O)O |
| Безопасность | |
| Пиктограммы опасности СГС |
|
| NFPA 704 |
0 0 1 |
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). |
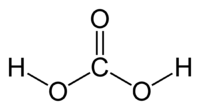
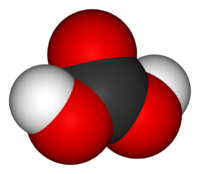
У́гольная кислота́ (химическая формула — H2CO3) — слабая химическая неорганическая кислота. Образуется в малых количествах при растворении углекислого газа в воде[1], в том числе и углекислого газа из воздуха.
При нормальных условиях, угольная кислота неустойчива и разлагается на углекислый газ и воду. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
Физические свойства[править | править код]
Угольная кислота существует в водных растворах в равновесии с диоксидом углерода, причём при нормальных условиях равновесие сильно сдвинуто в сторону разложения кислоты.
Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp2-гибридизацию. В гидрокарбонат- и карбонат-анионах происходит делокализация π-связи. Длина связи C—O в карбонат-ионе составляет 130 пм.
Безводная угольная кислота представляет собой бесцветные кристаллы, устойчивые при низких температурах, сублимирующиеся при температуре –30 °C, а при дальнейшем нагревании полностью разлагающиеся. Поведение чистой угольной кислоты в газовой фазе исследовано в 2011 г. австрийскими химиками[2].
Химические свойства[править | править код]
Равновесие в водных растворах и кислотность[править | править код]
Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода:
, константа равновесия при 25 °C
Скорость прямой реакции 0,039 с−1, обратной — 23 с−1.
В свою очередь растворённый гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода:
Данное равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево (подробнее см. Абсорбция газов).
Угольная кислота подвергается обратимому гидролизу, создавая при этом кислую среду:
, константа кислотности при 25 °C
Однако, для практических расчётов чаще используют кажущуюся константу кислотности, учитывающую равновесие угольной кислоты с гидратом диоксида углерода:
Гидрокарбонат-ион подвергается дальнейшему гидролизу по реакции
, константа кислотности при 25 °C
Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система, которую можно изобразить в общем виде следующим образом:
Значение водородного показателя pH в такой системе, соответствующего насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., можно рассчитать по формуле:
, где C₀ = 0,034 моль/л — растворимость CO2 в воде при указанных условиях.
Разложение[править | править код]
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие смещается в сторону разложения угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
Взаимодействие с основаниями и солями[править | править код]
Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли — карбонаты и гидрокарбонаты соответственно:
(конц.)
(разб.)
При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты:
Получение[править | править код]
Угольная кислота образуется при растворении в воде диоксида углерода:
Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа.
Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода:
Применение[править | править код]
Угольная кислота всегда присутствует в водных растворах углекислого газа (см. «Газированная вода»).
В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора.
Также применяется для производства хладагента, солнечных генераторов и морозильников.
Органические производные[править | править код]
Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот[3].
Некоторые представители подобных соединений перечислены в таблице.
| Класс соединений | Пример соединения |
|---|---|
| Сложные эфиры | поликарбонаты |
| Хлорангидриды | фосген |
| Амиды | мочевина |
| Нитрилы | циановая кислота |
| Ангидриды | пироугольная кислота |
Примечания[править | править код]
- ↑ 1 2 3 В водном растворе бо́льшая часть угольной кислоты обратимо переходит в гидрат диоксида углерода по реакции H2CO3 ⇄ CO2·H2O
- ↑ International first: Gas-phase carbonic acid isolated
- ↑ Нейланд О. Я. Органическая химия. — М.: Высшая школа, 1990. — С. 640—652. — 751 с. — ISBN 5-06-001471-1.
Литература[править | править код]
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2.
- Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — 685 с. — ISBN 5-7107-8085-5.
Random converter
угольная кислота: состав и молярная масса
Химическая формула
Молярная масса H2CO3, угольная кислота 62.02478 г/моль
1,00794·2+12,0107+15,9994·3
Массовые доли элементов в соединении
| Элемент | Символ | Атомная масса | Число атомов | Массовая доля |
|---|---|---|---|---|
| Hydrogenium | H | 1.00794 | 2 | 3.251% |
| Carboneum | C | 12.0107 | 1 | 19.365% |
| Oxygenium | O | 15.9994 | 3 | 77.386% |
Использование калькулятора молярной массы
- Химические формулы нужно вводить с учетом регистра
- Индексы вводятся как обычные числа
- Точка на средней линии (знак умножения), применяемая, например, в формулах кристаллогидратов, заменяется обычной точкой.
- Пример: вместо CuSO₄·5H₂O в конвертере для удобства ввода используется написание CuSO4.5H2O.
Калькулятор молярной массы
Моль
Молярная масса
Молярная масса элементов и соединений
Молекулярная масса
Расчет молярной массы
Моль
Все вещества состоят из атомов и молекул. В химии важно точно измерять массу веществ, вступающих в реакцию и получающихся в результате нее. По определению моль является единицей количества вещества в СИ. Один моль содержит точно 6,02214076×10²³ элементарных частиц. Это значение численно равно константе Авогадро NA, если выражено в единицах моль⁻¹ и называется числом Авогадро. Количество вещества (символ n) системы является мерой количества структурных элементов. Структурным элементом может быть атом, молекула, ион, электрон или любая частица или группа частиц.
Постоянная Авогадро NA = 6.02214076×10²³ моль⁻¹. Число Авогадро — 6.02214076×10²³.
Другими словами моль — это количество вещества, равное по массе сумме атомных масс атомов и молекул вещества, умноженное на число Авогадро. Единица количества вещества моль является одной из семи основных единиц системы СИ и обозначается моль. Поскольку название единицы и ее условное обозначение совпадают, следует отметить, что условное обозначение не склоняется, в отличие от названия единицы, которую можно склонять по обычным правилам русского языка. Один моль чистого углерода-12 равен точно 12 г.
Молярная масса
Молярная масса — физическое свойство вещества, определяемое как отношение массы этого вещества к количеству вещества в молях. Говоря иначе, это масса одного моля вещества. В системе СИ единицей молярной массы является килограмм/моль (кг/моль). Однако химики привыкли пользоваться более удобной единицей г/моль.
молярная масса = г/моль
Горение — высокотемпературная экзотермическая окислительно-восстановительная реакция.
Молярная масса элементов и соединений
Соединения — вещества, состоящие из различных атомов, которые химически связаны друг с другом. Например, приведенные ниже вещества, которые можно найти на кухне у любой хозяйки, являются химическими соединениями:
- соль (хлорид натрия) NaCl
- сахар (сахароза) C₁₂H₂₂O₁₁
- уксус (раствор уксусной кислоты) CH₃COOH
Молярная масса химических элементов в граммах на моль численно совпадает с массой атомов элемента, выраженных в атомных единицах массы (или дальтонах). Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении. Например, молярная масса воды (H₂O) приблизительно равна 1 × 2 + 16 = 18 г/моль.
Молекулярная масса
Молекулярная масса (старое название — молекулярный вес) — это масса молекулы, рассчитанная как сумма масс каждого атома, входящего в состав молекулы, умноженных на количество атомов в этой молекуле. Молекулярная масса представляет собой безразмерную физическую величину, численно равную молярной массе. То есть, молекулярная масса отличается от молярной массы размерностью. Несмотря на то, что молекулярная масса является безразмерной величиной, она все же имеет величину, называемую атомной единицей массы (а.е.м.) или дальтоном (Да), и приблизительно равную массе одного протона или нейтрона. Атомная единица массы также численно равна 1 г/моль.
Расчет молярной массы
Молярную массу рассчитывают так:
- определяют атомные массы элементов по таблице Менделеева;
- определяют количество атомов каждого элемента в формуле соединения;
- определяют молярную массу, складывая атомные массы входящих в соединение элементов, умноженные на их количество.
Например, рассчитаем молярную массу уксусной кислоты
CH₃COOH
Она состоит из:
- двух атомов углерода
- четырех атомов водорода
- двух атомов кислорода
Расчет:
- углерод C = 2 × 12,0107 г/моль = 24,0214 г/моль
- водород H = 4 × 1,00794 г/моль = 4,03176 г/моль
- кислород O = 2 × 15,9994 г/моль = 31,9988 г/моль
- молярная масса = 24,0214 + 4,03176 + 31,9988 = 60,05196 g/mol
Наш калькулятор выполняет именно такой расчет. Можно ввести в него формулу уксусной кислоты и проверить что получится.
Вы затрудняетесь в переводе единицы измерения с одного языка на другой? Коллеги готовы вам помочь. Опубликуйте вопрос в TCTerms и в течение нескольких минут вы получите ответ.
Другие конвертеры
Конвертеры единиц измерения, используемых при измерении скорости передачи данных, в типографике и обработке изображений, для измерения объема лесоматериалов, а также десятичные приставки и калькулятор молярной массы химических соединений
Вычисление молярной массы
Молярная масса — физическое свойство вещества, определяемое как отношение массы этого вещества к количеству вещества в молях, то есть, это масса одного моля вещества.
Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении.
Использование конвертера «Вычисление молярной массы»
На этих страницах размещены конвертеры единиц измерения, позволяющие быстро и точно перевести значения из одних единиц в другие, а также из одной системы единиц в другую. Конвертеры пригодятся инженерам, переводчикам и всем, кто работает с разными единицами измерения.
Пользуйтесь конвертером для преобразования нескольких сотен единиц в 76 категориях или несколько тысяч пар единиц, включая метрические, британские и американские единицы. Вы сможете перевести единицы измерения длины, площади, объема, ускорения, силы, массы, потока, плотности, удельного объема, мощности, давления, напряжения, температуры, времени, момента, скорости, вязкости, электромагнитные и другие.
Примечание. В связи с ограниченной точностью преобразования возможны ошибки округления. В этом конвертере целые числа считаются точными до 15 знаков, а максимальное количество цифр после десятичной запятой или точки равно 10.
Для представления очень больших и очень малых чисел в этом калькуляторе используется компьютерная экспоненциальная запись, являющаяся альтернативной формой нормализованной экспоненциальной (научной) записи, в которой числа записываются в форме a · 10x. Например: 1 103 000 = 1,103 · 106 = 1,103E+6. Здесь E (сокращение от exponent) — означает «· 10^», то есть «…умножить на десять в степени…». Компьютерная экспоненциальная запись широко используется в научных, математических и инженерных расчетах.
Мы работаем над обеспечением точности конвертеров и калькуляторов TranslatorsCafe.com, однако мы не можем гарантировать, что они не содержат ошибок и неточностей. Вся информация предоставляется «как есть», без каких-либо гарантий. Условия.
Если вы заметили неточность в расчётах или ошибку в тексте, или вам необходим другой конвертер для перевода из одной единицы измерения в другую, которого нет на нашем сайте — напишите нам!
Канал Конвертера единиц TranslatorsCafe.com на YouTube
Найди верный ответ на вопрос ✅ «Молярная масса угольной кислоты (Н2 СО3) равна … а) 31 г/моль б) 62 г в) 62 г/моль г) 124 г/мооль …» по предмету 📙 Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Искать другие ответы
Главная » Химия » Молярная масса угольной кислоты (Н2 СО3) равна … а) 31 г/моль б) 62 г в) 62 г/моль г) 124 г/мооль
62.0248 g/mol
The molar mass and molecular weight of H2C(O3) is 62.025.
| Element | Symbol | Atomic Mass | # of Atoms | Mass Percent |
|---|---|---|---|---|
| Hydrogen | H | 2.0159 g/mol | 2 | 3.2501% |
| Carbon | C | 12.0107 g/mol | 1 | 19.3644% |
| Oxygen | O | 47.9982 g/mol | 3 | 77.3855% |
Carbonic Acid Element Mass PercentOxygen47.9982gOxygen47.9982gCarbon12.0107gCarbon12.0107gHydrogen2.0159gHydrogen2.0159g
H2C(O3) # of AtomsOxygen3Oxygen3Hydrogen2Hydrogen2Carbon1Carbon1
Finding Molar Mass
Read our article on how to calculate molar mass.
You can also ask for help in our chat or forums.
Find the Molar Mass of Carbonic Acid, H2C(O3) Step-by-Step
There are 4 easy steps to find the molar mass of H2C(O3) based on its chemical formula.
1. Count The Number of Each Atom
The first step to finding the molar mass of Carbonic Acid is to count the number of each atom present in a single molecule using the chemical formula, H2C(O3):
| Element | Number of Atoms |
|---|---|
| H (Hydrogen) | 2 |
| C (Carbon) | 1 |
| O (Oxygen) | 3 |
2. Find Atomic Mass of Each Element
Next, using the periodic table, find the atomic mass in g/mol of each element (the molar mass of an element is equal to its atomic mass):
| Molar Mass (g/mol) | |
|---|---|
| H (Hydrogen) | 1.00794 |
| C (Carbon) | 12.0107 |
| O (Oxygen) | 15.9994 |
3. Compute Mass of Each Element
Multiply the number of atoms by the atomic weight of each element found in steps 1 and 2 to get the mass of each element in H2C(O3):
| Molar Mass (g/mol) | |
|---|---|
| H (Hydrogen) | 2 × 1.00794 = 2.01588 |
| C (Carbon) | 1 × 12.0107 = 12.0107 |
| O (Oxygen) | 3 × 15.9994 = 47.9982 |
4. Sum Each Element’s Mass
Finally, add together the total mass of each element to get the molar mass of H2C(O3):
2.01588 g/mol + 12.0107 g/mol + 47.9982 g/mol = 62.02478 g/mol
ngelererha832
Вопрос по химии:
Рассчитайте молярную массу угольной кислоты,сульфата алюминия, гидроксида кальция.
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок – бесплатно!
Ответы и объяснения 2
afidlanor356
угольная кислота = 62 г/моль
сульфат алюминия = 342 ш/моль
гидроксид кальция = 74 г/моль
ninertatem847
угольная кислота Н2СО3
сульфат алюминия Al2(SO4)3
гидроксид кальция Са(ОН)2
M(H2CO3) = 1*2 + 12 + 16*3 = 62 г/моль
M(Al2(SO4)3) = 27*2 + 32*3 + 16*12 = 342 г/моль
M(Ca(OH)2) = 40 + 16*2 + 1*2 = 74 г/моль
Знаете ответ? Поделитесь им!
Гость ?
Как написать хороший ответ?
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете
правильный ответ; - Писать подробно, чтобы ответ был исчерпывающий и не
побуждал на дополнительные вопросы к нему; - Писать без грамматических, орфографических и
пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся
уникальные и личные объяснения; - Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не
знаю» и так далее; - Использовать мат – это неуважительно по отношению к
пользователям; - Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует?
Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие
вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи –
смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.


![{displaystyle K_{p}={frac {mathsf {[H_{2}CO_{3}]}}{mathsf {[CO_{2}cdot H_{2}O]}}}=1{,}70cdot 10^{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d37e7cded585ef31bd6c1e0bffe2059cb4c31301)


![{displaystyle K_{a1}={frac {mathsf {[HCO_{3}^{-}]cdot [H_{3}O^{+}]}}{mathsf {[H_{2}CO_{3}]}}}=2{,}5cdot 10^{-4}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/60b755cc59015e8c81c7ef9c5ae032be5d82f54d)
![{displaystyle K_{a}'={frac {mathsf {[HCO_{3}^{-}]cdot [H_{3}O^{+}]}}{mathsf {[CO_{2}cdot H_{2}O]}}}=4{,}27cdot 10^{-7}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a59a9846bcab31633f769c9446951defde2b6250)

![{displaystyle K_{a2}={frac {mathsf {[CO_{3}^{2-}]cdot [H_{3}O^{+}]}}{mathsf {[HCO_{3}^{-}]}}}=4{,}68cdot 10^{-11}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/92eeeb8da9932abda580009c8475b23d9108b697)















