В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса – Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса – Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль – единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) – число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль – международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов – вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается “ню”).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса – M
Молярная масса – масса одного моля вещества, выражается в “г/моль” (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы – массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl – 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково – 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика – лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем – объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как – VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. – константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор – Cl2.


Моль (количество вещества) – самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи – выполнена 🙂

Относительная плотность и газы – D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): “Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества”

Относительная плотность и водный раствор – ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении – так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам “как к числам”, то не запутаетесь.
В ходе ваших действий “грамм” и “грамм” должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 🙂
К примеру, даны масса раствора HCl – 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля – ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах – его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
как узнать молярную массу зная плотность?
fffff ffffff
Ученик
(82),
на голосовании
12 лет назад
Голосование за лучший ответ
Женя
Знаток
(444)
12 лет назад
через уравнение ро=мю: 22.4
Максим Тернавский
Знаток
(477)
12 лет назад
молярная масса=плотность*объем/количество вещества
Похожие вопросы
В ЕГЭ иногда встречаются задачи (часть С последнее задание), где в условии дана относительная плотность вещества по… водороду, кислороду, воздуху, азоту и т.д.
и т.д.
В условии задачи может быть полная формулировка — «относительная плотность (паров)…», а может быть просто «плотность вещества по…»
Дана плотность паров вещества по воздуху, значит, нам подходит формула молярной массы вещества —
Нам дан углеводород — СхHy, значит, мы можем найти Mr(Cx и Mr(Hy). Обратите внимание, именно молярные массы, т.к.у нас несколько атомов углерода и водорода.
Для этого надо молярную массу вещества умножить на процентное содержание элемента:
x=Mr(Cx)Ar(C)=36 гмоль ÷ 12 гмоль =3.
x=Mr(Hy)Ar(H)=6 гмоль ÷ 1 гмоль =6.
Искомое вещество — C3H6 — пропен.
Дана относительная плотность по аргону.
Соотношение х : y2 как 1.5 : 1.5, т.е. y=2x, что соответствует общей формуле алкенов: Cnh3n
Обсуждение: «Относительная плотность по… задачи»
(Правила комментирования)
distant-lessons.ru
Как найти массу через плотность: учащемуся на заметку
#1
Плотность вещества ρ – физическая величина численно равная отношению массы вещества m к объему V, который занимает это вещество. Для однородного вещества плотность определяется формулой ρ =m/V. Плотность разных веществ может существенно отличаться. Например, плотность золота 19,32 г/см3, а плотность дерева бальза, из которого инки изготавливали каноэ, всего около 0,14 г/см3.
#2
Для решения задач по физике из курса средней школы нужно знать, как найти массу через плотность. Чтобы определить массу вещества mс известной плотностью ρ необходимо воспользоваться соотношением m =ρ·V, где V — объем. Плотность веществ ρ можно узнать из справочных таблиц. Объем веществ V, имеющих форму куба, трапеции, конуса, пирамиды, сферы и т. д. вычисляется с помощью геометрических формул.
#3
Приведенной выше формулой можно воспользоваться, чтобы решить задачу, как найти массу зная объем вещества. Если известен объем V, который занимает вещество, то по справочной таблице определяют плотность ρ данного вещества и по формуле m =ρ·Vопределяют массу.Например, масса куба из золота с ребром 2 см равна: 19,320 г/см3·23 см3=19,320·8=154,56 г. Масса такого же по размеру куба из древесины дерева бальза равна: 0,14 г/см3·23 см3=0,14·8=1,12 г.
#4
Зная плотность, легко решить вопрос, как найти массу воды. Плотность воды при нормальном атмосферном давлении (101325 Па) имеет наибольшее значение ρ = 999,973 кг/м3 при температуре 3,98°С, а при температуре 20°С — 998,203 кг/м3. Для расчетов плотность воды принимается равной 1000 кг/м3. Массу воды также определяют по формуле m =ρ·V, следовательно, mводы = ρводы·V = 103· V.
#5
Вопрос как перевести объем в массу решается легко. Это обратная задача для задачи нахождения массы через объем.Для определения массы m вещества, который занимает известный объем V, необходимо плотность вещества ρ (т.е. массу единичного объема) умножить на объем:m =ρ·VНапример, алюминиевый шар объемом 50 см3 имеет массу: 50 см3 · 2,6989 г/см3 = 134,945 г.
#6
Моль – количество вещества, которое содержит столько же молекул или атомов, сколько атомов в 0,012 кг углерода, т.е. число Авогадро NA = 6,022×1023 моль-1. Как рассчитать молярную массу? При нормальных условиях (давление Р = 105 Па, температура Т = 273 К) 1 моль вещества занимает объем Vмол = 22,4×10-3 м3. Следовательно, молярную массу вещества можно рассчитать по формуле: М = ρ× Vмол, где ρ— плотность вещества.Молярная масса вещества M— это масса одного моля.Молярная масса вещества — это отношение массы вещества m к его количеству n: M = m/n грамм/моль
uznay-kak.ru
Формула массы через объем и плотность
Формула для вычисления массы через объем и плотность
Это количество можно определять по-разному. Если речь идет о числе частиц, то говорят о плотности частиц. Эту величину обозначают буквой n. В СИ она измеряется в м-3. Если имеется ввиду масса вещества, то вводят плотность массы. Её обозначают через . В Си измеряется в кг/м3. Между и n существует связь. Так, если тело состоит из частиц одного сорта, то
= m×n,
где m – масса одной частицы.
Плотность массы можно вычислить по формуле:
= m / V.
Данное выражение можно преобразовать так, чтобы получилась формула массы через объем и плотность:
m = ×V.
Таблица 1. Плотности некоторых веществ.
|
Вещество |
Плотность, кг/м3 |
Вещество |
Плотность, кг/м3 |
|
Вещества атомного ядра |
1017 |
Вода |
1,00×103 |
|
Сжатые газы в центре самых плотных звезд |
108 |
Жидкий водород |
0,07×103 |
|
Золото |
1,93×104 |
Воздух у поверхности Земли |
1,2 |
|
Ртуть |
1,36×104 |
Воздух на высоте 20 км |
9×10-2 |
|
Сжатое железо в ядре Земли |
1,2×104 |
Наивысший искусственный вакуум |
10-13 |
|
Сталь |
(7,6 – 7,8)×103 |
Газы межзвездного пространства |
10-20 |
|
Алмаз |
3,53×103 |
Газы межгалактического пространства |
10-26 |
|
Алюминий |
2,7 ×103 |
||
|
Человеческое тело |
1,07 ×103 |
Независимо от степени сжатия плотности жидких и твердых тел лежат в весьма узком интервале значений (табл. 1). Плотности же газов варьируются в весьма широких пределах. Причина заключается в том, что как в твердых телах, так и в жидкостях частицы вплотную примыкают друг к другу. В этих средах расстояние между соседними частицами составляет величину порядка 1 А и сравнимо с размерами атомов и молекул. По этой причине твердые и жидкие тела обладают очень малой сжимаемостью, чем обусловлено малое различие в их плотности. В газах положение иное. Среднее расстояние между частицами значительно превышает их размеры. Например, для воздуха у поверхности Земли оно составляет 10
2 А. Вследствие этого газы обладают большой сжимаемостью, а их плотность может изменяться в очень широких пределах.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
ru.solverbook.com
Ответы@Mail.Ru: как найти массу вещества
Как найти массу вещества
Массу вещества требуется найти во многих задачах. Это можно сделать с помощью специальных формул. Обычно в условии задачи присутствует реакция, с помощью которой находятся некоторые величины.
Инструкция
1. При данном в условии задачи объеме и плотности вычисляйте массу следующим образом: m = V*p, где m – масса, V – объем, p – плотность.
2. В других случаях рассчитывайте массу так: m = n*M, где m – масса, n – количество вещества, M – молярная масса. Молярную массу не трудно подсчитать, для этого нужно сложить все атомные массы простых веществ, входящих в состав сложного (атомные массы указаны в таблице Д. И. Менделеева по обозначение элемента) .
3. Выражайте значение массы из формулы массовой доли вещества: w = m(x)*100%/m, где w – массовая доля вещества, m(x) – масса вещества, m – масса раствора, в котором растворено данное вещество. Чтобы найти массу вещества необходимо: m(x) = w*m/100%.
4. Из формулы выхода продукта вычисляйте нужную вам массу: выход продукта = mp(x)*100%/m(x), где mp(x) – масса продукта x, полученного в реальном процессе, m(x) – рассчитанная масса вещества x. Выводите: mp(x ) = выход продукта* m(x)/100% или m(x) = mp(x)*100%/ выход продукта. При данном в условии задачи выходе продукта эта формула будет необходима. Если выход продукта не дан, то следует считать, что он равен 100%.
5. Если в условии присутствует уравнение реакции, то решайте задачу по нему. Для этого сначала составьте уравнение реакции, затем вычислите из него количества вещества полученного или затраченного для данной реакции и уже это количество вещества подставьте в нужные формулы. Например, Na2SO4 + BaCl2 = BaSO4 + 2NaCl. Известно, что масса BaCl2 равна 10,4 г, нужно найти массу NaCl. Рассчитайте количество вещества хлорида бария: n = m/M. M (BaCl2) = 208 г/моль. n(BaCl2) = 10,4/208 = 0,05 моль. Из уравнения реакции следует, что из 1 моля BaCl2 образовалось 2 моль NaCl. Вычислите какое количество вещества образуется из 0,05 моль BaCl2. n(NaCl) = 0,05*2/1 = 0,1 моль. В задаче же требовалось найти массу хлорида натрия, найдите, предварительно рассчитав молярную массу хлорида натрия. M(NaCl) = 23+35,5 = 58,5 г/моль. m(NaCl) = 0,1*58,5 = 5,85 г. Задача решена.
а потом массу делишь на молярную
touch.otvet.mail.ru
Вычисление молекулярной и молярной массы вещества
Вычисление молекулярной и молярной массы вещества
— Как вычислить молекулярную и молярную массы вещества?
— Моль, молярная масса
Как вычислить молекулярную и молярную массы вещества?
Для этого нужно сложить массы всех атомов в этой молекуле.
Пример 1. В молекуле воды Н2О 2 атома водорода и 1 атом кислорода. Атомная масса водорода = 1, а кислорода = 16. Поэтому молекулярная масса воды равна 1 + 1 + 16 = 18 атомных единиц массы, а молярная масса воды =18 г/моль.
Пример 2. В молекуле серной кислоты Н2SO4 2 атома водорода, 1 атом серы и 4 атома кислорода. Поэтому молекулярная масса этого вещества составит 1 2 + 32 + 4 16 = 98 а.е.м, а молярная масса — 98 г/моль.
Пример 3. В молекуле сульфата алюминия Al2(SO4)3 2 атома алюминия, 3 атома серы и 12 атомов кислорода. Молекулярная масса этого вещества равна 27 · 2 + 32 · 3 + 16 · 12 = 342 а.е.м., а молярная масса — 342г/моль.
Моль, молярная масса
Молярная масса — это отношение массы вещества к количеству вещества, т.е. М(х) = m(x)/n(x), (1)
где М(х) — молярная масса вещества Х, m(x) – масса вещества Х, n(x) — количество вещества Х.
Единица СИ молярной массы — кг/моль,однако обычно используется единица г/моль. Единица массы — г, кг.
Единица СИ количества вещества — моль.
Моль — это такое количество вещества, в котором содержится 6,02·1023 молекул этого вещества.
Любая задача по химии решается через количество вещества. Необходимо помнить основные формулы:
n(x) =m(x)/ М(х)
n(x) = V(x)/Vm
n(x) = N/NA,
или общую формулу: n(x) =m(x)/М(х) = V(x)/Vm = N/NA, (2)
где V(x) – объем вещества Х(л), Vm — молярный объем газа при н.у. (22,4 л/моль), N — число частиц, NA — постоянная Авогадро (6,02·1023).
Пример 1. Определите массу иодида натрия NaI количеством вещества 0,6 моль.
|
Дано: n(NaI)= 0,6 моль. |
Решение Молярная масса иодида натрия составляет: M(NaI)= M(Na) + M(I) = 23 + 127 = 150 г / моль Определяем массу NaI: m(NaI) = n(NaI)·M(NaI) = 0,6 · 150 = 90 г. |
|
Найти: m(NaI) — ? |
Пример 2. Определите количество вещества атомного бора,содержащегося в тетраборате натрия Na2B4O7 массой 40,4 г.
|
Дано: m(Na2B4O7) = 40,4 г. |
Решение Молярная масса тетрабората натрия составляет 202 г/моль. Определяем количество вещества Na2B4O7: n(Na2B4O7) = m(Na2B4O7)/М(Na2B4O7) = 40,4/202 = 0,2 моль. Вспомним, что 1 моль молекулы тетрабората натрия содержит 2 моль атомов натрия, 4 моль атомов бора и 7 моль атомов кислорода (см. формулу тетрабората натрия). Тогда количество вещества атомного бора равно: n(B)= 4 · n(Na2B4O7) = 4 · 0,2 = 0,8 моль. |
|
Найти: n(B) = ? |
examchemistry.com
формула чтобы найти число молей через массу и молярную массу. Пожалуйста дайте формулу завтро экзамен!!!
Моль, молярная масса
В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.
Моль — это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов) , равное постоянной Авогадро
Постоянная Авогадро NA определяется как число атомов, содержащееся в 12 г изотопа 12С:
Таким образом, 1 моль вещества содержит 6,02 • 1023 частиц этого вещества.
Исходя из этого, любое количество вещества можно выразить определенным числом молей ν (ню) . Например, в образце вещества содержится 12,04 • 1023 молекул. Следовательно, количество вещества в этом образце составляет:
В общем виде:
где N – число частиц данного вещества;
NA – число частиц, которое содержит 1 моль вещества (постоянная Авогадро) .
Молярная масса вещества (M) – масса, которую имеет 1 моль данного вещества.
Эта величина, равная отношению массы m вещества к количеству вещества ν, имеет размерность кг/моль или г/моль. Молярная масса, выраженная в г/моль, численно равна относительной относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar).
Например, молярная масса метана Ch5 определяется следующим образом:
Мr(Ch5) = Ar(C) + 4 Ar(H) = 12+4 =16
M(Ch5)=16 г/моль, т. е. 16 г Ch5 содержат 6,02 • 1023 молекул.
Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) ν, по формуле:
Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей:
или найти массу вещества по числу молей и молярной массе:
m = ν • M
Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т. е. зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные массы m.
Пример
Вычислить массы метана Ch5 и этана С2H6, взятых в количестве ν = 2 моль каждого.
Решение
Молярная масса метана M(Ch5) равна 16 г/моль;
молярная масса этана M(С2Н6) = 2 • 12+6=30 г/моль.
Отсюда:
m(Ch5) = 2 моль • 16 г/моль = 32 г;
m(С2Н6) = 2 моль • 30 г/моль = 60 г.
Таким образом, моль – это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т. к. частицы вещества (атомы и молекулы) не одинаковы по массе.
n(Ch5) = n(С2Н6), но m(Ch5) < m(С2Н6)
Вычисление ν используется практически в каждой расчетной задаче.
масса измеряется в граммах, количество вещества в молях, молярная масса в граммах делённых на моль. Ясно что чтобы получить молярную массу надо массу разделить на количество, соответственно количество — это масса делить на молярную массу
1. Количество вещества ν определяется по формуле:
ν = n/NA
ν = NA/N
ν = N/NA
ν = NA/n
затрудняюсь ответить
touch.otvet.mail.ru
Основные формулы для решения задач по химии
05-Авг-2012 | комментариев 450 | Лолита Окольнова
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов). Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Несколько миллионов. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества. Обозначается как M
Есть еще молекулярная масса — Mr
Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 гмоль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=mM
n=V22.4 (лмоль)
Масса вещества m (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (лмоль)
или вот еще удобная табличка:
Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
В ОГЭ и ЕГЭ по химии задач , в которых нужно было бы найти только объем массу кол-во моль нет — это обычно ЧАСТЬ решения задачи. Однако, чтобы легко решать более сложные задачи, нужно тренироваться на таких вот небольших упражнениях.
Находим количество вещества по массе
1 Какое количество вещества алюминия содержится в образце металла массой 10.8 г?2 Какое количество вещества содержится в оксиде серы (VI) массой 12 г?
3 Определите количество моль брома, содержащееся в массе 12.8 г.
Находим массу по количеству вещества:
4. Определите массу карбоната натрия количеством вещества 0.25 моль.Объем по количеству вещества:
5. Какой объем будет иметь азот при н.у., если его количество вещества 1.34 моль?6. Какой объем занимают при н.у. 2 моль любого газа?
Ответы:/p>
- 0.4 моль
- 0.15 моль
- 0.08 моль
- 26.5 г
- 30 л
- 44.8 л
Категории:
|
Обсуждение: “Основные формулы для решения задач по химии”
(Правила комментирования)
Формула массы через плотность и объем является одной из базовых формул физики, изучаемых в рамках школьной программы еще в седьмом классе. Она пригодится в решении многих задач.
Формула зависимости массы от объема и плотности
Для того, чтобы найти плотность жидкости или твердого вещества, существует базовая формула: плотность равна массе, поделенной на объем.
Записывается это так:
ρ = m / V
И из нее можно вывести еще две формулы.
Формулу для объема тела:
V = m / ρ
А также формулу для расчета массы:
m = V * ρ
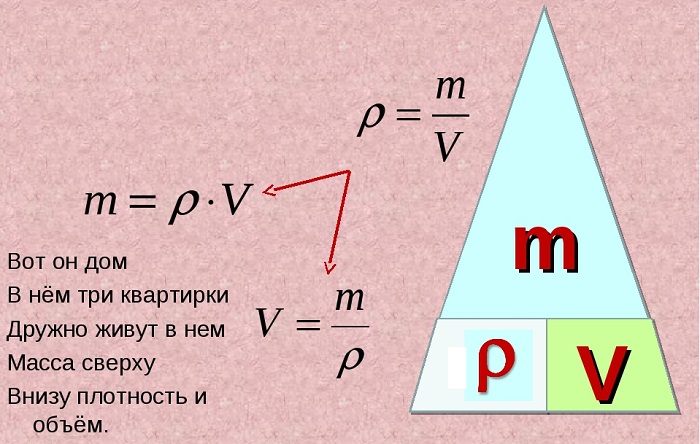
Как видите, запомнить последнюю очень легко: это единственная формула, где две единицы нужно умножить.
Для запоминания этой зависимости можно использовать рисунок в виде «пирамидки», разделенной на три секции, в вершине которой находится масса, а в нижних углах – плотность и объем.
Несколько иначе обстоят дела с газами. Рассчитать их вес гораздо сложнее, так как у газов нет постоянной плотности: они рассеиваются и занимают весь доступный им объем.
Для этого пригодится понятие молярной массы, которую можно найти, сложив массу всех атомов в формуле вещества при помощи данных из периодической таблицы.
Вторая единица, которая нам понадобится – количество вещества в молях. Его можно вычислить по уравнению реакции. Подробнее об этом можно узнать в рамках курса химии.
Другой способ нахождения мольного количества – через объем газа, который нужно поделить на 22,4 литра. Последнее число – это объемная постоянная, которую стоит запомнить.
В итоге, зная две предыдущие величины, мы можем определить массу газа:
m = n * M,
где M – это молярная масса, а n – количество вещества.
Результат получится в граммах, поэтому для решения физических задач важно не забыть перевести его в килограммы, поделив на 1000. Числа в этой формуле часто могут оказываться достаточно сложными, поэтому для вычислений может понадобиться калькулятор.
Еще один нестандартный случай, с которым можно столкнуться – необходимость найти плотность раствора. Для этого существует формула средней плотности, построенная аналогично формулам других средних величин.
Для двух веществ посчитать ее можно так:
(m1 + m2) / V1 + V2.
Также из этой формулы можно вывести несколько других в зависимости от того, какие из величин известны по условию задачи.
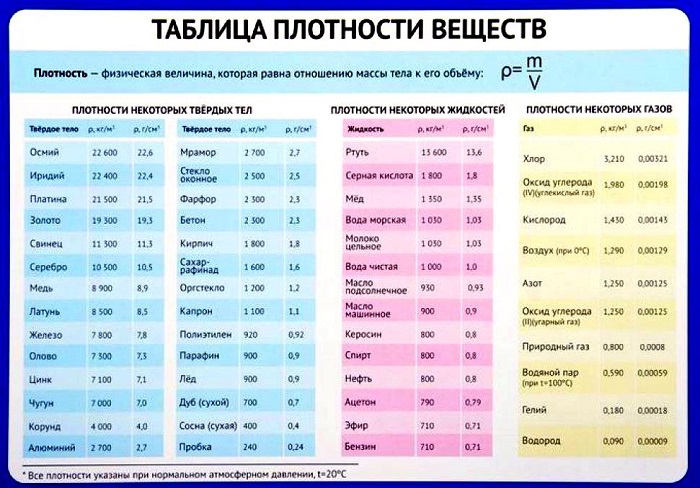
Таблица плотности некоторых веществ
Плотность многих веществ известна заранее и легко находится по соответствующей таблице.
В работе с ней важно обращать внимание на размерности и не забывать о том, что все данные собраны при нормальных условиях: комнатной температуре в 20 градусов Цельсия, а также определенном давлении, влажности воздуха и так далее.
Плотности других, более редких веществ можно найти онлайн.
Как минимум одно из значений плотности стоит запомнить, так как оно часто появляется в задачах. Это плотность воды – 1000 кг/м3 или 1 г/см3.
Примеры решения задач
Задача 1
Условие: имеется алюминиевый брусок со сторонами 3, 5 и 7 сантиметров. Какова его масса?
Решение:
Найдем объем бруска:
V = a * b * c;
V = 3 * 5 * 7 = 105 см3;
Табличное значение плотности алюминия: 2800 кг/м3 или 2,8 г/см3;
Вычислим массу бруска:
m = V * ρ;
m = 105 * 2,8 = 294 г.
Ответ: m = 294 г.
Задача 2
Задача по смежной теме.
Условие: сколько энергии потребуется для того, чтобы довести воду комнатной температуры (20 градусов Цельсия) из стакана (ёмкость 200 мл) до температуры кипения?
Решение:
Найдем недостающую информацию: температура кипения воды t2 = 100 градусов Цельсия, удельная теплоемкость воды с = 4200 Дж/кг * С, плотность воды 1 г/см3, 1 мл воды = 1 см3;
Найдем массу воды:
m = V * ρ;
m = 200 * 1 = 200 г = 0,2 кг;
Найдем энергию:
Q = c * m * (t2 – t1);
Q = 4200 * 0,2 * (100 – 20) = 67200 Дж = 67,2 кДж.
Ответ: Q = 67,2 кДж.
Задача 3
Задача с молярной массой.
Условие: найдите массу CO2 при объеме в 5,6 л.
Решение:
Найдем молярную массу CO2 :
M = 12 + 16 * 2 = 44 г/моль;
Найдем количество вещества через объем:
n = 5,6 / 22,4 = 0,25 моль;
Найдем массу:
m = n * M;
m = 0,25 * 44 = 11 г.
Ответ: m = 11 г.