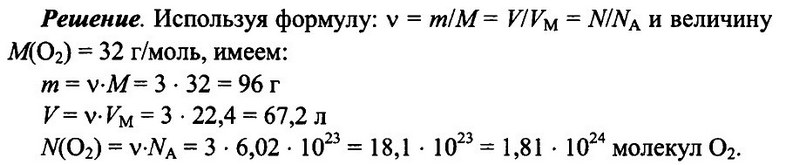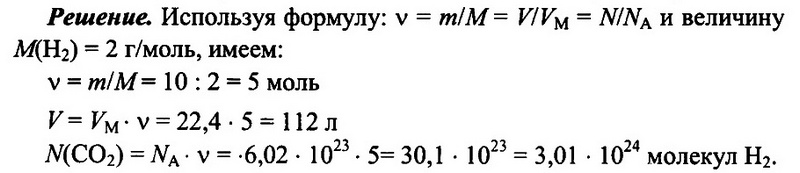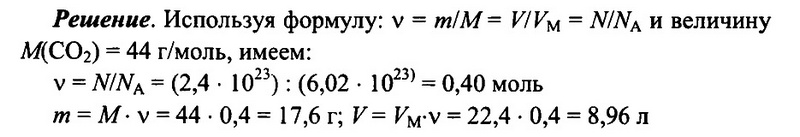Решение задач на количество вещества,
массу и объем
Ключевые слова: решение задач на количество вещества, решение задач по химии на массу и объем, какое количества вещества содержится, какое число молекул содержится, определите объем (н.у.), определите массу, какова масса порции, определите молярную массу, назовите вещество, найдите молярную массу, определите абсолютную массу молекулы, сколько атомов содержится, определите относительную плотность.
ФОРМУЛЫ ДЛЯ РЕШЕНИЯ ЗАДАЧ
Количество вещества характеризует число структурных единиц (атомов, молекул, ионов), которое содержится в определенном образце данного вещества. Единицей измерения количества вещества является моль. Количество вещества (ν) связано с числом структурных единиц (N) в образце вещества, его массой (m) и объемом (V) — для газообразных веществ при н. у. — следующими уравнениями:

Vm = 22,4 л/моль (мл/ммоль, м3/кмоль) при н.у.,
Na = 6,02 • 1023 (постоянная Авогадро),
а молярная масса (М) численно равна относительной молекулярной массе вещества:
Наличие подобной взаимосвязи позволяет, зная одну из величин (количество вещества, массу, объем, число структурных величин) определить все другие величины.
РЕШЕНИЯ ПРОСТЫХ ЗАДАЧ
Задача № 1.
Какое количество вещества содержится в 33 г оксида углерода (IV)?
Ответ: ν(СО2) = 0,75 моль.
Задача № 2.
Какое число молекул содержится в 2,5 моль кислорода?
Ответ: N(O2) = 1,505 • 1024.
Задача № 3.
Определите объем (н. у.), который займут 0,25 моль водорода.
Задача № 4.
Какую массу будет иметь порция оксида серы (IV), объем которой 13,44 л (н. у.)?
Задача № 5.
Имеется 3 моль кислорода О2 при н.у. Определите массу кислорода, его объем, а также число имеющихся молекул кислорода.
Ответ: m = 96 г; V = 67.2 л; N(O2) = 1,81 • 1024.
Задача № 6.
Имеется 10 г водорода Н2. Определите количество водорода, его объем при н.у., а также число имеющихся молекул водорода.
Ответ: 5 моль; 112 л; 3,01 • 1024.
Задача № 7.
Имеется 56 л хлора Сl2 при н.у. Определите количество вещества хлора, его массу и число имеющихся молекул хлора.
Ответ: 2,5 моль; 177,5 г; 1,5 • 1024.
Задача № 8.
Имеется 2,4 • 1023 молекул оксида углерода (IV) СO2. Определите количество вещества углекислого газа, его массу, а также объем (н.у.) углекислого газа.
Ответ: 0,4 моль; 17,6 г; 8,96 л.
Задача № 9.
Какова масса порции оксида азота (IV), содержащей 4,816 • 1023 молекул? Каков ее объем (н. у.)?
Задача № 10.
Масса порции простого вещества, содержащей 1,806 • 1024 молекул, равна 6 г. Определите молярную массу данного вещества и назовите его.
Внимание! В данном конспекте рассматриваются задачи обычной сложности. Чтобы перейти к конспекту решения сложных задач на количественные характеристики и задачи с кратким ответом нажмите на кнопку ниже…
Сложные задачи на количество …
Решение задач на количество вещества, массу и объем. Выберите дальнейшие действия:
- Перейти дальше: Решение задач с долей вещества в смеси, в соединении
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса – Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса – Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль – единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) – число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль – международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов – вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается “ню”).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса – M
Молярная масса – масса одного моля вещества, выражается в “г/моль” (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы – массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl – 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково – 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика – лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем – объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как – VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. – константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор – Cl2.


Моль (количество вещества) – самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи – выполнена 🙂

Относительная плотность и газы – D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): “Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества”

Относительная плотность и водный раствор – ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении – так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам “как к числам”, то не запутаетесь.
В ходе ваших действий “грамм” и “грамм” должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 🙂
К примеру, даны масса раствора HCl – 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля – ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах – его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Добрый день, дорогие друзья начинающие химики. Хочу начать делать разборы простых задач, чтобы потом перейти к более сложным. Для того, чтобы бегать быстрее всех, надо учиться ходить, точно также и в задачах по химии.
Начнем с теории.
Количество вещества (n, [ню]) – представляет собой размерную физическую величину, которая показывает число структурных единиц (атомов, молекул, ионов, электронов) в данной порции вещества.
Единицей количества вещества является моль.
Моль – это количество вещества, содержащие столь же структурных частиц данного вещества, сколько атомов в 12 г. углерода.
Молярная масса – величина равная отношения массы вещества к соответствующему количеству вещества.
Пример 1. Нахождение количества вещества (простого).
Какое количество вещества алюминия содержится в образце этого металла массой 10,8 г?
Пример 2. Нахождение количества вещества (сложного).
Какое количество вещества содержится в оксиде серы (IV), массой 12 г?
Пример 3. Нахождение массы вещества, исходя из количества вещества.
Определите массу Fe2O3, если известно, что его количество вещества равно 0,25 моль.
Потренироваться можно самостоятельно и решить типовые задачи. Из учебника Химия 8 класс О.С. Габрилян стр. 82., номера 1-4
Если ты хочешь больше узнать о том какие еще можно использовать методы при изучении химии подписывайся на мое сообщество в контакте https://vk.com/biochemschoolи в телеграмм https://t.me/biochemschool
Приглашаю желающих 10 января в 20:00 на разбор варианта ЕГЭ по химии в прямом эфире. Ссылка на вебинар: biochemschool.getcourse.ru/webinar
Просмотр содержимого документа
«Задачи на молярную массу»
|
Типовая задача № 1. |
|
|
Д а н о m(р-ра) = 100 г; Найти: w%(ВаСl2) |
Решение: Ответ: w%(ВаСl2)=0,2 или 20% |

|
Типовая задача № 2 . |
|
|
Д а н о m(H2O) = 20 г; Найти: w%(сахара) |
Решение: 2. Вычислим массовую долю сахара в растворе Ответ: w%(сахара)=0,2 или 20% |

|
Типовая задача № 3. |
|
|
Д а н о m(р-ра) = 2кг=2000 г; Найти: m(KN03);m(H2O) |
Решение: 2. Определим массу воды: Ответ:m(KN03)=100г; m(H2O)=1900г |

|
Типовая задача №4. |
|
|
Д а н о m(р-ра) = 71 г; |
Решение: 2. Вычислим массу кристаллогидрата Na2S04·10Н20, необходимого для приготовления раствора: m(Na2S04·10H2O)=322г·14,2г/142г=32,2г 3. Вычислим массу воды; Ответ: для приготовления 71 г раствора надо взять 38,8г H2O и 32,2г Na2S04·10H2O |
|
Типовая задача №5. |
|
|
Д а н о m1(р-ра) = 500 г; |
Решение: 2. Определим процентную концентрацию полученного раствора (масса Li2CO3 при выпаривании не изменилась) Ответ: w2(Li2CO3)= 25% |
|
Типовая задача № 6. |
|
|
Д а н о m1(р-ра) = 250 г; |
Решение: 2. Масса глюкозы при разбавлении не изменяется. Определим массу раствора, полученного после разбавления: 3.Определим w2(глюкозы): Ответ: w2(глюкозы)= 6,25% |

|
Типовая задача № 7. |
|
|
Д а н о V(HCl)=67,2 л |
Решение: 2. Определим массу HCl: 3. Определим массу раствора: 4. Определим массовую долю HCl в растворе: Ответ:w(HCl)= 35,38% |

|
Типовая задача № 8. |
|
|
Д а н о V(р-ра)=500мл, или 0,5 л |
Решение: 2. Определим молярную концентрацию раствора: Ответ:C=0,25моль/л; |

|
Типовая задача № 9. |
|
|
Д а н о V(р-ра)=200мл, или 0,2 л ____________________ |
Решение: 2. Вычислим массу NaCl: Ответ:m(NaCl)=23,4г |

|
Типовая задача № 10. |
|
|
Д а н о ρ(р-ра)=1,08г/мл |
Решение: 3. Найдём сколько моль H2S04 содержится в 129,6г 4. Найдём молярную концентрацию серной кислоты в растворе: Ответ:C(H2S04 )=1,32 моль/л |

|
Типовая задача №11. |
|
|
Д а н о C(KOH)=3,8 моль/л |
Решение: 2. Определим массу КОН в 1 л раствора: 3. Определим массу 1л (1000 мл) раствора: 4. Определим массу едкого кали в растворе: Ответ:w(KOH )=18% |
Количество вещества .
Количество вещества измеряется в молях.
В одном моле любого вещества содержится (6,02 cdot 10^{23} )
частиц (молекул или атомов )
( nu= dfrac{N}{N_А} )
( nu ) – Количество вещества [моль]
( N ) – общее число частиц (молекул или атомов)
( N_А=6,02 cdot 10^{23} dfrac{1}{моль} ) – число Авогадро
( nu= dfrac{m}{M} )
(m) -масса
(M)- молярная масса
Молярная масса – это масса одного моля вещества
Молярную массу можно узнать из таблицы Менделеева
Для этого нужно атомную массу разделить на 1000
Задача 1.
Какое количество вещества ( ; nu ) содержится в стакане , если число молекул воды
в этом стакане ( N=12,04 cdot 10^{23} )
Число Авогадро ( N_А=6,02 cdot 10^{23} dfrac{1}{моль} )
Показать ответ
Показать решение
Видеорешение
Репетитор по физике и математике
8 916 478 10 32
Пройти первый тест на эту тему (5 задач)
Задача 2.
Какое количество вещества ( ; nu ) содержится в стальном предмете , если число атомов
в этом предмете ( N=3,01 cdot 10^{23} )
Число Авогадро ( N_А=6,02 cdot 10^{23} dfrac{1}{моль} )
Показать ответ
Показать решение
Видеорешение
Задача 3.
Какое количество молекул содержится в ( ; nu=0,00001 ) молях воды?
Число Авогадро ( N_А=6,02 cdot 10^{23} dfrac{1}{моль} )
Показать ответ
Показать решение
Видеорешение
Задача 4.
Какое количество атомов содержится в ( ; nu=10^{-20} ) молях гелия?
Число Авогадро ( N_А=6,02 cdot 10^{23} dfrac{1}{моль} )
Показать ответ
Показать решение
Видеорешение
Пройти второй тест на эту тему
Задача 5.
Какое количество вещества содержится в воде массой (m=0,036 кг )?
Молярная масса воды (M=0,018 dfrac{кг}{моль} )
Показать ответ
Показать решение
Видеорешение
Задача 6.
Найти количество вещества, содержащееся в 44 граммах углекислого газа.
Молярная масса углекислого газа (M=0,044 dfrac{кг}{моль} )
Показать ответ
Показать решение
Видеорешение
Задача 7.
Какую массу имеет 1 моль воды?
Молярная масса воды (M=0,018 dfrac{кг}{моль} )
Показать ответ
Показать решение
Видеорешение
Задача 8.
Вычислить массу 100 моль воздуха
Молярная масса воздуха (M=0,029 dfrac{кг}{моль} )
Показать ответ
Показать решение
Видеорешение
Задача 9.
Сколько атомов содержится в алюминиевой кастрюле массой (m=1 ) килограмм
Молярная масса алюминия (M=0,027 dfrac{кг}{моль} )
Число Авогадро ( N_А=6,02 cdot 10^{23} dfrac{1}{моль} )
Показать ответ
Показать решение
Видеорешение
Задача 10.
Сколько молекул содержится в капле воды массой (m=0,05 ) грамм
Молярная масса воды (M=0,018 dfrac{кг}{моль} )
Число Авогадро ( N_А=6,02 cdot 10^{23} dfrac{1}{моль} )
Показать ответ
Показать решение
Видеорешение
Пройти третий тест на эту тему
Задача 11.
Найти массу молекулярного азота, если в нем содержится (N= 10^{23}) молекул
Молярная масса молекулярного азота (M=28 dfrac{г}{моль} )
Число Авогадро ( N_А=6,02 cdot 10^{23} dfrac{1}{моль} )
Ответ дать в граммах.
Показать ответ
Показать решение
Видеорешение
Задача 12.
Найти массу углерода, если в нем содержится (N= 10^{22}) атомов
Молярная масса углерода (M=12 dfrac{г}{моль} )
Число Авогадро ( N_А=6,02 cdot 10^{23} dfrac{1}{моль} )
Ответ дать в граммах.
Ответ округлить до целого числа грамм.
Показать ответ
Показать решение
Видеорешение
Задача 13.
Найти массу алюминиевой детали, если в ней содержится (N= 10^{25}) атомов,
а масса атома алюминия (m_0=44,8 cdot 10^{-27} кг )
Показать ответ
Показать решение
Видеорешение
Задача 14.
Найти массу серебрянного украшения, если количество атомов в нем (N= 10^{23}) ,
а масса атома серебра ( m_0 =1,794 cdot 10^{-25} кг )
Дать ответ в граммах.
Показать ответ
Показать решение
Видеорешение
Задача 16.
Найти массу атома серебра, если молярная масса серебра (M=0,108 dfrac{кг}{моль} )
Число Авогадро ( N_А=6,02 cdot 10^{23} dfrac{1}{моль} )
Показать ответ
Показать решение
Видеорешение