В уроке 5 «Моль и молярная масса» из курса «Химия для чайников» рассмотрим моль как единицу измерения количества вещества; дадим определение числу Авогадро, а также научимся определять молярную массу и решать задачи на количество вещества. Базой для данного урока послужат основы химии, изложенные в прошлых уроках, так что если вы изучаете химию с нуля, то рекомендую их просмотреть хотя бы мельком.

Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.

Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·1023 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·1023 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·1023).

Как уже было сказано, термин «моль» применяется не только к молекулам, но также и к атомам. Например, если вы говорите о моле гелия (He), то это означает, что вы имеет количество равное 6,022·1023 атомов. Точно так же, 1 моль воды (H2O) подразумевает количество равное 6,022·1023 молекул. Однако чаще всего моль применяют именно к молекулам.
Молярная масса вещества
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль). Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
- Молярная масса формула M=m/n
- Количество вещества формула n=m/M
- Число молекул формула N =NA·n
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
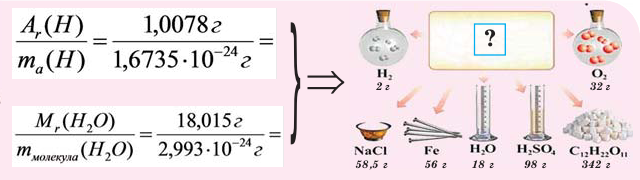
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.

Задачи на количество вещества
Пример 1. Сколько граммов Н2, Н2O, СН3ОН, октана (С8Н18) и газа неона (Ne) содержится в 1 моле?
Решение: Молекулярные массы (в атомных единицах массы) перечисленных веществ приведены в таблице Менделеева. 1 моль каждого из названных веществ имеет следующую массу:

Поскольку массы, указанные в решении примера 1, дают правильные относительные массы взвешиваемых молекул, указанная масса каждого из перечисленных веществ содержит одинаковое число молекул. Этим и удобно использование понятия моля. Нет даже необходимости знать, чему равно численное значение моля, хотя мы уже знаем, что оно составляет 6,022·1023; эта величина называется числом Авогадро и обозначается символом NA. Переход от индивидуальных молекул к молям означает увеличение шкалы измерения в 6,022·1023 раз. Число Авогадро представляет собой также множитель перевода атомных единиц массы в граммы: 1 г = 6,022·1023 а.е.м. Если мы понимаем под молекулярной массой массу моля вещества, то ее следует измерять в граммах на моль; если же мы действительно имеем в виду массу одной молекулы, то она численно совпадает
с молекулярной массой вещества, но выражается в атомных единицах массы на одну молекулу. Оба способа выражения молекулярной массы правильны.
Пример 2. Сколько молей составляют и сколько молекул содержат 8 г газообразного кислорода O2?
Решение: Выписываем из таблицы Менделеева атомную массу атома кислорода (O), которая равна 15,99 а.е.м, округляем до 16. Так как у нас молекула кислорода, состоящая из двух атомов O, то ее атомная масса равна 16×2=32 а.е.м. Хорошо, а теперь переводим ее в молярную массу: 32 а.е.м = 32 г/моль. Это означает, что 1 моль (6,022·1023 молекул) O2 имеет массу 32 грамма. Ну и в заключении по формулам выше находим количество вещества (моль) и число молекул, содержащихся в 8 граммах O2:
- n = m / M = 8г / 32г/моль = 0,25 моль
- N = NA × n = 6,022·1023 × 0,25 = 1,505·1023 молекул
Пример 3. 1 молекула Н2 реагирует с 1 молекулой Сl2, в результате чего образуются 2 молекулы газообразного хлористого водорода НСl. Какую массу газообразного хлора необходимо использовать, чтобы он полностью прореагировал с 1 килограммом (кг) газообразного водорода?
Решение: Молекулярные массы H2 и Cl2 равны 2,0160 и 70,906 г/моль соответственно. Следовательно, в 1000 г H2 содержится

Даже не выясняя, сколько молекул содержится в одном моле вещества, мы можем быть уверены, что 496 моля Cl2 содержат такое же число молекул, как и 496,0 моля, или 1000 г, H2. Сколько же граммов Cl2 содержится в 496 молях этого вещества? Поскольку молекулярная масса Cl2 равна 70,906 г/моль, то

Пример 4. Сколько молекул H2 и Cl2 принимает участие в реакции, описанной в примере 3?
Решение: В 496 молях любого вещества должно содержаться 496 моля × 6,022·1023 молекул/моль, что равно 2,99·1026 молекул.
Чтобы наглядно показать, сколь велико число Авогадро, приведем такой пример: 1 моль кокосовых орехов каждый диаметром 14 сантиметров (см) мог бы заполнить такой объем, какой занимает наша планета Земля. Использование молей в химических расчетах рассматривается в следующей главе, но представление об этом пришлось ввести уже здесь, поскольку нам необходимо знать, как осуществляется переход от молекулярной шкалы измерения масс к лабораторной шкале.
Надеюсь урок 5 «Моль и молярная масса» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Для того чтобы разобраться с понятием «молярная масса», необходимо вспомнить важный химический термин «моль». Моль тесно связан с химической константой – числом Авогадро и химическим элементом углерод (С), который взят за основу при определении количества вещества, равного 1 молю. Помнить наизусть его значение необязательно, любой электронный или бумажный справочник легко напомнит нам, что число Авогадро (оно обозначается NА) составляет 6,02х1023. Это число частиц вещества (количество молекул или атомов), которое содержится в одном его моле. Принято считать, что в 1 моле любого химического соединения содержится такое количество вещества, которое содержат 12 г атома углерода.
Простыми словами молярную массу можно идентифицировать как «вес 1 моля химического вещества».
В международной системе единиц СИ в соответствии с принятыми стандартами молярную массу определяют в граммах на моль (г/моль). В определенных случаях ее также указывают в кг/моль, если так удобнее производить расчеты. В процессе решения задач по химии молярную массу обозначают большой буквой «М».
Молярную массу не надо путать с весом молекулы, атома и иона, эти понятия отнюдь не тождественны, хотя их числовые величины могут и совпадать. Далеко не для всех химических веществ молярная масса и молекулярный вес равны друг другу. Молярная и молекулярная массы соединений имеют одинаковые значения для химических веществ, состоящих из атомов.
Не путайте молярную массу с весом молекулы!
Рассмотрим это на примере галогена из 7-й группы таблицы Менделеева – хлора (CL):
• атом хлора Cl «весит» 35,5;
• ион хлора Cl– – 35,5;
• молекула хлора Cl2 – 71.
Отличаются между собой эти значения и для другого газа – азота (N2):
• молекула азота, состоящая из 2 атомов, имеет массу 28;
• атом элемента N – 14.
Вывод напрашивается сам по себе – молярные массы элемента, иона и вещества могут существенно различаться.
Как вычислить молярную массу
Чтобы рассчитать значение молярной массы химического вещества, целесообразно придерживаться следующего алгоритма:
- Подготовить таблицу Менделеева (она может понадобиться для определения валентности и атомных масс химических элементов).
- Правильно составить химическую формулу вещества, пользуясь знаниями об основных классах неорганических соединений и их свойствах и сведениями, почерпнутыми из таблицы Менделеева, например:
- углекислый газ – СО2;
- серная кислота – Н2SO4;
- хлорид кальция CaCL2;
- гидроксид алюминия Al(OH)3.
Прежде всего при составлении формул соединений необходимо помнить о валентности элементов, из которых они состоят.
- Определяем молекулярный вес и молярную массу каждого из вышеуказанных химических соединений (вес атомов опять берем в ячейке химического элемента в таблице Менделеева):
- СО2 – 1 атом углерода (12) + 2 атома кислорода (32) = 44;
- Н2SO4 – 2 атома водорода (2) + 1 атом серы (32) + 4 атома кислорода (64) = 98;
- CaCL2 – 1 атом кальция (40) + 2 атома хлора (71) = 111;
- Al(OH)3 – 1 атом алюминия (27) + 3 атома водорода (3) + 3 атома кислорода (48) = 78.
Как видно из приведенных примеров, для выполнения необходимых вычислений достаточно сложить значения атомных масс элементов, находящихся в составе сложных веществ. Для простых веществ следует взять этот показатель, относящийся к соответствующему элементу, из таблицы Менделеева, принимая во внимание количество атомов в одной молекуле вещества (индекс в его формуле).
- Определяем массу одной молекулы каждого из этих неорганических соединений с помощью числа Авогадро:
- m(СО2) = Мr(СО2) : NA= 44:6,02·1023 = 7,3·1023 г;
- m(H2SO4) = Мr(H2SO4) : NA= 98:6,02·1023 = 16,28·1023 г;
- m(CaCL2) = Мr(CaCL2) : NA= 111:6,02·1023 = 18,5·1023 г;
- m(Al(OH)3) = Мr(Al(OH)3) : NA= 78:6,02·1023 = 13,0·1023 г.
Практическое значение молярной массы вещества
Термин «молярная масса» широко используется в таких научных дисциплинах, как химия и физика. Значения молярных масс соединений часто требуется вычислять в химической промышленности при разработке полимерных комплексов и в ряде других ситуаций. Современную фармакологию также трудно представить без проведения расчетов этой величины.
Молярная масса – одно из ключевых понятий при проведении биохимических исследований.
Таким образом, молярную массу необходимо уметь вычислять не только ученым-химикам и сотрудникам химических лабораторий, но и специалистам из ряда других областей науки, фармакологам и работникам ряда отраслей промышленного производства.
Тест по теме “Молярная масса”
Молярная масса


4.2
Средняя оценка: 4.2
Всего получено оценок: 875.
4.2
Средняя оценка: 4.2
Всего получено оценок: 875.
Атомы и молекулы – мельчайшие частицы вещества, поэтому в качестве единицы измерения можно выбрать массу одного из атомов и выражать массы других атомов в соотношении с выбранной. Так что же такое молярная масса, и какова ее размерность?
Что такое молярная масса?
Основоположником теории атомных масс был ученый Дальтон, который составил таблицу атомных масс и принял массу атома водорода за единицу.
Молярная масса – это масса одного моля вещества. Моль, в свою очередь, – количество вещества, в котором содержится определенное количество мельчайших частиц, которые участвуют в химических процессах. Количество молекул, содержащихся в одном моле, называют числом Авогадро. Эта величина является постоянной и не изменяется.

Таким образом, молярная масса вещества – это масса одного моля, в котором находится 6,02*10^23 элементарных частиц.
Число Авогадро получило свое название в честь итальянского ученого Амедео Авагадро, который доказал, что число молекул в одинаковых объемах газов всегда одинаково
Молярная масса в Международной системе СИ измеряется в кг/моль, хотя обычно эту величину выражают в грамм/моль. Эта величина обозначается английской буквой M, а формула молярной массы выглядит следующим образом:
M=m/v,
где m – масса вещества, а v – количество вещества.

Как найти молярную массу вещества?
Вычислить молярную массу того или иного вещества поможет таблица Д. И. Менделеева. Возьмем любое вещество, например, серную кислоту.Ее формула выглядит следующим образом: H2 SO4. Теперь обратимся к таблице и посмотрим, какова атомная масса каждого из входящих в состав кислоты элементов. Серная кислота состоит из трех элементов – водород, сера, кислород. Атомная масса этих элементов соответственно – 1, 32, 16.
Получается, что суммарная молекулярная масса равна 98 атомных единиц массы (1*2+32+16*4). Таким образом, мы выясняли, что один моль серной кислоты весит 98 грамм.
Молярная масса вещества численно равна относительной молекулярной массе, если структурными единицами вещества являются молекулы. Молярная масса вещества также может быть равна относительной атомной массе, если структурными единицами вещества являются атомы.
Вплоть до 1961 года за атомную единицу массы принимали атом кислорода, но не целый атом а его 1/16 часть. При этом химическая и физическая единицы массы не были одинаковыми. Химическая была на 0,03% больше, чем физическая.
В настоящее время в физике и химии принята единая система измерения. В качестве стандартной е.а.м. выбрана 1/12 часть массы атома углерода.

Молярная масса любого газа или пара измеряется очень легко. Достаточно использовать контроль. Один и тот же объем газообразного вещества равен по количеству вещества другому при одинаковой температуре. Известным способом измерения объема пара является определение количество вытесненного воздуха. Такой процесс осуществляется с использованием бокового отвода, ведущего к измерительному устройству.
Понятие молярной массы является очень важным для химии. Ее расчет необходим для создания полимерных комплексов и множества других реакций. В фармацевтике с помощью молярной массы определяют концентрацию данного вещества в субстанции. Также молярная масса важна при провидении биохимических исследований (обменный процесс в элементе).
В наше время благодаря развитию науки известны молекулярные массы практически всех составляющих крови, в том числе и гемоглобина.

Что мы узнали?
В 8 классе по химии важной темой является «молярная масса вещества». Молярная масса – важное физическое и химическое понятие. Молярная масса — характеристика вещества, отношение массы вещества к количеству молей этого вещества, то есть масса одного моля вещества. измеряется она в кг/моль или грамм/моль.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Александр Котков
10/10
-

Регина Медникова
10/10
-

Юля Владимировна
10/10
-

Ольга Королёва
8/10
-

Дима Торопов
10/10
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 875.
А какая ваша оценка?
Download Article
Download Article
Atoms are too small to allow meaningful measurement of chemical substances. To work with meaningful amounts of substances, scientists group them into units called moles. A mole is defined as the number of carbon atoms in 12 grams of the isotope carbon-12,[1]
which is roughly 6.022 x 1023 atoms. This number is called Avogadro’s number or Avogadro’s constant.[2]
This constant is used as the number of atoms given by one mole for any substance, and the mass of 1 mole of a substance is its molar mass.
-

1
Understand molar mass. Molar mass is the mass (in grams) of one mole of a substance.[3]
Using the atomic mass of an element and multiplying it by the conversion factor grams per mole (g/mol), you can calculate the molar mass of that element. -

2
Find the relative atomic mass of the element. An element’s relative atomic mass is the average mass, in atomic units, of a sample of all its isotopes.[4]
This information can be found on the periodic table of elements. Locate the element and find the number underneath the symbol for the element. It will not be a whole number, but will have decimals.- For example, for hydrogen, the relative atomic mass is 1.007; for carbon, it is 12.0107; for oxygen, it is 15.9994; and for chlorine, it is 35.453.
Advertisement
-

3
Multiply the relative atomic mass by the molar mass constant. This is defined as 0.001 kilogram per mole, or 1 gram per mole. This converts atomic units to grams per mole, making the molar mass of hydrogen 1.007 grams per mole, of carbon 12.0107 grams per mole, of oxygen 15.9994 grams per mole, and of chlorine 35.453 grams per mole.[5]
- Some elements are only found in molecules of 2 atoms or more. This means that if you want to find the molar mass of elements that are composed of 2 atoms, such as hydrogen, oxygen, and chlorine, then you’ll have to find their relative atomic masses. Multiply them by the molar mass constant, and then multiply the result by 2.
- For H2: 1.007 x 2 = 2.014 grams per mole; for O2: 15.9994 x 2 = 31.9988 grams per mole; and for Cl2: 35.453 x 2 = 70.096 grams per mole.
- One mnemonic device for remembering diatomic elements (molecules of 2 atoms) is: Have No Fear Of Ice Cold Beverages (Hydrogen, Nitrogen, Fluorine, Oxygen, Iodine, Chlorine, Bromine).[6]
Advertisement
-

1
Find the chemical formula for the compound. This is the number of atoms in each element that makes up the compound. (This information is given in any chemistry reference book.) For example, the formula for hydrogen chloride (hydrochloric acid) is HCl; for glucose, it is C6H12O6. Using this formula, you can identify the number of atoms of each element that makes up the compound.[7]
- For HCl, there is one atom of hydrogen and one atom of chlorine.
- For C6H12O6, there are 6 carbon atoms, 12 hydrogen atoms, and 6 oxygen atoms.
-

2
Find the relative atomic mass of each element in the compound. Using the periodic table, locate the relative atomic mass for each element. It is the number located beneath the symbol for the element.[8]
As we did in the first method of calculating the molar mass of an element, we will also multiply these masses by 1 gram/mole.- The relative atomic masses of the elements in hydrochloric acid are: hydrogen, 1.007 g/mol and chlorine, 35.453 g/mol.
- The relative atomic masses of the elements in glucose are: carbon, 12.0107 g/mol; hydrogen, 1.007 g/mol; and oxygen, 15.9994 g/mol.
-

3
Calculate the molar mass of each element in the compound. Multiply the element’s atomic mass by the number of atoms of that element in the compound. This will give you the relative amount that each element contributes to the compound.[9]
- For hydrogen chloride, HCl, the molar mass of each element is 1.007 grams per mole for hydrogen and 35.453 grams per mole for chlorine.
- For glucose, C6H12O6, the molar mass of each element is: carbon, 12.0107 x 6 = 72.0642 g/mol; hydrogen, 1.007 x 12 = 12.084 g/mol; and oxygen, 15.9994 x 6 = 95.9964 g/mol.
-

4
Add the molar masses of each element in the compound. This determines the molar mass for the entire compound. Take the products you obtained in the previous step and add them all together to calculate the molar mass of the compound.[10]
- For hydrogen chloride, the molar mass is 1.007 + 35.453 = 36.460 g/mol. 36.46 grams is the mass of one mole of hydrogen chloride.
- For glucose, the molar mass is 72.0642 + 12.084 + 95.9964 = 180.1446 g/mol. 180.14 grams is the mass of one mole of glucose.
Advertisement
Calculator, Practice Problems, and Answers
Add New Question
-
Question
What is the molar mass of Helium?

Bess Ruff is a Geography PhD student at Florida State University. She received her MA in Environmental Science and Management from the University of California, Santa Barbara in 2016. She has conducted survey work for marine spatial planning projects in the Caribbean and provided research support as a graduate fellow for the Sustainable Fisheries Group.

Environmental Scientist
Expert Answer
-
Question
What is the molecular mass of oxygen and hydrogen as a mixture?

Oxygen with Hydrogen gives you WATER (H2O). The relative atomic mass for Oxygen is 16, while Hydrogen is 1 since Hydrogen (H2) have two molecules you multiply by 2 1*2=2. Oxygen (O) being 16*1=16. Add up your answers to get 18, and the molecular mass of Oxygen and Hydrogen which is water gives you 18.
-
Question
How do you calculate the molar mass of water?

Water’s chemical formula is H2O, this means it is composed of 2 Hydrogen atoms and 1 Oxygen atom. To find the molar mass, find the atomic mass of all the components of a chemical. You can either memorize it, or find all of the atomic masses located on the periodic table of elements. In this case, hydrogen has an atomic mass of 1, and oxygen has an atomic mass of 16. The equation is therefore: 1(2) + 16(1) = 18. Therefore, the molar mass of water, is 18.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
-
While most relative atomic masses are known to a precision of 1 part in 10 thousand (4 decimal places), in most laboratory work, molar masses are normally quoted to 2 decimal places and fewer for particularly large masses. Thus, in the laboratory, the molar mass for hydrogen chloride would be given as 36.46 grams per mole and that of glucose as 180.14 grams per mole.
Advertisement
Things You’ll Need
- Chemistry reference book or periodic table of the elements
- Calculator
References
About This Article
Article SummaryX
When you’re measuring extremely tiny amounts of a substance, it can be helpful to use molar mass. According to the International System of Units, a mole is the amount of any substance that contains the same number of elementary entities—typically atoms or molecules—as there are atoms in 12 grams of the isotope carbon-12. Molar mass is the mass in grams of 1 mole of any given substance. To find an element’s molar mass, start by checking the periodic table for the relative atomic mass of the element. This is usually located under the symbol and name of the element. For instance, the relative atomic mass of zirconium (Zr) is 91.22. Next, multiply the atomic mass by the molar mass constant, which is equal to 1 gram per mole. For most elements, this means that the relative atomic mass is equal to the molar mass. For instance, zirconium has a molar mass of 91.22 x 1 g/mol, or 91.22 g/mol. However, some elements, such as hydrogen, nitrogen, and oxygen, only occur naturally in molecules of 2 or more atoms. In these cases, you’ll need to multiply the relative atomic mass of the element by the number of atoms in the molecule, then multiply the result by the molar mass constant. For example, the molar mass of H2 is 1.007 x 2 x 1 g/mol, or 2.014 g/mol. Finding the molar mass of a compound is a little more complicated. First, you’ll need to find the chemical formula for the compound. For example, if you’re calculating the molar mass of water, you’d start with the formula H2O. Then, calculate the molar mass of each element in the compound. Don’t forget to take into account the number of atoms of each element when you make your calculation. In this case, the molar mass of the two hydrogen atoms is 2.014 g/mol, while the single oxygen atom is 15.999 g/mol. Add them together to get the total molar mass of 18.013 g/mol. To see specific examples for how to calculate molar mass, read on!
Did this summary help you?
Thanks to all authors for creating a page that has been read 1,267,113 times.
Reader Success Stories
-

Sesame Makgasane
Aug 2, 2016
“The steps helped me understand really quickly. I am writing an examination tomorrow, and this really helped me.”
Did this article help you?
Содержание:
Количество вещества:
В чём разница между понятиями «масса» и «количество»
Если мы будем производить подобные расчеты, соответствующие этому заданию, для простых веществ, образованных различными элементами, то всякий раз получим одно и то же число — 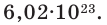
Например, в 1 моле водородного газа содержится  молекул, в 1 моле поваренной соли (NaCI)
молекул, в 1 моле поваренной соли (NaCI)  ионов натрия
ионов натрия 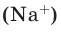 и
и  ионов хлора
ионов хлора 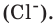
Количество частиц, содержащихся в 1 моле химических веществ (  ), называется постоянной Авогадро (Na). Постоянная Авогадро отличается от числа Авогадро тем, что измеряется определенной единицей
), называется постоянной Авогадро (Na). Постоянная Авогадро отличается от числа Авогадро тем, что измеряется определенной единицей 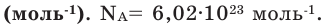
Количество вещества можно вычислить по следующей формуле:
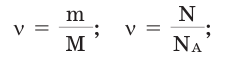
Здесь 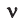 — количество вещества,
— количество вещества, 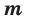 — масса, М — молярная масса, N – заданное количество молекул,
— масса, М — молярная масса, N – заданное количество молекул, 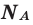 — постоянная Авогадро. Все представленные в формуле величины нам уже известны. Кроме понятия молярной массы. Давайте выясним сущность этого понятия.
— постоянная Авогадро. Все представленные в формуле величины нам уже известны. Кроме понятия молярной массы. Давайте выясним сущность этого понятия.
Молярная масса
Молярной массой называют массу 1 моля вещества, выраженного в граммах. Молярная масса обозначается
буквой М, единицей измерения является г/моль.
При выражении молярной массы вещества в граммах, она численно бывает равна его относительной молекулярной массе (если состоит из молекул). Для сравнения запишем (таблица 1):

Как видно из сравнений, молярная масса веществ по своей единице отличается от относительной молекулярной массы. То есть молярная масса – измеряемая величина.
Как видно из вышесказанного, понятие молярная масса применяется как к химическим элементам, так и к простым и сложным веществам с молекулярным и немолекулярным строением.
На основе количества вещества (моль) можно производить следующие вычисления. Если известно мольное количество вещества:
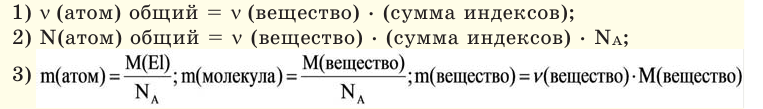
Закон Авогадро и молярный объём газов
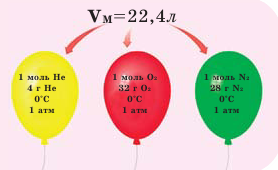
Обратите внимание на рисунки. Почему, несмотря на разные массы газов, они занимают одинаковый объём?
В начале XIX века итальянский ученый Авогадро, проведя наблюдения над свойствами газов в различных условиях и проанализировав открытые прежде законы о газах (Бойля-Мариотта, Гей-Люссака и др.) в 1811 году сформулировал новый закон о газах. Закон Авогадро звучит следующим образом: в равных объемах различных газов при одинаковых условиях (одинаковых температуре и давлении) содержится одинаковое число молекул.

Итальянский ученый. В 1811 году им был открыт закон о газах, который впоследствии был назван его именем.
Мы уже знаем, что 1 моль любого вещества содержит  молекул. Согласно закону Авогадро, можно утверждать, что одинаковое число молекул в 2 г водорода, 32 г кислорода, 28 г азота, 44 г углекислого газа занимает одинаковый объём.
молекул. Согласно закону Авогадро, можно утверждать, что одинаковое число молекул в 2 г водорода, 32 г кислорода, 28 г азота, 44 г углекислого газа занимает одинаковый объём.
Было вычислено, что при нормальных условиях объем 1 моля любого газа или смеси газов составляет примерно 22,4 л. Объем 1 моля газа при нормальных условиях (н.у.) называют молярным объемом данного газа, выраженным знаком 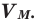 . При измерении объема газа в литрах молярный объём составит
. При измерении объема газа в литрах молярный объём составит 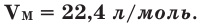 Зависимость между количеством вещества и молярным объёмом газа можно выразить следующей формулой:
Зависимость между количеством вещества и молярным объёмом газа можно выразить следующей формулой:
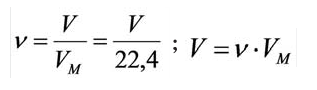
Здесь 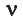 – количество вещества,
– количество вещества, 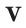 – объём газа,
– объём газа, 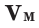 – молярный объем.
– молярный объем.
На основе закона Авогадро и молярного объёма газов можно вычислить плотность газов при нормальных условиях и относительную плотность одного газа по отношению к другому газу. Плотность обозначается буквой 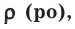 её единица
её единица
измерения – 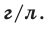
Нормальные условия означают: температура 0°С, 1 атм давления 1атм — 101,3 кПа
Для вычисления плотности какого-либо газа X в нормальных условиях (н.у.), следует его молярную массу разделить на молярный объем:
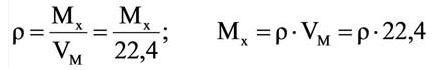
Например, вычислим плотности кислорода и углекислого газа при нормальных условиях:
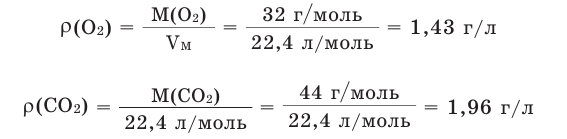
Плотность твёрдых и жидких веществ при н.у. вычисляется по формуле 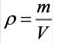 .
.
Для того, чтобы определить, масса какого из газов с одинаковыми объемами и при одинаковых условиях бывает тяжелее, пользуются понятием относительной плотности. Отношение плотностей различных газов при одинаковых условиях равно отношению их молярных масс. Относительная плотность обозначается буквой D и не имеет единицы измерения. Формула относительной плотности следующая:
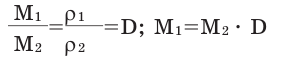
Относительную плотность газов в большинстве случаев вычисляют по самому легкому газу – водороду и воздуху:
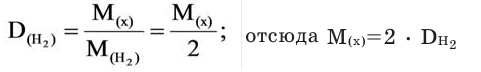
В таком случае, относительная плотность углекислого газа по водороду вычисляется следующим образом:
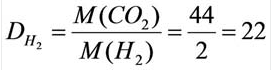
Так как средняя молярная масса воздуха, состоящего из смеси газов, примерно равна 29 г/моль, то формула его относительной плотности следующая:
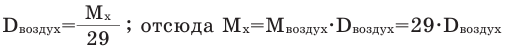
Способы вычисления средней молярной массы газовой смеси

Здесь: 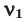 и
и 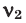 количество молей газов,
количество молей газов, 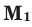 и
и 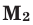 – молярные массы газов,
– молярные массы газов,  и
и 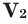 – объем газов в н.у., (
– объем газов в н.у., (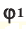 и
и 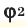 – доля газов в объеме газовой смеси.
– доля газов в объеме газовой смеси.
Среднюю молярную массу 1 моля смеси из двух различных газов можно вычислить по следующей формуле: 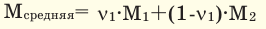 .
.
При смешивании газов с одинаковыми молярными массами, которые при одинаковом давлении не вступают друг с другом в реакцию, плотность газовой смеси (при н.у.), а также их средняя молярная масса остаются неизменными. Например, при смешивании 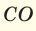 и
и 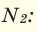
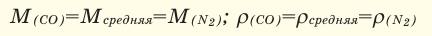
При смешивании газов с различными молярными массами, при одинаковом давлении, средняя молярная масса (при н.у.) и плотность полученной газовой смеси приобретают значение между молярными массами и плотностями смешиваемых газов. Например, при смешивании  и
и 
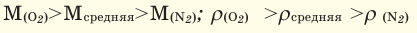
При добавлении газа с большей молярной массой в тот или иной газ при постоянном давлении плотность газовой смеси увеличивается, а при добавлении газа с меньшей молярной массой — уменьшается.
Закон объемных отношений
В химических реакциях соотношение объемов, вступающих в реакцию, и полученных газов равно соотношению их коэффициентов. Например:
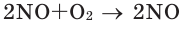 (объёмное соотношение 2:1:2)
(объёмное соотношение 2:1:2)
Численное соотношение объемов, молей и молекул газов равно друг другу.
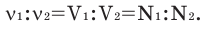
Можно производить следующие вычисления по смесям:
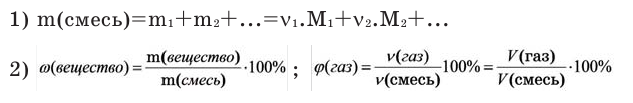
3) Массовое соотношение двух газов: 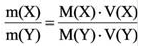
- Физические и химические явления
- Растворы в химии
- Периодический закон Д. И. Менделеева
- Химические связи
- Состав и строение веществ в химии
- Простые и сложные вещества в химии
- Химическая формула
- Относительная атомная и относительная молекулярная масса
