Молярный объем газа

4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
Для того, чтобы узнать состав любых газообразных веществ необходимо уметь оперировать такими понятиями, как молярный объем, молярная масса и плотность вещества. В данной статье рассмотрим, что такое молярный объем, и как его вычислить?
Количество вещества
Количественные расчеты проводят с целью, чтобы в реальности осуществить тот или иной процесс или узнать состав и строение определенного вещества. Эти расчеты неудобно производить с абсолютными значениями массы атомов или молекул из-за того, что они очень малы. Относительные атомные массы также в большинстве случаев невозможно использовать, так как они не связаны с общепринятыми мерами массы или объема вещества. Поэтому введено понятие количество вещества, которое обозначается греческой буквой v (ню) или n. Количество вещества пропорционально числу содержащихся в веществе структурных единиц (молекул, атомных частиц).
Единицей количества вещества является моль.
моль – это такое количество вещества, которое содержит столько же структурных единиц, сколько атомов содержится в 12 г изотопа углерода.
Масса 1 атома равна 12 а. е. м., поэтому число атомов в 12 г изотопа углерода равно:
Na= 12г/12*1,66057*10в степени-24г=6,0221*10 в степени 23
Физическая величина Na называется постоянной Авогадро. Один моль любого вещества содержит 6,02*10 в степени 23 частиц.
Молярный объем газа
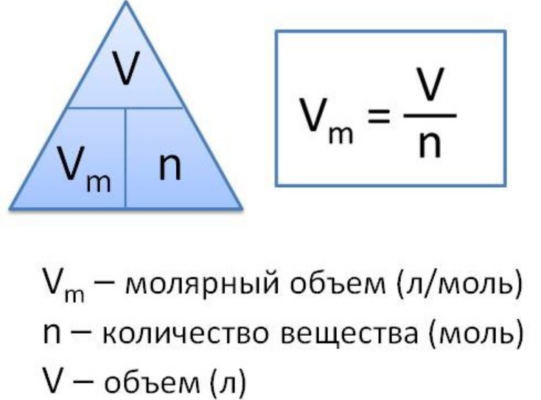
Молярный объем газа – это отношение объема вещества к количеству этого вещества. Эту величину вычисляют при делении молярной массы вещества на его плотность по следующей формуле:
Vm=M/p,
где Vm – молярный объем, М – молярная масса, а p – плотность вещества.
В международной системе Си измерение молярного объема газообразных веществ осуществляется в кубических метрах на моль (м3 /моль)
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа. Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм3 /м.
Таблица «молярный объем газов»
В следующей таблице представлен объем некоторых газов:
| Газ | Молярный объем, л |
| H2 | 22,432 |
| O2 | 22,391 |
| Cl2 | 22,022 |
| CO2 | 22,263 |
| NH3 | 22,065 |
| SO2 | 21,888 |
| Идеальный | 22,41383 |
Что мы узнали?
Молярный объем газа, изучаемый по химии (8 класс) наряду с молярной массой и плотностью являются необходимыми величинами для определения состава того или иного химического вещества. Особенностью молярного газа является то, что в одном моле газа всегда содержится одинаковый объем. Этот объем называется молярным объемом газа.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Аэлита Коробка
5/5
-
Александр Котков
5/5
-
Настя Бабич
5/5
-
Александр Котков
5/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
А какая ваша оценка?
Данный онлайн калькулятор рассчитывает молярный объем идеального газа в зависимости от условий (разных значений температуры и давления). Формулы и перечисление некоторых часто используемых значений для описания физических условий можно найти под калькулятором.
Молярный объем газа
Точность вычисления
Знаков после запятой: 3
Калькулятор использует уравнение молярного объема идеального газа:
Уравнение идеального газа является достаточно близкой аппроксимацией для многих реальных газов. Для заданных температуры и давления, молярный объем для всех идеальных газов один и тот же, и известен с точностью совпадающей с точностью универсальной газовой постоянной: R = 0.082 057 338(47) Л атм K−1 моль−1, то есть относительная стандартная неопределенность молярного объема равна 5.7×10−7, в соответствии с рекомендацией CODATA от 20141
Так как молярный объем одинаков для всех газов, он может быть вычислен независимо от газа по температуре и давлению (физическим условиям). Например, для стандартных условий по версии НИСТ (стандартной температуре 273.15 K и стандартному давлению 101.325 kPa), молярный объем идеального газа равен 22.413962×10-3 м3 моль-1 со стандартной неопределенностью 0.000013 x 10-3 м3 моль-12
Собственно, слова стандартные условия или нормальные условия (что не одно и тоже) для давления и температуры — это отсылка к “справочным”, известным значениям температуры и давления, применяющимся для вычисления значений других физических величин, зависящих от давления и температуры.
Для удобства значения молярного объема для некоторых общеупотребимых физических условий приведены в таблице ниже.
| Физические условия | Температура | Давление | Молярный объем, литры |
|---|---|---|---|
| Стандартные условия (НИСТ) | 0C (273.15K) | 101.325кПа (1атм) | 22.414 |
| Стандартные условия (ИЮПАК) | 0C (273.15K) | 100.000кПа (1бар) | 22.711 |
| Нормальные условия (некоторые ГОСТы, НИСТ) | 20C (293.15K) | 101.325кПа (1атм) | 24.055 |
Разные отрасли и организации, могут использовать свои значения температуры и давления для расчетов. Используя калькулятор, мы можете ввести нужные вам значения температуры и давления и получить молярный объем газа.
Обратите внимание, что для больших значений (сотни атмосфер и тысячи градусов) поведение реальных газов отличается от поведения идеальных газов (собственно, поэтому они и не “идеальные”) и использовать уравнение, приведенное выше, нельзя.
Расчеты, связанные с водяным паром
Задача 32.
В комнате объемом 45 м3 при температуре 25,0 °С относительная влажность воздуха равна 70% или 0,7. Определите массу водяного пара в комнате, если давление насыщенного водяного пара при этой температуре равно 3,17 кПа.
Решение:
Массу водяного пара в комнате можно определить из уравнения Менделеева-Клапейрона.
pV = (m/M . RT), где
р – давление насыщенного водяного пара; V – объем пара; М – молярная масса пара; R – газовая постоянная; Т – температура пара.
Температура, объем и молярная масса пара известны. Для определения давления водяного пара используем формулу относительной влажности.
ф = р/рн, из которой р = фрн.
При подставлении значения давления (фрн) в уравнение Клапейнона-Менделеева, то найдем массу пара m, получим:
фрнV = (m/M . RT)
откуда
m = фрнVM/RT = [0,7 . (3,17 . 103) .45 . (18 . 10-3)]/(8,31 . 298) = 0,738 кг = 738 г.
Ответ: масса водяного пара в комнате составляет 738 г.
Задача 33.
В комнате объемом 20,0 м3 температура воздуха равна 20,0 °С, а его относительная влажность составляет 20,0 %. Какое количество воды следует испарить, чтобы относительная влажность воздуха в комнате достигла 60,0 %? Известно, что при 20,0 °С давление насыщенного пара равно 2,33 кПа, молярная масса воды составляет 18,0 г/моль.
Решение:
Масса водяного пара в воздухе определяется следующими формулами:
при влажности ф1 = 20 %:
m1 = р1V, где
р1 — плотность водяного пара в воздухе при влажности 20 %; V — объем комнаты;
при влажности ф2 = 50%:
m2 = р2V, где
р2 — плотность водяного пара в воздухе при влажности 60 %.
Масса воды, которую следует испарить для повышения влажности воздуха, определяется разностью
∆m = m2 – m1, или, в явном виде, ∆m = р2V – р1V = (р2 – р1)V.
Плотность водяного пара при увеличении влажности увеличивается и определяется следующими формулами:
при влажности ф1 = 20%:
ф1 = p1M/RT, где
p1 — давление ненасыщенного водяного пара при влажности 20%; M — молярная масса водяного пара (воды); R — универсальная газовая постоянная, R = 8,31 Дж/(моль . К); T — температура воздуха, T = 273 + 20 = 293 K;
при влажности ф2 = 50%:
ф2 = p2M/RT, где
p2 — давление ненасыщенного водяного пара при влажности 60 %.
Формула для расчета искомой величины принимает вид:
∆m = p2M/RT – p1M/RT = (p2 – p1)VM/RT.
Давления ненасыщенного водяного пара найдем из формулы ф = (p . 100 %)/p0:
при влажности ф1 = 20%:
p1 = ф1p0/100%, где
р1 — первоначальная влажность воздуха, ф1 = 20%; p0 — давление насыщенного пара при температуре T = 293 К;
при влажности ф2 = 60%:
p2 = ф2p0/100%, где
ф2 — влажность воздуха после испарения некоторого количества воды, ф2 = 60 %.
Подстановка полученных выражений в формулу для ∆m дает:
∆m = (ф2 – ф1)/100% . p0VM/RT.
Вычислим:
∆m = (60,0% – 20,0%)/[100% . (2,33 . 103) . 20,0 . (18,0 . 10-3)/(8,31 / 293) = 137,8 . 10-3 кг = 137,8 г.
Ответ: Для указанного повышения влажности воздуха в комнате необходимо испарить 137,8 г воды.
Задача 34.
Определить состояние водяного пара, находящегося под давлением pп = 246660 Па, если его температура составляет:
а) t1 = 115 °С; б) t2 = 132 °С.
Решение:
Согласно табличным данным, давлению pп = 246,66 кПа соответствует температура насыщения tн = 127°С. Поскольку t1 < tн, то в первом случае пар является влажным. Для второго случая t2 > tн, т.е. пар является перегретым.
Таким образом, водяной пар при температуре 115 °С является влажным, а пар при температуре 132 °С – перегретый.
Ответ: а) влажный; б) перегретый.
Задача 35.
Водяной пар, имеющий температуру t = 150 °С, находится под давлением pп = 0,4 МПа. Определить степень его насыщенности.
Решение:
По табличным данным, применив метод интерполяции, определяем, что температуре t = 150°С соответствует давление насыщения pн = 475722 Па. Далее, использовав формулу:
ф = pп/pн, где
ф – степень насыщенности пара; pп – давление пара (плотность перегретого пара); pн – давление насыщенного пара воды (плотность насыщенного пара).
Находим степень насыщенности пара, получим:
ф = pп/pн = 400000/475722 = 0,84.
Ответ: ф = 0,84.
Жизнь на Земле невозможна без перехода воды в пар. Он присутствует в атмосфере всегда, в том или ином количестве. В некоторых ситуациях, человеку необходимо знать количество пара, содержащегося в воздухе, в текущий момент.
Чтобы это сделать, нужно знать массу водяного пара. Формула расчета, понятие о молярной и молекулярной массе, ее зависимость от давления и температуры, обо всем этом рассказывается в статье.
Содержание
- Что это такое?
- Молекулярная
- Молярная
- Удельная
- Какие факторы влияют на параметр?
- Как зависит от давления и температуры?
- Как найти массу паров воды в воздухе?
- Пример расчета
- Где в быту используются знания?
- Заключение
Что это такое?
Масса водного пара, находящегося в одном кубометре воздуха, носит название абсолютной влажности воздуха. В физике различают молярную и молекулярную массы веществ.
Молекулярная

Вода является составным веществом, одна её молекула содержит две молекулы водорода и одну молекулу воды.
Различают относительную молекулярную и абсолютную молекулярную массу. Относительная молекулярная масса – это единица, не имеющая размерности, и отображающая отношение массы атома или молекулы к 112 массы атома углерода (¹²С).
Абсолютная молекулярная – это значение атома или молекулы вещества, выраженная в атомных единицах массы (а.е.м.). Значение а.е.м, принимаемое для расчетов, берут из периодической таблицы Менделеева.
Рассчитывают молекулярную массу пара следующим образом:
- Ar (воды) = 2 x Ar (водорода) + Ar (кислорода).
- Возьмем из таблицы Менделеева значения атомных величин водорода и кислорода, округлим их до целых чисел, и подставив значения в формулу, получим:
- Ar (пара) = Ar (воды) = 2 x Ar (1,0) + Ar (16,0) = 18,0.
- Итог: абсолютная молярная масса водяного пара равна 18,0 (а.е.м).
Молярная
Молярная масса воды – это молекулярный вес её 1 моль. Учитывая, что пар – одно из состояний воды, значит его молярная величина, равна молярной массе воды. Этот вид физических измерений не зависит от каких-либо других факторов и является величиной постоянной.
Рассчитывается величина путем деления молекулярной величины вещества на единицу его количества.
Молярная масса вещества, состоящего из различных атомов других веществ, может незначительно отличаться от молекулярной величины, если какой-либо из элементов, входящих в его состав имеет нестабильное состояние.
Зная молекулярную массу, довольно легко определить его молярное значение: Mr (пара) = Ar (пара) : 1000 = 0,018 Кгмоль.
Удельная

Удельное отношение показывает содержание весовых единиц в единице объема, поэтому такого понятия, как «удельная масса вещества» в физике не существует, однако есть понятие удельного веса.
Удельный вес вещества – величина, указывающая, сколько его килограммов содержится в одном кубометре объема. По-другому, удельный вес называется плотностью, и измеряется в КДжКг.
Какие факторы влияют на параметр?
На этот параметр оказывает влияние только один фактор – суммарная атомная масса двух молекул водорода и одной кислорода. На удельный вес водяного пара значительно влияют его температура и давление, под которым он находится в единице объема.
Как зависит от давления и температуры?
Учитывая молекулярную сущность термина «масса пара», можно сказать, что ни от давления, ни от температуры она не зависит. От указанных параметров зависит только его удельный вес.
При повышении давления, удельный вес возрастает:
- при давлении в 6 Бар, 1 м³ будет весить 3170 г.;
- 10 Бар – вес 5150 г.;
- 25 Бар – уже 12500 г.
Похожие изменения происходят с удельным весом пара воды и при повышении температуры – он становится больше.
Существует небольшая таблица зависимости веса пара от давления и температуры:
| Давление пара, Кгссм² | Температура, ˚С | Вес 1 м³ пара, Кг |
| 1,0 | 99,1 | 0,580 |
| 1,2 | 104,2 | 0,688 |
| 1,6 | 112,7 | 0,901 |
| 2,0 | 119,6 | 1,11 |
| 3,0 | 132,8 | 1,62 |
| 4,0 | 151,0 | 2,12 |
Как найти массу паров воды в воздухе?

Шаг 1. Переведем формулу для поиска массы: m = РV*M/R*T.
Шаг 2. Для определения давления пара Р, применяется формула вычисления относительной влажности воздуха φ: φ = P/Pн. Давление будет: P = Pн*φ.
Шаг 3. Для получения корректных значений, необходимо все используемые значения перевести в одну систему единиц – температуру в значения по шкале Кельвина, а проценты относительной влажности в единичные доли.
Шаг 4. Выражение из шага №2, необходимо подставить в формулу из шага №1: m = Pн*φ*V*M/R*T. Проведя математические действия, получают искомое значение в килограммах.
Пример расчета
Определить вес водяного пара в 1 кубометре воздуха при нормальном атмосферном давлении, температуре 26˚С и относительной влажности 61%. Давление пара при 26˚С, составляет 3168 Па:
- Выпишем данные: V = 1 м³; T = 26˚С; φ = 61%; Pн = 3168 Па; m — ?
- Переведем величины: 26˚С = 299 К, и 61% = 0,61.
- Подставим данные в формулу из шага №4 инструкции: m = Pн*φ*V*M/R*T = 0,61*3168*1*0,018 8,31*299 = 0,0138 Кг.
Получаем ответ: Вес водяного пара в 1 кубометре воздуха при нормальном атмосферном давлении, температуре 26˚С, и относительной влажности 61%, составляет 0,0138 кг.
Определение массы водяных паров, видео-инструкция:
Где в быту используются знания?
Водяной пар широко используется в промышленности и других областях деятельности человека:
- Добыча и переработка нефти – его закачивают в скважины для повышения их продуктивности путем снижения вязкости нефти. Им прогревают трубопроводы, резервуары. На НПЗ он применяется для увеличения количества отбора светлых нефтепродуктов (бензин, керосин).
- Производство электроэнергии – применяют в ТЭЦ для вращения паровых турбин, а после отработки, в виде горячей воды закачивают в системы ГВС и отопления.
- Химическая промышленность – им разогревают гальванические ванны, используют его для ускорения процесса синтеза некоторых материалов.
- Деревообработка и производство бумаги – при его помощи разогревают дерево перед различными типами обработки: «раскрутка» ствола при производстве шпона, разделка дерева для получения целлюлозы и бумаги.
- Строительство – сушат железобетонные изделия, прогревают инертные материалы, увеличивают прочность газобетона сушкой паром в автоклавах.
- ЖКХ – разморозка трубопроводов, канализации и других конструкций в зимний период.
- Пищевая промышленность – стерилизация и пастеризация продуктов, их размораживание и варка.
- Судоходство и другие отрасли транспорта – использование в паровых турбинах и в системах парового пожаротушения.
Множественное применение нашел пар и в быту – приготовление еды в пароварках, парилки в банях, глажка одежды. Измерение его веса в быту вряд ли будет иметь место, но знание этого процесса никому не помешает.
Заключение
Подводя итог, можно сделать вывод – знание веса пара воды необходимо при расчетах паропроводов в системах энергетики, конструкций, работающих в других отраслях промышленности.
Необходимы такие знания и при расчете некоторых типов бытовых приборов. Несложные по своей сути, такие расчеты вполне по силам любому грамотному человеку.
Молекулярная масса растворенного вещества с учетом относительного снижения давления паров
Идти
Молекулярная масса растворенного вещества = (Вес растворенного вещества*Молекулярно-массовый растворитель*Давление паров чистого растворителя)/((Давление паров чистого растворителя–Давление паров растворителя в растворе)*Вес растворителя)
Масса растворенного вещества с учетом относительного снижения давления пара
Идти
Вес растворенного вещества = ((Давление паров чистого растворителя–Давление паров растворителя в растворе)*Вес растворителя*Молекулярная масса растворенного вещества)/(Давление паров чистого растворителя*Молекулярно-массовый растворитель)
Масса растворителя с учетом относительного снижения давления паров
Идти
Вес растворителя = (Давление паров чистого растворителя*Вес растворенного вещества*Молекулярно-массовый растворитель)/((Давление паров чистого растворителя–Давление паров растворителя в растворе)*Молекулярная масса растворенного вещества)
Фактор Вант-Гоффа для относительного снижения давления пара с использованием числа молей
Идти
Фактор Вант-Гоффа = ((Давление паров чистого растворителя–Давление паров растворителя в растворе)*Количество молей растворителя)/(Количество молей растворенного вещества*Давление паров чистого растворителя)
Процент насыщенности при заданном давлении
Идти
Процент насыщенности = 100*((Частичное давление*(Общее давление–Давление паров чистого компонента А))/(Давление паров чистого компонента А*(Общее давление–Частичное давление)))
Фактор Вант-Гоффа для относительного снижения давления паров с учетом молекулярной массы и моляльности
Идти
Фактор Вант-Гоффа = ((Давление паров чистого растворителя–Давление паров растворителя в растворе)*1000)/(Давление паров чистого растворителя*моляльность*Молекулярно-массовый растворитель)
Моли растворенного вещества в разбавленном растворе при относительном снижении давления пара
Идти
Количество молей растворенного вещества = ((Давление паров чистого растворителя–Давление паров растворителя в растворе)*Количество молей растворителя)/Давление паров чистого растворителя
Моль растворителя в разбавленном растворе при относительном снижении давления пара
Идти
Количество молей растворителя = (Количество молей растворенного вещества*Давление паров чистого растворителя)/(Давление паров чистого растворителя–Давление паров растворителя в растворе)
Молярный объем пара при заданной скорости изменения давления
Идти
Молярный объем = Моляльный объем жидкости+((Молярная теплота парообразования*Изменение температуры)/(Изменение давления*Абсолютная температура))
Молекулярная масса растворителя с учетом относительного снижения давления паров
Идти
Молекулярно-массовый растворитель = ((Давление паров чистого растворителя–Давление паров растворителя в растворе)*1000)/(моляльность*Давление паров чистого растворителя)
Моляльность с использованием относительного снижения давления паров
Идти
моляльность = ((Давление паров чистого растворителя–Давление паров растворителя в растворе)*1000)/(Молекулярно-массовый растворитель*Давление паров чистого растворителя)
Относительное снижение давления пара с учетом веса и молекулярной массы растворенного вещества и растворителя
Идти
Относительное снижение давления паров = (Вес растворенного вещества*Молекулярно-массовый растворитель)/(Вес растворителя*Молекулярная масса растворенного вещества)
Относительное снижение давления паров
Идти
Относительное снижение давления паров = (Давление паров чистого растворителя–Давление паров растворителя в растворе)/Давление паров чистого растворителя
Относительное снижение давления паров с учетом количества молей концентрированного раствора
Идти
Относительное снижение давления паров = Количество молей растворенного вещества/(Количество молей растворенного вещества+Количество молей растворителя)
Мольная доля растворенного вещества при заданном давлении паров
Идти
Мольная доля растворенного вещества = (Давление паров чистого растворителя–Давление паров растворителя в растворе)/Давление паров чистого растворителя
Относительное снижение давления паров по Вант-Гоффу с учетом количества молей
Идти
Относительное снижение давления паров = (Фактор Вант-Гоффа*Количество молей растворенного вещества)/Количество молей растворителя
Динамический метод Оствальда-Уокера для относительного снижения давления пара
Идти
Относительное снижение давления паров = Потеря массы в наборе ламп B/(Потеря массы в наборе ламп A+Потеря массы в наборе ламп B)
Относительное снижение давления паров по Вант-Гоффу с учетом молекулярной массы и моляльности
Идти
Относительное снижение давления паров = (Фактор Вант-Гоффа*моляльность*Молекулярно-массовый растворитель)/1000
Относительное снижение давления паров при заданном количестве молей разбавленного раствора
Идти
Относительное снижение давления паров = Количество молей растворенного вещества/Количество молей растворителя
Мольная доля растворителя при заданном давлении паров
Идти
Мольная доля растворителя = Давление паров растворителя в растворе/Давление паров чистого растворителя
Относительное снижение давления паров с учетом молекулярной массы и моляльности
Идти
Относительное снижение давления паров = (моляльность*Молекулярно-массовый растворитель)/1000