Как определять исходную концентрацию вещества
Вещества, вступающие в химическую реакцию, претерпевают изменения состава и строения, превращаясь в продукты реакции. Концентрация исходных веществ уменьшается вплоть до нуля, если реакция идет до конца. Но может протекать обратная реакция, когда продукты распадаются на исходные вещества. В таком случае устанавливается равновесие, когда скорость прямой и обратной реакции становится одинаковой. Разумеется, равновесные концентрации веществ будут меньше исходных.

Инструкция
Произошла химическая реакция по схеме: А + 2Б = В. Исходные вещества и продукт реакции – газы. В какой-то момент установилось равновесие, то есть, скорость прямой реакции (А + 2Б = В) сравнялась со скоростью обратной (В = А + 2Б). Известно, что равновесная концентрация вещества А равна 0,12 моль/литр, элемента Б – 0,24 моль/литр, а вещества В – 0,432 моль/литр. Требуется определить исходные концентрации А и Б.
Изучите схему химического взаимодействия. Из нее следует, что один моль продукта (элемента В) образовывался из одного моля вещества А и двух молей вещества Б. Если в одном литре реакционного объема образовывалось 0,432 моля элемента В (по условиям задачи), то, соответственно, одновременно расходовалось 0,432 моля вещества А и 0,864 моля элемента Б.
Вам известны равновесные концентрации исходных веществ: [A] = 0,12 моль/литр, [Б] = 0,24 моль/литр. Прибавив к этим величинам те, которые были израсходованы в ходе реакции, вы получите величины исходных концентраций: [A]0 = 0,12 + 0,432 = 0,552 моль/литр; [Б]0 = 0,24 + 0,864 = 1,104 моль/литр.
Также вы можете определить исходные концентрации веществ с помощью константы равновесия (Кр) – отношения произведений равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ. Константа равновесия рассчитывается по формуле: Кр = [C]n [D]m /([A]0x[B]0y), где [C] и [D] – равновесные концентрации продуктов реакции С и D; n, m – их коэффициенты. Соответственно, [A]0, [В]0 – равновесные концентрации элементов, вступающих в реакцию; x,y – их коэффициенты.
Зная точную схему протекающей реакции, равновесную концентрацию хотя бы одного продукта и исходного вещества, а также величину константы равновесия, можно записать условия этой задачи в виде системы двух уравнений с двумя неизвестными.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
В системе:
А (г) + 2B(г) ↔ С (г)
равновесные концентрации равны (моль/дм3): [A] = 0,6; = 1,2; [C] = 2,16. Определите константу рав-
новесия реакции и исходные концентрации веществ A и B.
Решение Константа равновесия этой реакции выражается уравнением:
K = [C]/[A]2.
Подставляя в него данные из условия задачи, получаем:
K = 2,16/0,6•1,22 = 2,5
Для нахождения исходных концентраций веществ А и В учтем, что, согласно уравнению реакции,
из 1 моля вещества А и 2 молей вещества В образуется 1 моль вещества С. Поскольку по условию зада-
чи в каждом дм3 системы образовалось 2,16 моля вещества С, то при этом было израсходовано 2,16 мо-
ля вещества А и 2,16•2 = 4,32 моля вещества В. Таким образом, искомые исходные концентрации рав-
ны:
[А] исх. = 0,6 + 2,16 = 2,76 моль/дм3;
исх. = 1,2 + 4,32 = 5,52 моль/дм3.
При изменении условий протекания реакции (температуры, давления, концентрации какого-либо из
участвующих в реакции веществ) скорости прямого и обратного процессов изменяются неодинаково, и
химическое равновесие нарушается. В результате преимущественного протекания реакции в одном из
возможных направлений устанавливается состояние нового химического равновесия, отличающееся от
исходного. Процесс перехода от одного равновесного состояния к новому равновесию называется сме-
щением химического равновесия.
Направление этого смещения подчиняется принципу Ле-Шателье: если на систему, находящую-
ся в состоянии химического равновесия, оказать какое-либо воздействие, то равновесие сместит-
ся в таком направлении, что оказанное воздействие будет ослаблено.
Так, повышение температуры приводит к смещению равновесия в направлении реакции, сопровож-
дающейся поглощением теплоты, т. е. охлаждением системы; повышение давления вызывает смещение
равновесия в направлении уменьшения общего числа молей газообразных веществ, то есть в направле-
нии, приводящем к понижению давления; удаление из системы одного из продуктов реакции ведет к
смещению равновесия в сторону прямой реакции; уменьшение концентрации одного из исходных ве-
ществ приводит к смещению равновесия в направлении обратной реакции.
Вычисление концентрации веществ, участвующих в реакции
Задача 18.
Реакция идет по уравнению: 4НСl + О2 = 2Н2О + 2Сl2. Через некоторое время после начала реакции концентрации участвующих в ней веществ стали (моль/л) НСl = 0,85; О2 = 0,44; Сl2 = 0,30. Какими были концентрации НСl и О2 в начале реакции?
Решение:
Для нахождения исходных концентраций НСl и О2 учтем, что, согласно уравнению реакции, из 4 молей НСl и 1 моля О2 образуется по 2 моля Н2О и Сl2. Поскольку по условию задачи в каждом литре системы образовалось по 0,3 моля, Н2О и Сl2,то при этом было израсходовано 0,6 молей НСl и 0,15 молей О2. Таким образом, искомые исходные концентрации равны:
[НСl]исх = 0,6 + 0,85 = 1,45 моль/л;
[О2]исх = 0,15 + 0,44 = 0,59 моль/л.
Задача 19.
Реакция идет по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакции были [N2]исх = 0,049 моль/л, [O2] = 0,01моль/л. Вычислите концентрацию этих веществ в момент когда [NO] = 0,005 моль/л.
Решение:
[N2]исх = 0,049 моль/л
[O2]исх =0,01моль/л
[NO] = 0,005 моль/л
Уравнение реакции имеет вид:
N2 + O2 = 2NO
1моль 1моль 2моль
Из уравнения реакции вытекает, что количество продукта реакции NO превышает в 2 раза количество исходных веществ N2 и O2. Отсюда
n(N2) = n(O2) = 0,005/2 = 0,0025 моль/л.
c(N2) = 0,049 – 0,0025 = 0,0465 моль/л;
c(O2) = 0,01 – 0,0025 = 0,0075 моль/л.
На чтение 4 мин Просмотров 4.6к. Опубликовано 04.07.2019
Пример 1: Вычисление константы равновесия реакции по равновесным концентрациям реагирующих веществ и определение их исходных концентраций.
При синтезе аммиака N2 +3H2 = 2NH3 равновесие установилось при следующих концентрациях реагирующих веществ (моль/л): 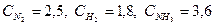 . Рассчитайте константу равновесии этой реакции и исходные концентрации азота н водорода.
. Рассчитайте константу равновесии этой реакции и исходные концентрации азота н водорода.
Определяем константу равновесия Кс этой реакции:
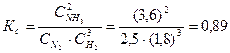
Исходные концентрации азота и водорода находим на основе уравнения реакции. На образование 2 моль NH3, расходуется 1 моль азота, а на образование 3,6 моль аммиака потребовалось 3,6/2 = 1,8 моль азота. Учитывая равновесную концентрацию азота, находим его первоначальную концентрацию:
На образование 2 моль NH3 необходимо израсходовать 3 моль водорода, а для получения 3,6 моль аммиака требуется 3∙3,6/2 = 5,4 моль; учитывая равновесную концентрацию водорода, находим его исходную концентрацию:
Таким образом, реакция начиналась при концентрациях (моль/л): С(N2) = 4,3; С(H2) = 7,2.
Пример 2: Вычисление равновесных концентраций реагирующих веществ.
Реакция протекает по уравнению А+В = 2C. Определите равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В соответственно равны 0,5 и 0,7 моль/л, а константа равновесия реакции Кс =50.
К моменту равновесия концентрации веществ А и В понизятся, а концентрация вещества С увеличится. На каждый моль веществ А и В образуется 2 моль вещества С; поэтому, если понижение концентрации веществ А и В обозначить через x моль, то увеличение концентрации вещества С будет равно 2x моль.
Равновесные концентрации реагирующих веществ будут: [A] = (0,5-х) моль/л; [B] = (0,7-х) моль/л; [С] = 2х моль/л.
Кс = 
Решая это уравнение, получаем: x1 = 0,86; x2 = 0,44. По условию задачи справедливо значение х2. Отсюда равновесные концентрации реагирующих веществ равны: [A] = (0,5-0,44) = 0,06 моль/л; [B] = (0,7-0,44) = 0,26 моль/л; [С] = 0,44∙2 = 0,88 моль/л.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Да какие ж вы математики, если запаролиться нормально не можете. 8447 —  | 7339 —
| 7339 —  или читать все.
или читать все.
78.85.5.224 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
В ходе протекания реакций одни вещества превращаются в другие, меняя при этом свой состав. Таким образом, «исходные концентрации» — это концентрации веществ до начала протекания химической реакции, то есть превращения их в другие вещества. Разумеется, такое преобразование сопровождается уменьшением их количества. Соответственно, снижаются и концентрации исходных веществ, вплоть до нулевых значений – если реакция протекла до конца, необратимо, а компоненты были взяты в эквивалентных количествах.
Предположим, перед вами поставлена следующая задача. Протекала некая химическая реакция, в ходе которой исходные вещества, принятые как А и Б, превращались в продукты, например, условно В и Г. То есть реакция проходила по следующей схеме: А + Б = В + Г.При концентрациях вещества Б равным 0,05 моль/л, а вещества Г — 0,02 моль/л, установилось некое химическое равновесие. Необходимо определить, какова начальная концентрация веществ А0 и Б0, если константа равновесия Кр равна показателю 0,04?
Для решения поставленной задачи примите равновесную концентрацию вещества А за величину «x», а концентрацию вещества В за «y». А также вспомните, что константа равновесия Кр исчисляется по следующей формуле: [В][Г]/[А][Б].
В ходе решения получите следующие вычисления: 0,04 = 0,02y /0,05x. То есть путем простейших вычислений вы получите, что y = 0,1x.
Теперь еще раз внимательно посмотрите на вышеуказанное уравнение химической реакции. Из него следует, что из одного моля веществ А и Б образовывалось по одному молю веществ В и Г. Исходя их этого, начальную молярную концентрацию вещества А можно представить следующим образом:А0 = x + 0,02А0 = x + y
Вспомните, что величина «y», как вы только что определили, равна некому показателю 0,1x. Преобразуя эти уравнения в дальнейшем, вы получите: x + 0,02 = 1,1 x. Из этого следует, что x = 0,2 моль/л, и тогда начальная концентрация [A0] равна 0,2 + 0,02 = 0,22 моль/л.
А как быть с веществом Б? Его начальная концентрация Б0 находится гораздо проще. Для определения к равновесной концентрации этого вещества надо прибавить равновесную концентрацию продукта-вещества Г. То есть [Б0] = 0,05 + 0,02 = 0,07 моль/л.Ответ будет таковым: [A0] = 0,22 моль/л., [Б0] = 0,07 моль/л. Поставленная задача решена.
В системе A(г)+2В(г)С(г) равновесие концентрации равны:
[A]=0,6 моль/л, [В]=1,2 моль/л, [С]=2,16 моль/л.
Найдите константу равновесия реакции и исходные концентрации веществ А и В.
Из уравнения видны, что 1 моль вещества А образует 1 моль вещества С, значит 2,16 моля образуется на 2,16 моль А.
П
р и м е р.
Вычислите
константу химического равновесия для
обратимой гомогенной реакции, СО + Н2О
= СО2
+ Н2,
исходя из того, что равновесие концентрации
веществ:
[СО]р
= 0,045 моль/л,
[Н2О]р
= 0,064 моль/л,
[СО2]р
= 0,18 моль/л.
Дано:
[СО]р
= 0,045 моль/л
[Н2О]р
= 0,064 моль/л
[СО2]р
= 0,18 моль/л
Кх.р
– ?
Решение:
Молярное
отношение продуктов реакции 1:1, поэтому
[СО2]р
= [Н2]р
= 0,18 моль/л.
Исходя
из выражения (2.1) рассчитываем величину
константы химического равновесия:
Кх.р
= [СО2]р
[Н2]р
/
[СО2]р
[Н2О]р
= 0,18 · 0,18/0,045 · 0,064
Ответ:
11,25.
2. Вычисление равновесных концентраций по исходным концентрациям реагирующих веществ и наоборот
П
р и м е р 1.
Обратимая
газовая реакция протекает по уравнению:
СО
+ CI2
= COCI2.
Исходные
концентрации реагирующих веществ:
[СО]0
= 0,03 моль/л;
[Cl2]0
= 0,02 моль/л.
После
наступления равновесия концентрация
угарного газа стала:
[СО]р
= 0,021 моль/л.
Вычислить
равновесные концентрации остальных
веществ и величину константы химического
равновесия.
Дано:
[СО]0
= 0,03 моль/л
[С12]0
= 0,02 моль/л
[СО]р
= 0,021 моль/л
[CI2]p,
[COCI2]p,
Kx.p
– ?
Решение:
К
моменту равновесия изменение концентрации
СО составило:
∆[СО]
= [СО]0
– [СО]р
= 0,03 – 0,021 = 0,009 моль/л.
Поскольку
молярное отношение веществ, участвующих
в реакции 1:1:1, то изменение концентрации
всех веществ одинаково:
[С12]р
=
[С12]0
– ∆[С12]
= 0,02 – 0,009 = 0,011 моль/л,
[СОС12]р
= 0,009 моль/л,
Кх·р
= [СОС12]Р
/ [СО]Р
[С12]р
= 0,009/0,021 · 0,011 = 39.
Результаты
вычислений внесем в таблицу, где знаки
«+» и «–» означают соответственно
увеличение или понижение концентрации
вещества.
|
Начальная |
Изменение |
Равновесная |
|
[CO]0
[Cl2]0
[COCl2]0 |
∆[CO]
∆[Cl2]
∆[COCl2] |
[CO]p
[Cl2]
[COCl2] |
Ответ:
[С12]р
= 0,011 моль/л; [СОС12]р
= 0,009 моль/л; Кх·р
=
39.
П
р и м е р 2.
Равновесные
концентрации веществ, участвующих в
обратимой реакции 2NO
+ О2
= 2NО2,
следующие
(моль/л):
[NО]р
= 0,056;
[О2]
= 0,028;
[NO2]р
= 0,044.
Рассчитать
начальные концентрации исходных веществ.
Дано:
[NО]р
= 0,056 моль/л
[O2]р
= 0,028 моль/л
[NO2]р
= 0,044 моль/л
[NO]0,
[О2]0
– ?
Решение:
Начальная
концентрация оксида азота (IV)
была [NO2]0
= 0, а ее изменение к моменту равновесия
составляет ∆[NО2]
= 0,044 моль/л.
Молярное
отношение NO
и NО2
в реакции 2:2 (1:1), следовательно, начальная
концентрация NO
будет:
[NO]0
= [NO]р
+ 0,044 = 0,056 + 0,044 = 0,1 моль/л.
Молярное
отношение О2
и NO2
составляет 1:2, отсюда начальная
концентрация О2
будет:
[О2]0
= [О2]р
+ 0,044/2 = 0,028 + 0,022 = 0,05 моль/л.
Результаты
вычислений записываем в таблицу
|
Равновесная |
Изменение |
Начальная |
|
[NO2]p
[NO]p
[O2]p |
∆[NO2]p
∆[NO]p
∆[O2]p |
[NO2]0
[NO]0
[O2]0 |
Ответ:
[NО]0
= 0,1 моль/л; [О2]0
= 0,05 моль/л.
П
р и м е р 3.
Реакция
синтеза аммиака протекает по уравнению
ЗН2
+ N2
= 2NH3.
Начальные концентрации исходных веществ
равны (моль/л): водорода – 0,05; азота –
0,04: константа скорости реакции равна
0,3. Рассчитать: а) начальную скорость
реакции; б) скорость реакции, когда
концентрация аммиака стала равной 0,02
моль/л.
Дано:
а)
[Н2]0
= 0,05 моль/л
[N2]0
= 0,04 моль/л
k
=0,3
υ0
– ?
б)
[NH3]
= 0,02 моль/л
k
=
0,3
υ
– ?
Решение:
а)
В соответствии с законом действующих
масс находим начальную скорость реакции:
υ0
= k[H2]03[N2]0
= 3 · 10–1
[5 · 10–2]3
[4 · 10–2]
= 1,5 · 10–6
моль/л·с.
б)
Исходя из уравнения реакции молярное
отношение водорода и аммиака 3:2. Увеличение
концентрации аммиака на 0,02 моль/л
вызывает уменьшение концентрации
водорода на 0,03 моль/л (0,02 – 3/2 = 0,03).
Таким
образом, к моменту когда концентрация
аммиака выросла на 0,02 моль/л, концентрация
водорода уменьшилась до 0,02 моль/л (0,05 –
0,03 = 0,02). Молярное отношение азота и
аммиака
1:2. Концентрация азота уменьшится на
0,01 моль (0,02 – 1/2 =
= 0,01) и станет равной 0,03 моль/л (0,04 – 0,01
= 0,03). Скорость реакции с уменьшением
концентрации реагирующих веществ также
понизится:
υ
= k[H2]3[N2]
= 3 · 10–1[2
· 10–2]3[3
· 10–2]
= 7,2 · 10–8
моль/л·с.
Ответ:
а)
1,5 · 10–6
моль/л·с; б) 7,2 · 10–8
моль/л·с.
П
р и м е р 4.
Реакция
протекает по уравнению 2NO
+ О2
= 2NO2,
через некоторое время после начала
реакции концентрации всех веществ,
участвующих в реакции, стали: [NO]
= 0,04 моль/л; [О2]
= 0,01 моль/л;
[NО2]
= 0,02 моль/л. Рассчитать начальные
концентрации исходных веществ и начальную
скорость реакции, если константа скорости
реакции k
= 1.
Дано:
[NO]
= 0,04 моль/л
[О2]
= 0,01 моль/л
[N02]
= 0,02 моль/л
k
= 1
[NO]0,
[O2]0,
x0
–
?
Решение:
В
соответствии с уравнением реакции
молярное отношение NO
и NO2
равно 2:2 (1:1).
Увеличение
концентрации продукта реакции NO2
до 0,02 моль/л вызвало уменьшение
концентрации NO
на 0,02 моль. Следовательно, начальная
концентрация оксида азота (II)
была:
[NО]0
= [NO]
+0,02 = 0,04 + 0,02 = 0,06 моль/л.
Молярное
отношение О2
и NO2
составляет 1:2, поэтому повышение
концентрации NO2
до 0,02 моль вызвало уменьшение концентрации
кислорода на 0,01 моль (0,02 · 1/2 = 0,01). В
результате начальная концентрация
кислорода была:
[О2]0
= [О2]
+ 0,01 = 0,01 + 0,01 = 0,02 моль/л.
Начальная
скорость реакции
υ0
= k[NO]02[O2]0
= 1 [6 · 10–2]2[2
· 10–2]
= 7,2 · 10–5
моль/л·с.
Ответ:
[NO]0
= 0,06 моль/л; [О2]0
= 0,02 моль/л;
х0
= 7,2 · 10–5моль/л·с.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
