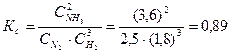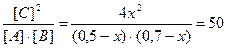Как определять исходную концентрацию вещества
Вещества, вступающие в химическую реакцию, претерпевают изменения состава и строения, превращаясь в продукты реакции. Концентрация исходных веществ уменьшается вплоть до нуля, если реакция идет до конца. Но может протекать обратная реакция, когда продукты распадаются на исходные вещества. В таком случае устанавливается равновесие, когда скорость прямой и обратной реакции становится одинаковой. Разумеется, равновесные концентрации веществ будут меньше исходных.

Инструкция
Произошла химическая реакция по схеме: А + 2Б = В. Исходные вещества и продукт реакции – газы. В какой-то момент установилось равновесие, то есть, скорость прямой реакции (А + 2Б = В) сравнялась со скоростью обратной (В = А + 2Б). Известно, что равновесная концентрация вещества А равна 0,12 моль/литр, элемента Б – 0,24 моль/литр, а вещества В – 0,432 моль/литр. Требуется определить исходные концентрации А и Б.
Изучите схему химического взаимодействия. Из нее следует, что один моль продукта (элемента В) образовывался из одного моля вещества А и двух молей вещества Б. Если в одном литре реакционного объема образовывалось 0,432 моля элемента В (по условиям задачи), то, соответственно, одновременно расходовалось 0,432 моля вещества А и 0,864 моля элемента Б.
Вам известны равновесные концентрации исходных веществ: [A] = 0,12 моль/литр, [Б] = 0,24 моль/литр. Прибавив к этим величинам те, которые были израсходованы в ходе реакции, вы получите величины исходных концентраций: [A]0 = 0,12 + 0,432 = 0,552 моль/литр; [Б]0 = 0,24 + 0,864 = 1,104 моль/литр.
Также вы можете определить исходные концентрации веществ с помощью константы равновесия (Кр) – отношения произведений равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ. Константа равновесия рассчитывается по формуле: Кр = [C]n [D]m /([A]0x[B]0y), где [C] и [D] – равновесные концентрации продуктов реакции С и D; n, m – их коэффициенты. Соответственно, [A]0, [В]0 – равновесные концентрации элементов, вступающих в реакцию; x,y – их коэффициенты.
Зная точную схему протекающей реакции, равновесную концентрацию хотя бы одного продукта и исходного вещества, а также величину константы равновесия, можно записать условия этой задачи в виде системы двух уравнений с двумя неизвестными.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
На чтение 4 мин Просмотров 4.6к. Опубликовано 04.07.2019
Пример 1: Вычисление константы равновесия реакции по равновесным концентрациям реагирующих веществ и определение их исходных концентраций.
При синтезе аммиака N2 +3H2 = 2NH3 равновесие установилось при следующих концентрациях реагирующих веществ (моль/л): 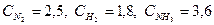
Определяем константу равновесия Кс этой реакции:
Исходные концентрации азота и водорода находим на основе уравнения реакции. На образование 2 моль NH3, расходуется 1 моль азота, а на образование 3,6 моль аммиака потребовалось 3,6/2 = 1,8 моль азота. Учитывая равновесную концентрацию азота, находим его первоначальную концентрацию:
На образование 2 моль NH3 необходимо израсходовать 3 моль водорода, а для получения 3,6 моль аммиака требуется 3∙3,6/2 = 5,4 моль; учитывая равновесную концентрацию водорода, находим его исходную концентрацию:
Таким образом, реакция начиналась при концентрациях (моль/л): С(N2) = 4,3; С(H2) = 7,2.
Пример 2: Вычисление равновесных концентраций реагирующих веществ.
Реакция протекает по уравнению А+В = 2C. Определите равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В соответственно равны 0,5 и 0,7 моль/л, а константа равновесия реакции Кс =50.
К моменту равновесия концентрации веществ А и В понизятся, а концентрация вещества С увеличится. На каждый моль веществ А и В образуется 2 моль вещества С; поэтому, если понижение концентрации веществ А и В обозначить через x моль, то увеличение концентрации вещества С будет равно 2x моль.
Равновесные концентрации реагирующих веществ будут: [A] = (0,5-х) моль/л; [B] = (0,7-х) моль/л; [С] = 2х моль/л.
Кс =
Решая это уравнение, получаем: x1 = 0,86; x2 = 0,44. По условию задачи справедливо значение х2. Отсюда равновесные концентрации реагирующих веществ равны: [A] = (0,5-0,44) = 0,06 моль/л; [B] = (0,7-0,44) = 0,26 моль/л; [С] = 0,44∙2 = 0,88 моль/л.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Да какие ж вы математики, если запаролиться нормально не можете. 8447 — 

78.85.5.224 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
В ходе протекания реакций одни вещества превращаются в другие, меняя при этом свой состав. Таким образом, «исходные концентрации» — это концентрации веществ до начала протекания химической реакции, то есть превращения их в другие вещества. Разумеется, такое преобразование сопровождается уменьшением их количества. Соответственно, снижаются и концентрации исходных веществ, вплоть до нулевых значений – если реакция протекла до конца, необратимо, а компоненты были взяты в эквивалентных количествах.
Предположим, перед вами поставлена следующая задача. Протекала некая химическая реакция, в ходе которой исходные вещества, принятые как А и Б, превращались в продукты, например, условно В и Г. То есть реакция проходила по следующей схеме: А + Б = В + Г.При концентрациях вещества Б равным 0,05 моль/л, а вещества Г — 0,02 моль/л, установилось некое химическое равновесие. Необходимо определить, какова начальная концентрация веществ А0 и Б0, если константа равновесия Кр равна показателю 0,04?
Для решения поставленной задачи примите равновесную концентрацию вещества А за величину «x», а концентрацию вещества В за «y». А также вспомните, что константа равновесия Кр исчисляется по следующей формуле: [В][Г]/[А][Б].
В ходе решения получите следующие вычисления: 0,04 = 0,02y /0,05x. То есть путем простейших вычислений вы получите, что y = 0,1x.
Теперь еще раз внимательно посмотрите на вышеуказанное уравнение химической реакции. Из него следует, что из одного моля веществ А и Б образовывалось по одному молю веществ В и Г. Исходя их этого, начальную молярную концентрацию вещества А можно представить следующим образом:А0 = x + 0,02А0 = x + y
Вспомните, что величина «y», как вы только что определили, равна некому показателю 0,1x. Преобразуя эти уравнения в дальнейшем, вы получите: x + 0,02 = 1,1 x. Из этого следует, что x = 0,2 моль/л, и тогда начальная концентрация [A0] равна 0,2 + 0,02 = 0,22 моль/л.
А как быть с веществом Б? Его начальная концентрация Б0 находится гораздо проще. Для определения к равновесной концентрации этого вещества надо прибавить равновесную концентрацию продукта-вещества Г. То есть [Б0] = 0,05 + 0,02 = 0,07 моль/л.Ответ будет таковым: [A0] = 0,22 моль/л., [Б0] = 0,07 моль/л. Поставленная задача решена.
В системе A(г)+2В(г)С(г) равновесие концентрации равны:
[A]=0,6 моль/л, [В]=1,2 моль/л, [С]=2,16 моль/л.
Найдите константу равновесия реакции и исходные концентрации веществ А и В.
Из уравнения видны, что 1 моль вещества А образует 1 моль вещества С, значит 2,16 моля образуется на 2,16 моль А.
В системе:
А (г) + 2B(г) ↔ С (г)
равновесные концентрации равны (моль/дм3): [A] = 0,6; = 1,2; [C] = 2,16. Определите константу рав-
новесия реакции и исходные концентрации веществ A и B.
Решение Константа равновесия этой реакции выражается уравнением:
K = [C]/[A]2.
Подставляя в него данные из условия задачи, получаем:
K = 2,16/0,6•1,22 = 2,5
Для нахождения исходных концентраций веществ А и В учтем, что, согласно уравнению реакции,
из 1 моля вещества А и 2 молей вещества В образуется 1 моль вещества С. Поскольку по условию зада-
чи в каждом дм3 системы образовалось 2,16 моля вещества С, то при этом было израсходовано 2,16 мо-
ля вещества А и 2,16•2 = 4,32 моля вещества В. Таким образом, искомые исходные концентрации рав-
ны:
[А] исх. = 0,6 + 2,16 = 2,76 моль/дм3;
исх. = 1,2 + 4,32 = 5,52 моль/дм3.
При изменении условий протекания реакции (температуры, давления, концентрации какого-либо из
участвующих в реакции веществ) скорости прямого и обратного процессов изменяются неодинаково, и
химическое равновесие нарушается. В результате преимущественного протекания реакции в одном из
возможных направлений устанавливается состояние нового химического равновесия, отличающееся от
исходного. Процесс перехода от одного равновесного состояния к новому равновесию называется сме-
щением химического равновесия.
Направление этого смещения подчиняется принципу Ле-Шателье: если на систему, находящую-
ся в состоянии химического равновесия, оказать какое-либо воздействие, то равновесие сместит-
ся в таком направлении, что оказанное воздействие будет ослаблено.
Так, повышение температуры приводит к смещению равновесия в направлении реакции, сопровож-
дающейся поглощением теплоты, т. е. охлаждением системы; повышение давления вызывает смещение
равновесия в направлении уменьшения общего числа молей газообразных веществ, то есть в направле-
нии, приводящем к понижению давления; удаление из системы одного из продуктов реакции ведет к
смещению равновесия в сторону прямой реакции; уменьшение концентрации одного из исходных ве-
ществ приводит к смещению равновесия в направлении обратной реакции.
Задачи
Рассчитать концентрацию в этот момент и начальную скорость прямой реакции.
Константа скорости гомогенной реакции
равна . Через некоторое время от начала реакции в реакционной смеси обнаружено 20 % от первоначального количества HJ, 0,2 моль/л
и 0,4 моль/л
. Рассчитать концентрацию
в этот момент и начальную скорость прямой реакции.
Решение. Известна концентрация одного из продуктов реакции – , что позволяет вычислить изменение концентрации
к моменту времени
:
моль/л;
моль/л.
Тогда, пользуясь соотношением (15)
,
определяем:
(моль/л);
(моль/л);
(моль/л).
Искомая концентрация в момент времени
:
моль/л;
Находим начальные концентрации реагентов.
Поскольку , то
моль/л.
О втором реагенте () известно, что в реакционной смеси обнаружено (
) 20 % от первоначального количества; значит, прореагировало (
) 80 %. Составляем пропорцию:
С0(HI) – 100%
Δc(HI) = 0,4 моль/л – 80%
откуда
(моль/л).
Начальную скорость прямой реакции рассчитываем по закону действующих масс:
.
Результаты расчетов представим в виде таблицы 6.
Таблица 6
| 2 | 1 | 1 | 2 | |
| 0,5 | 0,4 | 0 | 0 | |
| 0,4 | 0,2 | 0,2 | 0,4 | |
| 0,1 | 0,2 | 0,2 | 0,4 | |
| 0,2 |
Вычисление концентрации веществ, участвующих в реакции
Задача 18.
Реакция идет по уравнению: 4НСl + О2 = 2Н2О + 2Сl2. Через некоторое время после начала реакции концентрации участвующих в ней веществ стали (моль/л) НСl = 0,85; О2 = 0,44; Сl2 = 0,30. Какими были концентрации НСl и О2 в начале реакции?
Решение:
Для нахождения исходных концентраций НСl и О2 учтем, что, согласно уравнению реакции, из 4 молей НСl и 1 моля О2 образуется по 2 моля Н2О и Сl2. Поскольку по условию задачи в каждом литре системы образовалось по 0,3 моля, Н2О и Сl2,то при этом было израсходовано 0,6 молей НСl и 0,15 молей О2. Таким образом, искомые исходные концентрации равны:
[НСl]исх = 0,6 + 0,85 = 1,45 моль/л;
[О2]исх = 0,15 + 0,44 = 0,59 моль/л.
Задача 19.
Реакция идет по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакции были [N2]исх = 0,049 моль/л, [O2] = 0,01моль/л. Вычислите концентрацию этих веществ в момент когда [NO] = 0,005 моль/л.
Решение:
[N2]исх = 0,049 моль/л
[O2]исх =0,01моль/л
[NO] = 0,005 моль/л
Уравнение реакции имеет вид:
N2 + O2 = 2NO
1моль 1моль 2моль
Из уравнения реакции вытекает, что количество продукта реакции NO превышает в 2 раза количество исходных веществ N2 и O2. Отсюда
n(N2) = n(O2) = 0,005/2 = 0,0025 моль/л.
c(N2) = 0,049 – 0,0025 = 0,0465 моль/л;
c(O2) = 0,01 – 0,0025 = 0,0075 моль/л.