Как найти в физике начальную и конечную температуру через количество теплоты, удельную теплоту и массу?
Домашние задания
Николай Маслихов
21 декабря 2020 · 3,6 K
Ответить1Уточнить
Сергей Иванов
Математика
158
Мне интересно и нравятся: математика. физика. астрономия, информатика, астрофизика, науки… · 26 дек 2020 · ivanov610.narod.ru
Формула связи такая Q = cm(t2-t1). Если даны: количество теплоты, удельную теплоту и массу, то из этой формулы можно выразить только изменение температуры. t2-t1 =Q/cm. Чтобы найти конечную или начальную температуры, нужно какую-то из них тоже знать. Знаем конечную, найдем начальную и наоборот.
4,3 K
Комментировать ответ…Комментировать…
Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос
Wiki-учебник
Поиск по сайту
Реклама от партнёров:
Удельная теплоёмкость: расчет количества теплоты
Как вы думаете, что быстрее нагревается на плите: литр воды в кастрюльке или же сама кастрюлька массой 1 килограмм? Масса тел одинакова, можно предположить, что нагревание будет происходить с одинаковой скоростью.
А не тут-то было! Можете проделать эксперимент – поставьте пустую кастрюльку на огонь на несколько секунд, только не спалите, и запомните, до какой температуры она нагрелась. А потом налейте в кастрюлю воды ровно такого же веса, как и вес кастрюли. По идее, вода должна нагреться до такой же температуры, что и пустая кастрюля за вдвое большее время, так как в данном случае нагреваются они обе – и вода, и кастрюля.
Однако, даже если вы выждете втрое большее время, то убедитесь, что вода нагрелась все равно меньше. Воде потребуется почти в десять раз большее время, чтобы нагреться до такой же температуры, что и кастрюля того же веса. Почему это происходит? Что мешает воде нагреваться? Почему мы должны тратить лишний газ на подогрев воды при приготовлении пищи? Потому что существует физическая величина, называемая удельной теплоемкостью вещества.
Удельная теплоемкость вещества
Эта величина показывает, какое количество теплоты надо передать телу массой один килограмм, чтобы его температура увеличилась на один градус Цельсия. Измеряется в Дж/(кг * ˚С). Существует эта величина не по собственной прихоти, а по причине разности свойств различных веществ.
Удельная теплоемкость воды примерно в десять раз выше удельной теплоемкости железа, поэтому кастрюля нагреется в десять раз быстрее воды в ней. Любопытно, что удельная теплоемкость льда в два раза меньше теплоемкости воды. Поэтому лед будет нагреваться в два раза быстрее воды. Растопить лед проще, чем нагреть воду. Как ни странно звучит, но это факт.
Расчет количества теплоты
Обозначается удельная теплоемкость буквой c и применяется в формуле для расчета количества теплоты:
Q = c*m*(t2 – t1),
где Q – это количество теплоты,
c – удельная теплоемкость,
m – масса тела,
t2 и t1 – соответственно, конечная и начальная температуры тела.
Формула удельной теплоемкости: c = Q / m*(t2 – t1)
По этой формуле можно рассчитать количество тепла, которое нам необходимо, чтобы нагреть конкретное тело до определенной температуры. Удельную теплоемкость различных веществ можно найти из соответствующих таблиц.
Также из этой формулы можно выразить:
- m = Q / c*(t2-t1) – массу тела
- t1 = t2 – (Q / c*m) – начальную температуру тела
- t2 = t1 + (Q / c*m) – конечную температуру тела
- Δt = t2 – t1 = (Q / c*m) – разницу температур (дельта t)
А что насчет удельной теплоемкости газов? Тут все запутанней. С твердыми веществами и жидкостями дело обстоит намного проще. Их удельная теплоемкость – величина постоянная, известная, легко рассчитываемая. А что касается удельной теплоемкости газов, то величина эта очень различна в разных ситуациях. Возьмем для примера воздух. Удельная теплоемкость воздуха зависит от состава, влажности, атмосферного давления.
При этом, при увеличении температуры, газ увеличивается в объеме, и нам надо ввести еще одно значение – постоянного или переменного объема, что тоже повлияет на теплоемкость. Поэтому при расчетах количества теплоты для воздуха и других газов пользуются специальными графиками величин удельной теплоемкости газов в зависимости от различных факторов и условий.
Нужна помощь в учебе?

Предыдущая тема: Количество теплоты: формула, расчет
Следующая тема: Энергия топлива: удельная теплота сгорания + ПРИМЕРЫ
|
Нравится
|
Нравится |
Which takes more energy to heat up: air or water? How about water versus metal or water versus another liquid like soda?
These questions and many others are related to a property of matter called specific heat. Specific heat is the amount of heat per unit of mass needed to raise a substance’s temperature by one degree Celsius.
So it takes more energy to heat up water than air because water and air have different specific heats.
TL;DR (Too Long; Didn’t Read)
Use the formula:
Q = mcΔT, also written Q = mc(T – t0)
to find the initial temperature (t0) in a specific heat problem.
In fact, water has one of the highest specific heats of any “common” substance: It’s 4.186 joule/gram °C. That’s why water is so useful in moderating the temperature of machinery, human bodies and even the planet.
Equation for Specific Heat
You can use the property of specific heat to find a substance’s initial temperature. The equation for specific heat is usually written:
Q = mcΔT
where Q is the amount of heat energy added, m is the substance’s mass, c is specific heat, a constant, and ΔT means “change in temperature.”
Make sure your units of measurement match the units used in the specific heat constant! For example, sometimes the specific heat may use Celsius. Other times, you’ll get the SI unit for temperature, which is Kelvin. In these cases, the units for specific heat will either be Joules/gram °C or else Joules/gram K. The same could happen with grams versus kilograms for the mass, or Joules to Bmu for energy. Be sure to check the units and make any conversions needed before you get started.
Using Specific Heat to Find Initial Temperature
ΔT can also be written (T – t0), or a substance’s new temperature minus its initial temperature. So another way to write the equation for specific heat is:
Q = mc(T – t0)
So this rewritten form of the equation makes it simple to find initial temperature. You can plug in all the other values that you’re given, then solve for t0.
For example: Say you add 75.0 Joules of energy to 2.0 grams of water, raising its temperature to 87 °C. Water’s specific heat is 4.184 Joules/gram °C. What was the initial temperature of the water?
Plug the given values into your equation:
75.o J = 2.0 g x (4.184 J/g°C) x (87 °C – t0).
Simplify:
75.o J = 8.368 J/°C x (87 °C – t0).
8.96 °C = (87 °C – t0)
78°C = t0.
Specific Heat and Phase Changes
There’s one important exception to keep in mind. The specific heat equation doesn’t work during a phase change, for example, from a liquid to a gas or a solid to a liquid. That’s because all the extra energy that’s being pumped in is being used for the phase change, not for increasing the temperature. So the temperature stays flat during that period, throwing off the relationship between energy, temperature and specific heat in that situation.
Расчет конечной температуры реакции по удельной теплоемкости
На чтение 2 мин. Просмотров 92 Опубликовано 04.06.2021
Этот пример задачи демонстрирует, как вычислить конечную температуру вещества, учитывая количество использованной энергии, массу и начальную температуру.
Содержание
- Проблема
- Решение
- Конечная температура После смешивания
- Задача
- Решение
Проблема
300 граммов этанола при 10 ° C нагреваются с помощью 14640 джоулей энергии. Какова конечная температура этанола?
Полезная информация : удельная теплоемкость этанола составляет 2,44 Дж/г · ° C.
Решение
Используйте формулу
q = mcΔT
Где
- q = Нагрев Энергия
- m = Масса
- c = Удельная теплоемкость
- ΔT = Изменение температуры.
14640 Дж = (300 г) (2,44 Дж/г · ° C) ΔT
Решить для ΔT:
- ΔT = 14640 Дж/(300 г) (2,44 Дж/г · ° C)
- ΔT = 20 ° C
- ΔT = T final – T начальный
- T final = T начальный + ΔT
- T final = 10 ° C + 20 ° C
- T final = 30 ° C
Ответ : Конечная температура этанола составляет 30 ° C.
Конечная температура После смешивания
Когда вы смешиваете вместе два вещества с разными начальными температурами применяются одни и те же принципы. Если материалы не вступают в химическую реакцию, все, что вам нужно сделать для определения конечной температуры, – это предположить, что оба вещества в конечном итоге достигнут одинаковой температуры.
Задача
Найдите конечную температуру, когда 10,0 граммов алюминия при 130,0 ° C смешиваются с 200,0 граммами воды при 25 ° C. Предположим, что вода не теряется в виде водяного пара.
Решение
Опять же, вы используете q = mcΔT, но предполагаете, что q aluminium = q water и решите для T, которая является конечной температурой. Вам нужно найти значения удельной теплоемкости (c) для алюминия и воды. В этом решении используется 0,901 для алюминия и 4,18 для воды:
- (10) (130 – T) (0.901) = (200.0) ( T – 25) (4.18)
- T = 26,12 ° C
Для
определения начальной температуры
продукта найдем мольные доли компонентов.
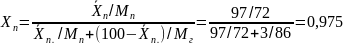
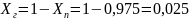
Где


При
изобарной кривой кипения найдем начальную
температуру смеси. Для этого, из точки
X=
0,985 восстановим перпендикуляр до
пересечения с изобарной кривой кипения,
где X=
0,975- мольная концентрация пентана в
смеси,
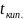
=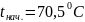
2.3. Определение температурного режима и
Принимаем,
что в теплообменнике смесь углеводородов
направлена в межтрубное пространство,
а охлаждающий агент (вода технологическая)-
в трубное пространство.
Схема
движения теплоносителей:








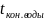

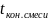
Имеем:



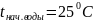
Тогда при движение теплоносителей
противотоком имем:

70,5
70,5
25
38

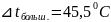
;
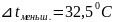
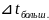
45,5
Так как
=
= 1,4

2 ,то
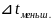
32,5
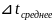
= ( 45,5 + 32,5) / 2= 39
25 +38
== =
31,5
= 70,5
2
2.4. Расчет физико- химических величин теплоносителей.
2.4.1. Смеси углеводородов при
а
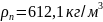

) плотность:
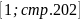
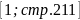
Плотность
для смеси жидких углеводородов находится
по формуле:
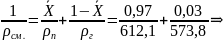
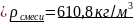
б)
динамический коэфициент вязкости:
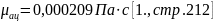
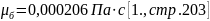
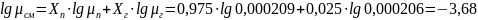
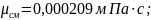
в)
теплопроводность:
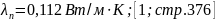
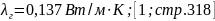
Теплопроводность
для смеси жидких углеводородов находим
по формуле:
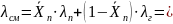
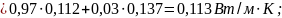
г)
Удельная
теплота парообразования:


Удельная
теплота парообразования для смеси
рассчитаем по правилу аддитивности:
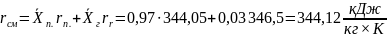
2.4.2 Физико- химические величины воды при
выписаны
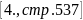
плотность:

;
теплоёмкость
:
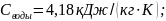
теплопроводность:

динамический
коэфициент вязкости :
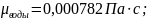
критерий
Прандтля:
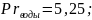
2.5. Тепловой расчет.
Общее
количество теплоты :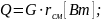
где
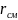
– удельная теплота парообразования
смеси.

2.6. Приближенный расчет площади поверхности теплопередачи.
Найдем
расход воды в дефлегматоре:
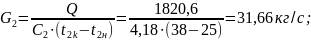
где
Q-тепловая
нагрузка аппарата;
Q=
2603,35 кВт;
(Расчет
темловой нагрузки аппарата Q,
смотри пункт 2.5. в курсовом проекте)
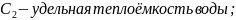


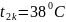
;
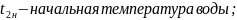

Соответсвенно
таблице 2
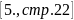
коэффициент теплопередачи от
конденсирующего пара органических
веществ к воде составляет :
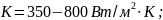
Для
приближенного расчета зададим
коэффициентом теплопередачи

.
тогда ориентировочная площадь поверхности
теплообмена составим :

,
где
Q-
тепловая нагрузка аппарата;
Q=
2603,35
кВт ;

(Расчет
средней разности тмператур
, смотри пункт 2.4. в курсавом проекте)
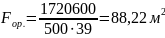
При
критерий Рейнольдса ~ 10000, скорость воды
составит:
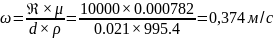
Но
скорость воды в заводских трубопроводах
должна быть не меньше 0,5 м/с. Поэтому в
нашем случае критерий Рейнольдса должен
быть больше.
Зададим
критерием Рейнольдса: Re=
15000, определяем соотношение n/z
для конденсатора из труб диаметром
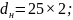
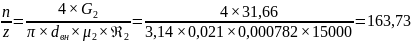
В
соответствии с таблицей II.4.

примем теплообменник со следующими
характеристиками:
I
вариант:

Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
