Идеальный газ — газ, удовлетворяющий трем условиям:
- Молекулы — материальные точки.
- Потенциальная энергия взаимодействия молекул пренебрежительно мала.
- Столкновения между молекулами являются абсолютно упругими.
Реальный газ с малой плотностью можно считать идеальным газом.
Измерение температуры
Температуру можно измерять по шкале Цельсия и шкале Кельвина. По шкале Цельсия за нуль принимается температура, при которой происходит плавление льда. По шкале Кельвина за нуль принимается абсолютный нуль — температура, при котором давление идеального газа равно нулю, и его объем тоже равен нулю.
Обозначение температуры
- По шкале Цельсия — t. Единица измерения — 1 градус Цельсия (1 oC).
- По шкале Кельвина — T. Единица измерения — 1 Кельвин (1 К).
Цена деления обеих шкал составляет 1 градус. Поэтому изменение температуры в градусах Цельсия равно изменению температуры в Кельвинах:
∆t = ∆T
При решении задач в МКТ используют значения температуры по шкале Кельвина. Если в условиях задачи температура задается в градусах Цельсия, нужно их перевести в Кельвины. Это можно сделать по формуле:
T = t + 273
Если особо важна точность, следует использовать более точную формулу:
T = t + 273,15
Пример №1. Температура воды равна oC. Определить температуру воды в Кельвинах.
T = t + 273 = 2 + 273 = 275 (К)
Основное уравнение МКТ идеального газа
Давление идеального газа обусловлено беспорядочным движением молекул, которые сталкиваются друг с другом и со стенками сосуда. Основное уравнение МКТ идеального газа связывает давление и другие макропараметры (объем, температуру и массу) с микропараметрами (массой молекул, скоростью молекул и кинетической энергией).
Основное уравнение МКТ
Давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
p=23n−Ek
p — давление идеального газа, n — концентрация молекул газа, −Ek — средняя кинетическая энергия поступательного движения молекул.
Выражая физические величины друг через друга, можно получить следующие способы записи основного уравнения МКТ идеального газа:
|
p=13m0n−v2 |
m0— масса одной молекулы газа; n — концентрация молекул газа; −v2 — среднее значение квадрата скорости молекул газа. Среднее значение квадрата скорости не следует путать со среднеквадратичной скоростью v, которая равна корню из среднего значения квадрата скорости: v=√−v2 |
|
p=13ρ−v2 |
ρ — плотность газа |
|
p=nkT |
k — постоянная Больцмана (k = 1,38∙10–3 Дж/кг) T — температура газа по шкале Кельвина |
Пример №2. Во сколько раз уменьшится давление идеального одноатомного газа, если среднюю кинетическую энергию теплового движения молекул и концентрацию уменьшить в 2 раза?
Согласно основному уравнению МКТ идеального газа, давление прямо пропорционально произведению средней кинетической энергии теплового движения молекул и концентрации его молекул. Следовательно, если каждая из этих величин уменьшится в 2 раза, то давление уменьшится в 4 раза:

Следствия из основного уравнения МКТ идеального газа
Через основное уравнение МКТ идеального газа можно выразить скорость движения молекул (частиц газа):
v=√3kTm0=√3RTM
R — универсальная газовая постоянная, равная произведения постоянной Авогадро на постоянную Больцмана:
R=NAk=8,31 Дж/К·моль
Температура — мера кинетической энергии молекул идеального газа:
−Ek=32kT
T=2−Ek3k
Полная энергия поступательного движения молекул газа определяется формулой:
E=N−Ek
Пример №3. При уменьшении абсолютной температуры на 600 К средняя кинетическая энергия теплового движения молекул неона уменьшилась в 4 раза. Какова начальная температура газа?
Запишем формулу, связывающую температуру со средней кинетической энергией теплового движения молекул, для обоих случаев, с учетом что:

Следовательно:

Составим систему уравнений:

Отсюда:

Задание EF19012
 На графике представлена зависимость объёма постоянного количества молей одноатомного идеального газа от средней кинетической энергии теплового движения молекул газа. Опишите, как изменяются температура и давление газа в процессах 1−2 и 2−3. Укажите, какие закономерности Вы использовали для объяснения.
На графике представлена зависимость объёма постоянного количества молей одноатомного идеального газа от средней кинетической энергии теплового движения молекул газа. Опишите, как изменяются температура и давление газа в процессах 1−2 и 2−3. Укажите, какие закономерности Вы использовали для объяснения.
Алгоритм решения
1.Указать, в каких координатах построен график.
2.На основании основного уравнения МКТ идеального газа и уравнения Менделеева — Клапейрона выяснить, как меняются указанные физические величины во время процессов 1–2 и 2–3.
Решение
График построен в координатах (V;Ek). Процесс 1–2 представляет собой прямую линию, исходящую из начала координат. Это значит, что при увеличении объема растет средняя кинетическая энергия молекул. Но из основного уравнения МКТ идеального газа следует, что мерой кинетической энергии молекул является температура:
T=2−Ek3
Следовательно, когда кинетическая энергия молекул растет, температура тоже растет.
Запишем уравнение Менделеева — Клапейрона:
pV=νRT
Так как количество вещества одинаковое для обоих состояния 1 и 2, запишем:
νR=p1V1T1=p2V2T2
Мы уже выяснили, что объем и температура увеличиваются пропорционально. Следовательно, давление в состояниях 1 и 2 равны. Поэтому процесс 1–2 является изобарным, давление во время него не меняется.
Процесс 2–3 имеет график в виде прямой линии, перпендикулярной кинетической энергии. Так как температуры прямо пропорциональна кинетической энергии, она остается постоянной вместе с этой энергией. Следовательно, процесс 2–3 является изотермическим, температура во время него не меняется. Мы видим, что объем при этом процессе уменьшается. Но так как объем и давление — обратно пропорциональные величины, то давление на участке 2–3 увеличивается.
Ответ:
• Участок 1–2 — изобарный процесс. Температура увеличивается, давление постоянно.
• Участок 2–3 — изотермический процесс. Температура постоянно, давление увеличивается.
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17560
Первоначальное давление газа в сосуде равнялось р1. Увеличив объём сосуда, концентрацию молекул газа уменьшили в 3 раза, и одновременно в 2 раза увеличили среднюю энергию хаотичного движения молекул газа. В результате этого давление р2 газа в сосуде стало равным
Ответ:
а) 13p1
б) 2p1
в) 23p1
г) 43p1
Алгоритм решения
1.Записать исходные данные.
2.Записать основное уравнение МКТ идеального газа.
3.Составить уравнения для состояний 1 и 2.
4.Выразить искомую величину.
Решение
Исходные данные:
• Начальное давление: p0.
• Начальная концентрация молекул: n1 = 3n.
• Конечная концентрация молекул: n2 = n.
• Начальная средняя энергия хаотичного движения молекул: Ek1 = Ek.
• Конечная средняя энергия хаотичного движения молекул: Ek2 = 2Ek.
Основное уравнение МКТ:
p=23n−Ek
Составим уравнения для начального и конечного состояний:
p1=23n1−Ek1=233n−Ek=2n−Ek
p2=23n2−Ek2=23n2−Ek=43n−Ek
Отсюда:
n−Ek=p12=3p24
p2=4p16=23p1
Ответ: в
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18416
Цилиндрический сосуд разделён неподвижной теплоизолирующей перегородкой. В одной части сосуда находится кислород, в другой – водород, концентрации газов одинаковы. Давление кислорода в 2 раза больше давления водорода. Чему равно отношение средней кинетической энергии молекул кислорода к средней кинетической энергии молекул водорода?
Алгоритм решения
1.Записать исходные данные.
2.Записать основное уравнение МКТ идеального газа.
3.Составить уравнения для обоих газов.
4.Найти отношение средней кинетической энергии молекул кислорода к средней кинетической энергии молекул водорода.
Решение
Анализируя условия задачи, можно выделить следующие данные:
• Концентрации кислорода и водорода в сосуде равны. Следовательно, n1 = n2 = n.
• Давление кислорода вдвое выше давления водорода. Следовательно, p1 = 2p, а p2 = p.
Запишем основное уравнение идеального газа:
p=23n−Ek
Применим его для обоих газов и получим:
p1=23n1−Ek1 или 2p=23n−Ek1
p2=23n2−Ek2 или p=23n−Ek2
Выразим среднюю кинетическую энергию молекул газа из каждого уравнения:
−Ek1=3pn
−Ek2=3p2n
Поделим уравнения друг на друга и получим:
−Ek1−Ek2=3pn·2n3p=2
Ответ: 2
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18824
В одном сосуде находится аргон, а в другом – неон. Средние кинетические энергии теплового движения молекул газов одинаковы. Давление аргона в 2 раза больше давления неона. Чему равно отношение концентрации молекул аргона к концентрации молекул неона?
Алгоритм решения
1.Записать исходные данные.
2.Записать основное уравнение МКТ идеального газа.
3.Составить уравнения для обоих газов.
4.Найти отношение концентрации молекул аргона к концентрации молекул неона.
Решение
Анализируя условия задачи, можно выделить следующие данные:
• Средние кинетические энергии теплового движения молекул газов одинаковы. Следовательно, −Ek1=−Ek2=−Ek.
• Давление аргона в 2 раза больше давления неона. Следовательно, p1 = 2p, а p2 = p.
Запишем основное уравнение идеального газа:
p=23n−Ek
Применим его для обоих газов и получим:
p1=23n1−Ek1 или 2p=23n1−Ek
p2=23n2−Ek2 или p=23n2−Ek
Выразим концентрации молекул газа из каждого уравнения:
n1=3p−Ek
n2=3p2−Ek
Поделим уравнения друг на друга и получим:
n1n2=3p−Ek·2−Ek3p=2
Ответ: 2
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 10.8k
Как определить начальную температуру газа?
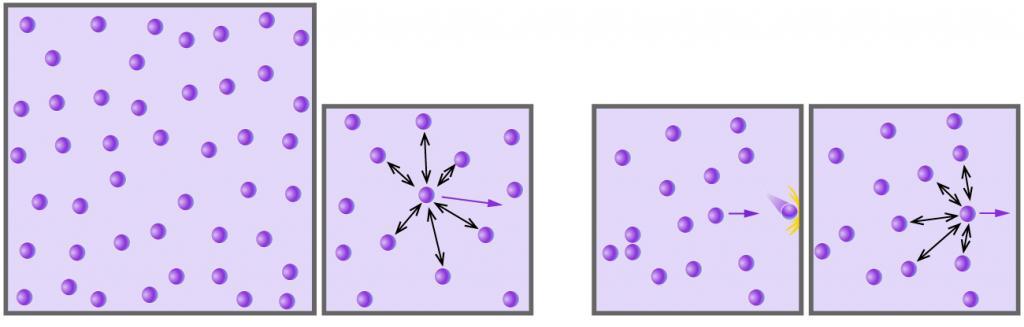
При нагревании газа до температуры 376 К средняя квадратичная
скорость его молекул увеличилась вдвое. Найти начальную температуру газа.
Решение.
Запишем формулу средней кинетической энергии молекулы газа.

m0
– масса молекулы; <vкв>
– средняя квадратичная скорость молекулы; k –
постоянная Больцмана; T
–
абсолютная температура газа.
Следовательно, T1
= T2/4
= 376/4 = 94,0 К.
Ответ: Начальная температура газа равна 94,0 К.
Источник: Пособие-репетитор для подготовки к централизованному тестированию. С.Н.Капельян, Л.А.Аксенович.
Как узнать температуру газа
Справочные данные: k (постоянная Больцмана) = 1,38 * 10-23 Дж/К. Температуру газа определим из формулы: Р = n * k * T, откуда T = Р / (n * k).
- Для определения температуры газа используются различные формулы и уравнения, включая формулу Клапейрона-Менделеева и уравнение Менделеева-Клапейрона.
- Единицей измерения температуры в газе является градус Кельвина, хотя некоторые практические измерения могут выражаться в градусах Цельсия.
- Температура газа может варьироваться в зависимости от его состояния, также как и в зависимости от режима горения и различных особенностей газовой смеси.
- Для измерения температуры газа используют газовые термометры, которые оперируют зависимостью давления или объема газа от температуры.
- Чтобы узнать содержимое газового баллона, можно взвесить его до и после использования, чтобы определить массу газа внутри.
- Начальную температуру газа можно определить с помощью уравнения P1/T1=P2/T2.
- Температура идеального газа может быть определена из формулы PV=mRT/M.
- Для определения температуры водорода в баллоне используется уравнение Менделеева-Клапейрона: Р*V=(m/M)*R*T.
- Как узнать температуру идеального газа
- Как определить температуру газа в баллоне
- Как определить начальную температуру газа
- В чем измеряется температура газа
- Какая температура у газа
- Каким прибором измеряют температуру газа
- Сколько градусов в газовом баллоне
- Как узнать что в баллоне
- Какая температура у сжиженного газа
- Как определить температуру газа в Кельвинах
- Как определить абсолютную температуру
- Чем определяется температура газа в газопроводе
- Что называется температурой газа
- В чем измеряет газ
- Как измеряется температура
- Как найти работу идеального газа
- Как найти температуру по формуле
- Как найти давление идеального газа
Как узнать температуру идеального газа
Ответы1. Состояние идеального газа описывается формулой Клапейрона-Менделеева: PV = mRT/M, где P, V, T — давление, объем и абсолютная температура соответственно, m — масса газа, R — универсальная газовая постоянная, M — молярная масса.
Как определить температуру газа в баллоне
Для вычисления температуры водорода в баллоне используем уравнение Менделеева — Клапейрона: Р * V = (m / M) * R * T, откуда T = Р * V * M / (m * R).
Как определить начальную температуру газа
Начальную температуру газа определим из равенства: P1 / T1 = P2 / T2, откуда Т1 = Р1 * Т2 / Р2 = Р1 * (Т1 + 1) / 1,002Р1 = (Т1 + 1) / 1,002.
В чем измеряется температура газа
В системе СИ единицей измерения температуры установлен градус Кельвина. Допускается для выражения практических результатов измерений температуры применение градуса Цельсия наряду с градусом Кельвина, в зависимости от начала отсчета (положения нуля) по шкале.
Какая температура у газа
Температура пламени при различных режимах горения
Воспламенение газа происходит при температуре от 650 до 700 градусах, а стабильный процесс горения — от 850 до 900. Таких значений вполне достаточно для готовки блюд и нагрева горячей воды: для мытья рук и даже отопления помещения.
Каким прибором измеряют температуру газа
Газовый термометр, прибор для измерения температуры, действие которого основано на зависимости давления или объёма идеального газа от температуры.
Сколько градусов в газовом баллоне
Существует несколько видов резьбовых баллонов этого стандарта, первые выдают температуру около 1300 градусов, а вторые используются пайки медии выдают температуру от 1500 до 2500 градусов. Уровень температуры горениянапрямую зависит от особенностей газовой смеси.
Как узнать что в баллоне
Взвешивание Наиболее простой и доступный для любого потребителя способ. Из маркировки баллона, которая находится на его горловине или на дне, можно узнать вес пустого сосуда. Взвесив баллон с остатками газа и определив разницу, вы узнаете массу газа в баллоне.
Какая температура у сжиженного газа
160°C.
ИА Neftegaz.RU. Сжиженный природный газ (СПГ) — природный газ, искусственно сжиженный путем охлаждения до -160°C, для облегчения хранения и транспортировки. СПГ представляет собой бесцветную жидкость без запаха, плотность которой в 2 раза меньше плотности воды. На 75-99% состоит из метана.
Как определить температуру газа в Кельвинах
Для перевода градусов цельсия в кельвины необходимо пользоваться формулой T=t+T0 где T- температура в кельвинах, t- температура в градусах цельсия, T0=273.15 кельвина. По размеру градус Цельсия равен Кельвину.
Как определить абсолютную температуру
T = t + 273 К. Напомним, что цена деления по шкале Кельвина и Цельсия одинакова. 1 градус Цельсия и 1 кельвин равны.
Чем определяется температура газа в газопроводе
При движении по участку температура газа постепенно снижается, достигая минимального значения в конце участка. Температурный режим участка определяется рядом факторов: теплообменом с окружающей средой, расширением газа и силами трения в потоке газа.
Что называется температурой газа
Температура газа является мерой степени возбуждения молекул. Таким образом, средняя кинетическая энергия поступательного движения молекул газа рассчитывается путем измерения его температуры.
В чем измеряет газ
Соответственно, количество газа, как правило, измеряют в кубических метрах (м³), редко — в единицах массы, килограммах или тоннах (в основном — технологических газов).
Как измеряется температура
Её измеряют с помощью термометра (от греческого термо — «тепло», метрон — «мера»). Единица измерения — градус. Термометры бывают ртутные или спиртовые (при температуре (-38) °С ртуть замерзает). Существуют разные шкалы измерения температуры: Цельсия (°С), Кельвина (К), Фаренгейта (°F).
Как найти работу идеального газа
Работа газа равна: A = F∆x = pS∆x. Но S∆x = ∆V изменение объёма газа.
Как найти температуру по формуле
T = tо + 273. Температура — мера средней кинетической энергии молекул.
Как найти давление идеального газа
Давление идеального газа определяется за формулой Клапейрона-Менделеева: pV = nRT.
Оставить отзыв (1)
Как найти первоначальную температуру газа
Часто в ходе какого-либо технологического процесса или при решении задач из курса термодинамики возникает необходимость ответить на вопрос: какова была начальная температура смеси газов, находившейся при определенных условиях (объеме, давлении и т.д.)

Инструкция
Предположим, заданы такие условия. Смесь трех газов: водорода, углекислого газа и кислорода, первоначально занимала сосуд объемом 22, 4 литра. Масса водорода составляла 8 г, масса углекислого газа – 22 г, а кислорода – 48 г. При этом парциальное давление водорода ровнялось примерно 4,05*10^5 Па, углекислого газа – 5,06*10^4 Па, а кислорода, соответственно – 3,04*10^5 Па. Требуется определить первоначальную температуру этой газовой смеси.
Прежде всего вспомните закон Дальтона, гласящий: общее давление смеси газов, находящейся в каком-то объеме, равно сумме парциальных давлений каждого из компонентов этой смеси. Сложите известные вам величины: 4,05*10^5 + 0,506*10^5 + 3,04*10^5 = 7,596*10^5 Па. Для упрощения расчетов примите округленное значение: 7,6*10^5 Па. Таково давление газовой смеси.
Теперь вам на помощь придет универсальное уравнение Менделеева-Клапейрона, описывающее состояние идеального газа. Разумеется, ни один из компонентов вашей смеси не является идеальным газом, но его вполне можно использовать в расчетах – погрешность будет очень невелика. Это уравнение записывается в такой форме: PV = MRT/m, где P – давление газа, V – его объем, R – универсальная газовая постоянная, M – фактическая масса газа, m – его молярная масса.
Но ведь у вас смесь газов. Как же быть в этом случае? Надо лишь немного преобразовать уравнение Менделеева-Клапейрона, записав его в таком виде: PV = (M1/m1 + M2/m2 + M3/m3) RT.
Легко можно понять, что если бы количество компонентов газовой смеси было равно 4, 5, 6 и т.д., уравнение преобразовывалось бы абсолютно аналогичным образом. Следовательно, искомая начальная температура газовой смеси вычисляется по формуле: Т = PV/(M1/m1 + M2/m2 + M3/m3)R.
Подставив в эту формулу известные вам значения (с учетом того, что величина R равна 8,31), и произведя вычисления, вы получите: 7,6*10^5* 0,0224 / (8,31 * 7,5) = 17024/62,325 = 273,15. Это значение температуры выражено, разумеется, в градусах Кельвина. То есть получается, что первоначально газовая смесь содержалась при температуре, равной 0 градусов по шкале Цельсия. Задача решена.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Температура – термодинамическая макроскопическая характеристика, которая играет важную роль практически во всех физических процессах. В данной статье сосредоточим свое внимание на освещении вопросов, что такое абсолютная температура газа идеального и как ее можно вычислить.
Абсолютная шкала температур
Для начала познакомимся со шкалой, которая используется в физике для описания температуры. Она называется абсолютной или шкалой Кельвина. Впервые ее ввел в использование английский физик лорд Кельвин в 1848 году. При этом ученый основывался на завоевавшей популярность шкале Цельсия.

Абсолютная температура так называется потому, что она имеет нижний предел – 0 кельвин, при котором считается “замороженным” любой вид движения (на самом деле при 0 К существуют так называемые нулевые колебания). Верхнего предела у этой шкалы нет.
С градусами Цельсия C абсолютная шкала T связана следующим простым равенством:
T = C + 273,15.
В отличие от других температурных шкал, например, от шкалы Фаренгейта, кельвин имеет точно такой же масштаб, что и градус Цельсия. Последнее означает, что для перевода в абсолютную любой температуры по Цельсию достаточно добавить к ней число 273,15. Так, по шкале Кельвина вода замерзает при 273,15 К, а кипит при 373,15 К.

Краткое понятие о газе идеальном
Поскольку далее будет рассмотрена формула для определения абсолютной температуры газа идеального, то будет полезным познакомиться с этим понятием поближе. Под идеальным понимают такой газ, молекулы которого практически не взаимодействуют друг с другом, обладают большой кинетической энергией по сравнению с потенциальной, и расстояния между которыми значительно превышают их собственные размеры.
Все реальные газы проявляют поведение идеальных при небольших давлениях и высоких температурах. Примерами могут служить благородные газы, воздух, метан и другие. В то же время пар H2O даже при низких давлениях сильно отличается от идеального газа, поскольку в нем всегда присутствуют значительные водородные связи между полярными молекулами воды.
Температура абсолютная идеального газа
Существует два подхода к определению температуры в газах. Рассмотрим каждый из них.
Первый подход заключается в привлечении положений молекулярно-кинетической теории (МКТ) и физического смысла самой температуры T. Последний заключается в кинетической энергии частиц газа. Чем больше эта энергия, тем выше температура, причем зависимость является прямо пропорциональной. Используя формулу из механики для энергии кинетической и постоянную Больцмана kB можно записать следующее равенство МКТ:
m*v2/2 = 3/2*kB*T.
Где m – масса движущейся поступательно частицы. Выражая из этого равенства величину T, получаем формулу:
T = m*v2/(3*kB).
Чем меньше масса частицы и чем больше ее скорость, тем выше абсолютная температура.
Второй подход в определении величины T заключается в использовании универсального уравнения Клапейрона-Менделеева. Это уравнение было записано в XIX веке Эмилем Клапейроном (впоследствии модифицировано Д. И. Менделеевым) как результат обобщения открытых экспериментально в XVII-XIX веках газовых законов (Шарля, Гей-Люссака, Бойля-Мариотта, Авогадро). Математически универсальное уравнение записывается так:
P*V = n*R*T.
Как видно, оно связывает три основных термодинамических величины системы: давление P, объем V и температуру абсолютную T. Две другие величины, присутствующие в уравнении, – это n – количество вещества и R – газовая постоянная.
Не представляет особого труда получить формулу для температуры из Клапейрона-Менделеева закона:
T = P*V/(n*R).
В закрытой системе (n = const) температура газа прямо пропорциональна произведению объема на давление.
Пример задачи
Воздух, которым мы дышим, является смесью газов идеальных. Известно, что молярная масса воздуха составляет 29 г/моль. Необходимо определить температуру воздуха, если средняя скорость его молекул составляет 530 м/с.
Очевидно, что решение этой задачи можно получить, если воспользоваться следующим выражением:
T = m*v2/(3*kB).
Массу одной молекулы m воздуха можно получить, если поделить величину M на число Авогадро NA. Произведение же числа NA на константу Больцмана kB – это не что иное, как газовая постоянная R, которая равна 8,314 Дж/(К*моль). Учитывая эти рассуждения, получаем рабочую формулу:
T = M*v2/(3*R ) = 0,029*6002/(3*8,314) = 326,60 К.

В градусах Цельсия найденной температуре соответствует значение 53,45 oC. На нашей планете такие температуры характерны для жарких песчаных пустынь в полдень.
