подскажите пожалуйста как определить по таблице менделеева какой элемент активнее ?
Ученик
(137),
закрыт
11 лет назад
NiNa Martushova
Искусственный Интеллект
(153334)
11 лет назад
В периодах с увеличением порядкового номера металлические свойства ослабевают, а неметаллические усиливаются. В группах с увеличением зарада ядра металлические свойства усиливаются, а неметаллические ослабевают. Поэтому, чем выше и правее стоит элемент в таблице, тем активнее его свойства, как неметалла. Если левее и ниже, элемент более активен, как металл.
Самый активный металл – литий Li, самый активный неметалл – фтор F2
их соединение – фторид лития LiF
Высший гидроксид хлора – хлорная кислота HClO4
одноосновная кислота, одна из самых сильных, исключительно сильный окислитель.
TomasR_zn
18 Апр, 18

Найди верный ответ на вопрос ✅ «1) Как изменяются металлические свойства элементов в периодах? в главных подгруппах? 2) Найдите в периодической системе наиблее активный …» по предмету 📙 Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Искать другие ответы
Главная » Химия » 1) Как изменяются металлические свойства элементов в периодах? в главных подгруппах? 2) Найдите в периодической системе наиблее активный металл и наиболее активный неметалл?
Неметаллы


4.1
Средняя оценка: 4.1
Всего получено оценок: 2384.
4.1
Средняя оценка: 4.1
Всего получено оценок: 2384.
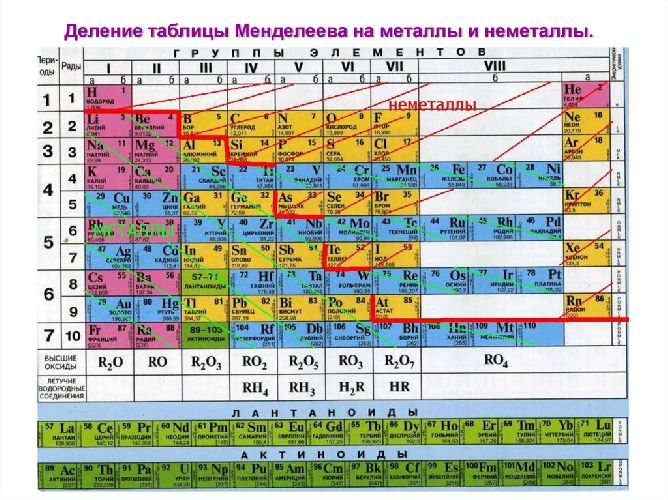
Неметаллы – элементы, которые обладают неметаллическими свойствами и занимают положение в правом верхнем углу в таблице Менделеева. Каков же характер неметаллов, а также чем они отличаются от других соединений узнаем в этой статье.
Общая характеристика
К неметаллическим элементам относятся p-элементы, а также водород и гелий, которые в свою очередь относятся к s-элементам. Они расположены правее и выше диагонали бор-астат. Всего же известно 22 неметалла. У наиболее типичных неметаллов заполнение электронами внешнего уровня близко к максимальному, а радиусы атомов – минимальные среди элементов данного периода.
Атомы неметаллов имеют более высокие значения электроотрицательности, а соответственно высокие энергии ионизации и большое сродство к электрону. В связи с этим характер неметаллов таков, что, в отличии от металлов, могут проявлять окислительные свойства. В реакциях они могут восстанавливаться, присоединяя столько электронов, чтобы общее их количество на внешнем уровне достигло восьми (завершенный уровень, стабильное состояние атома).
Именно поэтому отрицательное значение степени окисления, которое могут иметь в соединениях неметаллы, в отличие от металлов, равно разности (8-N группы). Наиболее высокую электроотрицательность имеют неметаллы, положение которых приходится на правый верхний угол в Периодической системе, то есть галогены фтор и хлор, а также кислород. Именно эти элементы могут образовывать ионные связи. Самым активным неметаллом является фтор, который в соединениях может проявлять только одну валентность I и одну степень окисления -1.
Особенности строения неметаллов заключаются в том, что внешний электронный слой у большинства атомов неметаллов содержит от 4 до 8 электронов.
Другие неметаллы (кроме фтора) могут проявлять и положительные степени окисления, образуя ковалентные связи с другими элементами.
Физические свойства
Для большинства неметаллов простых веществ в твердом агрегатном состоянии характерна молекулярная кристаллическая решетка. То есть эти неметаллы являются кристаллическими веществами. Поэтому при обычных условиях они имеют вид газов, жидкостей или твердых веществ с низкими температурами плавления. Примерами таких веществ являются газы: водород H2 , неон Ne, жидкость – бром Br2 , твердые вещества йод I2, сера S8, фосфор P4 (белый фосфор). Существуют неметаллы (бор, углерод, кремний), которые имеют атомные кристаллические решетки.

Важнейшие элементы, которые содержаться в живых организмах – органогены. Они образуют воду, белки, витамины, жиры. К ним относятся 6 элементов: углерод, кислород, водород, азот, фосфор, сера.
Химические свойства и соединения
Водородные соединения неметаллов в основном являются летучими соединениями, в водных растворах имеющими кислотный характер. Они имеют молекулярные структуры, ковалентную полярную связь. Некоторые из них (вода, аммиак, фтороводород) образуют водородные связи. Соединения образуются при непосредственном взаимодействии неметаллов с водородом. Электронная формула серы с водородом выглядит следующим образом:
S+H2 =H2 S (до 350 градусов равновесие смещено вправо)
Все водородные соединения – восстановители (кроме HF), причем их восстановительная сила возрастает справа налево по периоду и сверху вниз по подгруппе.
Неметаллы взаимодействуют с металлами и другими неметаллами:
2Na+Cl2 =2NaCl
В результате получается натриевая соль соляной кислоты

S+O2 =SO2
соединения неметаллов с кислородом, как правило, являются кислотными оксидами, которым соответствуют кислородосодержащие кислоты. Структура оксидов типичных неметаллов молекулярная (SO3, P4 O10). Чем выше степень окисления неметалла, тем сильнее соответствующая оксокислота. Так, хлор непосредственно не взаимодействует с кислородом, однако образует ряд оксокислот, которым соответствуют оксиды, ангидриды этих кислот.
Неметаллы находят применение в разных отраслях промышленности. Вот список отраслей, где их использование является наиболее востребованным.
| Область применения | Примеры, перечень неметаллов, применяемых в той или иной промышленности |
| промышленность | Сера, азот и фосфор часто используют для получения кислот. Серу также используют на производстве резины. |
| транспорт | важным неметаллом в транспортной промышленности является водород. Его используют в качестве топлива. При сгорании такой вид топлива не загрязняет окружающую среду. |
| аграрная отрасль | сера используется для борьбы с вредными насекомыми и болезнями растений |
| медицина | Кислород используют для восстановления дыхания (кислородные подушки), уголь в форме активированного угля, который способен выводить из организма вредные вещества. |
| пищевая промышленность | азот используют для продления срока годности продуктов |

Что мы узнали?
В этой статье за 9 класс химии кратко излагается основная информация о неметаллах, их строении, и о том, с чем реагируют неметаллы. Неметаллами могут быть газы, жидкости и твердые вещества с кристаллической решеткой. Самым активным неметаллом является фтор, который имеет степень окисления-1.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Владомир Петрунько
10/10
-

Евгений Бурлуцкий
10/10
-

Анна Кучапова
10/10
-

Полина Богданова
10/10
-

Иван Сутягин
10/10
-

Саша Сиднев
9/10
-

Ислам Искаков
10/10
-

Kiřill Kóřóbóchki
10/10
-

Fozil Fhhbv
10/10
-

Александр Балабан
10/10
Оценка доклада
4.1
Средняя оценка: 4.1
Всего получено оценок: 2384.
А какая ваша оценка?
 Наиболее активные неметаллы относятся к семейству галогенов, которое находится слева от благородных газов в правой части периодической таблицы. Галогены настолько реактивны, что они никогда не встречаются в природе сами по себе.
Наиболее активные неметаллы относятся к семейству галогенов, которое находится слева от благородных газов в правой части периодической таблицы. Галогены настолько реактивны, что они никогда не встречаются в природе сами по себе.
Элементы фтора, хлора, брома, йода и астатина составляют группу галогенов. Галогены имеют семь валентных электронов, а это означает, что у них семь электронов в их самых внешних оболочках. Эти валентные электроны являются причиной реактивности элемента.
Тенденция атомов состоит в том, чтобы заполнить эту самую внешнюю оболочку потенциалом для достижения стабильного расположения электронов. Например, благородные газы, которые содержат восемь электронов в крайнем энергетическом уровне, являются чрезвычайно стабильными элементами, поскольку они уже имеют полный набор электронов.
В природе благородные газы обычно не образуют соединений с каким-либо другим элементом. Все остальные элементы должны найти ситуации, в которых они могут либо пожертвовать, либо получить электроны для достижения своего полного дополнения. Галогены, потому что им нужен еще один электрон, чтобы иметь стабильную компоновку, как правило, пытаются захватить электроны из других элементов; поэтому галогены считаются электроотрицательными элементами.
Галогены, как правило, образуют стабильные устройства, называемые двухатомными молекулами, в которых два из одного и того же галогенового элемента разделяют электрон. Электронные доноры, такие как металлы, как в сочетании с галогенами, образуют стабильные соединения. Хлорид натрия, обычная поваренная соль, является результатом химической реакции между металлом натрия и галогеном.
