Загрузить PDF
Загрузить PDF
Умение давать названия основным химическим соединениям – необходимая составляющая успешного изучения химии. Следуйте данному руководству, чтобы узнать некоторые базовые правила присвоения названий химическим соединениям, а также научиться называть химические соединения, которые вы увидели впервые.
-
1
Выясните, что делает соединение ионным. Ионные соединения содержат металл и неметалл. Взгляните на периодическую систему и посмотрите, к какой категории относятся элементы соединения.
-
2
Составьте имя. Назвать двухэлементное ионное соединение легко. Первая часть названия – это название элемента-неметалла с суффиксом “-ид”. Вторая часть названия – это название элемента-металла в родительном падеже.
- Пример: Al2O3. Al2 = Алюминий; O3 = Кислород (Оксиген). Соответственно, название этого соединения – “оксид алюминия”.
-
3
Научитесь определять металлы переменной валентности. Металлы в блоках D и F периодической системы называются металлами переменной валентности. При составлении названия соединения их валентность пишется как римская цифра. Это объясняется тем, что у них может быть больше одной валентности, и что они могут образовывать больше одного соединения с другим атомом.
- Пример: FeCl2 и FeCl3. Fe = Железо; Cl2 = Хлорид -2; Cl3 = Хлорид -3. Название будет выглядеть так: хлорид железа (II) и хлорид железа (III).
Реклама
-
1
Выясните, что такое многоатомное соединение. Эти соединения состоят из групп атомов, связанных друг с другом, причем вся группа имеет положительный или отрицательный заряд. Вы можете выполнять с многоатомными соединениями три базовые операции:
- Добавлять атом водорода в начало соединения. Тогда в начало названия соединения добавляется слово “гидро”. Это снижает отрицательный заряд на единицу. Например, “карбонат” CO32- превратится в “гидрокарбонат” HCO3–.
- Убирать атом кислорода из соединения. Заряд останется таким же, а окончание названия соединения изменится с “-ат” на “-ит”. Например: переход от NO3 к NO2 – это переход от “нитрата” к “нитриту”.
- Заменять центральный атом другим из той же группы периодической системы. Например, сульфат SO42- может стать селенатом SeO42-.
- Добавлять атом водорода в начало соединения. Тогда в начало названия соединения добавляется слово “гидро”. Это снижает отрицательный заряд на единицу. Например, “карбонат” CO32- превратится в “гидрокарбонат” HCO3–.
-
2
Запомните наиболее часто встречающиеся сложные ионы. Данные ионы – база для формирования большинства названий многоатомных соединений. Они приведены ниже в порядке возрастания отрицательного заряда:
- Гидроксид-ион: OH–
- Нитрат-ион: NO3–
- Гидрокарбонат-ион: HCO3–
- Перманганат-ион: MnO4–
- Карбонат-ион: CO32-
- Хромат-ион: CrO42-
- Дихромат-ион: Cr2O72-
- Сульфат-ион: SO42-
- Сульфит-ион: SO32-
- Тиосульфат-ион: S2O32-
- Фосфат-ион: PO43-
- Ион аммония: NH4+
-
3
Составляйте названия соединений на основе данного списка. Объедините название какого-либо элемента или элементов, связанных со сложным ионом, и назовите соединение. Если элемент стоит перед сложным ионом, название элемента попросту ставится после названия иона.
- Пример: KMnO4. Мы видим, что ион MnO4– – это перманганат. K – это калий, поэтому название соединения – перманганат калия.
- Пример: NaOH. Мы видим, что OH– – это гидроксид-ион. Na – это натрий, поэтому название соединения – гидроксид натрия.
Реклама
- Пример: KMnO4. Мы видим, что ион MnO4– – это перманганат. K – это калий, поэтому название соединения – перманганат калия.
-
1
Выясните, что такое ковалентное соединение. Ковалентные соединения образуются из двух или более элементов-неметаллов. Имя соединения базируется на количестве присутствующих атомов. Добавляемый префикс – это латинское числительное, характеризующее количество молекул.
-
2
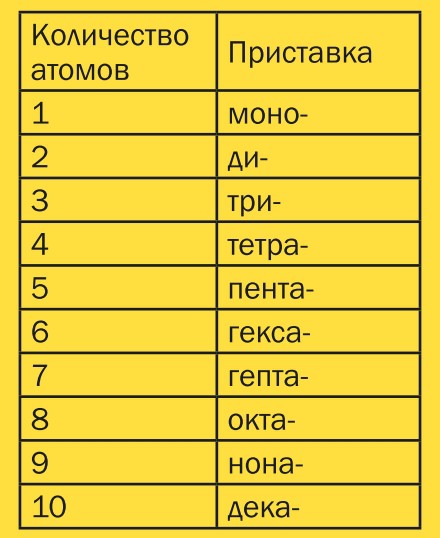
Изучите префиксы. Запомните префиксы для обозначения количества атомов от 1 до 8:
- 1 атом – “Моно-“
- 2 атома – “Ди-“
- 3 атома – “Три-“
- 4 атома – “Тетра-“
- 5 атомов – “Пента-“
- 6 атомов – “Гекса-“
- 7 атомов – “Гепта-“
- 8 атомов – “Окта-“
-
3
Называйте соединения. Используя соответствующие префиксы, назовите новое соединение. Вы можете добавлять префикс к любой части соединения, в котором есть несколько атомов.
- Пример: CO – это монооксид углерода, а CO2 диоксид углерода.
- Пример: N2S3 – это трисульфид диазота.
- В большинстве случаев префикс “моно-“ можно не использовать, поскольку при отсутствии префиксов подразумевается именно он. Однако этот префикс до сих пор используется для монооксида углерода в связи с использованием этого термина со времен ранней химии.
Реклама
- Пример: CO – это монооксид углерода, а CO2 диоксид углерода.
Советы
- Конечно же, у этих правил есть множество исключений. Например, несмотря на то, что CaCl2 имеет два атома хлора, он называется хлоридом кальция, а НЕ дихлоридом кальция, как можно было бы ожидать.
- Также важно понимать, что все это не относится к органической химии.
- Эти правила предназначены для людей, начинающих изучать химию и науку. Когда вы достигнете продвинутого уровня, вы узнаете, что существуют другие правила, например правило переменной валентности.
Реклама
Об этой статье
Эту страницу просматривали 62 495 раз.
Была ли эта статья полезной?
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Хочешь сдать ЕГЭ по химии и биологии на 90+? WhatsApp репетитора Богуновой В.Г. +7(903)186-74-55
Сайт репетитора Богуновой В.Г.
Репетитор Богунова В.Г. ВК
Ютуб-канал репетитора Богуновой В.Г.
Полный каталог статей – на авторском сайте в разделе “Статьи репетитора Богуновой В.Г.”
Знаете, в чем ошибка большинства преподавателей химии и репетиторов? Желая продемонстрировать степень собственного образования и никчемность знаний абитуриента, они, практически с первых занятий, начинают решать трудные задачи “уровня Белавина” и задания олимпиад. Кстати, профильные лицеи при ведущих медицинских ВУЗах – не исключение (у каждого ученика есть репетиторы). Как результат, у ребенка формируется страх перед сложным и объемным учебным материалом, который необходимо освоить. Нервная система включает защитный механизм – блокирование негативно воспринимаемой информации. И все … у абитуриента развивается стойкое отвращение к предмету! Теперь, чтобы инициировать ребенка на изучение химии, необходим опытный Преподаватель и много-много времени для работы. И нет никакой гарантии, что ученик раскроется и позволит Учителю выстроить у себя в голове стройную систему предмета. Поэтому, в преподавании, как и во врачевании, важны принципы: “Не навреди!”, “Пироги должен печь пирожник, а не сапожник”! Это я к тому, что репетиторов в последнее время развелось, как тараканов, очень много, а преподавателей среди них – днем с огнем не найдешь!
Не будем спотыкаться о чужие ошибки (своих не допустить бы, тьфу-тьфу), начнем изучение химии с нуля и сделаем первый шаг – составление, название и понимание формул веществ.
Конспект репетитора
Химическая формула – это запись состава вещества с помощью символов элементов и подстрочных индексов.
Индекс (подстрочный) обозначает число атомов данного элемента в молекуле вещества.
Коэффициент – число, стоящее перед химической формулой, обозначает число молекул вещества.
Например, запись 7H2SO4 означает: семь молекул серной кислоты, каждая из которых состоит из двух атомов водорода, одного атома серы и четырех атомов кислорода.
Познакомимся с алгоритмом составления формул веществ на примере бинарных соединений.
Бинарные соединения – вещества, образованные двумя химическими элементами (H2O, Al2S3, PCl5, NH3 и др.). Поучимся составлять формулы бинарных соединений по конкретному заданию.
Задание
Написать одну из формул и назвать соединение, молекула которого содержит атомы серы и фосфора
Алгоритм составления формул:
1. Выписать символы химических элементов в порядке увеличения их электроотрицательности.
Электроотрицательность (ЭО на схеме) – способность атома притягивать к себе электроны (и свои, и чужие).
2. Определить валентность элементов
Валентность – способность атомов химических элементов образовывать определенное число химических связей.
Высшая валентность (в) равна номеру группы. У первого элемента, стоящего левее, валентность либо определена, либо высшая. В нашем случае валентность фосфора не озвучена, поэтому берем высшую.
Низшая валентность (н) равна “восемь минус номер группы” (определяется только для элементов IVA-VIIA групп). У второго элемента, стоящего правее, валентность всегда низшая. В нашем случае сера – элемент VIA-группы, ее низшая валентность равна 8-6=2.
Запомнить: у кислорода валентность всегда 2, у фтора – всегда 1!
3. Определить число атомов каждого элемента (нижние индексы).
Для этого находим наименьшее общее кратное значений валентностей и делим его на каждое из них.
Для справки
Наименьшее общее кратное двух целых чисел m и n есть наименьшее натуральное число, которое делится на m и n без остатка.
4. Назвать вещество
Название бинарного соединения состоит из двух слов.
Первое слово – название второго элемента, стоящего правее (с низшей валентностью) с добавлением суффикса -ИД. В нашем случае – сульфид. Таким образом, суффикс -ИД указывает на то, что этот элемент имеет низшую валентность “восемь минус номер группы”.
Второе слово – название первого элемента, стоящего левее (с более низкой электроотрицательностью) – в родительном падеже. В нашем случае – фосфора (кого? чего?).
Если первый элемент может иметь несколько значений валентности, то в конце названия указывается конкретное значение валентности в скобках римскими цифрами. В нашем случае фосфор может иметь валентности 3 и 5, поэтому название вещества – сульфид фосфора (V).
Вы хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий, теоретического материала и познакомитесь с моими учениками, многие из которых уже давно закончили ВУЗы и, работая врачами, спасают наши с вами жизни.
На странице ВК я анонсирую свои публикации, вебинары, уроки, рассказываю и показываю решение задач и заданий, выкладываю новинки теоретического материала, конспекты и лекции. Добавляйтесь ко мне в друзья, и вы всегда будете в курсе всех событий, связанных с подготовкой к ЕГЭ, ДВИ, олимпиадам!
Полный каталог статей репетитора Богуновой В.Г. вы найдете на странице сайта Статьи репетитора
Подписывайтесь на YouTube-канал Репетитор по химии и биологии. Здесь ежедневно появляются новые вебинары, видео-уроки, видео-консультации, видео-решения.
Пишите мне в WhatsApp +7(903)186-74-55, я отвечу вам обязательно.
Приходите ко мне на занятия, я помогу вам фундаментально изучить химию и биологию, научу решать любые задачи, даже самые сложные.
Репетитор по химии и биологии кбн В.Богунова
Свод правил, как надо называть то или иное химическое соединение, называется 
Какая номенклатура лучше
С тех пор как химия стала наукой, предпринимались неоднократные попытки систематизировать химические названия. На данный момент существует множество химических номенклатур, популярных в большей или меньшей степени. Наиболее распространенной являются «Рациональная номенклатура» для неорганических соединений и «Правила номенклатуры органических соединений IUPAC 1957». Тем не менее, абсолютно универсальной системы названий нет, разные организации, научные издания и даже страны отдают предпочтение той или иной номенклатуре, поэтому практически любая номенклатура содержит таблицы синонимов. Например, воду можно называть дигидрогена монооксид или H2O, а серную кислоту — тетраоксосульфат диводорода или H2SO4. В таблице Менделеева у каждого элемента есть два названия, к примеру, русское и международное обозначение: олово и Sn (Stannum), серебро и Ag (Argentum).
В России употребляются разные номенклатуры. Роспатент рекомендует использовать Chemical Abstracts, в ГОСТе используются правила ИЮПАК (Международный союз теоретической и прикладной химии). При этом считается разумным для давно известных веществ использовать устоявшиеся тривиальные названия: сода, вода, лимонная кислота, а вот для новых веществ, особенно органических, сложного состава, лучше использовать систематические названия, в которых отражено строение соединения.
Систематика для неорганических веществ

Названия химического вещества отражает его химическую формулу, состоящую из реальных или условных ионов. Названия читаются справа налево. Число ионов указывается с помощью приставки либо степенью окисления римской цифрой в скобках:
SnO2 — диоксид олова, оксид олова (IV);
SnO — монооксид олова, оксид олова (II).
Для известных веществ используются устоявшиеся названия: вода, аммиак, сероводород, озон, кислород, фтороводород и т. д.
Названия кислот и щелочей
Названия кислот состоят из названия образующего вещества и слова «кислота»: угольная кислота, азотная кислота, соляная кислота. Для менее известных кислот используются правила построения названия для комплексных соединений. Например, борофтористоводородная кислота HBF4 еще называется тетрафтороборная кислота.
Названия щелочей состоят из названия металла и слова «гидроксид (гидроокись)»: гидроксид натрия, гидроокись кальция.
Названия солей
Составляются из названия кислотного остатка и металла. Главным является кислотный остаток. Для кислородосодержащих солей используется суффикс «-ат/-ит», для не содержащих кислород — «-ид». Например, NaBr — бромид натрия, K2CO3 — карбонат калия.
Для кислородосодержащих солей используются различные суффиксы и приставки, показывающие степень окисления кислотного остатка.
За основу взят суффикс «-ат»,
при понижении степени окисления, используется сначала суффикс «-ит», потом, в дополнение к суффиксу «-ит», приставка «гипо-».
Для более высокой степени окисления суффикс «-ат» дополняется приставкой «пер-». Например,
NaClO4 — перхлорат натрия,
NaClO3 — хлорат натрия,
NaClO2 — хлорит натрия,
NaClO — гипохлорит натрия.
Для кислых, оснóвных солей, кристаллогидратов и некоторых других групп существуют свои групповые названия и правила образования. Например, для кристаллогидратов используют слово «гидрат» перед названием соли. Квасцы — это общее название класса двойных сульфатов, например, KAl(SO4)2*12H2O — алюмокалиевые квасцы.
Для органических веществ используются номенклатурные правила, отражающие строение этих соединений. Мы рассмотрим их в наших следующих статьях.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 29 июня 2022 года; проверки требуют 78 правок.
Хими́ческая номенклату́ра — совокупность химических терминов и названий индивидуальных химических веществ, их групп и классов, а также правила составления этих названий.[1]
История[править | править код]
Система наименований химических соединений длительное время развивалась хаотично, наименования давались в основном первооткрывателями каких-либо соединений. Многие вещества известны настолько давно, что происхождение их наименований носит легендарный характер. Исторически сложившиеся «собственные имена» выделяют как тривиальные названия. Они не вытекают из каких-либо единых систематических принципов, не выражают строения соединения и чрезвычайно разнообразны. Например: рудничный газ, винный спирт, ванилин, сода.
Создание систематической номенклатуры[править | править код]
Химическая номенклатура, как система единых принципов для создания общепринятой терминологии и названий веществ (систематическая номенклатура), берет свое начало с работы Гитон де Морво, который в 1782 г предложил в противовес спорадическому присвоению названий химических веществ подход, согласно которому простейшим химическим веществам следует присвоить простые химические названия, из которых далее возможно составляться названия соединений более сложного состава.[2][3] Гитон де Морво опубликовал первую таблицу химической номенклатуры (Tableau de Nomenclature Chimique), включавшую шесть минеральных кислот, шесть кислот растительного и четыре животного происхождения, а также три щелочи и предложил на их основе метод наименования около пятиста соединений.[4] В 1787 г шесть французских химиков — Гитон де Морво, Лавуазье, Бертолле, Фуркруа, Хассенфратц и Аде, — опубликовали первую общепринятую систематическую химичекую номенклатуру (Méthode de nomenclature chimique), получившую далее известноть как номенклатура Лавуазье.[5][6] Наряду с правилами наименования веществ, в ней было предложено использовать комбинацию букв и геометрических фигур в качестве символов для обозначения химических веществ и отдельных групп (например, квадрат с буквой F обозначал железо, а круг с буквой F обозначал фторид-ион),[7]−347[3]−245 что явилось прообразом химических формул.
1801 году В. М. Севергин принимает новую химическую номенклатуру Лавуазье, переводит и вводит русскоязычные химические термины[8]. Например, он впервые назвал: «кислотворное вещество» (кратко «кислотвор», совр. кислород), водотворное — водород, удушливое — (азот), угольное — углерод. Оксиды металлов назвал — «земли». Дал химическое обозначение солям. В дальнейшем он переводил[9] и составлял химические словари[10], что способствовало закреплению его химической номенклатуры. Развернутое описание химической номенклатуры на русском языке было дано Г. Гессом в 1831 году.[11]
В 1803—1810 годах Дальтон предложил альтернативный номенклатуре Лавуазье подход для краткой записи химических соединений, в котором элементы отображались в виде кругов, символизировавшие атомы, с особыми символами или буквами для каждого химического элемента. Достоинством такого подхода являлась возможность изображать структуры молекул в виде комбинации атомов, что явилось прототипом современных структурных формул. Основной недостаток, как и для символических обозначений в номенклатуре Лавуазье, состоял в трудности использования таких обозначений в печатных изданиях.[12][3]−256
В 1813—1814 годах Берцелиус ввел термин формула для используемого и в настоящее время способа краткой записи соединений, в которой буквенными символами и числами отражается их элементный состав. Каждому химическому элементу соответствовало буквенное обозначение (символ), которое являлось сокращением от его названия на латинском языке и состояло из заглавной буквы или комбинации заглавной и строчной букв латинского алфавита. Формулы Берцелиуса состояли из символов элементов и числовых индексов, отражающих соотношение элементов в соединении.[13]−359[7]−348 Берцелиус таже предложил использовать предложенные им формулы химических веществ при записи уравнений химических реакций.[14]−52 Основная критика формул Берцелиуса, в частности, со стороны Дальтона, состояла в невозможности их использования для отражения последовательности соединения атомов в молекулах.[15] К середине XIX века сформировалась традиция ставить в соответствие названию химического соединения его буквенно-числовую формулу. Созданная Берцелиусом электрохимическая теория, согласно которой соединения образуются в результате взаимодействия «электроположительных» и «электроотрицательных» элементов, стала прочной основой для выработавшей к этому времени номенклатуры неорганических соединений и предшественником бинарной номенклатуры, используемой в настоящее время в неорганической химии.
Этапы развития систематической номенклатуры органических веществ[править | править код]
В конце XVII-начале XIX века химикам удалось выделить из растений и животных большую группу соединений, названных органическими веществами. Однако их ограниченный элементный состав (углерод, водород, а также кислород и, реже, азот и фосфор), отсутствие данных о структуре молекул, а также трудности в установлении количественного состава органических соединений не позволяли использовать для конструирования их названий систематические подходы, достаточно успешно применяемые в то время для неорганических веществ. Поэтому до середины XIX века для органических веществ использовались лишь тривиальные названия по источнику их происхождения (муравьиная, винная, лимонная кислоты), первооткрывателю (кетон Михлера, основание Трёгера), а также являющиеся сокращениями слов и других названий (альдегид — Alcohol dehydrohenatus или ацеталь — продукт реакции ацетона и спирта (alcohol)).
Систематическая номенклатура органических соединений в полной мере возникла после разработки научных основ органической химии, сформированной в 1861 году Бутлеровым в виде теории строения молекул органических веществ, согласно которой идентичность органических соединений определяется не только элементным составом молекул, но и порядком соединения в них атомов и их пространственным расположением.
Можно выделить четыре основных этапа развития систематической номенклатуры:
- Рациональная (радикально-функциональная) номенклатура создана в середине XIX века под влиянием теории радикалов Берцелиуса и более поздней теории типов Дюма и Лорана. Следствием теории типов и последующего открытия гомологии и изомерии стала возможность объединять вещества с близкими свойствами в одну группу (спирты, кетоны, карбоновые кислоты), используя при их наименовании название самого простого представителя (метан, фенол, нафталин, муравьиная кислота и др) в качестве основы, к которой в качестве приставок добавлялись названия радикалов, замещавшие водород; так, этан в рациональной номенклатуре имел название метилметан. Использовали и другие основы названий, не связанные с конкретными соединениями (кетон, карбинол), например, диметилкетон для ацетона, метилэтилкарбинол для бутан-2-ола.[3]−299 Последние значимые уточнения в рациональную номенклатуру вносились в 1879 году Лондоским Химическим обществом.[16]−276 В настоящее время рациональная номенклатура широкого распространения не имеет, но отдельные ее положения нашли отражение в современной заместительной номенклатуре.
- Женевская номенклатура.[17] 19—22 апреля 1892 на Женевском конгрессе[18][19] Международной комиссии для реформы химической номенклатуры были приняты правила номенклатуры, называемой Женевской. Это были первые научно обоснованные и хорошо систематизированные правила для органических веществ, основанные на данных о структуре и составе соединений. Появляется термин «систематическая номенклатура», в которой каждому названию может быть сопоставлена соответствующая структурная формула соединения. В основу легли принципы заместительной номенклатуры, в которой молекулы соединений рассматриваются как продукты замещения атомов водорода в молекулах углеводородов на различные другие атомы, заместители или функциональные группы, при этом, основу названий стали составлять названия соответствующих углеводородов. Например, диметилэтилметан получил название 2-метилбутан. Появились первые правила выбора главной углеродной цепи и боковых цепей при построении названий, обозначение и нумерация кратных связей. Названия многих функциональных групп стали отражаться в суффиксе (пропанон для ацетона, этановая кислота для уксусной кислоты), при этом понятие главной функциональной группы при выборе основной цепи ещё отсутствует (например, для бензилового спирта использовалось название бензол-этилол). Женевская номенклатура составила основу номенклатурных правил органической химии разрабатываемых далее при участии ИЮПАК.
- Льежская номенклатура.[20][21] В 1930 ИЮПАК по результатам конференции в Льеже принял новые правила наименования органических соединений, которые были близки к Женевской номенклатуре, но уточняли ряд ее положений, в частности,
- химическая номенклатура фокусировалась на соединениях известного строения;
- точная форма терминов, окончаний и др. составляющих названий должна была быть приведена в соответствие с особенностями каждого национального языка;
- введено понятие главной функциональной группы в соединении, с которой должна быть обязательно соединена главная углеродная цепь молекулы, функциональные группы ранжированы по старшинству для возможности выбора одной главной группы;
- рассмотрение названний белков, витаминов и гормонов переведено в биохимическую номенклатру.[⇨]
- Последующие версии номенклатуры ИЮПАК. Разнообразие номенклатурных систем для новых органических соединений и возникающие из-за этого сложности в научной и практической деятельности привели к тому, что в 1947 году на совещании ИЮПАК в Лондоне было принято решение о выработке новых международных правил номенклатуры, которые были созданы в 1957 году и опубликованы под названием Правила номенклатуры органических соединений IUPAC 1957[22]. Впоследствии они составили регулярно обновляемый свод номенклатурных правил ИЮПАК по органической химии, известный как Синяя книга[23][24].
Совершенствование номенклатуры неорганических и координационных соединений[править | править код]
Существенным дополнением к бинарной номенклатуре неорганических соединений, созданной при участии Лавуазье и Берцелиуса, стала аддитивная номенклатура, предложенная Вернером для координационных соединений.[25][26] В аддитивной номенклатуре названия лигандов следовали за названием центрального атома, к которому добавлялось окончание -ат, если комплексная часть координационного соединения была анионом. Вернер тажке предложил использовать мультипликативные приставки (ди-, три- итд) для указания количества лиандов. Например, тетрацианоникелат(0) калия для K4[Ni(CN)4] или хлорид трис(этилендиамин)кобальта (III) для [Co(NH2CH2CH2NH2)3]Cl3.
Дальнейшая работа по совершенствованию номенклатуры неорганических соединений проводилось под эгидой ИЮПАК, в частности, в 1940 году вышли первые общепринятые Правила наименования неорганических веществ, которые регламентировали построения названий бинарных соединений и веществ, составленных из более двух элементов, номенклатуру кислородсодержащих кислот и их анионов (в том числе мета-, пиро- и поликислот), солей и их кристаллогидратов, координационных соединений.[27] Последующие редации этого документа составили свод номенклатурных правил ИЮПАК по неорганической химии, называемый Красная книга[28].
Создание номенклатуры полимеров[править | править код]
Впервые упорядоченные номенклатурные правила в области химии полимеров (высокомолекулярных соединений) были разработаны ИЮПАК в 1952 году.[29][30] Наряду с общей терминологией и принципами наименования полимерных молекул они включали определения понятий молекулярной массы полимеров, осмотического давления и вязкости их растворов, номенклатуру полисахаридов, определения основных типов реакций полимеризации и их кинетических аспектов. Первые систематические названия линейных органических полимеров, не получившие впоследствие широкого распространения, состояли из приставки поли-, названия простейшего структурно-повторяющегося фрагмента и суффикса -амер (например, полиметамер для полиэтилена). Далее эта номенклатура была дополнена описанием пространственной структуры для случая регулярных полимеров.[31]
В 1975 году[32] номенклатура была существенно пересмотрена и стали допустимыми два подхода для наименования полимеров на основе:
- названий синтетического предшественника — исходного мономера или его условного аналога (например, полиэтилен),
- названий структурно повторяющегося фрагмента (поли(метилен)),
причём, в обоих случаях для названий основы использовалась заместительная номенклатура ИЮПАК для органической химии[⇨]. Эти походы используются в современной номенклатуре высокомолекулярных соединений,[33] составляющей Фиолетовую книгу ИЮПАК[34], в которой также классифицированы структурные типы полимеров и приведены способы построения их структурных формул и перечень общеупотребимых аббревиатур.
Создание биохимической номенклатуры[править | править код]
В период с 1921 до 1954 года разработкой номенклатуры в области биологической химии занималась отдельная комиссия ИЮПАК. За это время в сотрудничестве с комиссией ИЮПАК по номенклатуре органической химии ею были созданы единые правила для наименования углеводов, аминокислот и пептидов, жиров, ферментов, каротеноидов и витаминов.[35] Выделение биохимии в отдельную от химии и родственную молекулярной биологии область науки привело к созданию в 1955 году самостоятельного Международного союза биохимии (International Union of Biochemistry, IUB), позднее ставшего Международным союзом биохимии и молекулярной биологии (International Union of Biochemistry and Molecular Biology, IUBMB), который создал собственную комиссию по номенклатуре.[36][37][38] С этого времени ИЮПАК и IUB(MB) ведут совместную работу по совершенствованию биохимической номенклатуры в рамках объединенной комиссии (до 1977 года — Commission of Biochemical Nomenclature, CNB, далее — Joint Commission on Biochemical Nomenclature, JCNB), при этом вопросы номенклатуры, не затрагивающие напрямую интересы химиков, рассматриваются отдельной номенклатурной комиссией IUBMB (Nomenclature Committee of IUBMB, NC-IUBMB).[38][39][40]−159 В 1992 году ИЮПАК и IUBMB выпустили актуальный в то время сборник статей по биохимической номенклатуре, названный Белая книга.[41] Номенклатурные правила по биохимии традиционно выпускаются в виде отдельных статей для каждого класса природных соединений и публикуются в изданиях ИЮПАК[42] и IUBMB[43], а также размещаются на сайте JCNB.
Изначально предполагалось, что для наименования веществ биологического происхождения известного состава и строения будет применяться заместительная номенклатура органических веществ, однако, для биохимического сообщества более приемлемым оказался подход, основанный на принципах рациональной номенклатуры[⇨] с использованием большого количества тривиальных основ (например, гидрокси-4-L-пролин, деоксирибоза), а для природных соединений более сложного строения (например, ферменты) структурный подход оказался полностью неприменим. Далее основным принципом биохимической номенклатуры стало создании не систематических, а скорее согласованных (coherent) названий и последовательных подходов к их построению,[35]−86 при этом названия биохимических молекул выстраиваются на основе одного или более критериев, приведенных ниже:[40]−160
- источник для выделения (организм, органелла);
- функции в живых организмах;
- структурные особенности;
- в виде производного от другого родственного соединения, названного по вышеуказанным критериям;
- порядковые или каталожные номера.
Современное состояние[править | править код]
Номенклатура ИЮПАК — действующий мировой стандарт[править | править код]
Наличие устоявшейся общепризнанной на мировом уровне и активно используемой химической номенклатуры является результатом активной и скрупулезной работы ИЮПАК в течение всей столетней истории[44] существования этого химического общества, сумевшего консолидировать усилия химиков всего мира для выработки единых принципов[45] наименования химических веществ и химической терминологии. На сегодняшний день именно номенклатура ИЮПАК является стандартным средством коммуникации в большинстве научных и промышленных областей химии.
Современная химическая номенклатура ИЮПАК содержит сведения по трем основным направлениям:
- Химическая терминология и единицы измерения;[34][46][47][48][49]
- Правила наименования химических веществ и химических элементов,[24][28][34][41] универсальные идентификаторы для химических веществ (InChI)[50][51];
- Методологические основы теоретической и экспериментальной химии для различных ее областей (аналитическая химия,[48] физическая химия,[47] клиническая биохимия[49]).
Совершенствуя химическую номенклатуру по междисциплинарным областям химии, ИЮПАК тесно взаимодействует с другими мировыми научными организациями, например, Международным союзом биохимии и молекулярной биологии в случае биохимической номенклатуры[52] или Международной федерацией клинической химии и лабораторной медицины для развития раздела химической номенклатуры для применения в клинической биохимии[53].
Успешность создания химической номенклатуры, общепринятой в мировом масштабе, зачастую, определяется возможностью нахождения компромиссов в случае неоднозначных вопросов. В номенклатуре ИЮПАК яркими примерами таких компромиссных решений являются:
- Отказ от доминирующей роли английского языка – применение номенклатуры вне англоговорящих стран учитывает нормы и правила национальных языков, что создает определённые трудности в переводе названий и терминов с одного языка на другой, но позволяет делать их лексически и фонетически более гармоничными.
- Соглашение о возможности использования устойчивых тривиальных (не относящихся к систематической или полусистематической номенклатуре) названий для ряда широко известных веществ.
- Решение ИЮПАК о названиях ряда тяжелых трансурановых химических элементов в 2016 году с учетом приоритетов различных стран в их синтезе.[54]
Тривиальные названия соединений[править | править код]
Тривиальные названия — названия, исторически закрепившиеся за какими-либо соединениями, и не соответствующие никакой номенклатуре.
- Тривиальные названия неорганических соединений
- Тривиальные названия органических соединений
См. также[править | править код]
- Научная номенклатура
- Систематическое название элемента
Примечания[править | править код]
- ↑ Химическая Энциклопедия, 1992, Т. 3, с. 290–293.
- ↑ Guyton de Morveau, Louis-Bernard. Mémoire sur les dénominations chimiques, la nécessité d’en perfectionner le système, et les règles pour y parvenir (фр.) // Observations sur la physique, sur l’histoire naturelle et sur les arts. — 1782. — Janvier (vol. 19). — P. 370—382.
- ↑ 1 2 3 4 Maurice P. Crosland. Historical studies in the language of chemistry (англ.). — London: Heinemann, 1962. — 406 p. — ISBN 0-486-43802-3.
- ↑ Guyton de Morveau, Louis-Bernard. Tableau de Nomenclature Chimique (фр.) // Observations sur la physique, sur l’histoire naturelle et sur les arts. — 1782. — Mai (vol. 19). — P. 382.
- ↑ Louis-Bernard Guyton de Morveau, Pierre-Auguste Adet, Claude-Louis Berthollet, Antoine Laurent Lavoisier, Jean-Henri Hassenfratz, comte Antoine-François de Fourcroy. Méthode de nomenclature chimique (фр.). — Paris: Académie Royale des Sciences, 1787. — 312 с.
- ↑ Wolfgang Lefèvre. The Méthode de nomenclature chimique (1787): A Document of Transition (англ.) // Ambix. — 2018-01-02. — Vol. 65, iss. 1. — P. 9–29. — ISSN 1745-8234 0002-6980, 1745-8234. — doi:10.1080/00026980.2017.1418233.
- ↑ 1 2 Jaime Wisniak. Jöns Jacob Berzelius A Guide to the Perplexed Chemist (англ.) // The Chemical Educator. — 2000-12. — Vol. 5, iss. 6. — P. 343–350. — ISSN 1430-4171. — doi:10.1007/s00897000430a.
- ↑ Севергин В. М. Пробирное искусство, или руководство к химическому испытанию металлических руд и других ископаемых тел. СПб.: ИАН, 1801. XVI, [15], 370 c.
- ↑ Каде де Гассикур Ш. Словарь химический, содержащий в себе теорию и практику химии с приложением её к естественной истории и искусствам. В 4-х томах / Перевод В. М. Севергина. — СПб.: тип. ИАН, 1810—1813.
- ↑ Севергин В. М. Руководство к удобнейшему разумению химических книг иностранных, заключающее в себе словари: латинско-российский, французско-российский и немецко-российский, по старинному и новейшему словознанию. СПб.: тип. ИАН, 1815. V, 291, 4 с.
- ↑ Гесс Г.И. Основания чистой химии. — СПб.: Тип. Императ. акад. наук, 1831. — 611 с.
- ↑ Dalton J. A new system of chemical philosophy. Part I. — London: R. Bickerstaff, 1808. — С. 218. — 598 с.
- ↑ J. Berzelius. Experiments on the Nature of Azote, of Hydrogen and of Ammonia, and upon the Degrees of Oxidation of which Azote is susceptible (англ.) // Annals of Philosophy. — 1813. — November (vol. 2). — P. 357—368.
- ↑ J. Berzelius. Essay on the cause of chemical properties, and on some circumstances relating to them: together with the short and easy method of expressing them. III. On the chemical signs and the method of employing them to express the chemical proportions (англ.) // Annals of Philosophy. — 1814. — January (vol. 3). — P. 51—60.
- ↑ В более поздних вариантах записи формул, чтобы отразить связность атомов в соединениях, Берцелиус предлагал использовать точки для обозначения атомов кислорода и запятые для обозначений атомов серы над символами элементов, с которыми они были соединены, однако эти подходы для записи формул не получили распространение.
- ↑ Anniversary meeting, March 31st, 1879 (англ.) // Journal of the Chemical Society, Transactions. — 1879-01-01. — Vol. 35, iss. 0. — P. 257–281. — ISSN 0368-1645. — doi:10.1039/CT8793500257.
- ↑ Справочник химика, 1968, Т. 7, с. 283–292.
- ↑ Henry E. Armstrong. The International Conference on Chemical Nomenclature (англ.) // Nature. — 1892-05. — Vol. 46, iss. 1177. — P. 56–59. — ISSN 1476-4687. — doi:10.1038/046056c0.
- ↑ Congrès de nomenclature chimique, Genève 1892, Bulletin de la Société Chimique de Paris, Série 3 Т. 8: xiii–xxiv, 1892, <http://gallica.bnf.fr/ark:/12148/bpt6k2820064.image>.
- ↑ Справочник химика, 1968, Т. 7, с. 293–303.
- ↑ Definitive Report of the Committee for the Reform of Nomenclature in Organic Chemistry (англ.) // Journal of the Chemical Society (Resumed). — 1931. — P. 1607. — ISSN 0368-1769. — doi:10.1039/jr9310001607.
- ↑ Definitive Rules for Nomenclature of Organic Chemistry (англ.) // Journal of the American Chemical Society. — 1960-11. — Vol. 82, iss. 21. — P. 5545–5574. — ISSN 1520-5126 0002-7863, 1520-5126. — doi:10.1021/ja01506a003.
- ↑ Henri A Favre, Warren H Powell. Nomenclature of Organic Chemistry. — The Royal Society of Chemistry, 2013-12-17. — ISBN 978-0-85404-182-4, 978-1-84973-306-9.
- ↑ 1 2 Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013. — Cambridge, England: Royal Society of Chemistry, 2014. — 1 online resource (ixiii, 1568 pages) с. — ISBN 978-1-84973-306-9, 1-84973-306-6.
- ↑ Werner, A. Neuere Anschauungen auf den Gebieten der Anorganischen Chemie (нем.). — Braunschweig: Vieweg, 1905. — S. 92—95. — 189 S.
- ↑ Edwin C. Constable. What’s in a Name?—A Short History of Coordination Chemistry from Then to Now (англ.) // Chemistry. — 2019-12. — Vol. 1, iss. 1. — P. 126–163. — ISSN 2624-8549. — doi:10.3390/chemistry1010010.
- ↑ W. P. Jorissen, H. Bassett, A. Damiens, F. Fichter, H. Remy. Report of the Committee for the Reform of Inorganic Chemical Nomenclature, 1940 (англ.) // Journal of the Chemical Society (Resumed). — 1940. — P. 1404. — ISSN 0368-1769. — doi:10.1039/jr9400001404.
- ↑ 1 2 Nomenclature of inorganic chemistry. IUPAC recommendations 2005. — Cambridge: Royal Society of Chemistry, 2005. — xii, 366 pages с. — ISBN 978-0-85404-438-2, 0-85404-438-8.
- ↑ Report on nomenclature in the field of macromolecules. International union of pure and applied chemistry // Journal of Polymer Science. — 1952-03. — Т. 8, вып. 3. — С. 257–277. — doi:10.1002/pol.1952.120080301.
- ↑ History of IUPAC Polymer Terminology and Nomenclature (амер. англ.). IUPAC | International Union of Pure and Applied Chemistry. Дата обращения: 15 марта 2023.
- ↑ M. L. Huggins, G. Natta, V. Desreux, H. Mark. Report on nomenclature dealing with steric regularity in high polymers (англ.) // Pure and Applied Chemistry. — 1966-01-01. — Vol. 12, iss. 1—4. — P. 643–656. — ISSN 0033-4545 1365-3075, 0033-4545. — doi:10.1351/pac196612010643.
- ↑ Nomenclature of Regular Single-Strand Organic Polymers // Pure and Applied Chemistry. — 1976-01-01. — Т. 48, вып. 3. — С. 373–386. — ISSN 0033-4545 1365-3075, 0033-4545. — doi:10.1351/pac197648030373.
- ↑ R. C. Hiorns, R. J. Boucher, R. Duhlev, Karl-Heinz Hellwich, Philip Hodge, Aubrey D. Jenkins, Richard G. Jones, Jaroslav Kahovec, Graeme Moad, C. K. Ober, D. W. Smith, Robert F. T. Stepto, J.-P. Vairon, Jiří Vohlídal. A brief guide to polymer nomenclature (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2012-10-03. — Vol. 84, iss. 10. — P. 2167–2169. — ISSN 0033-4545 1365-3075, 0033-4545. — doi:10.1351/PAC-REP-12-03-05.
- ↑ 1 2 3 International Union of Pure and Applied Chemistry. Subcommittee on Polymer Terminology. Compendium of polymer terminology and nomenclature : IUPAC recommendations, 2008. — Cambridge: Royal Society of Chemistry, 2009. — 1 online resource (xix, 443 pages) с. — ISBN 978-1-84755-942-5, 1-84755-942-5, 978-1-62870-146-3, 1-62870-146-3.
- ↑ 1 2 Courtois, J.E. Work of Commission on Nomenclature of Biological Chemistry (англ.) // Advances in Chemistry. — 1953. — Vol. 8. — P. 83—94. — doi:10.1021/ba-1953-0008.ch010.
- ↑ E. C. Slater. The uncertain birthday of IUB (англ.) // Trends in Biochemical Sciences. — 1980-07-01. — Vol. 5, iss. 7. — P. VII–VIII. — ISSN 0968-0004. — doi:10.1016/0968-0004(80)90225-X.
- ↑ Mary Osborn. IUBMB: the first half-century (англ.) // Trends in Biochemical Sciences. — 2005-06-01. — Т. 30, вып. 6. — С. 273–275. — ISSN 0968-0004. — doi:10.1016/j.tibs.2005.04.011.
- ↑ 1 2 (Bill) Slater. The History of IUB(MB) // IUBMB Life (International Union of Biochemistry and Molecular Biology: Life). — 2005-05-01. — Т. 57, вып. 4—5. — С. 203–211. — ISSN 1521-6551 1521-6543, 1521-6551. — doi:10.1080/15216540500128098.
- ↑ Kurt L. Loening. Activities of the IUPAC/IUB Joint Commission on Biochemical Nomenclature (JCBN) and the Nomenclature Committee of IUB (NC-IUB) (англ.) // The Terminology of Biotechnology: A Multidisciplinary Problem / Kurt L. Loening. — Berlin, Heidelberg: Springer Berlin Heidelberg, 1990. — P. 1–8. — ISBN 978-3-540-53052-7, 978-3-642-76011-2. — doi:10.1007/978-3-642-76011-2_1.
- ↑ 1 2 Richard Cammack. The Biochemical Nomenclature Committees // IUBMB Life (International Union of Biochemistry and Molecular Biology: Life). — 2000-09-01. — Т. 50, вып. 3. — С. 159–161. — ISSN 1521-6551 1521-6543, 1521-6551. — doi:10.1080/152165400300001453.
- ↑ 1 2 Biochemical nomenclature and related documents : a compendium. — 2nd ed. — London: Portland Press, 1992. — x, 347 pages с. — ISBN 1-85578-005-4, 978-1-85578-005-7.
- ↑ IUPAC-Journals (амер. англ.). International Union of Pure and Applied Chemistry. Дата обращения: 15 марта 2023.
- ↑ IUBMB-Journals (амер. англ.). International Union of Biochemistry and Molecular Biology. Дата обращения: 15 марта 2023.
- ↑ Nomenclature Notes (амер. англ.). IUPAC 100. Дата обращения: 26 марта 2023.
- ↑ Principles of Chemical Nomenclature : a Guide to IUPAC Recommendations. — 2011 edition. — Cambridge, UK, 2011. — xii, 257 pages с. — ISBN 978-1-84973-007-5, 1-84973-007-5.
- ↑ The IUPAC Compendium of Chemical Terminology (англ.). goldbook.iupac.org. Дата обращения: 26 марта 2023.
- ↑ 1 2 Quantities, units, and symbols in physical chemistry. — 3rd ed. — Cambridge, UK: RSC Pub, 2007. — 1 online resource (xiv, 233 pages) с. — ISBN 978-1-84755-788-9, 1-84755-788-0, 978-0-85404-433-7, 0-85404-433-7.
- ↑ 1 2 Compendium of Terminology in Analytical Chemistry / D. Brynn Hibbert. — 2023-01-27. — 666 с. — ISBN 978-1-78262-947-4.
- ↑ 1 2 Compendium of terminology and nomenclature of properties in clinical laboratory sciences : recommendations 2016.. — Cambridge, UK, 2017. — 1 online resource (xxix, 182 pages) с. — ISBN 978-1-78262-245-1, 1-78262-245-4.
- ↑ The IUPAC International Chemical Identifier (InChI) (амер. англ.). IUPAC | International Union of Pure and Applied Chemistry. Дата обращения: 26 марта 2023.
- ↑ Stephen R. Heller, Alan McNaught, Igor Pletnev, Stephen Stein, Dmitrii Tchekhovskoi. InChI, the IUPAC International Chemical Identifier // Journal of Cheminformatics. — 2015-05-30. — Т. 7, вып. 1. — С. 23. — ISSN 1758-2946. — doi:10.1186/s13321-015-0068-4.
- ↑ Body Details (амер. англ.). IUPAC | International Union of Pure and Applied Chemistry. Дата обращения: 26 марта 2023.
- ↑ Silver Book (амер. англ.). IUPAC | International Union of Pure and Applied Chemistry. Дата обращения: 26 марта 2023.
- ↑ Fabienne Meyers. IUPAC Announces the Names of the Elements 113, 115, 117, and 118 (амер. англ.). IUPAC | International Union of Pure and Applied Chemistry (30 ноября 2016). Дата обращения: 26 марта 2023.
Литература[править | править код]
- Химическая энциклопедия : [рус.] : в 5 т. / под ред. И. Л. Кнунянца. — М. : Большая Российская энциклопедия, 1992. — Т. 3, Номенклатура химическая. — С. 290–293. — 639 с. — ISBN 5-85270-039-8.
- Справочник химика : [рус.] : в 7 т. / гл. ред. Б.П. Никольский. — Л. : Химия, 1968. — Т. 7 : Дополнительный том: Номенклатура органических соединений. Техника безопасности. Сводный предметный указатель.. — 508 с. — 50 000 экз.
Названия химических соединений
Химическое соединение — это молекула, в составе которой находится более одного элемента. Оно образуется в том случае, когда элементы соединяются друг с другом при помощи особой прочной связи. Такое соединение является новым веществом.
По какому принципу химические соединения получают свои названия? Происходит это в соответствии с определенными правилами, принятыми и понятными во всем мире. Название вещества состоит из наименований всех элементов этого соединения и указания на строение молекулы.
Основной принцип присвоения названий
Если в состав вещества входит только один элемент, то наименование в большинстве случаев совпадает с названием соответствующего элемента. Например: Fe — железо, Na — натрий, Si — кремний.
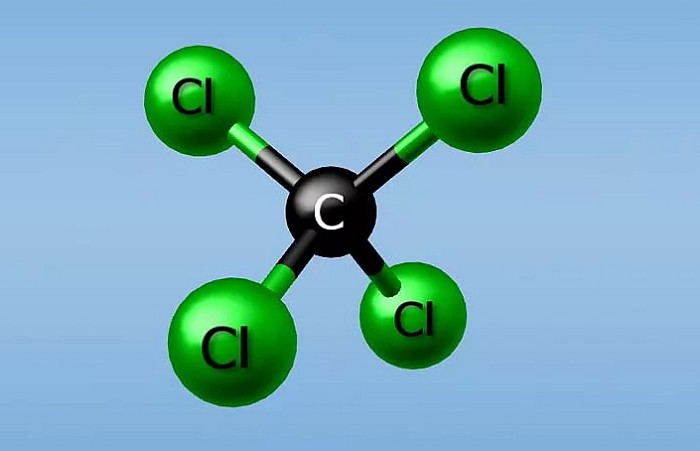
Тетрахлорид углерода
А сейчас давай разберемся, как называют молекулы, в состав которых входят два элемента. Название такого вещества состоит из двух слов.
Одно из них — это название того элемента, который стоит в формуле первым. Для того чтобы получить второе слово, мы используем название второго элемента, но добавляем к нему суффикс «-ид».
Например: CI — хлор — хлорид, Br — бром — бромид.
Если в молекуле больше одного атома какого-либо элемента, то химики используют так называемые числовые приставки, которые указывают количество атомов в молекуле.
Например: ССI4 — тетрахлорид углерода, РСI3 — трихлорид фосфора, СO2 — диоксид углерода.
Как определяется порядок элементов в формуле?
Если в вещество входят два элемента, какой из них должен стоять на первом месте?
Когда в состав химического соединения входят металл и неметалл, то металл ставится на первое место.
Если же соединение состоит из двух неметаллов, то первым в формуле становится элемент, который находится в таблице периодических элементов Менделеева левее. Например:
- Если в химическом соединении содержатся железо и фтор, то в формуле железо (металл) нужно поставить на первое место.
- Если в составе соединения есть углерод и кислород, т.е. два неметалла, то на первое место необходимо поставить углерод, так как в периодической таблице Менделеева он расположен левее кислорода.
Запомни: как правило, при составлении наименований химических соединений используются названия элементов на русском языке, но для некоторых элементов применяются их латинские наименования, например О — кислород (оке, оксиген) — оксид, S — сера (сульф) — сульфид и др.
Например: NaCI — хлорид натрия, MgS — сульфид магния.
Поделиться ссылкой