
Как решать задачи по химии? Как проводить простейшие расчеты по уравнениям химических реакций? Сколько выделяется газа, образуется воды, выпадает осадка или сколько получается конечного продукта реакций? Сейчас мы постараемся разобрать все нюансы и ответить на эти вопросы, которые очень часто возникают при изучении химии.
Решение задач в химии является неотъемлемой частью в изучении этой сложной, но очень интересной науки.
Алгоритм решения задач по химии
- Прочитать условия задачи (если они есть). Да, об этом все знают — как же решить задачу без условий — но все же, для полноты инструкции, мы не могли не указать этот пункт.
- Записать данные задачи. На этом пункте мы не будем заострять внимание, так как требования различных учебных заведений, учителей и преподавателей могут значительно отличаться.
- Записать уравнение реакции. Теперь начинается самое интересное! Здесь нужно быть внимательным! Обязательно необходимо верно расставить коэффициенты перед формулами веществ. Если вы забудете это сделать, то все наши усилия буду напрасны.
- Провести соответствующие расчеты по химическому уравнению. Далее рассмотрим, как же сделать эти самые расчеты.
Для этого у нас есть два пути, как решить задачу по химии. Условно, назовем их правильным (используя понятия количества вещества) и неправильным (используя пропорции). Конечно же, мы бы рекомендовали решать задачи правильным путем. Так как у неправильного пути имеется очень много противников. Как правило, учителя считают, что ученики, решающие задачи через пропорции, не понимают самой сути протекания процессов химических реакций и решают задачи просто математически.
Расчет по уравнениям химических реакций с использованием понятия количества вещества
Суть данного метода, состоит в том, что вещества реагируют друг с другом в строгом соотношении. И уравнение реакции, которое мы записали ранее, дает нам это соотношение. Коэффициенты перед формулами веществ дают нам нужные данные для расчетов.
Для примера, запишем простую реакцию нейтрализации серной кислоты и гидроксида натрия.
H_{2}SO_{4} + NaOH → Na_{2}SO_{4} + H_{2}O
Расставим коэффициенты:
H_{2}SO_{4} + 2NaOH → Na_{2}SO_{4} + 2H_{2}O
Исходя из этого уравнения, мы видим, что одна молекула серной кислоты взаимодействует с двумя молекулами гидроксида натрия. И в результате этой реакции получается одна молекула сульфата натрия и две молекулы воды.
Сейчас мы немного отступим от разбора задач, чтобы познакомиться с основными понятиями, которые пригодятся нам в решении задач по химии.
Рассчитывать количество молекул, например в 98 граммах серной кислоты — это не самое удобное занятие. Числа будут получаться огромными ( ≈ 6,022140857⋅1023 молекул в 98 граммах серной кислоты) . Для этого в химии ввели понятие количества вещества (моль) и молярная масса.
1 Моль (единица измерения количества вещества) — это такое количество атомов, молекул или каких либо еще структурных единиц, которое содержится в 12 граммах изотопа углерода-12. Позднее выяснилось, что в 12 граммах вещества углерод-12 содержится 6,022140857⋅1023 атомов. Соответственно, можно сказать, что 1 моль, это такая масса вещества, в которой содержится 6,022140857⋅1023 атомов (или молекул) этого вещества.
Но ведь молекулы и атомы имеют различный состав и различное строение. Разные атомы содержат разное количество протонов и нейтронов. Соответственно 1 моль для разных веществ будет иметь разную массу, имея при это одинаковое количество молекул ( атомов). Эта масса называется молярной.
Молярная масса — это масса 1 моля вещества.
Используя данные понятия, можно сказать, что 1 моль серной кислоты реагирует с 2 молями гидроксида натрия, и в результате получается 1 моль сульфата натрия и 2 моль воды. Давайте запишем эти данные под уравнением реакции для наглядности.
begin{matrix}H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль end{matrix}
Следом запишем молярные массы для этих веществ
begin{matrix} H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г end{matrix}
Теперь, зная массу одного из веществ, мы можем рассчитать, сколько нам необходимо второго вещества для полного протекания реакции, и сколько образуется конечных продуктов.
Для примера, решим по этому же уравнению несколько задач.
Задача. Сколько грамм гидроксида натрия (NaOH) необходимо для того, чтобы 49 грамм серной кислоты (H2SO4) прореагировало полностью?
Итак, наши действия: записываем уравнение химической реакции, расставляем коэффициенты. Для наглядности, запишем данные задачи над уравнением реакции. Неизвестную величину примем за Х. Под уравнением записываем молярные массы, и количество молей веществ, согласно уравнению реакции:
begin{matrix}49 : г & & X : г & & & & \ H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г end{matrix}
Записывать данные под каждым веществом — не обязательно. Достаточно это будет сделать для интересующих нас веществ, из условия задачи. Запись выше дана для примера.
Примерно так должны выглядеть данные, записанные по условиям задачи. Не претендуем на единственно правильное оформление, требования у всех разные. Но так, как нам кажется, смотрится все довольно наглядно и информативно.
Первое наше действие — пересчитываем массу известного вещества в моли. Для этого разделим известную массу вещества (49 грамм) на молярную массу:
4998=0,5 моль серной кислоты
Как уже упоминалось ранее, по уравнению реакции 1 моль серной кислоты реагирует с 2 моль гидроксида натрия. Соответственно с 0,5 моль серной кислоты прореагирует 1 моль гидроксида натрия.
n(NaOH)=0.5*2=1 моль гидроксида натрия
Найдем массу гидроксида натрия, умножив количество вещества на молярную массу:
1 моль * 40 г/моль = 40 грамм гидроксида натрия.
Ответ: 40 грамм NaOH
Как видите, в решении задачи по уравнению реакции нет ничего сложного. Задача решается в 2-3 действия, с которыми справятся ученики начальных классов. Вам необходимо всего лишь запомнить несколько понятий.
Решение задач по химии через пропорцию
Ну и расскажем про второй способ вычислений по уравнениям химических реакций — вычисления через пропорцию. Этот способ может показаться немного легче, так как в некоторых случаях можно пропустить стадию перевода массы вещества в его количество. Чтобы было более понятно, объясню на том же примере.
Так же, как и в прошлом примере, запишем уравнение реакции, расставим коэффициенты и запишем над уравнением и под уравнением известные данные.
Для этого способа, нам так же понадобится записать под уравнением реакции, следом за молярной массой, массу вещества, соответствующую его количеству по уравнению. Если проще, то просто перемножить две строки под уравнением реакции, количество моль и молярную массу. Должно получиться так:
begin{matrix}49 : г & & X : г & & & & \ H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г \ 98 : г & & 80 : г & & 142 : г & & 36 : г end{matrix}
А теперь внимание, начинается магия! Нас интересует строка данных над уравнением, и самая нижняя строка под уравнением. Составим из этих данных пропорцию.
frac{49}{98} = frac{X}{80}
Далее находим неизвестное значение Х из пропорции и радуемся полученному значению:
Х=49*80/98=40 грамм
Как видим, получается тот же результат. Прежде всего, при решении задач в химии, главное все же — понимание химических процессов. Тогда решение задачи не станет для вас проблемой!
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса – Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса – Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль – единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) – число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль – международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов – вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается “ню”).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса – M
Молярная масса – масса одного моля вещества, выражается в “г/моль” (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы – массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl – 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково – 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика – лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем – объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как – VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. – константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор – Cl2.


Моль (количество вещества) – самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи – выполнена 🙂

Относительная плотность и газы – D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): “Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества”

Относительная плотность и водный раствор – ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении – так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам “как к числам”, то не запутаетесь.
В ходе ваших действий “грамм” и “грамм” должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 🙂
К примеру, даны масса раствора HCl – 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля – ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах – его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Фреоны
Задача. В мастерской по ремонту холодильников и климатического оборудования отклеились этикетки от 5 баллонов с хранившимися в них фреонами (техническое название группы насыщенных алифатических галогенсодержащих углеводородов, применяемых в качестве хладагентов). Этикетки содержали следующие надписи: R-12, R-23, R-32, R-41, R-161. Для установления формул фреонов были проведены исследования. При сжигании фреона 1 образовалось 2,24 л СО2 и 4 г HF. Фреон 2 не горит (ω(C) = 9,92%; D(H2) = 60,5). У фреона 3 (ω(F) = 39,58%, ω(Н) = 10,42%). При взаимодействии фреона 4 с натрием образовался этан и фторид натрия. При щелочном гидролизе фреона 5 образовались две соли: формиат натрия (ω(C) = 17,65%; ω(О) = 47,06%) и фторид натрия. Установите структурные формулы указанных фреонов и дайте им химические названия, установите соответствие между кодом фреона и его формулой.
Данная задача предназначена для десятиклассников, которые еще не освоили курс кислородсодержащих органических соединений, поэтому даны массовые доли.
1. Начнем с фреона № 1. При его сжигании образовалось 2,24 л углекислого газа. Найдем количество углекислого газа. Делим его объем на молярный объем и получаем 0,1 моль. Соответственно, атомов углерода тоже 0,1 моль, поскольку в каждой молекуле углекислого газа содержится один атом углерода.
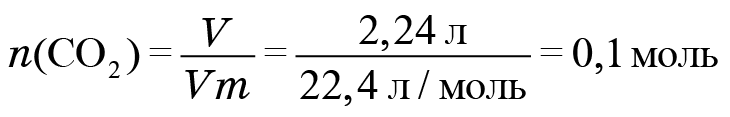
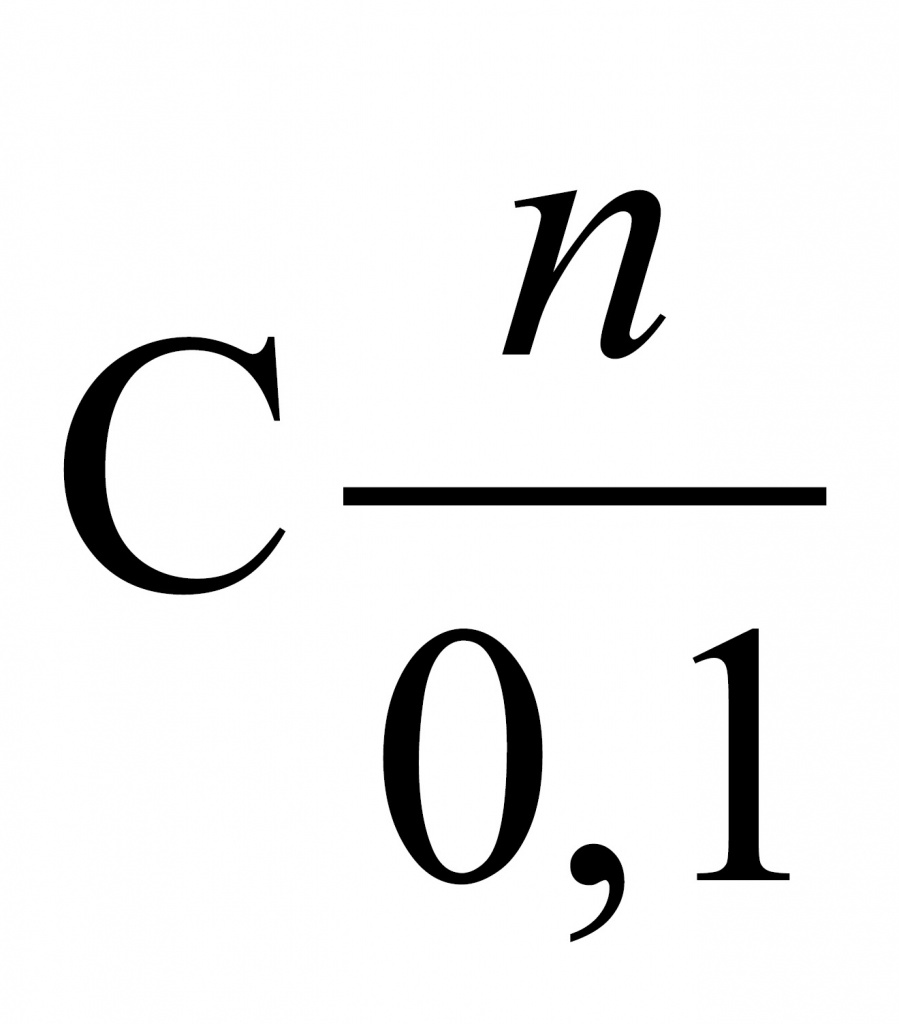
Информацию по водороду возьмем из фтороводорода. Найдем количество фтороводорода. Поскольку дана его масса, мы должны поделить массу (4 г) на молярную массу. Молекула фтороводорода состоит из атома фтора и атома водорода. Масса атома фтора 19, у водорода масса 1, значит, молярная масса 20. И мы получаем 0,2 моль.
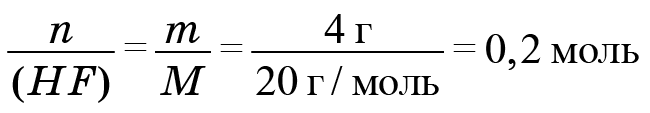
Следовательно, H = 0,2 и F = 0,2. Формула вещества, фреона № 1: CH2F2 (на один атом углерода приходится два атома водорода и два атома фтора).

2. Узнаем, что скрывается под фреоном № 2. Известно, что он не горит, и дана его плотность по водороду. Это относительная плотность, которая показывает, во сколько раз молярная масса вещества больше молярной массы (в данном случае) водорода. Молярная масса фреона № 2 равна 121 г/моль.
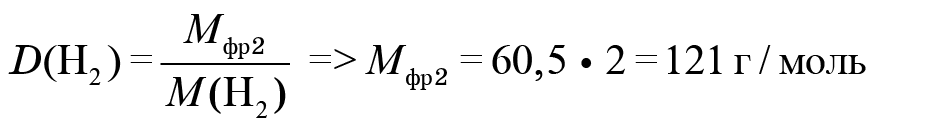
Сколько атомов углерода во фреоне № 2? Для подсчета используем массовую долю углерода. Масса углерода равна: молярную массу умножить на массовую долю. Получаем 12. Значит, в данной молекуле фреона № 2 содержится только один атом углерода.
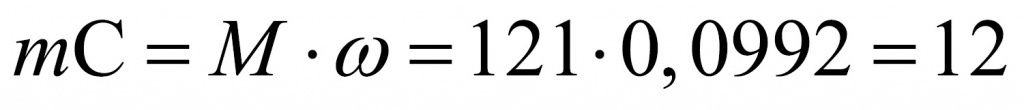
Нарисуем этот атом углерода. У него имеется четыре связи, поскольку в органической химии углерод четырехвалентный. Попробуем определить атомы, исходя из того, что в сумме один атом углерода и все остальные атомы должны равняться молярной массе (равной молекулярной) 121. Попробуем рассчитать. Если это четыре атома фтора, то получается мало. А если это четыре атома хлора, то много. Возьмем нечто среднее: половина — атомы фтора и половина — атомы хлора. Единица в показателе 121 говорит о том, что имеются нечетные значения. Молярная масса хлора 35,5. Для того чтобы получить целое численное значение, вероятно, нужны два атома хлора.
121 – 71 – 12 = 38 (ровно на два атома фтора)
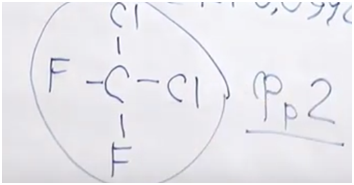
3. Перейдем к фреону № 3. Нам дана массовая доля фтора: 39,58. Дана массовая дола водорода: 10,42. Поскольку это органическое вещество, должен быть и углерод — попробуем его найти.
100 – 39,58 – 10,42 = 50
Проверим вариант, что там только хлор и нет других атомов. Предположим, что там всего один атом углерода (его масса будет равна 12). Посчитаем, какая масса при этом будет приходиться, например, на атом фтора.
12 ∙ 39,58 : 50 = 9,5
Как указано в периодической системе Менделеева, атомная масса фтора — 19. Ровно половина одного атома фтора — 9,5, так что в составе этой молекулы не может быть один атом углерода, их должно быть как минимум два. Следовательно, на углерод приходиться масса 24, на фтор — 19. Какая масса в данном случае приходится на водород? По сути, должно оставаться пять атомов водорода.
24 ∙ 10,42 : 50 = 5
Поскольку у нас один атом фтора, пять атомов водорода и два атома углерода, мы имеем дело с фторэтаном.

4. Что касается фреона № 4, то в реакции с натрием образовались этан и фторид натрия. Это реакция Вюрца — Фиттига. Мы имеем исходное вещество фторметан, которое реагирует с натрием, и образуются этан и фторид натрия.
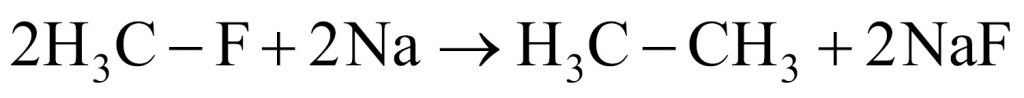
5. Переходим к фреону № 5. Формиат натрия образуется при гидролизе трифторметана. Получается формиат натрия, фторид натрия и две молекулы воды.
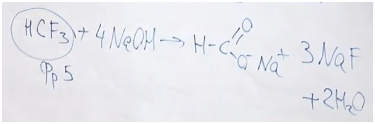
Посмотрев в справочную информацию, вы можете соотнести с кодами каждый из найденных фреонов.
Изучение фреонов очень интересно. Каждый тип холодильного оборудования требует особую марку фреона. Сегодня холодильное оборудование часто заполняют и углеводородами, поскольку, как известно, фреоны способствуют разрушению озонового слоя Земли. Но на сегодняшний день полного отказа от фреонов еще не произошло.

Химия. 10 класс. Углубленный уровень. Учебник.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова и продолжает курс химии, изложенный в учебниках «Химия. 8 класс» и «Химия. 9 класс» данного авторскогo коллектива. Предназначен для изучения химии на углубленном уровне. Учебник соответствует федеральному государственному образовательному стандарту среднего общeгo образования.
Купить
Вильгельм Рудольф Фиттиг
Задача. Вещество, открытое в 1862 году немецким ученым Вильгельмом Рудольфом Фиттигом, представляет собой бесцветные кристаллы (tпл = +690С). Они широко применяются в качестве пищевой добавки для сохранения товарного вида фруктов (например, цитрусовых) путем нанесения на кожуру плода. Для установления состава вещество массой 15,4 г сожгли, образовалось 26,88 л (н.у.) углекислого газа и 9 г воды. Установите структурную формулу, если известно, что оно может подвергаться каталитическому галогенированию. Составьте уравнение этого вещества с избытком водорода на платиновом катализаторе при повышенном давлении.
Похожую задачу часто можно встретить на ЕГЭ.
Начнем с определения молекулярной формулы вещества, то есть узнаем состав этой молекулы. Найдем количество углекислого газа, а оно равно количеству углерода. Разделим объем на молярный объем. Поскольку условия нормальные, молярный объем для газообразного вещества составляет около 22,4 л/моль.
26,88 л : 22,4 л/моль = 1,2 моль
Поскольку воды 9 г, а молярная масса воды 18 г, следовательно, воды 0,5 моль, а водорода 1 моль. Как такое может быть? В одной молекуле воды содержится целых два атома водорода. Но нам не сказано: соединение ли углеводородом? содержит ли кислород? Мы должны проверить наличие кислорода и найти массу углерода и водорода.
1,2 моль ∙ 12 = 14,4 г
Сумма углерода и водорода: 14,4 + 1 = 15,4. Следовательно, в составе неизвестного вещества нет кислорода.

Молярное соотношение показывает, что формула вещества С12H10. Почему не С6H5? Потому что в углеводородах никогда не бывает нечетного числа атомов водорода. Радикал С6H5 в химии называется фенилом. Иными словами, мы имеем соединение, которое называется в химии дифенил. На это также указывают химические свойства дифенила, и он является разрешенной пищевой добавкой. В магазинах можно встретить, например, апельсины, покрытые белым веществом — это и есть дифенил. Иногда его применяют в изрядном количестве, поэтому нужно тщательно мыть фрукты.
Составим уравнение реакции с избытком водорода. Очень просто посчитать, сколько атомов водорода потребуется на реакцию с дифенилом. Мы видим шесть двойных связей. Следовательно, на одну двойную связь нужна одна молекула водорода, а на шесть двойных связей — шесть молекул водорода при исчерпывающем гидрировании. Конечно, на platinum-катализаторе, потому что соединение ароматическое и требует преодоления достаточно высокого энергетического барьера. Мы получаем соединение, которое нельзя назвать никак иначе, кроме как дициклогексил.

Соединение дифенил и было открыто Рудольфом Фиттигом в 1862 году с температурой плавления 69°С.
Желеобразующая жидкость
Задача. Некоторая нерастворимая в воде жидкость при хранении на воздухе способна уплотняться, превращаясь в желе. Химик отобрал, отмерив, некоторый объем этой жидкости и установил, что при действии избытка раствора брома в четыреххлористом углероде образовалось 26,4 г дибромида. А при действии раствора хлора на такой же объем этой жидкости образовалось 17,5 г дихлорида. Определите структурную формулу этой жидкости, если известно, что в ее состав входят только атомы водорода и углерода. Составьте уравнение реакции полимеризации этой жидкости.
Обозначим неизвестную жидкость-углеводород через формулу CXHY. О какой реакции идет речь: замещения или присоединения? Поскольку реакция протекает при обычных условиях, значит, речь идет о реакции присоединения.
Для решения данной задачи нужно применить прием, известный в учебной химии как прием вычитания массы. Представим, что жидкости у нас ровно 1 моль. В этом случае разница между массой дибромида и дихлорида будет разницей между массой брома и хлора.
Молекула брома имеет массу 160, а молекула хлора — 71. Получаем 89. То есть если бы вещества у нас было 1 моль, то разница составила бы 89 г. Вычислим разницу массы дибромида и дихлорида:
26,4 – 17,5 = 8,9
Искомого вещества 0,1 моль.
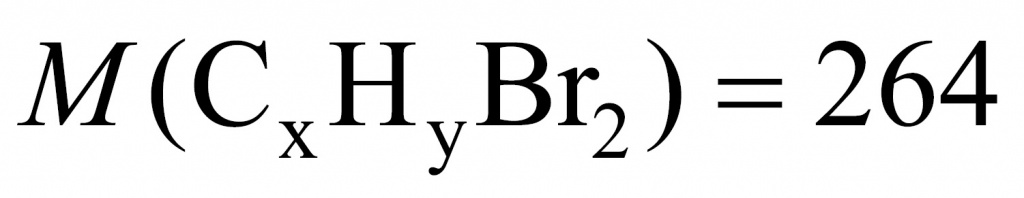
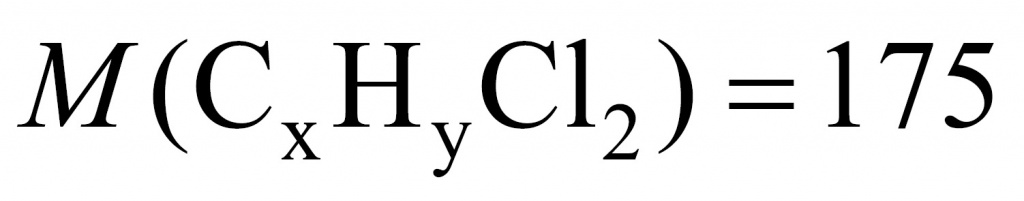
Теперь установим формулу. Обратимся к молекулярной записи. На углеводородную часть приходится 104. Сколько там может быть углеродов и водородов? Если углеродов 8 (что подходит), тогда на углероды приходится 96 и на водороды — 8.
Формула углеводорода C8H8.
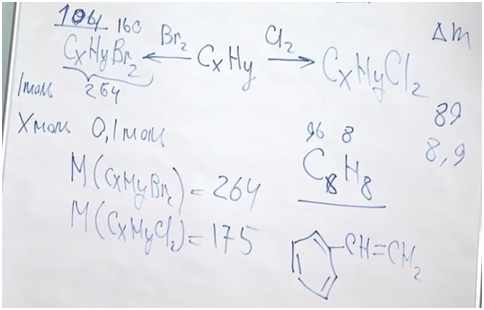
Разберемся, о каком углеводороде идет речь. Обратим внимание, что соединение непредельное, но оно способно присоединить только одну молекулу брома или одну молекулу хрома. Значит, исходя из малого числа атомов водорода по отношению к атомам углерода, скорее всего, это соединение есть не что иное, как производное бензола, то есть ароматическое соединение. В бензоле шесть атомов углерода и пять атомов водорода в остатке. У нас получается кетастирол.
Чтобы не было полимеризации, обычно в тот стирол, который можно купить в магазине, добавляют стабилизатор.
Уравнение полимеризации. Из n молекул стирола получается полимер, состоящий из n фрагментов.
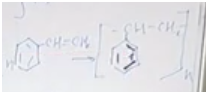
Полистирол — это, например, одноразовая посуда. Она наносит существенный вред окружающей среде, и сейчас идет речь о том, чтобы ее запретить.
Отдушка для мыла
Задача. Некоторое легкоплавкое вещество, обладающее приятным запахом, используют в качестве ингибитора полимеризации, в качестве отдушки для мыла. При сжигании этого вещества массой 8,4 г получили 11,2 л (н.у.) углекислого газа, 7,2 г воды. Установите структурную формулу неизвестного соединения, если известно, что оно не реагирует с бромной водой, но реагирует с водородом в присутствии катализатора. Известно, что это соединение может быть получено в результате прокаливания кальциевой соли органической кислоты. Составьте уравнение соответствующей химической реакции.
По данным задачи, углекислый газ составляет 0,1 моль, соответственно, столько же и углерода. Поскольку воды 7,2 г, что в молях 0,4, то водорода 0,8. Проверим на наличие кислорода. Масса углерода 6, масса водорода – 0,8. Поскольку общая масса сожженного вещества составляет 8,4, то на кислород приходится масса 1,6 (в молях 0,1). Получается молекулярная формула C5H8O.

Перейдем к структурой формуле вещества. Вещество не реагирует с бромной водой — из этого можно делать вывод, что нет кратных соединений (то есть двойных, тройных углерод-углеродных связей). Но вещество реагирует с водородом в присутствии катализатора. Исходя из условий, скорее всего, речь идет о двухосновной кислоте. В результате прокаливания, нагревания (в пределах 200–250°С) отщепляется карбонат кальция и образуется кетон циклопентанон.
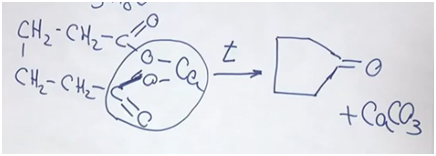
Циклопентанон как раз используют в качестве отдушки для мыла.
Ошибка А. М. Бутлерова
Задача. Установите структурную формулу альдегида, в определении которой немного ошибся великий А. М. Бутлеров, если известно, что в результате взаимодействия 100 г 0,9%-го раствора этого вещества с избытком раствора перманганата калия образуется осадок массой 3,48 г. Составьте уравнение реакции этого альдегида с раствором перманганата калия.
Все великие химики ошибались, в том числе и А. М. Бутлеров.
Для начала вспомним, как альдегиды взаимодействуют с перманганатом калия. Мы не знаем, о каком альдегиде идет речь. Допустим, у него была одна альдегидная группа (хотя, если в соединении две альдегидные группы, он все равно будет альдегидом). Возьмем также перманганат калия и мысленно нагреем. Мы получаем калиевую соль некой карбоновой кислоты, оксид марганца (IV) и гидроксид калия. Степень окисления углерода в альдегидной группе была +1, а стала +3. Получается, что углерод альдегид потерял два электрона. Марганец был +7, стал +4? значит, он принял три электрона. Так мы определили ключевые коэффициенты. Проблема состоит в том, что калия всего два атома. Можно сказать, что две молекулы были в форме соли, а одна молекула в форме кислоты. Поскольку гидроксида калия 3, мы видим, что его не хватает — вместо него будет вода.
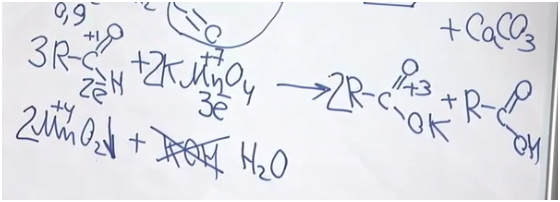
После составления уравнения найдем массу альдегида и массу осадка. Но осадок — это, разумеется, оксид марганца (IV).
Поскольку у нас 100 г 0,2%-го раствора и на 1% приходится 1 г, масса альдегида 0,9 г. Чтобы найти количество оксида марганца, 3,48 разделим на молярную масса оксида марганца — 87. Получаем 0,04 моль. В соответствии с этим уравнением альдегида у нас должно быть больше в полтора раза: 0,06 моль.
Найдем молярную массу альдегида.
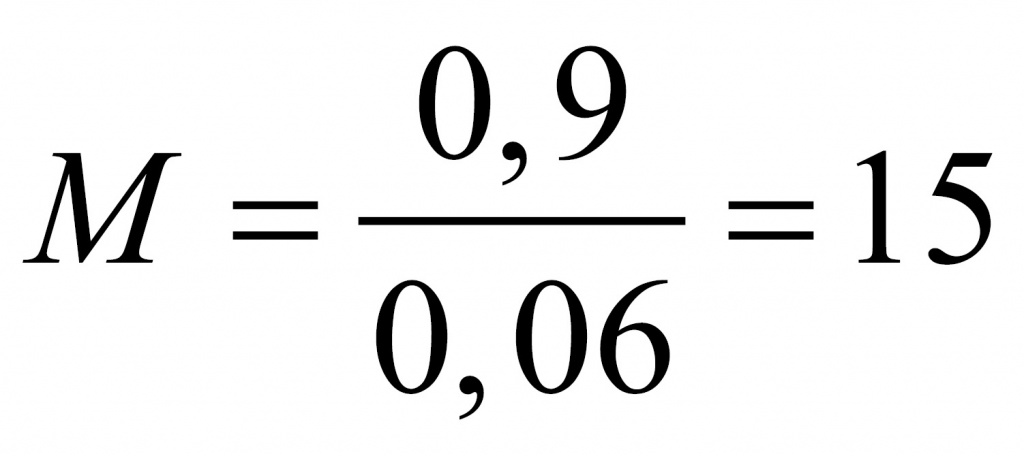
Где вы видели альдегид с молярной массой 15? Только на атом кислорода приходится 16. Значит, что либо альдегид содержал две альдегидные группы, либо это был формальдегид. Если бы он содержал две альдегидные группы, он бы отдал не два, а четыре электрона. Столько же отдал бы и формальдегид. Перманганат калия принимал бы три электрона. У оксида марганца (IV) было бы 4 моль. В этом случае оксида марганца 0,4 моль, а альдегида 0,3 моль.

Тогда
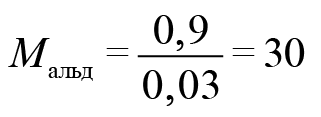
Следовательно, искомый альдегид — формальдегид. CH2O.
А. М. Бутлеров изначально определил формулу как C2H4O2.

Химия. 11 класс. Углубленный уровень. Учебник.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова и продолжает курс химии для старшей школы, изложенный в учебнике «Химия. Углубленный уровень. 10 класс» данного авторского коллектива. Учебник предназначен для изучения химии на углублённом уровне. Учебник соответствует Федеральному государственному образовательному стандарту среднего общего образования.
Купить
…ловая кислота
Задача. На полке в химической лаборатории стояла склянка с полустертой надписью. Единственное, что можно было разобрать: «…ловая кислота». Для установления состава кислоты провели ряд экспериментов. Для полной нейтрализации раствора, содержащего 0,36 г этой кислоты, понадобилось 50 мл 0,1-молярного раствора гидроксида натрия. Такая же навеска кислоты смогла обесцветить V = 80 мл (ω = 1%, ρ ≈ 1 г/мл) бромной воды. Восстановите надпись на склянке.
Обозначим формулу кислоты (будем считать, что она монокарбоновая). Если она одноосновная, то реакция идет один к одному. Найдем количество гидроксида натрия: 50 миллилитров 0,1-молярного раствора. У нас раствор, в одном литре которого содержится 0,1 моль вещества. Поскольку 50 мл — это в 20 раз меньше, то 0,1 разделим на 20. Получаем 0,005 гидроксида натрия. Столько же и карбоновой кислоты.
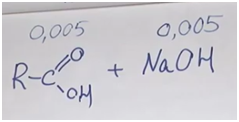
Отсюда легко находим молекулярную массу карбоновой кислоты.
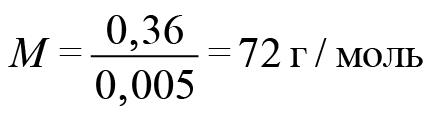
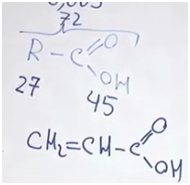
На карбоксильную группу приходится 45. Значит, на углеводородную часть приходится 27. В них поместятся два атома углерода и три атома водорода. Искомая кислота — акриловая.
Электроны
Задача. 0,800000 кг вещества содержит 0,2743 г электронов. Установите формулу вещества, если известно, что масса электрона равна 0,0005486 а.е.м.
Начнем с количества электронов. Масса электронов у нас известна и молярная масса тоже.
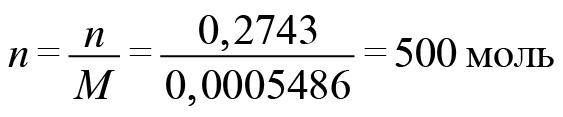
Число протонов равно количеству электронов:
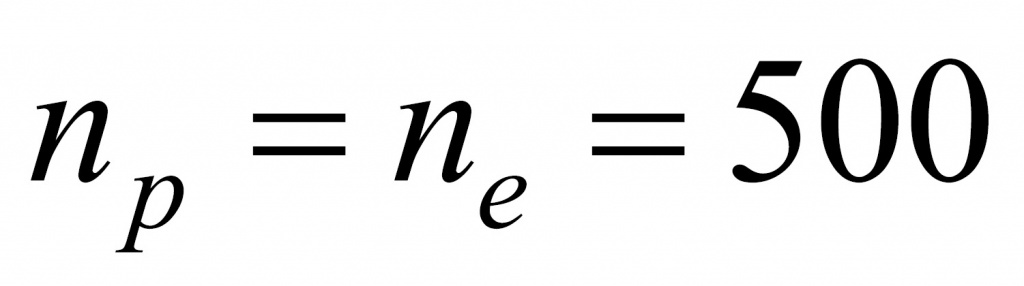
Отсюда находим массу, которая приходится на нейтроны (поскольку с точки зрения школьной химии любое число состоит из протонов, нейтронов и электронов). Обычно мы пренебрегаем массой электронов, но в данной задаче ей пренебрегать не нужно.
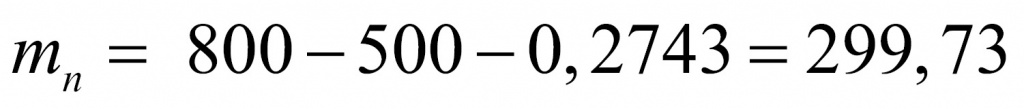
Получается интересное вещество. Обычно в атомах число нейтронов либо равно числу протонов, либо больше. В данном веществе протоны преобладают. Скорее всего, мы имеем дело с водородным соединением. Найдем соотношение между числом протонов и числом нейтронов.
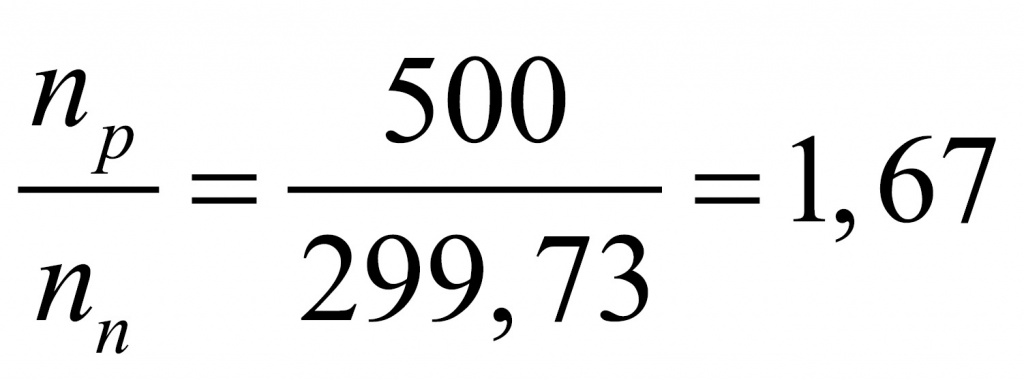
Если мы переберем водородные соединения элементов второго периода, то для метана получим, что в составе метана протонов буде 10, а нейтронов — 6.
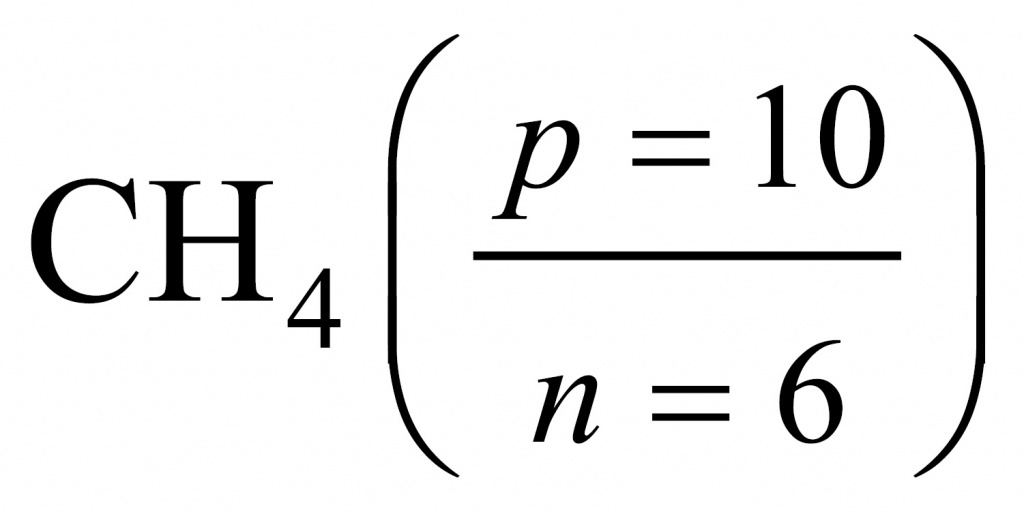
Поделив 10 на 6, получаем 1,67. Следовательно, искомым соединением был родоначальник предельных углеводородов, первый член гомологического ряда — метан.
#ADVERTISING_INSERT#
Доступно
и понятно каждому ученику
Эффективная
методика решения задач
Башкин Анатолий
Васильевич,
Учитель химии МБОУ
СОШ
с. Сырское,
Липецкого района,
победитель
конкурса
лучших учителей
Российской
Федерации 2006 г.
Липецк
Решение задач на
определение формулы вещества, состоящего из 2-х или 3-х элементов,
когда известны их массовые доли, при этом один из элементов неизвестен.
Предлагается
алгоритм (методика) решения подобных задач (2 решения).
Задачи для
закрепления (3).
Для любой химической формулы из 2-х
элементов AaBb
выполняется соотношение:
![]() =
= ![]() = const
= const
где
nA и nB –
количества вещества данного элемента, а и b – индексы.
Для любой химической формулы из 3-х
элементов CcAaBb
выполняется соотношение:
![]() =
= ![]() =
= ![]() = const
= const
где
nC, nA и nB –
количества вещества данного элемента, с, а, b – индексы.
1.
Принимая
всю формулу соединения за 100 г. по массе и за 100 %, получаем, что массы этих
элементов соответствуют точно цифрам их процентов в данной формуле.
2.
Затем
определяем количества вещества известных элементов по формуле:
n
= ![]()
3.
Далее
определяем молярную массу неизвестного элемента (по проценту) и используя constанту для
формулы – соотношение количества вещества элемента к его индексу в любой
формуле ПОСТОЯННО.
Например:
Задача 1. Определить
формулу соединения, если известно, что оно содержит 28 % металла,
24 % серы и 48 % кислорода по массе (3 уровень).
Алгоритм
решения:
1)
Всю
формулу обозначаем за 100 г. и 100 %, тогда:
m (Me) = 28 г.
m (S) = 24 г.
m (O) = 48 г.
2)
Определяем
количества вещества серы (S)
n
(S) = ![]() = 0,75 моль
= 0,75 моль
3)
Определяем
количества вещества кислорода (O)
n (O) = ![]() = 3 моль
= 3 моль
4)
Соотношение
n (S) : n (O) = 0,75 :
3 = 1 : 4 это кислотный остаток серной кислоты – сульфат анион = SO42-
5)
Металлы
бывают разные, со степенью окисления +1, +2, +3
6)
Возможные
варианты солей:
а) Me2SO4
б) MeSO4 в) Me2(SO4)3
7)
Прорешиваем
все варианты:
Первый
вариант:
Me2SO4
à ![]() =
= ![]() =
= ![]() =
= ![]() =
= ![]() =
= ![]() = 0,75
= 0,75
![]() =
= ![]() n (Me) = 1,5
n (Me) = 1,5
моль
M(Me) = ![]() =
= ![]() = 18,67 г/моль
= 18,67 г/моль
Такого
металла нет.
8)
Второй
вариант:
MeSO4
à ![]() =
= ![]() =
= ![]() =
= ![]() =
= ![]() =
= ![]() = 0,75
= 0,75
![]() =
= ![]() n (Me) = 0,75
n (Me) = 0,75
моль
тогда
M(Me) = ![]() = 37,33 г/моль
= 37,33 г/моль
Такого
металла тоже нет.
9)
Третий
вариант:
Me2(SO4)3
à ![]() =
= ![]() =
= ![]() =
= ![]() =
= ![]() =
= ![]() = 0,25
= 0,25
![]() = 0,25 n (Me) = 0,5
= 0,25 n (Me) = 0,5
моль
M(Me) = ![]() = 56 г/моль
= 56 г/моль
Искомая
формула соли: Fe2(SO4)3
Задачи для закрепления:
1.
Определить
формулу соединения, если известно, что оно содержит: 27,48 % металла, 23,66 %
фосфора и 48,86 % кислорода по массе.
Ответ:
Mg3(PO4)2
2.
Определить
формулу соединения, если известно, что оно содержит: 40 % металла,
20 % серы и 40 % кислорода по массе.
Ответ:
CuSO4
3.
Определить
формулу соединения, если известно, что оно содержит: 40 % металла,
12 % углерода и 48 % кислорода по массе.
Ответ:
CaCO3
Задача 2. Определить
формулу бинарного соединения, если известно, что оно
содержит 5,88 % водорода по массе.
Решение:
1)
На
неизвестный элемент приходится 100 % – 5,88 % = 94,12 %
2)
Тогда
m (Э) =
94,12 г. m (H) = 5,88
г.
3)
Предположим
возможные варианты формул, так как элемент может принимать валентность
а) ЭН b) ЭН2
с) ЭН3 d) ЭН4
или
I, или II, или III, или IV.
4)
Прорешиваем
все варианты с определением молярной массы элемента.
5)
ЭН
а)
n(Н) = ![]() = 5,88 моль.
= 5,88 моль.
b) n(Н) = n(Э) = 5,88
моль.
с)
М(Э) = ![]() = 16 г/моль кислород.
= 16 г/моль кислород.
d) ОН
такого соединения нет.
6)
ЭН2
а)
n(Н) = ![]() = 5,88 моль.
= 5,88 моль.
b) n(Э) = ½ n(Н) = ½ х
5,88 моль. = 2,94 моль.
с)
М(Э) = ![]() = 32 г/моль сера.
= 32 г/моль сера.
d) Н2S или H2O2
7)
Варианты
ЭН3 и ЭН4 не имеют решения.
