Методы определения концентрации растворов
Концентрацию
растворов можно определять различными
методами:
1) По плотности
раствора, когда не требуется большой
точности;
2) Титрованием,
если значение концентрации необходимо
определить с точностью до 0,01%.
Плотность
раствора определяется по формуле:
![]() ,
,
где m
– масса раствора, г;
V
– объем раствора, мл.
Определение
плотности проще всего производить при
помощи ареометра. Не существует
универсального ареометра. Каждый
ареометр предназначен для жидкостей,
значения плотностей которых лежат в
определенных пределах. Поэтому при
выборе ареометра необходимо, чтобы
ориентировочное значение плотности
данного раствора попадало в интервал
шкалы данного ареометра.
Так как плотность
раствора обусловлена его концентрацией,
то измерив ареометром плотность, можно
по таблицам найти массовую долю
растворённого вещества в растворе
(таб.1).
Титрование
– определение неизвестной концентрации
одного раствора по известной концентрации
другого путем измерения объемов
реагирующих растворов.
Согласно
закону эквивалентов
вещества вступают и образуются в
результате реакции в эквивалентных
количествах. Следовательно, в процессе
титрования νэ(1)=νэ(2).
Выразим количества эквивалентов
реагирующих веществ через объемы (V)
растворов и молярные концентрации их
эквивалентов Сэ,
тогда
V(1)
∙ Сэ(1)
= V(2)
∙ Сэ(2),
или
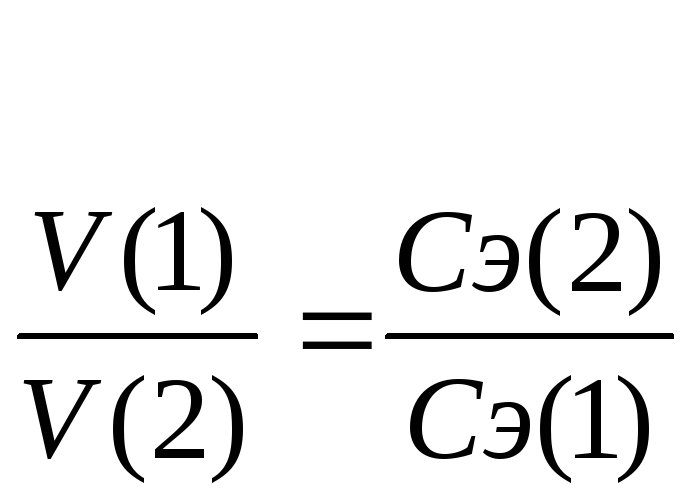 (11)
(11)
Эти два соотношения
называются формулами
титрования.
Способы приготовления растворов заданной концентрации
Растворы
заданной концентрации можно приготовить
различными способами:
1. Растворением вещества в растворителе
Пример 1.
Приготовить 50 г 5% раствора хлорида
натрия NaCl.
Решение.
Для этого необходимо рассчитать, какую
массу (г) хлорида натрия и массу воды
(г) нужно взять для приготовления 50 г 5%
раствора.
По определению
массовой доли в 100 г 5% раствора содержатся
5 г хлорида натрия, а в 50 г 5% раствора
будет содержаться Х г хлорида натрия.
Отсюда: Х =
![]() = 2,5гNaCl,
= 2,5гNaCl,
тогда легко вычислить массу воды:
50г
– 2,5г = 47,5г.
Если
воспользоваться формулой (2), то решение
будет следующим: ω
=
![]() ∙ 100% →
∙ 100% →
→ m(
р.в. )= ω
∙ m
(р-ра) /100% = 5% ∙ 50 г / 100% = 2,5 г
m
(H2O)
= m
(р-ра) – m
(р.в.) = 50 г – 2,5 г = 47,5 г
Таким образом,
для приготовления раствора данной
концентрации, необходимо на весах
взвесить 2,5г NaCl
и растворить его в 47,5 мл воды (учитывая,
что плотность воды равна 1 г/мл, объем
воды будет равен ее массе).
Пример 2.
Приготовить 100 мл раствора сульфата
меди с молярной концентрацией 0,1 моль/л
сульфата меди.
Решение.
По определению молярной концентрации
в 1000 мл раствора содержится 0,1 моль
CuSO4,
а в 100 мл раствора будет содержаться х
моль CuSO4.
х =
![]()
= 0,01 моль
Из соотношения
(4) следует m= ν∙М, т.к. М (CuSO4)
= 160 г/моль, то
m
= 0,01 моль ∙160 г/моль = 1,6 г
Если
воспользоваться формулой (5), то решение
будет следующим:
С
=![]()
→ m
= С ∙ М ∙ V
= 0,01моль/л ∙ 160 г/моль ∙ 0,1 л = 1,6 г
Таким образом,
для того, чтобы приготовить 100 мл раствора
с концентрацией 0,1 моль/л CuSO4,
необходимо
на весах взвесить 1,6 г
CuSO4,
перенести
в мерную колбу на 100 мл и довести объем
раствора в колбе до метки.
Пример 3.
Приготовить 200 мл раствора NaОН
с 0,5 молярной концентрацией эквивалента
NaОН.
Решение.
Из уравнения (7)
находим массу NaОН
Сэ
=
![]() →m=
→m=
Сэ
∙ Vэ
∙ Мэ
зная, что Мэ
(NaОН)
=
![]()
= 40г /моль, тогда m =0,5 моль/л
∙ 0,2 л ∙ 40 г/моль = 4 г
Итак, для
приготовления 200 мл раствора с 0,5 молярной
концентрацией эквивалента NaОН
необходимо взвесить 4 г NaОН,
перенести в мерную колбу на 200 мл и
довести объем раствора в колбе до метки.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Раствор – неизвестная концентрация
Cтраница 1
Раствор NaOH неизвестной концентрации разбавлен в мерной колбе емкостью 250 мл.
[1]
Раствор NaOH неизвестной концентрации разбавлен в мерной колбе до 250 мл.
[2]
Получив раствор неизвестной концентрации, определяют показатель преломления. Пользуясь калибровочной кривой, находят концентрацию спирта в исследуемом растворе.
[3]
Получают у руководителя раствор неизвестной концентрации и, как описано выше, находят для него показание на шкале поляриметра. Берут среднее из нескольких отсчетов и по калибровочной кривой вычисляют концентрацию раствора.
[4]
Получают у руководителя раствор неизвестной концентрации и, как описано выше, находят для него показание на шкале поля – риметра. Берут среднее из нескольких отсчетов и по калибровоч – ной кривой вычисляют концентрацию раствора.
[5]
Получают у руководителя раствор неизвестной концентрации и, как описано выше, находят для него показание на шкале поляриметра. Берут среднее из нескольких отсчетов и по калибровочной кривой вычисляют концентрацию раствора.
[6]
Получив у преподавателя раствор неизвестной концентрации, определяют показатель преломления ( стр. Пользуясь калибровочной кривой, находят концентрацию спирта в исследуемом растворе.
[7]
При проведении анализа раствора неизвестной концентрации следует определить коэффициент поглощения чистого вещества при выбранных для анализа длинах ъолн.
[8]
Если в лаборатории имеется раствор неизвестной концентрации, то последняя может быть установлена определением удельного веса и сопоставлением его с соответствующими справочными таблицами.
[9]
Для этого к исследуемому раствору неизвестной концентрации постепенно, порциями, приливают титрованный раствор AgNO3 или Hg2 ( NO3) 2 при непрерывном перемешивании раствора и с помощью компенсационной схемы измеряют разность потенциалов между индикаторным электродом, находящимся в исследуемом растворе, и электродом сравнения – например, каломельным. Выбор индикаторного электрода определяется выбором титрованного раствора.
[10]
Если при получении от преподавателя раствора неизвестной концентрации на колбочке указан объем раствора, то рассчитать концентрацию меди в полученном растворе ( в г / л) и концентрацию соли меди ( II) ( моль / л), считая анион соли не выше двухза-рядного.
[11]
Затем определяют содержание серебра в растворе неизвестной концентрации, используя полученный график.
[12]
Для определения ионов никеля в растворе неизвестной концентрации готовят три-четыре колонки, как указано выше.
[13]
Затем в поляриметрическую трубку помещают исследуемый раствор неизвестной концентрации, измеряют угол вращения и по градуировочному графику устанавливают концентрацию глюкозы в исследуемом растворе.
[14]
Затем замеряют угол вращения для исследуемого раствора неизвестной концентрации и по графику устанавливают ее величину.
[15]
Страницы:
1
2
3
Как найти концентрацию
Концентрацией называется отношение числа частиц компонента системы (смеси, раствора, либо сплава), его количества (молярная концентрация) или массы (массовая концентрация) к объему системы.

Вам понадобится
- Для определения вещества в растворе проще всего воспользоваться титрованием. Для этого нам необходимы: исследуемый раствор, бюретка, колба, рабочий раствор известной концентрации и индикатор.
Инструкция
В роли индикатора чаще всего выступают кислотно-щелочные индикаторы, к примеру, фенолфталеин.
Залив в бюретку рабочий раствор до нулевой отметки, следует по капле добавлять его в исследуемый раствор с растворенным в нем индикатором. Как только реакция произошла, исследуемый раствор меняет цвет.
Теперь, путем нехитрых вычислений, мы можем узнать концентрацию исследуемого вещества в растворе.
К примеру, у нас было 50 мл. раствора NaOH неизвестной концентрации. На титрование этого раствора у нас ушло 10 мл. HCl с концентрацией 0,01 моль/л. Находим концентрацию неизвестного раствора следующим образом: 0,01 (10/50) = 0,002 моль/л.
Видео по теме
Обратите внимание
Не забудьте расставить стехиометрические коэффициенты в уравнении реакции при необходимости.
Источники:
- статья о титровании
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
В реальности, химики редко работают с чистыми веществами. В большинстве своем для работы, при проведении химических реакций, расчетов по ним используются различные растворы.
Раство́р — гомогенная (однородная) смесь, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия
Подробнее о процессе растворения мы поговорим в следующих статьях.
При решении расчетных задач нам нудно уметь находить количество чистого вещества, находящегося в растворе. Это необходимо затем, что, как правило, в химическое взаимодействие вступает вещество, а не дополнительные продукты, которое оно содержит: примеси, если это не чистое вещество, компоненты растворителя, или инертные для данного химического процесса компоненты смеси (если это смесь веществ).
Если мы работаем с 500 граммами раствора, в котором всего 10 грамм чистого вещества, то в расчеты мы берем 10 грамм, а не 500! – пример, почему необходимо уметь вычислять количественные характеристики чистого вещества.
Способы выражения концентрации растворов
Существуют различные способы выражения концентраций растворов. В задачах могут встретиться любые из них. Рассмотрим основные из них более подробно.
I. Массовая доля вещества
Массовая доля – отношение массы чистого вещества к массе всего раствора. Данная величина безразмерная (говорят доля от единицы, всегда меньше 1, или равна единице для чистого вещества), или выражается в %.
Очень часто можно встретить запись запись, например NaOH, 15% – это значит, что из всей массы раствора на долю гидроксида натрия (NaOH) приходится только 15 %.
Следует не забывать, что масса раствора = масса растворителя + масса чистого вещества.
Зная массовую долю вещества, нетрудно выразить формулу для расчета массы чистого вещества:
В некоторых задачах масса раствора может быть не дана в условии. В этом случае мы сами можем её задать. Как правило в таких случаях, мы задаём массу раствора как 100 г. Дальнейший расчет ведется уже исходя из заданной массы (если требуется перевести одну концентрацию в другую).
Приведем примеры задач:
Мы специально делаем подробное решение, чтобы отследить ход мыслей.
Решим аналогичную задачу:
Более часто встречаются задачи, в которых требуется приготовить раствор из другого раствора путем добавления чистого вещества (в этом случае концентрация увеличится), растворителя (концентрация уменьшится) или другого раствора (концентрация займёт промежуточное значение).
Рассчитайте массу соли, которую необходимо добавить к 150 г 10% -го раствора, чтобы концентрация полученного раствора стала 15%?
Данную задачу можно решать различными способами. В настоящий момент приведем только один (более длинный, но более понятный). Для решения таких задач другим способом мы подготовим видео.
Задачи, в которых добавляется растворитель – решаются проще.
Какое количество воды необходимо добавить к 200 г 15%-го раствора, чтобы его концентрация стала 10%?
Для решения задач, в которых смешиваются два раствора, имеющих различные концентрации, можно использовать следующий алгоритм:
1. Рассчитать количество чистого вещества в обоих растворах и сложить их.
2. Поделить полученное число на сумму масс растворов. Домножить на 100 %.
Решим для примера следующую задачу
Смешали 200 г 10%-го раствора серной кислоты и 100 г 20-% го. Какая массовая доля стала у получившегося раствора?
II. Молярная концентрация вещества
Молярная концентрация вещества – отношение количества вещества к объему раствора. Данная величина показывает нам, сколько (моль) вещества растворено в 1 литре раствора. Единица измерения – моль/л.
Обозначается молярная концентрация заглавной буквой C
В химической лаборатории очень часто для обозначения концентрации используется именно данная величина.
Очень часто, на химических склянках можно увидеть следующие обозначения:
Таким способом также обозначается молярная концентрация. Число перед буквой М обозначает концентрацию: 1 моль/л; 0,1 моль/л; 0,02 моль/л; 3 моль/л; 0,5 моль/л.
Можно также встретить в задачах такое обозначение, связанное с данной формой записи: молярный раствор (1 М) – раствор, концентрация которого составляет 1 моль/л. Децимолярный раствор (0,1 М) – 0,1 моль/л; сантимолярный раствор (0,01 М) – 0,01 моль/л.
Решим некоторые задачи, в которых используется молярная концентрация:
Для приготовления раствора сульфата натрия навеску, содержащую 14,2 г соли растворили в 500 мл воды и довели до метки.
Доведение до метки обозначает, что объем приготовленного раствора составляет (в данном случае) 500 мл.
Часто требуется рассчитать количество вещества:
Прежде чем проводить расчет по уравнению химических реакций, необходимо найти количество вещества.
III. Моляльная концентрация
Моляльная концентрация – отношение количества (моль) растворенного вещества к массе растворителя. Данная концентрация показывает нам, сколько моль вещества необходимо добавить к 1 кг растворителя (воды, например), чтобы получить нужную концентрации. Обозначается данная концентрация См, а измеряется в моль/кг(растворителя).
IV. Мольная доля
Мольная доля – отношение количества вещества к сумме количеств всех компонентов раствора. Данная физическая величина не имеет размерности.
Сумма всех мольных долей раствора равна “1”.
Данная физическая величина нашла широкое применение в химической химии для описания равновесных термодинамических процессов.
V. Титр
Титр – отношение массы вещества к единице объема (выраженного в миллилитрах). Титр показывает, сколько грамм вещества находится в каждом миллилитре раствора. обозначается как “Т” и измеряется в г/мл.
Титр – очень маленькая величина, так как в в 1 миллилитре раствора может находиться незначительное количество вещества.
Титр нашел широкое применение в аналитической химии.
В заключении
По данной теме существует огромное количество расчетных задач. Многие из них мы рассмотрим в следующих статьях. О пока…
Проверьте, как Вы усвоили материал.
Задание №1. Перейдите к гугл-форме и ответьте на вопросы (базовый уровень):
https://forms.gle/7u32uLfxRk1Yug7a8
Задание №2. Решите расчетные задачи: https://vk.com/page-205267346_56951920 (повышенный уровень)
Задание №3. Решите следующую задачу:
Какова молярная концентрация 12%-ного раствора серной кислоты (H2S04) с плотностью р = 1,08 г/см3. Рассчитайте титр данного вещества, моляльную концентрацию, мольную долю.
Отчет о решении задач пришли в беседу “Учебный класс”:
https://vk.me/join/DKsyQe2p0hJ2Wdoch1XOTwi_qZEJow1udOM=
Концентраций раствора бывает несколько видов.
Наиболее распространена так называемая массовая доля.
Массовую долю наиболее часто обозначают греческой буквой “омега”. Я буду обозначать её буквой w. Это допустимое обозначение, мы его изредка применяли в колледже.
Итак, массовая доля находится по следующей формуле:
w = [m(в-ва)/m(р-ра)] * 100%
m(в-ва) — масса растворённого вещества
m(р-ра) — масса раствора.
В свою очередь масса раствора равна сумме масс растворённого вещества и растворителя:
m(р-ра) = m(в-ва) + m(р-ля)
Соответственно, мы можем записать формулу так:
w = {m(в-ва)/[m(в-ва) + m(р-ля)]} * 100%
Пример задачи.
“Какова концентрация (массовая доля) раствора, для приготовления которого взяли 5 г хлорида натрия и 45 мл воды?”
Ключи к решению:
1) Во-первых, нам облегчает решение то, что неважно, о каком веществе идёт речь. По условию дан NaCl, но вместо него может быть любое другое растворимое вещество: иодид калия, нитрат серебра, сахароза и мн. др.
2) Во-вторых, радует то, что никаких уравнений химических реакций в задачах такого вида составлять не надо.
Решим задачу по действиям.
1) Находим массу растворителя, то есть воды.
m (H2O) = V (H2O) * po (H2O) = 45 мл * 1 г/мл = 45 г.
2) Находим массу раствора:
m(р-ра) = m(в-ва) + m(р-ля) = 5 г + 45 г = 50 г.
3) Находим массовую долю:
w = [m(в-ва)/m(р-ра)] * 100% = (5 г/50 г) * 100% = 0,1 * 100% = 10%.
Ответ: концентрация раствора (массовая доля NaCl) равна 10%.
Кроме массовой доли, существует ещё множество иных видов концентраций раствора.
1) Молярная концентрация (Cm). Равна отношению количества растворённого вещества к объёму раствора.
Cm = v(в-ва)/V(р-ра)
2) Нормальная концентрация (Cn). Равна отношению количества эквивалента растворённого вещества к объёму раствора.
Cn = v(в-ва)/[(1/f) * V(р-ра)]
Cn = z * v(в-ва)/ V(р-ра)
3) Моляльная концентрация (обозначим её K). Равна отношению количества растворённого вещества к массе растворителя.
K = v(в-ва)/m(р-ля)
4) Титр вещества (T). Равен отношению массы растворённого вещества к объёму раствора.
T = m(в-ва)/V(р-ра).
5) Мольная доля (обозначим её как X). Равна отношению количества вещества некоторого компонента к сумме количеств веществ всех компонентов раствора.
X = v/S(vi)
где S(vi) — сумма количеств веществ всех компонентов раствора.
