Загрузить PDF
Загрузить PDF
В химии термины «окисление» и «восстановление» означает реакции, при которых атом или группа атомов теряют или, соответственно, приобретают электроны. Степень окисления — это приписываемая одному либо нескольким атомам численная величина, характеризующая количество перераспределяемых электронов и показывающая, каким образом эти электроны распределяются между атомами при реакции. Определение этой величины может быть как простой, так и довольно сложной процедурой, в зависимости от атомов и состоящих из них молекул. Более того, атомы некоторых элементов могут обладать несколькими степенями окисления. К счастью, для определения степени окисления существуют несложные однозначные правила, для уверенного пользования которыми достаточно знания основ химии и алгебры.
-
1
Определите, является ли рассматриваемое вещество элементарным. Степень окисления атомов вне химического соединения равна нулю. Это правило справедливо как для веществ, образованных из отдельных свободных атомов, так и для таких, которые состоят из двух, либо многоатомных молекул одного элемента.
- Например, Al(s) и Cl2 имеют степень окисления 0, поскольку оба находятся в химически несвязанном элементарном состоянии.
- Обратите внимание, что аллотропная форма серы S8, или октасера, несмотря на свое нетипичное строение, также характеризуется нулевой степенью окисления.
-
2
Определите, состоит ли рассматриваемое вещество из ионов. Степень окисления ионов равняется их заряду. Это справедливо как для свободных ионов, так и для тех, которые входят в состав химических соединений.
- Например, степень окисления иона Cl– равняется -1.
- Степень окисления иона Cl в составе химического соединения NaCl также равна -1. Поскольку ион Na, по определению, имеет заряд +1, мы заключаем, что заряд иона Cl -1, и таким образом степень его окисления равна -1.
-
3
Учтите, что ионы металлов могут иметь несколько степеней окисления. Атомы многих металлических элементов могут ионизироваться на разные величины. Например, заряд ионов такого металла как железо (Fe) равняется +2, либо +3.[1]
Заряд ионов металла (и их степень окисления) можно определить по зарядам ионов других элементов, с которыми данный металл входит в состав химического соединения; в тексте этот заряд обозначается римскими цифрами: так, железо (III) имеет степень окисления +3.- В качестве примера рассмотрим соединение, содержащее ион алюминия. Общий заряд соединения AlCl3 равен нулю. Поскольку нам известно, что ионы Cl– имеют заряд -1, и в соединении содержится 3 таких иона, для общей нейтральности рассматриваемого вещества ион Al должен иметь заряд +3. Таким образом, в данном случае степень окисления алюминия равна +3.
-
4
Степень окисления кислорода равна -2 (за некоторыми исключениями). Почти во всех случаях атомы кислорода имеют степень окисления -2. Есть несколько исключений из этого правила:
- Если кислород находится в элементарном состоянии (O2), его степень окисления равна 0, как и в случае других элементарных веществ.
- Если кислород входит в состав перекиси, его степень окисления равна -1. Перекиси — это группа соединений, содержащих простую кислород-кислородную связь (то есть анион перекиси O2-2). К примеру, в составе молекулы H2O2 (перекись водорода) кислород имеет заряд и степень окисления -1.
- В соединении с фтором кислород обладает степенью окисления +2, читайте правило для фтора ниже.
-
5
Водород характеризуется степенью окисления +1, за некоторыми исключениями. Как и для кислорода, здесь также существуют исключения. Как правило, степень окисления водорода равна +1 (если он не находится в элементарном состоянии H2). Однако в соединениях, называемых гидридами, степень окисления водорода составляет -1.
- Например, в H2O степень окисления водорода равна +1, поскольку атом кислорода имеет заряд -2, и для общей нейтральности необходимы два заряда +1. Тем не менее, в составе гидрида натрия степень окисления водорода уже -1, так как ион Na несет заряд +1, и для общей электронейтральности заряд атома водорода (а тем самым и его степень окисления) должен равняться -1.
-
6
Фтор всегда имеет степень окисления -1. Как уже было отмечено, степень окисления некоторых элементов (ионы металлов, атомы кислорода в перекисях и так далее) может меняться в зависимости от ряда факторов. Степень окисления фтора, однако, неизменно составляет -1. Это объясняется тем, что данный элемент имеет наибольшую электроотрицательность — иначе говоря, атомы фтора наименее охотно расстаются с собственными электронами и наиболее активно притягивают чужие электроны. Таким образом, их заряд остается неизменным.
-
7
Сумма степеней окисления в соединении равна его заряду. Степени окисления всех атомов, входящих в химическое соединение, в сумме должны давать заряд этого соединения. Например, если соединение нейтрально, сумма степеней окисления всех его атомов должна равняться нулю; если соединение является многоатомным ионом с зарядом -1, сумма степеней окисления равна -1, и так далее.
- Это хороший метод проверки — если сумма степеней окисления не равна общему заряду соединения, значит вы где-то ошиблись.
Реклама
-
1
Найдите атомы, не имеющие строгих правил относительно степени окисления. По отношению к некоторым элементам нет твердо установленных правил нахождения степени окисления. Если атом не подпадает ни под одно правило из перечисленных выше, и вы не знаете его заряда (например, атом входит в состав комплекса, и его заряд не указан), вы можете установить степень окисления такого атома методом исключения. Вначале определите заряд всех остальных атомов соединения, а затем из известного общего заряда соединения вычислите степень окисления данного атома.
- Например, в соединении Na2SO4 неизвестен заряд атома серы (S) — мы лишь знаем, что он не нулевой, поскольку сера находится не в элементарном состоянии. Это соединение служит хорошим примером для иллюстрации алгебраического метода определения степени окисления.
-
2
Найдите степени окисления остальных элементов, входящих в соединение. С помощью описанных выше правил определите степени окисления остальных атомов соединения. Не забывайте об исключениях из правил в случае атомов O, H и так далее.
- Для Na2SO4, пользуясь нашими правилами, мы находим, что заряд (а значит и степень окисления) иона Na равен +1, а для каждого из атомов кислорода он составляет -2.
-
3
Умножьте количество атомов на их степень окисления. Теперь, когда нам известны степени окисления всех атомов за исключением одного, необходимо учесть, что атомов некоторых элементов может быть несколько. Умножьте число атомов каждого элемента (оно указано в химической формуле соединения в виде подстрочного числа, следующего за символом элемента) на его степень окисления.
- В Na2SO4 мы имеем 2 атома Na и 4 атома O. Таким образом, умножая 2 × +1, получаем степень окисления всех атомов Na (2), а умножая 4 × -2 — степень окисления атомов O (-8).
-
4
Сложите предыдущие результаты. Суммируя результаты умножения, получаем степень окисления соединения без учета вклада искомого атома.
- В нашем примере для Na2SO4 мы складываем 2 и -8 и получаем -6.
-
5
Найдите неизвестную степень окисления из заряда соединения. Теперь у вас есть все данные для простого расчета искомой степени окисления. Запишите уравнение, в левой части которого будет сумма числа, полученного на предыдущем шаге вычислений, и неизвестной степени окисления, а в правой — общий заряд соединения. Иными словами, (Сумма известных степеней окисления) + (искомая степень окисления) = (заряд соединения).
- В нашем случае Na2SO4 решение выглядит следующим образом:
- (Сумма известных степеней окисления) + (искомая степень окисления) = (заряд соединения)
- -6 + S = 0
- S = 0 + 6
- S = 6. В Na2SO4 сера имеет степень окисления 6.
Реклама
- В нашем случае Na2SO4 решение выглядит следующим образом:
Советы
- В соединениях сумма всех степеней окисления должна равняться заряду. Например, если соединение представляет собой двухатомный ион, сумма степеней окисления атомов должна быть равна общему ионному заряду.
- Очень полезно уметь пользоваться периодической таблицей Менделеева и знать, где в ней располагаются металлические и неметаллические элементы.
- Степень окисления атомов в элементарном виде всегда равна нулю. Степень окисления единичного иона равна его заряду. Элементы группы 1A таблицы Менделеева, такие как водород, литий, натрий, в элементарном виде имеют степень окисления +1; степень окисления металлов группы 2A, таких как магний и кальций, в элементарном виде равна +2. Кислород и водород, в зависимости от вида химической связи, могут иметь 2 различных значения степени окисления.
Реклама
Что вам понадобится
- Периодическая таблица элементов
- Доступ в интернет или справочники по химии
- Лист бумаги, ручка или карандаш
- Калькулятор
Об этой статье
Эту страницу просматривали 644 341 раз.
Была ли эта статья полезной?
Степень окисления и валентность – понятия в чём-то близкие и взаимозаменяемые в ряде ситуаций. Но если валентность всегда положительна (поскольку по определение – способность атомов образовывать то или иное число химических связей. А число связей, очевидно, отрицательным быть не может), то степень окисления может иметь как положительные, так и отрицательные значения. А всё потому, что степень окисления – показывает, каким бы был заряд атома, если бы все электроны, образующие химическую связь сместились к нему (или полностью от него оторвались, сместившись к другому атому).
В бинарных соединениях степень окисления найти просто. Нужно помнить два момента:
1. Молекула всегда нейтральна, у неё нет заряда (или же он равен 0), поэтому число отрицательных зарядов равно числу зарядов положительных.
2. Произведения степени окисления атома и индекса, стоящего у атома в молекуле, у обоих составляющих молекулу атомов равны по модулю.
Также стоит запомнить, что
у многих элементов степени окисления почти всегда постоянны. Так, кислород имеет степень окисления -2, водород (очень часто, но не всегда!) и щелочные металлы +1, металлы второй группы +2 и т.д.
Но есть и элементы, которые могут иметь разную степень кисления, например, у серы она может быть -2, +4 или +6.
Для примера определим степени окисления меди в двух оксидах: Cu2O и CuO.
Известно, что у кислорода степень окисления -2. Напомню, что степень окисления указывается справа вверху от элемента. Таким образом, запишем для первого оксида:
Для кислорода произведение степени окисления и индекса -2*1=-2 или по модулю 2. Для меди произведение степени окисления и индекса тоже должно равняться 2. С учётом того, что у меди стоит индекс 2 получаем степень окисления 1. Очевидно, что это +1: поскольку в молекуле уже есть отрицательно заряженная составляющая, другая составляющая должна быть заряжена положительно. Таким образом, в оксиде меди Cu2O степень окисления меди +1.
С оксидом CuО дело обстоит ещё проще. Когда в молекуле атомы соединены 1 к 1, то степени окисления у них равны по модулю. Поскольку у кислорода степень окисления -2, то у меди здесь степень окисления +2.
Теперь разберём примеры посложнее и рассмотрим молекулы, состоящие из атомов трёх видов.
Пример 1.
Определите степень окисления серы в серной кислоте.
Серная кислота имеет формулу H2SO4. Чтобы понять, какая степень окисления у серы в этом соединении, нужно помнить, что заряд молекулы всегда равен 0, то есть число отрицательных зарядов всегда равно числу положительных. Теперь посмотрим на формулу и вспомним, что кислород имеет степень окисления -2, водород +1, то есть:
Что отсюда видно? Что пока у нас имеется два положительных заряда, это вклад водорода (+2 мы получаем, умножив степень окисления водорода на индекс: +1*2=+2) и восемь отрицательных, это вклад кислорода (-8 мы получаем, умножив степень окисления кислорода на индекс: -2*4=-8). Но нам нужно, чтобы число положительных зарядов было равно числу отрицательных, только при этом условии заряд молекулы будет 0. Следовательно, недостаёт 6 положительных зарядов. Это и есть степень окисления серы в серной кислоте: +6. То есть можно записать так:
Пример 2.
Найдём степень окисления азота в азотистой кислоте HNO2.
Рассуждать будет аналогично, исходя из известных степеней окисления (-2 у кислорода и +1 и водорода):
Перемножив степени окисления с индексами, получим, что у нас 1 положительный заряд (от водорода: +1*1=+1) и четыре отрицательных (от кислорода: -2*2=-4). Для общего нулевого заряда молекулы недостаёт трёх положительных зарядов, которые и даст азот. То есть в азотистой кислоте степень окисления азота +3:
Для тренировки попробуйте самостоятельно определить степень окисления хрома в бихромате калия K2CrO4.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Просмотров 8.5к. Опубликовано 04.09.2022
Простые вещества, такие как Cl2и О2 в этом случае не происходит сдвига электронов и степень окисления равна нулю.
Качественная характеристика окислительно-восстановительных реакций
Окислительно-восстановительные реакции являются наиболее распространенными химическими реакциями в природе. К ним относятся, например, фотосинтез, метаболизм и биологические процессы, а также сжигание топлива, производство металлов и многие другие реакции.
Реакции восстановления давно и успешно используются человечеством для самых разных целей, но сама теория электронов в окислительно-восстановительных процессах возникла совсем недавно, т.е. в начале 20 века.
Для того чтобы перейти к современной теории окислительно-восстановительных процессов, необходимо ввести различные понятия, такие как сила, степень окисления и структура электронной оболочки атома. Мы уже сталкивались с этими понятиями при изучении таких модулей, как периодический закон Менделеева, основные принципы атомной структуры элементов, химическая связь и молекулярная структура. Давайте теперь рассмотрим их более подробно.
Валентность
Живучесть — это сложное понятие, которое возникает с понятием химической связи и определяется как свойство атома соединяться с определенным количеством атомов другого элемента или вытеснять их, т.е. способность атома образовывать химические связи в соединении.
Изначально валентность определялась по водороду (считался как 1) или кислороду (валентность 2).
Впоследствии были выделены положительные и отрицательные значения. Количественно, положительная валентность — это число электронов, поставляемых атомом, а отрицательная валентность — это число электронов, которые должны быть присоединены к атому для выполнения правила октавы (т.е. для завершения внешнего энергетического уровня).
Совсем недавно в понятие жизненной силы стали включать природу химических связей, образующихся при объединении людей.
Как правило, наибольшая интенсивность данных соответствует номеру группы в периодической таблице.
Однако, как и во всех правилах, есть исключения.
Например, медь и золото находятся в первой группе периодической таблицы, и их интенсивность должна быть равна номеру группы, т.е. 1, тогда как на практике медь имеет максимальную интенсивность 2, а золото — 3.
Степень окисления
Степень окисления, иногда называемая окислительным числом, электрохимической валентностью или состоянием окисления, является относительным понятием.
Например, при расчете степеней окисления большинство соединений вообще не являются ионными, а молекулами считаются только ионы.
Количественно, степень окисления атомов элемента в соединении определяется числом электронов, присоединенных к атомам или смещенных с них.
Таким образом, если смещения электронов не происходит, степень окисления будет равна нулю, отрицательной — если электроны смещены в сторону конкретного атома, и положительной — если они смещены в сторону от конкретного атома.
Нахождение степени окисления химического вещества — простое занятие, требующее лишь внимания и знания основных правил и исключений. Для того чтобы разобраться в исключениях и использовать специальные таблицы, не требуется много времени.
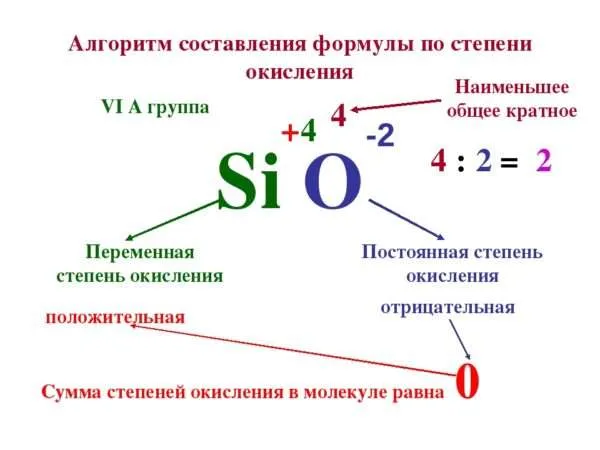
Как расставлять и как определить степень окисления элементов
Атомы и молекулы играют важную роль в химических процессах, а их свойства определяют последствия химических реакций. Одним из важных свойств атомов является их число окисления. Это упрощает метод расчета переноса электронов на частицы. Как определить степень окисления или типичный заряд частицы и какие правила для этого нужно знать?
Все химические реакции происходят в результате взаимодействия атомов различных веществ. Свойства мелких частиц определяют процесс реакции и ее последствия.
Термин окисление в химии относится к реакции, в которой группа атомов или один из них теряет или приобретает электрон. В случае усиления реакция называется «восстановлением».
Состояние окисления — это количественная мера перераспределения электронов в реакции. Другими словами, в процессе окисления электроны внутри атома уменьшаются или увеличиваются и перераспределяются между другими взаимодействующими частицами, а степень окисления показывает, как именно они реорганизуются. Это понятие тесно связано с электроотрицательностью частиц, т.е. их способностью притягивать и отталкивать свободные ионы.
Это интересно! Что такое алканы: структура и химические свойства
Определение степени окисления зависит от свойств и характеристик каждого вещества, поэтому процесс расчета нельзя однозначно охарактеризовать как простой или сложный, но результаты помогают документировать процесс обычных окислительно-восстановительных реакций. Важно понимать, что результаты расчета являются следствием переноса электронов, не имеют физического смысла и не представляют фактический заряд ядра.
Важно знать! Обратите внимание, что в неорганической химии термин валентность часто используется вместо состояния окисления элемента, что не является ошибкой, но второй термин более распространен.
Понятия и правила расчета движения электронов лежат в основе классификации химических веществ (номенклатуры), описания их свойств и синтеза типов связей. Однако часто этот термин используется для описания и проведения окислительно-восстановительных реакций.
Правила определения степени окисления
Как узнать состояние окисления? Имея дело с окислительно-восстановительными реакциями, важно знать, что типичный заряд частицы всегда равен численно выраженному значению электрона. Эта специфика обусловлена предположением, что электронная пара, образующая связь, всегда полностью смещается к наиболее отрицательной частице. Если мы говорим об ионной связи, то следует понимать, что в случае реакций ковалентной связи электроны поровну распределяются между одними и теми же частицами.
Число окисления может иметь как положительное, так и отрицательное значение. Важно отметить, что во время реакции атомы должны стать нейтральными. Для этого необходимо добавить электрон, если ион положительный, или удалить его, если он отрицательный. Чтобы указать на это значение при записи типа, принято писать арабскую цифру с соответствующим символом над названием предмета. Например, или и т.д.
Следует отметить, что заряд металла всегда положительный и в большинстве случаев его можно определить с помощью таблицы Менделеева. Существует несколько характеристик, которые необходимо учитывать для правильного определения цены
Как определить степень окисления
- У простых элементов всегда равна нулю: или .
- У фтора всегда будет равна -1.
- Как и у металлов, у элементов из групп IA, IIA и IIIA групп всегда одинаковая – это номер группы, в которой они расположены.
- У кислорода в любой связи равна -2, кроме связей с пероксидами (Н2О2), когда значение равно -1 и оксидом фтора (O+2F2-1, O2+1F2-1), когда она равна +2.
- У водорода всегда +1, кроме его взаимодействия с гидридами (Na+H- и связями по типу C+4H4-1).
- У простого вещества без связей с другими элементами всегда равна нулю.
- У простого иона с одним атомом равна числу его электрона (Na+, Ca+2).
- Если рассматривается связь двух веществ различной природы (металл и неметалл), то отрицательное окислительное число будет наблюдаться у вещества, которое обладает большей электроотрицательностью (H+F-, Cu+Br-), а положительное, соответственно, у элемента с электроотрицательностью больше нуля.
- У щелочных металлов, таких как литий, натрий, калий и прочих, всегда +1.
- У металлов из главной подгруппы II (магний, барий, кальций и стронций) равна +2.
- У алюминия всегда одинаковое значение +3.
Запомнив эти свойства, очень легко определить номер окисления элемента, независимо от его атомной сложности или количества уровней.
Полезное видео: определение степени окисления
Регулярные таблицы Менделеева содержат практически всю информацию, необходимую для работы с химическими веществами. Например, студенты используют их только для описания химических реакций. Например, чтобы определить максимальные положительные и отрицательные числа окисления, им нужно проверить названия химических веществ в таблице.
- Максимально положительное – это номер группы, в которой находится элемент.
- Максимально отрицательная степень окисления – это разница между максимально положительной границей и числом 8.
Поэтому очень легко найти стандартные пределы погрузки для того или иного товара. Такие действия можно выполнить с помощью расчетов, основанных на таблице Менделеева.
Это важно знать! Элемент может одновременно иметь множество различных значений окисления.
Существует два основных способа определения уровня окисления. Примеры приведены ниже. Первый метод требует знания и умения применять химические законы. Как с помощью этого метода можно определить степень окисления?
Правила определения состояния окисления.
- Определить, является ли данное вещество элементарным и находится ли оно вне связи. Если да, то его окислительное число будет равно 0, независимо от состава вещества (отдельные атомы или многоуровневые атомные соединения).
- Определить, состоит ли рассматриваемое вещество из ионов. Если да, то степень оксидации будет равна их заряду.
- Если рассматриваемое вещество металл, то посмотреть на показатели других веществ в формуле и вычислить показания металла путем арифметических действий.
- Если все соединение имеет один заряд (по сути это сумма всех частиц представленных элементов), то достаточно определить показатели простых веществ, затем вычесть их от общей суммы и получить данные металла.
- Если связь нейтральная, то общая сумма должна быть равна нулю.
Это интересно! Курс химии: что такое галоген?
В качестве примера рассмотрим соединение ионов алюминия с общим зарядом, равным нулю. Правила химии подтверждают тот факт, что число окисления иона Cl равно -1, и в этом случае в соединении их три. Поэтому, чтобы нейтрализовать все соединение, ион al должен иметь значение +3.
Этот метод очень хорош тем, что, суммируя все уровни окисления вместе, всегда можно контролировать точность раствора.
Второй метод можно применять без знания химических законов.
- Найти данные частиц, по отношению к которым нет строгих правил и точное количество их электронов неизвестно (можно путем исключения).
- Выяснить показатели всех прочих частиц и после из общей суммы путем вычитания найти нужную частицу.
Рассмотрим второй метод на примере вещества Na2SO4, где отдельные S не определены.
Это интересно! Курс химии: катионы и анионы — что это такое?
Для того чтобы все степени окисления были одинаковыми, необходимо
- Найти известные элементы, помня о традиционных правилах и исключениях.
- Ион Na = +1, а каждый кислород = -2.
- Умножить количество частиц каждого вещества на их электроны и получить степени оксидации всех атомов, кроме одного.
- В Na2SO4 состоят 2 натрия и 4 кислорода, при умножении получается: 2 X +1 = 2 – это окислительное число всех частиц натрия и 4 X -2 = -8 – кислородов.
- Сложить полученные результаты 2+(-8) =-6 – это общий заряд соединения без частицы серы.
- Представить химическую запись в виде уравнения: сумма известных данных + неизвестное число = общий заряд.
- Na2SO4 представлено следующим образом: -6 + S = 0, S = 0 + 6, S = 6.
С ионом NH4 + ион, вид азотной нагрузки — x + (+1) x 4 = 1. Ясно, что x = -3, т.е. степень окисления азота равна -3.
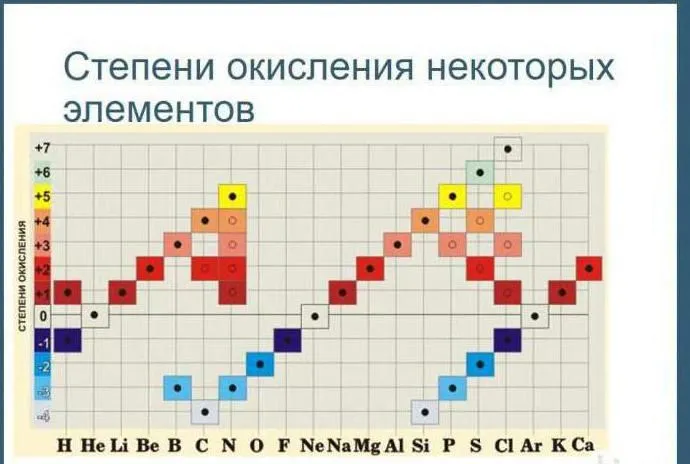
Таблица окисления химических элементов
Таблицы химического окисления используются для определения состояния загрузки индивида в реакции окисления. В зависимости от качества индивида элемент может иметь положительное или отрицательное состояние окисления.
Что такое степень окисления
Элементарная нагрузка элемента в композитном материале называется его состоянием окисления. Величина нагрузки индивидуума регистрируется в окислительно-восстановительной реакции, чтобы понять, какие элементы восстанавливаются и какие окислители восстанавливаются.
Степень окисления связана с электричеством и указывает на способность человека принимать или отдавать электроны. Чем выше значение электронов, тем больше способность человека потреблять электроны в реакции.
Рисунок 1. Ряд электрических свойств.
Для состояния окисления существует три значения.
- нулевое – атом находится в состоянии покоя (все простые вещества имеют степень окисления 0);
- положительное – атом отдаёт электроны и является восстановителем (все металлы, некоторые неметаллы);
- отрицательное – атом принимает электроны и является окислителем (большинство неметаллов).
Например, степень окисления в реакции между натрием и хлором составляет
В реакциях с неметаллическими металлами металл всегда является восстановителем, а неметалл — окислителем.
Как определить
Существует таблица, показывающая все возможные состояния окисления элементов.
Состояние окисления
В качестве альтернативы используйте эту версию таблицы в уроке.
Рисунок 2.Таблица окисления.
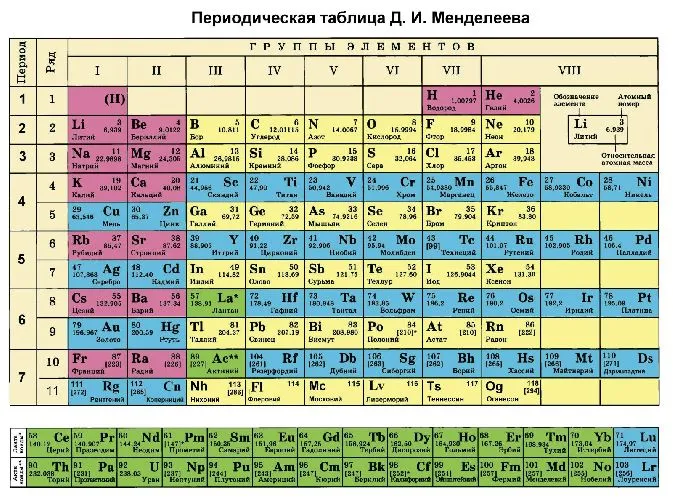
В качестве альтернативы, степень окисления химического элемента можно определить по периодической таблице Менделеева.
- высшая степень (максимально положительная) совпадает с номером группы;
- для определения минимального значения степени окисления из номера группы вычитается восемь.
Рисунок 3. Таблица Менделеева.
Большинство неметаллов имеют положительную и отрицательную степень окисления. Например, кремний относится к группе IV и имеет максимальную степень окисления +4 и минимальную -4. К неметаллическим соединениям (так3co2, sic) окислительные среды — это неметаллы с отрицательной степенью окисления или высшей электризуемостью. Например, в Союзе PCL3Фосфор имеет степень окисления +3, а хлор -1. Электроны фосфора составляют 2,19, а хлора — 3,16.
Второе правило не применяется к щелочным и щелочноземельным металлам, которые всегда имеют положительную степень окисления, равную номеру группы. Исключение составляют магний и бериллий (+1 и +2). Состояние окисления также является постоянным.
Другие металлы не имеют стабильного состояния окисления. В большинстве реакций они выступают в качестве восстановителей. В редких случаях это могут сделать окислители с отрицательной степенью окисления.
Фтор является сильнейшим окислителем. Его степень окисления всегда равна -1.
Для соединений определяется, состоят ли они из ионов. Для многоатомных ионов сумма всех степеней окисления равна их нагрузке. Найдите эту сумму из таблицы растворителей и приравняйте ее к известному числу окисления.
Как расставлять степень окисления в солях
Соль состоит из металла и одного или нескольких кислотных остатков. Метод определения такой же, как и для кислых кислот.
Металл, непосредственно образующий соль, находится в главной подгруппе, и его степень равна номеру группы. Это означает, что они всегда остаются стабильными.
В качестве примера рассмотрим расположение степеней окисления нитрата натрия. Соль образована элементами главной подгруппы в группе 1, поэтому ее степень окисления положительна и равна 1. В нитрате кислород имеет значение -2. Чтобы получить числовое значение, сначала строится уравнение с неизвестными, учитывающее все отрицательные и положительные значения, +1 +x-6 = 0. Решив уравнение, можно прийти к тому, что число положительное и равно + 5. Такова цена азота. Таблица является ключом к расчету степени окисления.