Способы определения молекулярной формулы оксида и элемента металла, образующего данный оксид
Задача 115.
Некоторый элемент образует оксид вида Э2О3, где Э — неизвестный элемент. Массовая доля кислорода в нем составляет 30,08% . Определите элемент и формулу оксида.
Дано: формула оксида: Э2О3; массовая доля кислорода в оксиде: (О) = 30,08%.
(О) = 30,08%.
Найти: элемент и формулу оксида.
Решение:
Для выявления неизвестного элемента необходимо определить его молярную массу, по которой, пользуясь Периодической системой Д.И.Менделеева, возможно найти неизвестный элемент.
I способ (последовательно-разветвленный алгоритм).
Схематично этот алгоритм можно изобразить так:
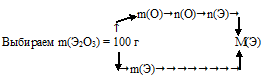
1) Произвольно выбираем некоторую массу образца. Наиболее удобная масса — 100 г, т.к. в условии фигурирует массовая доля. Тогда в 100 г Э2О3 содержится 30,08 г кислорода.
2) По разности находим массу неизвестного элемента:
m(Э) = 100 – m(О) = 100 – 30,08 = 69,92 г содержится в выбранном образце Э2О3.
3) Находим количество вещества атомарного кислорода:
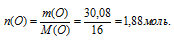
4) По известной общей формуле Э2О3 вычисляем количество вещества атомов неизвестного элемента. На каждые 3 моль атомов кислорода приходится 2 моль атомов неизвестного элемента.
Составим пропорцию:
3 моль атомов кислорода приходится на 2 моль атомов Э
1,88 моль атомов кислорода приходится на х моль атомов Э.
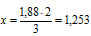 атомов элемента содержится в выбранном образце Э2О3.
атомов элемента содержится в выбранном образце Э2О3.
5) Теперь находим молярную массу атомов неизвестного элемента:
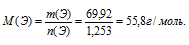
По таблице Д. И. Менделеева находим элемент, имеющий молярную массу 55,8 г/моль. Подходит железо. Этот элемент действительно проявляет степень окисления (+3) и образует оксид Fе2О3.
II способ (встречный алгоритм).
Схематично алгоритм можно изобразить таким образом:
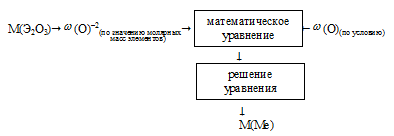
Применим предложенный алгоритм.
1) Записываем выражение для молярной массы Э2О3:
М(Э2О3) = М(Э) . 2 + М(О) . 3 = (М(Э) . 2 + 48) г/моль.
2) Выбираем массу образца Э2О3, соответствующую 1 моль вещества. Она составит m(Э2О3) = (M(Э) . 2 + 48) г. Масса кислорода в этом образце будет 48 г.
3) Записываем выражение для массовой доли кислорода в выбранном образце:
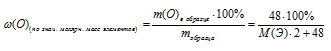
4) Приравниваем полученное выражение к значению массовой доли кислорода из условия:
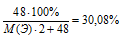
Получили одно уравнение с одним неизвестным М(Э). Решаем его и получаем М(Э) = 55,8 г/моль.
По таблице Д.И. Менделеева находим элемент, имеющий молярную массу 55,8 г/моль. Подходит железо. Этот элемент действительно проявляет степень окисления (+3) и образует оксид Fе2О3.
Ответ: искомый элемент — железо, формула Fе2О3.
Определение неизвестного элемента: как распознать его свойства
Определение неизвестного элемента – одна из важнейших задач в химии. Существует несколько способов узнать, какой элемент находится перед вами.
Методы определения
1. Химический анализ
Химический анализ – это метод определения состава смеси. Он включает в себя несколько этапов:
-
Начальное знакомство с смесью: внешний вид, цвет, запах.
-
Разделение смеси на компоненты: дистилляция, кристаллизация, экстракция.
-
Идентификация отдельных компонентов, используя методы количественного и качественного анализов, например, хроматографию и масс-спектрометрию.
2. Электронная конфигурация
Электронная конфигурация атома позволяет определить, в какой группе (вертикальной колонке) таблицы Менделеева находится элемент. Кроме того, она может указать на возможные химические свойства элемента.
3. Физические свойства
Физические свойства могут также помочь определить неизвестный элемент:
- Температура плавления и кипения.
- Плотность.
- Теплоемкость.
- Электропроводность и магнитные свойства.
Примеры определения элементов
Некоторые примеры определения элементов:
- Калий: красно-фиолетовый пламя при горении.
- Натрий: желтый пламя при горении.
- Кислород: дыхание возбуждает пламя, способствуя его горению.
- Азот: не реагирует с пламенем свечи.
- Серебро: высокая теплопроводность и проводимость электричества.
Вывод
Определение неизвестного элемента является существенным аспектом науки о химии. Для определения элемента могут использоваться различные методы, в том числе химический анализ, электронная конфигурация и физические свойства. Знание свойств элементов может помочь в дальнейшем применении химических реакций в различных областях от промышленности до производства лекарств.
Решение задач на вывод формул в соединении
Ключевые слова конспекта: решение задач на вывод формул в соединении, простейшая формула соединения, эмпирическая формула, истинная формула, молекулярная формула, вывод формулы, установление формулы, рассчитать количество вещества элементов.
При определении формул химических соединений необходимо различать простейшую (или эмпирическую) формулу соединения и его истинную (или молекулярную) формулу.
Простейшая формула (эмпирическая формула) показывает соотношение числа атомов каждого элемента в молекуле (формульной единице) вещества. Например, простейшая формула оксида фосфора (V) Р2O5. Она показывает, что на каждые 2 атома фосфора в молекуле данного оксида приходится 5 атомов кислорода.
Истинная формула (молекулярная формула) показывает точный качественный и количественный состав одной молекулы данного соединения. Так, истинная формула оксида фосфора (V) Р4О10. Она показывает, что одна молекула данного оксида образована четырьмя атомами фосфора и десятью атомами кислорода.
При выводе простейшей формулы соединения необходимо помнить, что индексы в ней пропорциональны количествам вещества элементов, образующих данное соединение и содержащихся в определенной порции данного вещества. Например, 1 моль воды содержит 2 моль атомов водорода и 1 моль атомов кислорода (т. е. v(H) : v(O) = 2:1, а формула воды — Н2О). Таким образом, чтобы определить простейшую формулу вещества, необходимо рассчитать количество вещества элементов, образующих данное соединение.
Чтобы установить истинную формулу, необходимо знать относительную молекулярную (или молярную) массу данного соединения. Молекулярная масса в целое число раз больше массы, которая отвечает простейшей формуле. На это число нужно умножить индексы в простейшей формуле, чтобы получить молекулярную формулу. Например, простейшая формула глюкозы СН2О, относительная молекулярная масса, отвечающая этой формуле, равна 30. Истинная относительная молекулярная масса глюкозы равна 180, т. е. в 6 раз больше. Таким образом, истинная формула глюкозы (СН2О)6, или С6Н12О6.
Цитаты из пособия «Задачи по химии 8-9 кл.» (авт. О.С. Габриелян и др.) использованы в учебных целях. Ссылка на покупку книги указана в конце конспекта.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
Массовые доли железа и серы в соединении равны соответственно 46,67 и 53,33%. Определите формулу этого соединения.

Ответ. FeS2.
Задача № 2.
Массовая доля азота в оксиде азота равна 36,84%. Выведите простейшую формулу данного оксида.
Посмотреть РЕШЕНИЕ

Ответ. N2О3.
Задача № 3.
Массовая доля серы в ее оксиде в 1,5 раза меньше массовой доли кислорода. Определите простейшую формулу оксида.
Посмотреть РЕШЕНИЕ

Ответ. SО3.
Задача № 4.
Элемент образует оксид состава ЭO2. Плотность оксида по воздуху равна 1,586. Определите неизвестный элемент.
Посмотреть РЕШЕНИЕ

Ответ. Э — азот.
Задача № 5.
Азот образует оксид, плотность паров которого по гелию равна 19, а массовая доля кислорода в нем — 63,16%. Определите молекулярную формулу неизвестного оксида.
Посмотреть РЕШЕНИЕ

Ответ. N2О3.
Задача № 6.
Плотность по водороду смеси оксида серы (IV) и одного из оксидов азота равна 20,1, массовая доля оксида азота в смеси 52,24%, а массовая доля азота в оксиде — 46,67%. Определите молекулярную формулу оксида азота.
Посмотреть РЕШЕНИЕ

Ответ. NО.
Задача № 7.
Из 185,6 г оксида железа при восстановлении было получено 134,4 г железа. Какова формула данного оксида?
Посмотреть РЕШЕНИЕ

Ответ. Fe3О4.
Задача № 8.
Массы углерода и водорода, входящие в состав газа, занимающего объем 16,8 л (н. у.), равны соответственно 18 и 4,5 г. Определите истинную формулу газа.
Посмотреть РЕШЕНИЕ

Ответ. С2Н6.
Задача № 9.
Отношение молярных масс хлорида и оксида металла (М), в которых металл проявляет степень окисления +2, равно 1,679. Определите неизвестный металл.
Посмотреть РЕШЕНИЕ

Ответ. Цинк.
Задача № 10.
Элементы X и Y образуют с хлором соединения состава ХYСl2 и XY2Cl2. Массовые доли хлора в этих соединениях равны соответственно 59,66 и 52,59%. Определите формулы неизвестных соединений.
Посмотреть РЕШЕНИЕ

Ответ. SOCl2 и SO2Cl2.
Решение задач на вывод формул в соединении. Выберите дальнейшие действия:
- Перейти к: Решение задач на расчет исходных веществ и продуктов реакции
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.
- Купить книгу Задачи по химии и способы их решения. 8-9 кл. / О.С. Габриелян и др. — М.: Дрофа.
Одна из моих предыдущих статей была посвящена разбору решения задач «на пластинку». В продолжение этой темы, хочу предложить разбор еще двух задач “на пластинку”. Особенностью этих задач является определение неизвестного металла пластинки или металла оседающего на пластинке.
И вот эти задачи.
Условие первой задачи:
Две пластинки с одинаковой массой, изготовленные из одного и того же металла, проявляющего в соединениях степень окисления +2, погрузили одну в раствор сульфата меди, а другую – в раствор нитрата свинца. Через некоторое время масса первой пластинки уменьшилась на 3,6%, а масса второй увеличилась на 7,125%. Определить, какой это металл.
Решение:
Для ответа на этот вопрос нужно искать молярную массу металла.
Введем условные обозначения:
Ме – металл пластинки;
х – молярная масса металла, г/моль;
у – количество прореагировавшего металла, моль.
Запишем уравнения реакции:
Ме + СuSO4 = Cu+ MeSO4 (1)
Ме + PbSO4 = Pb+ MeSO4 (2)
Примем, что исходная масса каждой пластинки равна 100 г. Тогда, масса первой пластинки уменьшилась на 3,6 г, а масса второй увеличилась на 7,125 г.
Изменение массы пластинок связано с растворением металла пластинки и оседанием на нем меди (первое уравнение) или свинца (второе уравнение):
Откуда,
143y = 10,725
y = 0,075
-0,075х + 4,8 = -3,6
0,075х = 8,4
x =112
M(Me) = 112 г/моль. Металл пластинок – кадмий.
Условие второй задачи:
Цинковую пластинку поместили в раствор сульфата некоторого металла. Масса раствора составляет 50 г. Металл в сульфате находится в степени окисления +2. Через некоторое время масса пластинки увеличилась на 1,08 г. Массовая доля сульфата цинка в растворе стала равна 6,58%. Определите, какой металл выделился на пластинке?
Решение:
Уравнение реакции:
Zn + МеSO4 = Me + ZnSO4
Для решения введем обозначения:
х – молярная масса металла, г/моль;
у – количество моль прореагировавшего цинка.
Изменение массы пластинки происходит из-за растворения цинка и оседания на пластинке металла из соли:
-65у+ху=1,08
Массовая доля сульфата цинка в растворе:
w(ZnSO4) = m(ZnSO4)/m(p-pa)
где m(ZnSO4) – масса сульфата цинка, г.
m(ZnSO4) = M(ZnSO4)*y = 161y
m(p-pa) – масса раствора после реакции, г.
m(p-pa) = 50-1,08 = 48,92
0,0658 =161y/48,92
161y = 3,219
y= 0,02
n(Zn) = 0,02 моль.
Подставляя полученное значение в первое уравнение, получим:
-65*0,02+0,02х =1,08
0,02х = 2,38
х = 119
Молярная масса металла: М(Ме) = 119 г/моль
Металл пластинки – олово.
Задачи для самостоятельного решения:
1. Кусочек железа поместили в раствор нитрата металла, который проявляет в соединениях степень окисления +1. Масса образца металла увеличилась на 16 г. через полученный раствор нитрата железа пропустили избыток сероводорода, получив сульфид железа массой 8,8 г. Какой металл выделен из раствора? [Cеребро]
2. В раствор, содержащий 3,2 г 2-х валентного металла в виде хлорида, погрузили железную пластинку массой 50 г. После полного осаждения металла масса пластинки увеличилась на 0,8%. Определите, соль какого металла находилась в растворе? [Медь]
3. Две пластинки одинаковой массы, изготовленные из одного и того же металла, проявляющего в своих соединениях валентность, равную 2, погрузили в растворы одинаковой концентрации: одну – в раствор соли кадмия, другую – в раствор соли свинца. Через некоторое время оказалось, что масса первой пластинки увеличилась на 0,47%, второй – на 1,42%. Определите металл, из которого были изготовлены пластинки? (железо).
4. Пластинку неизвестного металла поместили в 800 г раствора нитрата свинца с массовой долей соли 5 %. Через некоторое время масса пластинки увеличилась на 14,3 г, а массовая доля нитрата свинца стала равна 0,88 %. Какой металл был взят, если известно, что в нитрате он находится в степени окисления +2.
Успехов в решении задач!
Можаев Г.М.
Мастер-класс «Решаем трудные
задачи»
В реакцию вступает
неизвестное вещество.
Цель задачи очевидна, определить это
неизвестное вещество, или неизвестный
элемент, входящий в его состав. В КИМах
ЕГЭ по химии этот тип задач представлен
заданием С5, как правило, не слишком
сложным. Среди этих заданий есть
статические задачи на определение
формул веществ по данным элементного
анализа, по характеристикам его плотности
и аналогичные.
Установите молекулярную формулу
предельной одноосновной карбоновой
кислоты, кальциевая соль которой содержит
30,77% кальция. (ЕГЭ-2009)
Масса неизвестного объема воздуха равна
0,123 г, а масса такого же объема газообразного
алкана – 0,246 г (при тех же условиях).
Определите молекулярную формулу алкана.
(ЕГЭ-2009)
Как статические, без использования
расчетов по уравнению реакции решаются
обычно и типовые задачи на определение
формул органических веществ по массам
продуктов сгорания.
Мы будем рассматривать задачи связанные
с расчетом по уравнению реакции. Школьник,
приступая к решению задач такого типа,
должен быть готов использовать для
написания уравнений реакций общие
формулы классов веществ, обозначать
неизвестные элементы, радикалы подходящими
буквами (Ме, Х, Э, R и т.п.)
Не всегда есть возможность (и необходимость)
полностью расставить коэффициенты,
часто для расчетов можно использовать
схемы, уравненные по какому-то одному
элементу: Ме2О3 2
MeCl3
Часто приходится буквами обозначать
валентность элемента, индексы в формулах,
коэффициенты в уравнениях… Надо следить,
чтобы одной буквой не обозначались
разные величины.
К лючевой
лючевой
количественной характеристикой, обычно
необходимой для определения формулы
вещества является относительная атомная
масса (для элемента) или относительная
молекулярная масса (для вещества). Если
в условии задачи кроме массы неизвестного
вещества указана порция какого-то
известного вещества – задачу можно
решить обычным путем, по следующему
плану:
1. Переходим к количеству вещества,
2.
Проводим расчет по уравнению реакции;
3.
Находим молярную и относительную
молекулярную массу вещества;
4.
Определяем формулу.
Задача 1. При окислении 16,2 г некоторого
альдегида аммиачным раствором оксида
серебра(I) выделилось 48,6 г серебра.
Определите молекулярную формулу
альдегида.
|
Дано:
m(R-CHO)= m(Ag)= 48,6 г |
Уравнение реакции:
R-CHO + Ag2O
1. n(Ag)=48,6/108 |
|
Mr(R) Формула – ? |
3. M(R-CHO)=m/n = 16,2/0,225 = 72 г/моль; Mr |
4. Поскольку в условии ничего не сказано
о группе альдегида, используем общую
формулу углеводородного радикала СхНу
и анализируем ее возможный состав:
12х+3у=43; х=3, у = 7 С3Н7-CHO
– два возможных изомера.
Вообще, недостатком задания С5 ЕГЭ по
химии можно считать то, что от ученика
требуется определить лишь молекулярную
формулу вещества. Конечно, это упрощает
задание, но окончательным определением
вещества можно считать только определение
наряду с составом и его строения. Во
всяком случае, на олимпиаде, в вузовском
курсе от школьника может потребоваться
умение предложить к найденному составу
формулы всех или наиболее вероятных
изомеров. Поэтому убирать этот этап
решения из решения данного типа задач
только потому, что его нет в заданиях
ЕГЭ, нежелательно.
В более сложных задачах может быть не
указана порция ни одного из известных
участников реакции, ни даже самого
неизвестного вещества. Как всегда в
этом случае поможет алгебраический
метод. Например:
Задача 2. (Дейнеко, 19, с.79) Некоторое
количество ненасыщенного углеводорода
при действии на него избытком хлора в
темноте дает дихлорпроизводное массой
3,5 г, а при действии избытка брома –
дибромпроизводное массой 5,28 г. Установить
молекулярную формулу и строение
углеводорода.
|
Дано:
m(CxHyCl2)=
m(CxHyBr2)= |
Уравнения: СхНу + Cl2
СхНу + Br2 |
|
Mr(СхНу) Строение – ? |
1. В качестве неизвестных величин
n(СхНу) = n
(чтобы не путать с уже использованными |
2. По уравнениям реакций: n(CxHy)
= n(CxHyCl2)
= n(CxHyBr2)
= n моль
3. Находим массы галогенпроизводных и
составляем алгебраические уравнения:
(M+71)*n=3,5 |
M*n+71*n=3,5
(M+160)*n=5,28 |
M*n+160*n=5,28 (160-71)n
= 5,28-3,5; n = 0,02 моль;
M = (3,5-71*0,02)/0,02 = 104 г/моль;
Mr(СхНу)
= 104; 12х + у = 104
Здесь тоже необходим анализ состава:
x<9; при x=7
y=20 > 2x+2
вещество имеет пересыщенный состав,
что невозможно. Тоже и при х < 7. Остается:
x=8 y=8 C8H8
Большая степень ненасыщенности, наряду
с тем, что вещество образует
дигалогенпроизводные, позволяет сделать
вывод о наличии бензольного кольца и
одной двойной связи: C6H5-CН=СH2
Иногда алгебраического решения можно
избежать при внимательном анализе
условия задачи:
Задача 3. Сложный эфир массой 30 г
подвергнут щелочному гидролизу. При
этом получено 34 г натриевой соли
предельной одноосновной кислоты и 16 г
спирта. Установите молекулярную формулу
этого эфира. (ЕГЭ – 2007)
Казалось бы, что в условии приведены
характеристики только неизвестных
веществ, но применение закона сохранения
массы позволяет найти массу четвертого
участника реакции и решить задачу прямым
способом:
|
Дано:
m(RCOOR’)= 30
m(RCOONa)= 34 m(R’OH)= |
Уравнение гидролиза эфира в общем
30
RCOOR’ + NaOH
(ошибка многих участников экзамена: |
|
Mr(R) Формула – ? |
1. m(NaOH)
2. По уравнению: n(RCOOR’)
3. M(RCOOR’)
M(R Формула эфира НСООСН3 |
Задача 4. Имеются образцы пентена-1
и неизвестного этиленового углеводорода
равной массы. Первый образец может
присоединить в два раза большую массу
брома, чем второй. Определите молекулярную
формулу неизвестного углеводорода.
(пособие, прислано Целиковской Е.В.)
Задача интересна тем, что это задача
в интенсивных величинах – здесь нет
величин связанных с порцией участников
реакции. Поэтому для решения задачи мы
можем выбрать любую порцию вещества.
|
Дано:
m(C5H10)= m1(Br2) |
Уравнения реакций:
С5Н10 + Br2
(А) СnН2n |
|
Mr(А) Формула – ? |
1. Пусть для реакции взят
n2(Br2)
2. По уравнению 2: n(A)
M(A)
3.Формула алкена: С10Н20 |
В олимпиадных заданиях задачи на
определение неизвестного вещества
часто комбинируются с задачами на
определение состава смеси. Присутствуют
такие задания и в пособиях для подготовки
к ЕГЭ:
Задача 5. 7,84 л (н.у) смеси этиленового
и ацетиленового углеводородов, содержащих
одинаковое число атомов углерода, может
присоединить 80 г брома. Образовавшаяся
смесь продуктов присоединения брома
имеет массу 94,4 г. Определите формулы
углеводородов и их мольные доли в
исходной смеси. (ЕГЭ-2005, прислано
Воздвиженской С.А)
(Сам я не помню в заданиях С5 таких сложных
задач. Если это задание из реального
КИМа, остается только сделать вывод,
что задания ЕГЭ с тех пор стали значительно
проще.) Помогает в решении задачи то,
что конкретно указан класс углеводородов,
то, что число атомов у них одинаково, а
также то, что объем смеси позволяет
найти суммарное количество вещества.
А дальше – опять применяем алгебраический
метод
|
Дано: V(смеси)= 7,84 л
m(Br2)= m(смеси2)= |
Уравнения реакций:
(А) СnН2n
(Б) СnН2n-2 |
|
Формулы – ?
φ(А) – ? φ(Б) – ? (для обозначения мольной |
1. n(Br2)
Пусть количество вещества алкена – |
2. По уравнениям реакций: n1(Br2)
= n(A) = x
моль; n2(Br2)
= 2n(Б) = 2y
моль;
3 .
.
Система уравнений: х + у = 0,35
x + 2y = 0,5
; y = 0,15, x =
0,2
4. Мольные доли: φ(А) =n(A)/n(см)
= 0,2/0,35 = 0,571 = 57,1% φ(Б) = 42,9%
5. Используя закон сохранения массы,
определим массу смеси углеводородов:
m(смеси) = 94,4 – 80 = 14,4 г и
составим еще одно алгебраическое
уравнение, учитывая, что M(A)
= 14n, а M(Б) =
14n – 2, где n
– число атомов углерода:
m(A) + m(Б) =
m(смеси); 14n*0,2 + (14n – 2)*0,15 =
14,4; n = 3
Алкен – С3Н6
, алкин – С3Н4
В многочисленных пособиях для подготовки
к ЕГЭ часто приводятся задачи на
определение формул неизвестного
вещества, значительно превышающие
сложность заданий реального ЕГЭ. Примером
может служить задача, присланная О.П.
Русецкой:
Задача 6. 2,25 г аминокислоты, входящей
в состав белков, сожгли в избытке
кислорода. После приведения продуктов
реакции к нормальным условиям получили
2,016 л газовой смеси и 1,35 г воды. Газовую
смесь пропустили через 5М раствор
гидроксида натрия массой 36 г с плотностью
1,2 г/мл, после чего массовая доля щелочи
в растворе уменьшилась до 3,106 %. Не
поглощенную щелочью газовую смесь
пропустили над избытком раскаленной
меди, после чего объем газа уменьшился
в 2 раза (н.у.). Определите формулу исходной
аминокислоты.
Здесь есть все: и несколько уравнений
реакций, и состав раствора полученного
в ходе реакции (3,106 %), и определение
формулы. Понятно, что цепочки превращений
нужны для того, чтобы определить порции
продуктов сгорания, после чего задача
становится стандартной. Предлагаю вам
самостоятельно разобраться с этой
задачей, возможно разбив ее на несколько
этапов.
Своя специфика в решении задач этого
типа на материале неорганической химии.
Они связаны с нахождением неизвестного
элемента, соединения которого участвуют
в химических реакциях. Для этого
необходимо определить относительную
атомную массу элемента, которую используют
для нахождения элемента по ПСХЭ. Часто
в роли неизвестной величины выступает
и валентность элемента. В продвинутых
курсах химии для решения этих задач
часто используется закон эквивалентов.
Эти задачи весьма характерны для
химических олимпиад различного уровня,
но в заданиях ЕГЭ по химии не встречаются.
Не будем разбирать их и в рамках данного
мастер-класса.
Этим занятием заканчивается рассмотрение
трудных задач ЕГЭ по химии (впереди
зачетные занятия мастер-класса). При
желании можно вынести вопросы, связанные
с решением задач других типов, на форум
творческой группы.
Задание № 8.
Задача 6. Дать решение задачи.
Возможно, на каком то этапе вам поможет
разобраться в ней и схема превращения
фаз.
Задача 7. При обработке натрия
первичным предельным одноатомным
спиртом выделилось 6,72л газа (н.у.). При
дегидратации того же количества спирта
образуется алкен массой 33,6г. Определите
молекулярную формулу спирта. (пособие,
прислано Кокоревой С.В.)
Задача 8. При окислении 0,04 моль
неизвестного органического вещества
водным раствором перманганата калия
образовалось 6,4 г бензоата калия, 11,04 г
К2СО3, 20,88 г MnO2, 2,24 г КОН
и вода. Какое вещество подверглось
окислению? Определите его брутто-формулу
и возможное строение.
Задача 9. Смесь двух предельных
одноосновных кислот массой 23,82 г
обработали 128 г 12,5%-ного раствора
гидроксида натрия. Массовые доли металла
в образовавшихся солях равны 28,05 и
20,91%. Затем через раствор пропустили
углекислый газ. В реакцию вступило 1,12
л (н.у.) газа и образовалась кислая соль.
Найдите массовую долю кислоты с меньшей
относительной молекулярной массой в
исходной смеси. (прислано Александровой
Е.И.)
Ответы (с указанием фамилии) оформлять
в файле WORD, имя файла
Familija–Z-8.
Возможен рукописный вариант, который
сканируется или фотографируются и
пакуются в архиве с таким же именем
Familija–Z-8
(Familija– фамилия
участника –англ.)
Файлы ответов загружаются в библиотеку
творческой группы. Ответы считаются
учебными работами, не выставляются на
общее обозрение, после проверки удаляются
из библиотеки. Общий анализ ответов
дается на форуме. Контрольный срок
выполнения задания №8 до 19-00 мск вр,
29.11.10
(понедельник)
