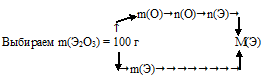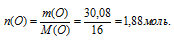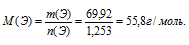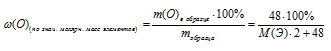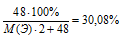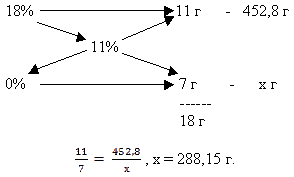Способы определения молекулярной формулы оксида и элемента металла, образующего данный оксид
Задача 115.
Некоторый элемент образует оксид вида Э2О3, где Э — неизвестный элемент. Массовая доля кислорода в нем составляет 30,08% . Определите элемент и формулу оксида.
Дано: формула оксида: Э2О3; массовая доля кислорода в оксиде:
Найти: элемент и формулу оксида.
Решение:
Для выявления неизвестного элемента необходимо определить его молярную массу, по которой, пользуясь Периодической системой Д.И.Менделеева, возможно найти неизвестный элемент.
I способ (последовательно-разветвленный алгоритм).
Схематично этот алгоритм можно изобразить так:
1) Произвольно выбираем некоторую массу образца. Наиболее удобная масса — 100 г, т.к. в условии фигурирует массовая доля. Тогда в 100 г Э2О3 содержится 30,08 г кислорода.
2) По разности находим массу неизвестного элемента:
m(Э) = 100 – m(О) = 100 – 30,08 = 69,92 г содержится в выбранном образце Э2О3.
3) Находим количество вещества атомарного кислорода:
4) По известной общей формуле Э2О3 вычисляем количество вещества атомов неизвестного элемента. На каждые 3 моль атомов кислорода приходится 2 моль атомов неизвестного элемента.
Составим пропорцию:
3 моль атомов кислорода приходится на 2 моль атомов Э
1,88 моль атомов кислорода приходится на х моль атомов Э.
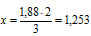
5) Теперь находим молярную массу атомов неизвестного элемента:
По таблице Д. И. Менделеева находим элемент, имеющий молярную массу 55,8 г/моль. Подходит железо. Этот элемент действительно проявляет степень окисления (+3) и образует оксид Fе2О3.
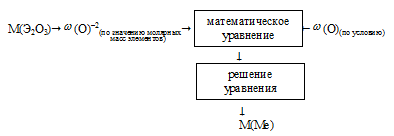
II способ (встречный алгоритм).
Схематично алгоритм можно изобразить таким образом:
Применим предложенный алгоритм.
1) Записываем выражение для молярной массы Э2О3:
М(Э2О3) = М(Э) . 2 + М(О) . 3 = (М(Э) . 2 + 48) г/моль.
2) Выбираем массу образца Э2О3, соответствующую 1 моль вещества. Она составит m(Э2О3) = (M(Э) . 2 + 48) г. Масса кислорода в этом образце будет 48 г.
3) Записываем выражение для массовой доли кислорода в выбранном образце:
4) Приравниваем полученное выражение к значению массовой доли кислорода из условия:
Получили одно уравнение с одним неизвестным М(Э). Решаем его и получаем М(Э) = 55,8 г/моль.
По таблице Д.И. Менделеева находим элемент, имеющий молярную массу 55,8 г/моль. Подходит железо. Этот элемент действительно проявляет степень окисления (+3) и образует оксид Fе2О3.
Ответ: искомый элемент — железо, формула Fе2О3.
Решение задач на вывод формул в соединении
Ключевые слова конспекта: решение задач на вывод формул в соединении, простейшая формула соединения, эмпирическая формула, истинная формула, молекулярная формула, вывод формулы, установление формулы, рассчитать количество вещества элементов.
При определении формул химических соединений необходимо различать простейшую (или эмпирическую) формулу соединения и его истинную (или молекулярную) формулу.
Простейшая формула (эмпирическая формула) показывает соотношение числа атомов каждого элемента в молекуле (формульной единице) вещества. Например, простейшая формула оксида фосфора (V) Р2O5. Она показывает, что на каждые 2 атома фосфора в молекуле данного оксида приходится 5 атомов кислорода.
Истинная формула (молекулярная формула) показывает точный качественный и количественный состав одной молекулы данного соединения. Так, истинная формула оксида фосфора (V) Р4О10. Она показывает, что одна молекула данного оксида образована четырьмя атомами фосфора и десятью атомами кислорода.
При выводе простейшей формулы соединения необходимо помнить, что индексы в ней пропорциональны количествам вещества элементов, образующих данное соединение и содержащихся в определенной порции данного вещества. Например, 1 моль воды содержит 2 моль атомов водорода и 1 моль атомов кислорода (т. е. v(H) : v(O) = 2:1, а формула воды — Н2О). Таким образом, чтобы определить простейшую формулу вещества, необходимо рассчитать количество вещества элементов, образующих данное соединение.
Чтобы установить истинную формулу, необходимо знать относительную молекулярную (или молярную) массу данного соединения. Молекулярная масса в целое число раз больше массы, которая отвечает простейшей формуле. На это число нужно умножить индексы в простейшей формуле, чтобы получить молекулярную формулу. Например, простейшая формула глюкозы СН2О, относительная молекулярная масса, отвечающая этой формуле, равна 30. Истинная относительная молекулярная масса глюкозы равна 180, т. е. в 6 раз больше. Таким образом, истинная формула глюкозы (СН2О)6, или С6Н12О6.
Цитаты из пособия «Задачи по химии 8-9 кл.» (авт. О.С. Габриелян и др.) использованы в учебных целях. Ссылка на покупку книги указана в конце конспекта.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
Массовые доли железа и серы в соединении равны соответственно 46,67 и 53,33%. Определите формулу этого соединения.
Ответ. FeS2.
Задача № 2.
Массовая доля азота в оксиде азота равна 36,84%. Выведите простейшую формулу данного оксида.
Посмотреть РЕШЕНИЕ
Ответ. N2О3.
Задача № 3.
Массовая доля серы в ее оксиде в 1,5 раза меньше массовой доли кислорода. Определите простейшую формулу оксида.
Посмотреть РЕШЕНИЕ
Ответ. SО3.
Задача № 4.
Элемент образует оксид состава ЭO2. Плотность оксида по воздуху равна 1,586. Определите неизвестный элемент.
Посмотреть РЕШЕНИЕ
Ответ. Э — азот.
Задача № 5.
Азот образует оксид, плотность паров которого по гелию равна 19, а массовая доля кислорода в нем — 63,16%. Определите молекулярную формулу неизвестного оксида.
Посмотреть РЕШЕНИЕ
Ответ. N2О3.
Задача № 6.
Плотность по водороду смеси оксида серы (IV) и одного из оксидов азота равна 20,1, массовая доля оксида азота в смеси 52,24%, а массовая доля азота в оксиде — 46,67%. Определите молекулярную формулу оксида азота.
Посмотреть РЕШЕНИЕ
Ответ. NО.
Задача № 7.
Из 185,6 г оксида железа при восстановлении было получено 134,4 г железа. Какова формула данного оксида?
Посмотреть РЕШЕНИЕ
Ответ. Fe3О4.
Задача № 8.
Массы углерода и водорода, входящие в состав газа, занимающего объем 16,8 л (н. у.), равны соответственно 18 и 4,5 г. Определите истинную формулу газа.
Посмотреть РЕШЕНИЕ
Ответ. С2Н6.
Задача № 9.
Отношение молярных масс хлорида и оксида металла (М), в которых металл проявляет степень окисления +2, равно 1,679. Определите неизвестный металл.
Посмотреть РЕШЕНИЕ
Ответ. Цинк.
Задача № 10.
Элементы X и Y образуют с хлором соединения состава ХYСl2 и XY2Cl2. Массовые доли хлора в этих соединениях равны соответственно 59,66 и 52,59%. Определите формулы неизвестных соединений.
Посмотреть РЕШЕНИЕ
Ответ. SOCl2 и SO2Cl2.
Решение задач на вывод формул в соединении. Выберите дальнейшие действия:
- Перейти к: Решение задач на расчет исходных веществ и продуктов реакции
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.
- Купить книгу Задачи по химии и способы их решения. 8-9 кл. / О.С. Габриелян и др. — М.: Дрофа.
Задача. Найти неизвестный элемент ядерной реакции. Пример реакции: , остальные реакции будут разобраны в тексте задачи (ибо лень делать страницу для каждой реакции).
Дано:
Реакция
Найти:
Элемент — ?
Решение
Думаем: все вопросы нахождения неизвестного элемента ядерной реакции касаются закона сохранения нуклонного и протонного заряда:
(1)
(2)
— количество нуклонов (протонов+нейтронов) в соответствующих атомах,
— количество протонов в соответствующих атомах.
Также есть набор элементов, которые могут не записываться без протонного и нуклонного заряда.
Решаем: рассматривая реакцию , исходя из (1) и (2) можем вывести два соотношения.
(3)
(4)
Считаем: исходя из (3) и (4), получаем:
;
Тогда: — этот элемент является нейтроном.
Ответ: (нейтрон)
Задача 2. Реакция .
Решаем: в этой задаче дополнительно необходимо «узнать» элементы. В нашей задаче — дейтерий — «тяжёлый» водород с 1 протоном (всё же водород) и 1 нейтрон. Тогда форма записи:
.
— нейтрон — элемент с 0 протонов и 1 нейтроном, т.е.
. Тогда:
Решаем: исходя из (1) и (2) можем вывести два соотношения.
(5)
(6)
Считаем: исходя из (5) и (6), получаем:
;
Тогда: — используя таблицу Менделеева, заключаем, что этот элемент — фтор (
)
Ответ: (фтор).
Задача 3. Реакция .
Решаем: в этой задаче дополнительно необходимо «узнать» элементы. В нашей задаче — гамма-квант или фотон света без нейтронов и протонов. Тогда форма записи:
.
— протон — элемент с 1 протоном и 0 нейтронов, тогда форма записи:
.
— нейтрон — элемент с 0 протонов и 1 нейтроном, т.е.
. Тогда:
Решаем: исходя из (1) и (2) можем вывести два соотношения.
(7)
(8)
Считаем: исходя из (7) и (8), получаем:
;
Тогда: — используя таблицу Менделеева, заключаем, что этот элемент — калий (
)
Ответ: (калий).
Задача 4. Реакция .
Решаем: в этой задаче дополнительно необходимо «узнать» элементы. В нашей задаче — альфа частица или ядро гелия с 2 протонами и 2 нейтронами. Тогда форма записи:
.
— нейтрон — элемент с 0 протонов и 1 нейтроном, т.е.
. Тогда:
Решаем: исходя из (1) и (2) можем вывести два соотношения.
(9)
(10)
Считаем: исходя из (9) и (10), получаем:
;
Тогда: — используя таблицу Менделеева, заключаем, что этот элемент — бериллий (
).
— используя таблицу Менделеева, заключаем, что этот элемент — углерод (
)
Ответ: (бериллий),
(углерод).
Задача 5. Реакция .
Решаем: в этой задаче дополнительно необходимо «узнать» элементы. В нашей задаче — свинец, из таблицы Менделеева находим количество протонов — 94. Тогда форма записи:
.
— кюрий, из таблицы Менделеева находим количество протонов — 96.
— нейтрон — элемент с 0 протонов и 1 нейтроном, т.е.
. Тогда:
Решаем: исходя из (1) и (2) можем вывести два соотношения.
(11)
(12)
Считаем: исходя из (11) и (12), получаем:
;
Тогда: — используя таблицу Менделеева, заключаем, что этот элемент — Гелий (или альфа-частица) (
).
Ответ: (гелий).
Одна из моих предыдущих статей была посвящена разбору решения задач «на пластинку». В продолжение этой темы, хочу предложить разбор еще двух задач “на пластинку”. Особенностью этих задач является определение неизвестного металла пластинки или металла оседающего на пластинке.
И вот эти задачи.
Условие первой задачи:
Две пластинки с одинаковой массой, изготовленные из одного и того же металла, проявляющего в соединениях степень окисления +2, погрузили одну в раствор сульфата меди, а другую – в раствор нитрата свинца. Через некоторое время масса первой пластинки уменьшилась на 3,6%, а масса второй увеличилась на 7,125%. Определить, какой это металл.
Решение:
Для ответа на этот вопрос нужно искать молярную массу металла.
Введем условные обозначения:
Ме – металл пластинки;
х – молярная масса металла, г/моль;
у – количество прореагировавшего металла, моль.
Запишем уравнения реакции:
Ме + СuSO4 = Cu+ MeSO4 (1)
Ме + PbSO4 = Pb+ MeSO4 (2)
Примем, что исходная масса каждой пластинки равна 100 г. Тогда, масса первой пластинки уменьшилась на 3,6 г, а масса второй увеличилась на 7,125 г.
Изменение массы пластинок связано с растворением металла пластинки и оседанием на нем меди (первое уравнение) или свинца (второе уравнение):
Откуда,
143y = 10,725
y = 0,075
-0,075х + 4,8 = -3,6
0,075х = 8,4
x =112
M(Me) = 112 г/моль. Металл пластинок – кадмий.
Условие второй задачи:
Цинковую пластинку поместили в раствор сульфата некоторого металла. Масса раствора составляет 50 г. Металл в сульфате находится в степени окисления +2. Через некоторое время масса пластинки увеличилась на 1,08 г. Массовая доля сульфата цинка в растворе стала равна 6,58%. Определите, какой металл выделился на пластинке?
Решение:
Уравнение реакции:
Zn + МеSO4 = Me + ZnSO4
Для решения введем обозначения:
х – молярная масса металла, г/моль;
у – количество моль прореагировавшего цинка.
Изменение массы пластинки происходит из-за растворения цинка и оседания на пластинке металла из соли:
-65у+ху=1,08
Массовая доля сульфата цинка в растворе:
w(ZnSO4) = m(ZnSO4)/m(p-pa)
где m(ZnSO4) – масса сульфата цинка, г.
m(ZnSO4) = M(ZnSO4)*y = 161y
m(p-pa) – масса раствора после реакции, г.
m(p-pa) = 50-1,08 = 48,92
0,0658 =161y/48,92
161y = 3,219
y= 0,02
n(Zn) = 0,02 моль.
Подставляя полученное значение в первое уравнение, получим:
-65*0,02+0,02х =1,08
0,02х = 2,38
х = 119
Молярная масса металла: М(Ме) = 119 г/моль
Металл пластинки – олово.
Задачи для самостоятельного решения:
1. Кусочек железа поместили в раствор нитрата металла, который проявляет в соединениях степень окисления +1. Масса образца металла увеличилась на 16 г. через полученный раствор нитрата железа пропустили избыток сероводорода, получив сульфид железа массой 8,8 г. Какой металл выделен из раствора? [Cеребро]
2. В раствор, содержащий 3,2 г 2-х валентного металла в виде хлорида, погрузили железную пластинку массой 50 г. После полного осаждения металла масса пластинки увеличилась на 0,8%. Определите, соль какого металла находилась в растворе? [Медь]
3. Две пластинки одинаковой массы, изготовленные из одного и того же металла, проявляющего в своих соединениях валентность, равную 2, погрузили в растворы одинаковой концентрации: одну – в раствор соли кадмия, другую – в раствор соли свинца. Через некоторое время оказалось, что масса первой пластинки увеличилась на 0,47%, второй – на 1,42%. Определите металл, из которого были изготовлены пластинки? (железо).
4. Пластинку неизвестного металла поместили в 800 г раствора нитрата свинца с массовой долей соли 5 %. Через некоторое время масса пластинки увеличилась на 14,3 г, а массовая доля нитрата свинца стала равна 0,88 %. Какой металл был взят, если известно, что в нитрате он находится в степени окисления +2.
Успехов в решении задач!
Необходимость уметь решать расчётные
задачи
Уметь решать задачи – интегрированный
показатель степени овладения знаниями по химии,
физике, математике и, несомненно, мыслительных
способностей учащихся. Поэтому решение задач –
это не только один из ведущих методов обучения,
но и самый информативный способ контроля.
Процесс усвоения знаний может быть условно
разделён на четыре этапа:
- понимание;
- запоминание;
- применение в стандартных условиях;
- применение в новых, нестандартных условиях и
различных сочетаниях.
На всех этих этапах для обучения и контроля
можно использовать различные типы задач.
Первыми преподавателями и методистами, которые
выдвинули и отстаивали идею необходимости
введения задач в процесс обучения химии, были В.Н.
Верховский, Я.Л. Гольдфарб, Л.А. Цветков, Л.М.
Сморгонский, С.Г. Шаповаленко, Ю.В. Ходаков.
Несмотря на многообразие подходов к проблеме
обучения школьников решению химических задач,
все признают, что основной формой обучения
должна быть самостоятельная работа.
Самостоятельная работа учащихся эффективна при
наличии достаточных базовых знаний и хороших
пособий, задачников.
В настоящее время существует противоречие
между уровнем стандартных задач школьного курса
и уровнем задач ЕГЭ. Трудность некоторых задач
ЕГЭ часто запредельна не только для школьников,
но и для большинства учителей. В различных
пособиях приведены примеры решения достаточно
трудных задач. Однако, как показывает опыт,
химические, физические и математические знания
большинства школьников недостаточны для того,
чтобы разобраться в них. Поэтому невозможно
успешно сдать ЕГЭ без занятий на
подготовительных курсах или с репетиторами. А
это требует больших затрат времени и средств и
приводит к перегрузке старшеклассников.
Отсюда очевидна актуальность проблемы
обучения школьников умению решать химические
задачи.
Задачи на нахождение массовой доли
элемента в веществе
Первый и, естественно, самый простой тип задач,
изучаемых учащимися в VIII классе – это нахождение
массовых долей химических элементов в веществе.
Это очень простые задачи, но опыт работы
показывает, что для большинства учащихся
представляет серьёзную проблему запоминание
даже простых формул для расчётов. Я с самого
начала делаю упор на логику учащихся, а, не на их
механическую зубрёжку. Само название “массовая
доля” показывает, что для расчёта берут массы.
Я задаю учащимся простой вопрос:
– Что нужно делать, чтобы каждый получил свою
долю от чего-либо?
Учащиеся мгновенно дают ответ:
– Надо делить!
Далее фиксирую их внимание на том, что доля –
это часть от целого. Значит при расчёте
необходимо часть массы, приходящуюся на
химический элемент, делить на массу всей
молекулы.
Таким образом, учащиеся легко, при помощи
логики, сами выводят формулу, необходимую для
нахождения массовой доли химического элемента в
веществе.
Задача 1. Вычислить массовую долю водорода
и кислорода в молекуле воды.
Решение: Сначала вычисляется относительная
молекулярная масса Mr воды:
Mr (H2O) = Ar (H) * 2 + Ar (O) = 1*2+16 = 18;
затем массовая доля водорода: (H) =
* 100% =
= 11.1%
и кислорода: (O) =
=
= 88.9%
Ответ: (H) = 11,1%, ? (О) =
88,9%.
Задачи на нахождение формулы вещества по
массовым долям элементов, его составляющих
Затем изучают решение обратной задачи –
находят формулу вещества по известным массовым
долям входящих в его состав химических
элементов. Сам алгоритм решения подобных задач
осваивается учащимися довольно легко. Трудность
вызывает приведение соотношения атомов
химических элементов к простым целым числам. Я
объясняю, что необходимо из всех чисел
соотношения выбрать самое меньшее и на него
делить все числа соотношения. Но и в этом случае
могут получиться не целые числа. Тогда
приходится все результаты удваивать, утраивать и
т.д. до получения целых чисел, которые не
сокращаются.
Задача 2. Найти формулу вещества, которое
содержит 83,33% углерода и 16,67% водорода.
Решение: Для вещества состава АхВу
справедлива формула 1:
: = х : у
(1)
Подставляя данные в эту формулу, получаем
выражение: :
Несложные вычисления дают ответ: 5 : 12
Ответ: формула вещества С5Н12
Но не всегда ответ находится так легко.
На примере этой задачи в старших классах при
работе с более одарёнными учениками можно
показать, что в бинарном соединении
эквивалентное число атома z численно равно его
степени окисления. Для этого условно рассмотрим
вещество состава АхВу как продукт
взаимодействия атомов элементов А и В:
хА + уВ -> Ах+m By-n;
A0 – me -> A+m;
B0 + ne -> B-n.
Из схемы окислительно-восстановительного
процесса следует, что: z(A) = m , z(B) = n .
Существует, однако, немало бинарных
соединений, формулы которых составлены не в
соответствии со степенями окисления элементов. К
ним относятся многие карбиды, нитриды, оксиды,
углеводороды и другие вещества. Например: CaC2,
Cr7C3, Mn8C3, Mn4N, Mo2N,
Fe3O4, U3O8.
Совершенно очевидно, что для любого элемента в
веществе, даже если формула составлена не по
степеням окисления, можно рассчитать эквивалент
или молярную массу элемента. Но у многих таких
веществ степени окисления элементов выражаются
дробными числами, а значит, и эквивалентные числа
также будут дробными. Решим задачу 2, используя
понятие “эквивалент”. Для этого в
математическое выражение закона эквивалентов
= где M
(1/z (A)A) – молярная масса эквивалента А,
M (1/z (B)B) – молярная масса эквивалента В
- нужно ввести массовые доли элементов А и В в
составе сложного вещества АхВу. - как показано выше, z (A) = m , z (B) = n .
Поделим z(A) на z(B): =
. Учитывая, что x m = y n , найдём
отношение :
=
,
следовательно =
.
Выразим молярные массы А и В через молярные
массы эквивалентов:
M (A) = z (A)*M (1/z (A)A),
M (B) = z (B)*M (1/z (B)B).
Подставим в формулу: =
=
записанные выражения, а
отношение эквивалентных чисел выразим через
отношение индексов, получим математическое
выражение закона эквивалентов:
=
=
. (2)
Используем эту формулу для решения задачи:
подставим значение молярной массы эквивалента
водорода и массовые доли элементов:
=
.
Отсюда вычислим молярную массу эквивалента
углерода в этом веществе:
M (1/z(C)C) = 5 г/моль.
Затем определим эквивалентное число углерода в
этом веществе:
=
=
.
Значит, степень окисления углерода в
углеводороде равна -12/5.
Определим его формулу: Сх-12/5 Ну+1;
=1*у;
х : у = 5 : 12,
значит, простейшая формула С5Н12.
Если по условию задачи надо определить формулу
бинарного соединения, образованного неизвестным
элементом, понятие “эквивалент” можно
весьма успешно использовать для её решения.
Задача 3. Определить формулы двух оксидов
одного и того же элемента, если его массовая доля
в этих оксидах равна 88,11% и 84,75%. Этот элемент
образует также фторид, содержащий 32,47% фтора по
массе.
Решение
Вычислим эквивалент кислорода в оксидах,
учитывая, что степень окисления кислорода равна
-2:
z (O) = 2;
М (1/2 О) =
Используя формулу (2), вычислим молярную массу
эквивалента неизвестного элемента R в первом
оксиде:
; M (1/z (R)R) = 89.28 г/моль.
Далее предположим, что эквивалентное число
элемента R в первом оксиде выражается целым
числом, и методом подбора определим молярную
массу элемента, учитывая, что:
M (R) = z (R) * M (1/z (R)R) получим таблицу 1:
Таблица 1
z (R) M (R) элемент 1 59,28 —- 2 118,6 Sn 3 177,8 —- 4 237,1 Np 5 296,4 —-
Предположим, что число z элемента R во втором
оксиде также выражается целым числом, и проведём
аналогичные вычисления для второго оксида:
;
Таблица 2
элемент 1 44,46 —- 2 88,92 —- 3 113,4 —- 4 177,78 Hf 5 296,4 Fr
Вычислим молярную массу эквивалента элемента R
во фториде и, затем, проведём вычисления
аналогично тем, которые были сделаны для оксидов:
;
.
Таблица 3
z2(R) M2(R) элемент 1 39,52 —- 2 79,04 —- 3 118,6 Sn 4 158,1 —- 5 197,6 —- 6 237,1 Np
Из данных таблицы 3 следует, что неизвестным
элементом может быть нептуний, так как фторида
трёхвалентного олова не существует. Тогда первым
оксидом, в котором массовая доля элемента равна
88,11%, может быть NpO2. В то же время вычисления
по второму оксиду дают один реальный ответ:
гафний (оксид Fr2O5 не существует). Как
устранить это противоречие?
Можно предположить, что во втором оксиде
элемент имеет дробную степень окисления и
эквивалентное число z (R) во втором оксиде дробное.
Исходя из этого предположения, определим
эквивалентное число z1 (R), а, затем, формулу
второго оксида:
z1 (R) =
Rx+16/3Oy-2;
;
Для определения формулы второго оксида можно
использовать формулу (1):
= 3 : 8.
Таким образом, формула второго оксида Np3O8.
Решение задач с использованием “правила
креста”
“Правило креста” знакомо учащимся с уроков
математики. Я приучаю своих учеников при
химических расчётах, там, где это возможно,
использовать это правило. Таких возможностей
достаточно много, особенно при расчётах,
связанных с приготовлением растворов заданной
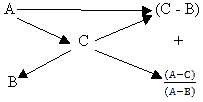
концентрации. Для этого “правило креста” можно
записать следующим образом:
Здесь А и В – концентрации исходных веществ, С
– концентрация полученного раствора.
Если концентрация растворов выражена в
процентах, то правило можно сформулировать так: чтобы
получить (А – В) грамм раствора концентрации С%,
необходимо взять (С – В) грамм раствора
концентрации А% и (А – С) грамм раствора
концентрации В%.
А и В могут принимать значения от 0 (чистый
растворитель) до 100 (чистое растворяемое
вещество), при этом С всегда будет больше А, но
меньше В.
Если концентрация растворов выражена в моль/л,
то это правило можно сформулировать так: чтобы
получить (А – В)мл (или л) раствор концентрации С
моль/л, необходимо взять(С-В)мл (или л)раствора
концентрации А моль/л и (А-С)мл (или л) раствора
концентрации В моль/л.
Применение “правила креста” позволяет
упростить решение задач и избежать
промежуточных вычислений, в которых очень часто
допускаются ошибки, а также сократить время на
решение задачи.
Рассмотрим возможности применения “правила
креста” на конкретных примерах.
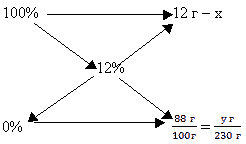
Задача 4. Определить массу поваренной соли
и объём дистиллированной воды, необходимых для
получения 230 г 12%-ного раствора соли.
Решение:
Составим схему для применения “правила
креста”, дополнив её исходными данными: х – масс
соли, у – масса воды:
Для определения х и у составим и решим две
пропорции:
х = 27,60 г;

Ответ: V (H2O) = 202.4 мл.
Задача 5. Определить объём воды (в мл),
который нужно добавить к 400 мл 18%-ного раствора
соли плотностью 1,132 г/мл, чтобы получить 11%-ный
раствор.
Решение:
Масса исходного раствора составляет: m = p * V;
m = 1.130 * 400 = 152.8 (г).
Составим схему и найдём объём воды:
Ответ: V (H2O) = 288.15 мл.
Компьютерные программы для обучения
решению задач по химии
Одно из универсальных средств для образования
– компьютерные обучающие программы, которые
обладают самыми широкими возможностями. Идея
использования компьютеров при обучении
школьников решению химических задач не нова и
нашла отражение даже в названиях ряда задачников
и пособий для учителей. У меня в этом плане
имеются прекрасные, если не сказать уникальные,
возможности: на ряду с химией я ещё преподаю и
информатику. В моём распоряжении не только
компьютерный кабинет. Имею приличный опыт
использования компьютера в обучении учащихся
химии, в том числе и решению химических задач.