Содержание
- Способы определения молекулярной формулы оксида и элемента металла, образующего данный оксид
- Секретная шпаргалка по химии. 5.2. Вывод формулы вещества по массовой доле элементов
- Секретная шпаргалка по химии. 3.1 Массовая доля элемента в соединении
- Массовая доля элемента в соединении: задачи
- Пример 1.
- Пример 2.
- Пример 3.
- Как найти массовую долю вещества по формуле
- Нахождение массовой доли химического элемента
- Нахождение массовой доли вещества в смесях и растворах
- Массовая доля примесей
- Видео
Способы определения молекулярной формулы оксида и элемента металла, образующего данный оксид
Задача 115.
Некоторый элемент образует оксид вида Э2О3, где Э — неизвестный элемент. Массовая доля кислорода в нем составляет 30,08% . Определите элемент и формулу оксида.
Дано: формула оксида: Э2О3; массовая доля кислорода в оксиде: (О) = 30,08%.
(О) = 30,08%.
Найти: элемент и формулу оксида.
Решение:
Для выявления неизвестного элемента необходимо определить его молярную массу, по которой, пользуясь Периодической системой Д.И.Менделеева, возможно найти неизвестный элемент.
I способ (последовательно-разветвленный алгоритм).
Схематично этот алгоритм можно изобразить так:
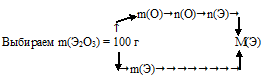
1) Произвольно выбираем некоторую массу образца. Наиболее удобная масса — 100 г, т.к. в условии фигурирует массовая доля. Тогда в 100 г Э2О3 содержится 30,08 г кислорода.
2) По разности находим массу неизвестного элемента:
m(Э) = 100 – m(О) = 100 – 30,08 = 69,92 г содержится в выбранном образце Э2О3.
3) Находим количество вещества атомарного кислорода:
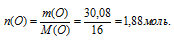
4) По известной общей формуле Э2О3 вычисляем количество вещества атомов неизвестного элемента. На каждые 3 моль атомов кислорода приходится 2 моль атомов неизвестного элемента.
Составим пропорцию:
3 моль атомов кислорода приходится на 2 моль атомов Э
1,88 моль атомов кислорода приходится на х моль атомов Э.
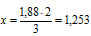 атомов элемента содержится в выбранном образце Э2О3.
атомов элемента содержится в выбранном образце Э2О3.
5) Теперь находим молярную массу атомов неизвестного элемента:
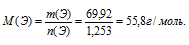
По таблице Д. И. Менделеева находим элемент, имеющий молярную массу 55,8 г/моль. Подходит железо. Этот элемент действительно проявляет степень окисления (+3) и образует оксид Fе2О3.
II способ (встречный алгоритм).
Схематично алгоритм можно изобразить таким образом:
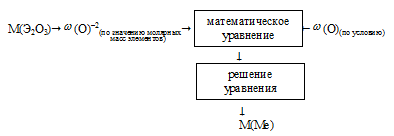
Применим предложенный алгоритм.
1) Записываем выражение для молярной массы Э2О3:
М(Э2О3) = М(Э) . 2 + М(О) . 3 = (М(Э) . 2 + 48) г/моль.
2) Выбираем массу образца Э2О3, соответствующую 1 моль вещества. Она составит m(Э2О3) = (M(Э) . 2 + 48) г. Масса кислорода в этом образце будет 48 г.
3) Записываем выражение для массовой доли кислорода в выбранном образце:
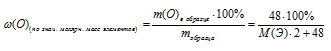
4) Приравниваем полученное выражение к значению массовой доли кислорода из условия:
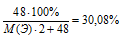
Получили одно уравнение с одним неизвестным М(Э). Решаем его и получаем М(Э) = 55,8 г/моль.
По таблице Д.И. Менделеева находим элемент, имеющий молярную массу 55,8 г/моль. Подходит железо. Этот элемент действительно проявляет степень окисления (+3) и образует оксид Fе2О3.
Ответ: искомый элемент — железо, формула Fе2О3.
Источник
Секретная шпаргалка по химии. 5.2. Вывод формулы вещества по массовой доле элементов
Вы хотите изучать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
А вы знаете, что такое аффирмация?
Аффирмация — это короткая фраза, содержащая словесную формулу (лингвистический код), которая при многократном повторении закрепляет требуемую установку в подсознании.
Как работает аффирмация?
Если сосредоточить свое внимание на действиях (целях, установках), в головном мозге включаются интересные процессы. Между лимбической системой и корой больших полушарий формируются нейронные связи, определяющие конкретные чувства и действия человека. В результате, когда вы думаете о конкретных действиях (установках, целях), мозг начинает вырабатывать особые химические вещества — нейромедиаторы, которые активируют программу достижения ваших целей. Если вы натренируете свой мозг таким образом, чтобы он ассоциировал ваши действия по достижению результата с позитивными чувствами, вы каждый раз будете испытывать чувство радости и удовлетворения, вспоминая о целях, о действиях по достижению целей, о результатах работы. Таким образом, ваше подсознание будет ставить важные цели и действия на первое место среди остальных приоритетов.
Возьмите ручку в руки и напишите три аффирмации , определяющие ваши цели и действия на ближайшие месяцы. Например:
1) Я хорошо себя чувствую и уверен в своих силах
2) Я буду изучать химию и решать задачи по химии каждый день
3) Я сдам ЕГЭ по химии на очень высокий балл
Прикрепите ваши аффирмации на видное место, например, над компьютером. Каждый день в течение пяти минут вы должны стать перед зеркалом и вслух произнести эти фразы. Произносите слова уверенно, так, словно вы уже достигли поставленных целей. Если вы чувствуете в своем теле дискомфорт, связанный с определенной аффирмацией , поместите свою руку на эту область тела и, в момент произношения фразы, мысленно направьте энергию руки в эту область.
Наверняка, у вас возник вопрос: «Откуда репетитор по химии Богунова В.Г. так хорошо знает психотерапевтические техники?» Отвечу. У меня есть советник. Мой психолог-консультант — Кристина . Это она знакомит меня с тайнами практик психотерапии. Чуть позже я расскажу о Кристине много интересного, а пока вернемся к основной теме статьи — Вывод формулы вещества по массовым долям . Итак, поехали!
Алгоритм решения лучше разобрать на конкретной задаче. Все задачи, конечно, решаются по Четырем Заповедям. Но если алгоритм решения — очень специфичный, лучше акцентировать внимание именно на нем.
Найти простейшую формулу соединения, содержащего 43,4% натрия, 11,3% углерода и 45,3% кислорода.
Источник
Секретная шпаргалка по химии. 3.1 Массовая доля элемента в соединении
За окном — дождь и пронизывающий ветер. Холодно. В такую погоду музы особенно активны. Они слетаются в гости и садятся ко мне на плечо. На правое. Сразу все. И, свесив ноги, начинают болтать друг с другом. Я им уже не нужна. Ребята, о чем это вы? Мне, как и вам, тоже хочется чая с имбирем. И шоколада. И венских вафель. Но я обещала написать статью (и не одну) о массовой доле элемента. Такие расчеты очень важны для развития логических основ алгоритмики. Умение определять массовую долю (или компоненты системы по известной массовой доле) пригодится и во время учебы в медицинском, и во врачебной практике. Поэтому, берем тетрадку, ручку, карандаш и ластик, читаем статью и записываем вместе со мной решение задач. Вначале, как всегда, теория практики. Разберемся с основными понятиями.
Доля — часть чего-нибудь (толковый словарь С.И. Ожегова)
Массовая доля — число, показывающее отношение массы части к общей массе целого или по-другому, отношение массы компонента системы к массе всей системы. Эта величина обозначается греческой буквой «омега» и может выражаться в долях единицы или в процентах.
Например, мы купили у бабули на рынке ведро яблок и груш общей массой 10 кг. Дома разделили фрукты на две кучки. Масса груш составила 3 кг. Значит, массовая доля груш 3/10 = 0,3 (30%). Вспомнили, как рассчитать массовую долю? Отлично! Поехали дальше.
Массовая доля элемента в соединении — число, показывающее, какую часть составляет масса всех атомов данного элемента в молекуле вещества от общей массы молекулы, определяется отношением массы атомов к массе молекулы. Разберемся на примере конкретной задачи
Определите массовую долю железа в оксиде железа (III)
Записываем формулу массовой доли в общем виде, затем конкретизируем ее. Читаем внимательно и следим за моими руками. Массовая доля элемента в соединении определяется отношением массы атомов (числитель) к массе молекулы (знаменатель), то есть:
1) в числителе мы работаем с атомами того элемента, чью массовую долю определяем, для этого умножаем атомную массу элемента (молярная масса атомов) на число атомов этого элемента
2) в знаменателе мы записываем молярную массу вещества
Это очень легкая прямая задача. Попробуем решить обратные задачи — по известной массовой доле определяем неизвестный элемент (вернее, его атомную массу), либо неизвестное число атомов углерода в общей формуле класса органических веществ.
Соединение элемента имеет формулу Э2О3, массовая доля элемента в нем 68,42%. Установите элемент.
Для определения неизвестного элемента необходимо рассчитать его атомную массу (молярную массу атомов), а затем по Периодической системе химических элементов Д.И. Менделеева по атомной массе определяем химический элемент.
Алгоритм решения задачи строим на основании алгебраической формулы определения массовой доли элемента в соединении. Атомную массу элемента обозначаем как неизвестное Х. В числителе записываем массу атомов того элемента, чья массовая доля представлена в условии, в знаменателе — молярную массу вещества в общем виде. Решаем уравнение. По рассчитанной атомной массе определяем элемент. Это хром. Записываем формулу и называем вещество.
Оксид неизвестного пятивалентного элемента содержит 56,34% кислорода. Определите этот элемент.
Массовая доля водорода в алкине CnH2n-2 составляет 12,2 %. Определите число атомов углерода
Алгоритм решения задачи строим на основании алгебраической формулы определения массовой доли элемента в соединении. В числителе записываем массу атомов того элемента, чья массовая доля представлена в условии, в знаменателе — молярную массу вещества в общем виде. Решаем уравнение, определяем неизвестное n, записываем формулу, называем вещество. Это гексин.
Массовая доля водорода в молекуле алкина CnH2n-2 равна 11,11 %. Определите число атомов углерода
Если вы думаете, что все так просто, вы очень и очень ошибаетесь. То ли еще будет! Гораздо более веселые задачи вас ожидают в следующей статье — «Массовая доля элемента в соединении». Но это будет завтра. Сегодня музы устали от пустой болтовни и улетели в теплые края. А я, довольная проделанной работой, иду пить чай с имбирем, лимоном и медом! Чего и вам желаю.
Приходите ко мне на занятия, и вы будете поражены тем, что всего за ТРИ ЧАСА сможете усвоить объем знаний, намного превышающий тот, который вам вкладывали в голову на протяжении ТРЕХ ЛЕТ! Занятие будет проходить динамично, интересно, весело, но главное, РЕЗУЛЬТАТИВНО! Вы блестяще сдадите ЕГЭ по химии и станете студентом престижного медицинского ВУЗа!
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии http://repetitor-him.ru . Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7(903) 186-74-55. Приходите ко мне на курс, на Мастер-классы «Решение задач по химии» — и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте, или на Facebook. Я обязательно отвечу вам.
Репетитор по химии и биологии кбн В.Богунова
Источник
Массовая доля элемента в соединении: задачи
Массовая доля элемента в соединении показывает, какую долю составляет масса данного элемента в соединении . Для того, чтобы рассчитывать массовую долю , нужно правильно рассчитывать молекулярную массу и обязательно учитывать число атомов каждого элемента. Кстати, иногда требуется решить по химии и обратную задачу: зная массовую долю, составлять формулы. Теперь потренируемся на примерах.
Пример 1.
Определите массовые доли элементов в сульфате натрия.
Формула сульфата натрия Na2SO4 . Молекулярная масса Na2SO4 2*23+32+4*16=142 (мы взяли атомные массы элементов из таблицы Менделеева и умножили их на нужные индексы: атомов натрия в формуле 2, атом серы 1, атомов кислорода 4).
Рассчитываем массовые доли, составляя пропорции.
Массовая доля натрия:
142 (молекулярная масса Na2SO4) – 100%
2*23 (берём атомную массу натрия, умноженную на 2, потому что у нас 2 атома Na) – X%
Массовая доля серы:
142 (молекулярная масса Na2SO4) – 100%
32 (берём атомную S) –Y%
Массовая доля кислорода:
142 (молекулярная масса Na2SO4) – 100%
4*16 (берём атомную массу кислорода, умноженную на 4, потому что у нас 4 атома О) –Z%
Ответ: в сульфате натрия массовая доля натрия 32,4%, массовая доля серы 22,5%, массовая доля кислорода 45,1% (проверим себя. При сложении всех массовых долей должно получиться 100%. У нас 32,4+22,5+45,1=100).
Пример 2.
Это сложный пример, который может встретиться на огэ по химии. Но, разобравшись в нём без репетитора по химии, вы точно поймёте, что такое массовая доля. Итак, нужно определить массовые доли в нитрате меди (II).
Формула нитрата меди (II) Cu(NO3)2. Обратите внимание, что здесь имеется кислотный остаток NO3, заключённый в скобки. Индекс 2 относится ко всему кислотному остатку! Это крайне важно для правильного расчёта! То есть в нашем соединении Cu(NO3)2 есть 1 атом меди Cu и два кислотных остатка NO3, то есть 2 атома азота и 2*3=6 атомов кислорода. Обязательно поймите это!
Теперь переходим к расчёту молекулярной массы Cu(NO3)2 (как всегда, берём атомные массы элементов из таблицы Менделеева). Она составляет 64+2*14+6*16=188. Далее рассчитываем массовые доли.
Ответ: в нитрате меди (II) массовая доля меди 34,0%, массовая доля азота 14,9%, массовая доля кислорода 51,1% (для проверки сложим все массовые доли 34,0+14,9+51,1=100, всё верно).
Пример 3.
Обратная задача. По массовым долям элементов в соединении нужно определить формулу. Известно, что в соединение входят калий К, марганец Mn и кислород О. Массовая доля калия 24,7%, массовая доля марганца 34,8%, массовая доля кислорода 40,5%. Определите формулу.
Нам нужно найти Х, Y и Z. Для начала найдём в периодической таблице атомные массы элементов: атомная масса калия 39, марганца 55, кислорода 16. Теперь вспомним, что массовая доля показывает нам вклад каждого элемента в массу вещества. Отсюда следует, что, разделив массовую долю на атомную массу, мы получим число атомов в соединении. То есть здесь:
· атомов калия 27,4/39=0,6 (27,4 – массовая доля калия, она дана в условии. 39 – атомная масса калия, взятая из таблицы Менделеева)
· атомов марганца 34,8/55=0,6 (34,8 – массовая доля марганца, она дана в условии. 55 – атомная масса марганца, взятая из таблицы Менделеева).
· атомов кислорода 40,5/16=2,5 (40,5 – массовая доля кислорода, она дана в условии. 16 – атомная масса кислорода, взятая из таблицы Менделеева)
Таким образом, у нас получились индексы Х, Y и Z, которые нам были нужны: Х=0,6, Y=0,6 и Z=2,5. Но индексы не могут быть нецелыми, ведь они показывают, сколько атомов элемента входит в вещества. А число атомов всегда целое. Поэтому наши дробные Х, Y и Z нужно привести к целому виду. Для этого мы просто разделим их все на наименьшее число (у нас это 0,6). Тогда получаем:
Z=2,5/0,6=4 (тут получается чуть больше, но округляем до целого числа).
Теперь мы знаем индексы и можем сказать, что соединение входит 1 атом калия, 1 атом марганца и 4 атома кислорода.
Ответ: формула соединения KMnO4.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник
Как найти массовую долю вещества по формуле
Массовая доля — один из важных параметров, который активно используется для расчетов и не только в химии. Приготовление сиропов и рассолов, расчет внесения удобрений на площадь под ту или иную культуру, приготовление и назначение лекарственных препаратов. Для всех этих расчетов нужна массовая доля. Формула для ее нахождения будет дана ниже.
В химии она рассчитывается:
- для компонента смеси, раствора;
- для составной части соединения (химического элемента);
- для примесей к чистым веществам.
Раствор — это тоже смесь, только гомогенная.
Массовая доля — это отношение массы компонента смеси (вещества) ко всей его массе. Выражают в обычных числах или в процентах.
Формула для нахождения такая:
? = (m (сост. части) · m (смеси, в-ва)) / 100% .
Нахождение массовой доли химического элемента
Массовая доля химического элемента в веществе находится по отношению атомной массы химического элемента, умноженной на количество его атомов в этом соединении, к молекулярной массе вещества.
Например, для определения w кислорода (оксигена) в молекуле углекислого газа СО2 вначале найдем молекулярную массу всего соединения. Она составляет 44. В молекуле содержится 2 атома кислорода. Значит w кислорода рассчитываем так:
w(O) = (Ar(O) · 2 ) / Mr(СО2)) х 100%,
w(O) = ((16 · 2) / 44) х 100% = 72,73%.
Аналогичным образом в химии определяют, например, w воды в кристаллогидрате — комплексе соединения с водой. В таком виде в природе находятся многие вещества в минералах.
Например, формула медного купороса CuSO4 · 5H2O. Чтобы определить w воды в этом кристаллогидрате, нужно в уже известную формулу подставить, соответственно, Mr воды (в числитель) и общую m кристаллогидрата (в знаменатель). Mr воды 18, а всего кристаллогидрата — 250.
w( H2O ) = ((18 · 5) / 250 ) · 100% = 36%

Нахождение массовой доли вещества в смесях и растворах
Массовая доля химического соединения в смеси или растворе определяется по той же формуле, только в числителе будет масса вещества в растворе (смеси), а в знаменателе — масса всего раствора (смеси):
? = (m (в-ва) · m (р-ра)) / 100% .
Следует обратить внимание, что массовая концентрация — это отношение массы вещества к массе всего раствора, а не только растворителя.
Например, растворили 10 г поваренной соли в 200 г воды. Нужно найти процентную концентрацию соли в полученном растворе.
Для определения концентрации соли нам нужна m раствора. Она составляет:
m (р-ра) = m (соли) + m (воды) = 10 + 200 = 210 (г).
Находим массовую долю соли в растворе:
? = ( 10 · 210) / 100% = 4,76%
Таким образом, концентрация поваренной соли в растворе составит 4,76%.
Если в условии задачи дается не m, а объем раствора, то его нужно перевести в массу. Делается это обычно через формулу для нахождения плотности:
где m — масса вещества (раствора, смеси), а V — его объем.
Такую концентрацию используют чаще всего. Именно ее имеют в виду (если нет отдельных указаний), когда пишут о процентном содержании веществ в растворах и смесях.

Массовая доля примесей
В задачах часто дается концентрация примесей в веществе или вещества в его минералах. Следует обратить внимание на то, что концентрация (массовая доля) чистого соединения будет определяться путем вычитания из 100% доли примеси.
Например, если говорится, что из минерала получают железо, а процент примесей 80%, то чистого железа в минерале 100 — 80 = 20%.
Соответственно, если написано, что в минерале содержится только 20% железа, то во все химические реакции и в химическом производстве будут участвовать именно эти 20%.
Например, для реакции с соляной кислотой взяли 200 г природного минерала, в котором содержание цинка 5%. Для определения массы взятого цинка пользуемся той же формулой:
? = (m (в-ва) · m (р-ра)) / 100% ,
из которой находим неизвестную m раствора:
m (Zn) = ( w · 100% ) / m (минер.)
m (Zn) = (5 · 100) / 200 = 10 (г)
То есть, в 200 г взятого для реакции минерала содержится 5% цинка.
Задача. Образец медной руды массой 150 г содержит сульфид меди одновалентной и примеси, массовая доля которых составляет 15%. Вычислите массу сульфида меди в образце.
Решение задачи возможно двумя способами. Первый — это найти по известной концентрации массу примесей и вычесть ее из общей m образца руды. Второй способ — это найти массовую долю чистого сульфида и по ней уже рассчитать его массу. Решим обоими способами.
Вначале найдем m примесей в образце руды. Для этого воспользуемся уже известной формулой:
? = ( m (примесей) · m (образца)) / 100% ,
m(примес.) = (w · m (образца)) · 100% , (А)
m(примес.) = (15 · 150) / 100% = 22,5 (г).
Теперь по разности найдем количество сульфида в образце:
150 — 22,5 = 127,5 г
Вначале находим w соединения:
А теперь по ней, воспользовавшись той же формулой, что и в первом способе (формула А), найдем m сульфида меди:
m(Cu2S) = (w · m (образца)) / 100% ,
m(Cu2S) = (85 · 150) / 100% = 127,5 (г).
Ответ: масса сульфида меди одновалентного в образце составляет 127,5 г.
Видео
Из видео вы узнаете, как правильно производить рассчеты по химическим формулам и как найти массовую долю.
Источник
Одна из моих предыдущих статей была посвящена разбору решения задач «на пластинку». В продолжение этой темы, хочу предложить разбор еще двух задач “на пластинку”. Особенностью этих задач является определение неизвестного металла пластинки или металла оседающего на пластинке.
И вот эти задачи.
Условие первой задачи:
Две пластинки с одинаковой массой, изготовленные из одного и того же металла, проявляющего в соединениях степень окисления +2, погрузили одну в раствор сульфата меди, а другую – в раствор нитрата свинца. Через некоторое время масса первой пластинки уменьшилась на 3,6%, а масса второй увеличилась на 7,125%. Определить, какой это металл.
Решение:
Для ответа на этот вопрос нужно искать молярную массу металла.
Введем условные обозначения:
Ме – металл пластинки;
х – молярная масса металла, г/моль;
у – количество прореагировавшего металла, моль.
Запишем уравнения реакции:
Ме + СuSO4 = Cu+ MeSO4 (1)
Ме + PbSO4 = Pb+ MeSO4 (2)
Примем, что исходная масса каждой пластинки равна 100 г. Тогда, масса первой пластинки уменьшилась на 3,6 г, а масса второй увеличилась на 7,125 г.
Изменение массы пластинок связано с растворением металла пластинки и оседанием на нем меди (первое уравнение) или свинца (второе уравнение):
Откуда,
143y = 10,725
y = 0,075
-0,075х + 4,8 = -3,6
0,075х = 8,4
x =112
M(Me) = 112 г/моль. Металл пластинок – кадмий.
Условие второй задачи:
Цинковую пластинку поместили в раствор сульфата некоторого металла. Масса раствора составляет 50 г. Металл в сульфате находится в степени окисления +2. Через некоторое время масса пластинки увеличилась на 1,08 г. Массовая доля сульфата цинка в растворе стала равна 6,58%. Определите, какой металл выделился на пластинке?
Решение:
Уравнение реакции:
Zn + МеSO4 = Me + ZnSO4
Для решения введем обозначения:
х – молярная масса металла, г/моль;
у – количество моль прореагировавшего цинка.
Изменение массы пластинки происходит из-за растворения цинка и оседания на пластинке металла из соли:
-65у+ху=1,08
Массовая доля сульфата цинка в растворе:
w(ZnSO4) = m(ZnSO4)/m(p-pa)
где m(ZnSO4) – масса сульфата цинка, г.
m(ZnSO4) = M(ZnSO4)*y = 161y
m(p-pa) – масса раствора после реакции, г.
m(p-pa) = 50-1,08 = 48,92
0,0658 =161y/48,92
161y = 3,219
y= 0,02
n(Zn) = 0,02 моль.
Подставляя полученное значение в первое уравнение, получим:
-65*0,02+0,02х =1,08
0,02х = 2,38
х = 119
Молярная масса металла: М(Ме) = 119 г/моль
Металл пластинки – олово.
Задачи для самостоятельного решения:
1. Кусочек железа поместили в раствор нитрата металла, который проявляет в соединениях степень окисления +1. Масса образца металла увеличилась на 16 г. через полученный раствор нитрата железа пропустили избыток сероводорода, получив сульфид железа массой 8,8 г. Какой металл выделен из раствора? [Cеребро]
2. В раствор, содержащий 3,2 г 2-х валентного металла в виде хлорида, погрузили железную пластинку массой 50 г. После полного осаждения металла масса пластинки увеличилась на 0,8%. Определите, соль какого металла находилась в растворе? [Медь]
3. Две пластинки одинаковой массы, изготовленные из одного и того же металла, проявляющего в своих соединениях валентность, равную 2, погрузили в растворы одинаковой концентрации: одну – в раствор соли кадмия, другую – в раствор соли свинца. Через некоторое время оказалось, что масса первой пластинки увеличилась на 0,47%, второй – на 1,42%. Определите металл, из которого были изготовлены пластинки? (железо).
4. Пластинку неизвестного металла поместили в 800 г раствора нитрата свинца с массовой долей соли 5 %. Через некоторое время масса пластинки увеличилась на 14,3 г, а массовая доля нитрата свинца стала равна 0,88 %. Какой металл был взят, если известно, что в нитрате он находится в степени окисления +2.
Успехов в решении задач!
 Сегодня у нас урок химии 109 – Задачи и упражнения по металлам с решениями. Как изучить? Полезные советы и рекомендации – повторите уроки по химии соответствующих классов неорганических соединений. При возникновении вопросов оставьте свои комментарии, или свяжитесь со мной на адрес: beev.aues@yandex.ru
Сегодня у нас урок химии 109 – Задачи и упражнения по металлам с решениями. Как изучить? Полезные советы и рекомендации – повторите уроки по химии соответствующих классов неорганических соединений. При возникновении вопросов оставьте свои комментарии, или свяжитесь со мной на адрес: beev.aues@yandex.ru
- В схеме превращений
+H2O +H2SO4 + BaCl2
К → X1 → X2 → X3
веществами Х1, Х2 Х3 являются соответственно:
1) КOH, К2SO4, BaSO4;
2) К2O, К2SO4, КOH;
3) К2O, К2SO4, BaSO4;
4) К2O2, КOH, BaSO4.
Решение:
2К + 2Н2О = 2КОН + Н2↑
КОН + 2Н2SO4 = К2SO4 + 2Н2O
К2SO4 + BaCl2 = BaSO4↑ + 2KCl
Ответ: 1.
- Какая пара веществ придает постоянную жесткость воде?
1) сульфатов и хлоридов натрия и калия;
2) сульфатов и хлоридов кальция и магния;
3) карбонатов и гидрокарбонатов кальция и магния;
4) сульфатов и хлоридов натрия и магния.
Решение:
Постоянную жесткость воде придают сульфаты и хлориды кальция и магния.
Ответ: 2.
- При реакции смеси 2,294г цинкаи кальция с раствором щелочи выделилось 0,672л водорода (н.у.). Какова массовая доля (%) цинка в смеси?
1) 25; 2) 46; 3) 75; 4) 85.
Решение:
С раствором щелочи как амфотерный элемент, реагирует цинк:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2↑
n(H2) = 0,672/22,4 = 0,03 моль;
n(H2) = n(Zn) = 0,03 моль;
A(Zn) = 65 г/атом;
m(Zn) = 65*0,03 = 1,95 г.
ω(Zn) = 1,95 *100/2,294 = 85 %
Ответ: 4.
- При реакции магния массой 0,96г с галогеном образовался галогенид магния массой 3,8г. Какой галоген был взят?
1); I2; 2) Br2; 3) Cl2; 4) F2.
Решение:
Mg + Г2 = MgГ2, где Г – галоген;
A(Mg) = 24 г/атом;
n(Mg) = 0,96/24 = 0,04 моль;
n(Mg) = n(MgГ2) = 0,04 моль;
М(MgГ2) = 3,8/0,04 = 95 г/моль;
95 – 24 = 71г – масса двух атомов галогена. Это хлор (по 35,5г/атома)
Ответ: 3.
- При обработке сплаважелеза с углеродом массой 10г избытком раствора хлороводородной кислоты выделился водород объемом 3,92л (н.у.). Определите массовую долю углерода в сплаве.
1) 1%; 2) 2%; 3) 3%; 4) 4%.
Решение:
С раствором хлороводородной кислоты реагирует железо:
Fe + 2HCl → FeCl2 + H2↑
n(H2) = 3,22/22,4 = 0,175 моль;
n(Fe) = n(H2) = 0,175 моль;
A(Fe) = 56 г/атом;
m(Fe) = 56*0,175 = 9,8 г.
ω(Fe) = 9,8 *100/10 = 98 %
ω(C) = 100 – 98 = 2 %.
Ответ: 2.
- Какую массу серы можно получить при пропускании 4,48л сероворода через подкисленный раствор, содержащий 79г перманганата калия?
1) 8,25; 2) 9,36; 3) 6,4; 4) 10,7.
Решение:
Реакция сероворода с подкисленным раствором, перманганата калия:
5Н2S + 2КМnО4 + ЗН2SО4 = 5S + 2МnSО4 + К2SО4 + 8Н2О
n(Н2S) = 4,48/22,4 = 0,2 моль;
М(КМnО4) = 158 г/моль;
n(КМnО4) = 79/158 = 0,5 моль;
Учитывая стехиометрию реакции, найдем избыток-недостаток:
Н2S:КМnО4 = 0,2/5:0,5/2 = 0,04:0,25;
Сероводород в недостатке, расчет массы серы ведем по нему.
n(Н2S) = n(S) = 0,2 моль;
A(S) = 32 г/атом;
m(S) = 32*0,2 = 6,4г.
Ответ: 3.
- Через ряд последовательных реакций, из 60кг пирита получили 100кг 75%-ной серной кислоты. Каков выход серной кислоты от теоретического? Ответ округлить до десятых.
1) 82,7%; 2) 70,8%; 3) 76,5%; 4) 65,8%.
Решение:
Протекающие реакции:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑
2SO2 + O2 ↔ 2SO3
SO3 + H2O → H2SO4
Из этих реакций видно, что упрощенно, можно записать:
FeS2 → 2H2SO4
m(H2SO4) = 100*75/100 = 75кг;
М(FeS2) = 120 г/моль;
М(H2SO4) = 98 г/моль;
n(FeS2) → 2n(H2SO4)
Теоретический выход:
m(H2SO4) = 60*98*2/120 = 98кг;
Практический выход:
m(H2SO4) = 75*100/98 = 76,5%.
Ответ: 3.
- При обработке 20г смеси железа, оксида железа (II) и оксида железа (III) раствором избытка хлороводородной кислоты выделяется 2,24л водорода (н.у.). Если восстановить водородом таку же массу смеси, получают 4,23г воды. Определите массовую долю (%) оксида железа (III) с точностью до целых в исходной смеси.
1) 63; 2) 31,5; 3) 45,5; 4) 54,6.
Решение:
Протекающие реакции:
Fe + 2HCl = FeCl2 + H2↑
FeО + H2 = Fe + H2О
Fe2О3 + 3H2 = 2Fe + 3H2О
n(Fe) = n(H2) = 2,24/22,4 = 0,1 моль;
A(Fe) = 56 г/атом;
m(Fe) = 56*0,1 = 5,6 г.
Значит, масса смеси оксидов железа равна:
20 – 5,6 = 14,4г;
М(FeО) = 72 г/моль;
М(Fe2О3) = 160 г/моль;
М(Н2О) = 18 г/моль;
Обозначим массу FeО в смеси «а», массу Fe2О3 – «в».
Массу воды, образующуюся из «а» FeО обозначим через «х».
Тогда масса воды, образующаяся из «в» Fe2О3 будет равна: 4,23 – х.
Исходя из изложенного, можно составить уравнения:
а = 72х/18; в = 160*(4,23 – х)/3*18
а + в = 14,4
72х/18 + 160*(4,23 – х)/3*18 = 14,4
х = 1,8г – это масса FeО в смеси;
масса Fe2О3 будет: 14,4 – 1,8 = 12,6г
ω(Fe2О3) = 12,6*100/20 = 63 %
Ответ: 1.
- На 15,43г сплава магния с серебром подействовали избытком соляной кислоты. Нерастворившуюся растворили растворили в концентрированной азотной кислоте. Сухой остаток, полученный после выпаривания раствора помыли, посушили, и прокалили, в результате осталось 10,8г твердого вещества. Вычислите массовую долю(%) серебра в сплаве:
1) 25; 2) 70; 3) 85; 4) 60.
Решение:
Протекающие реакции:
Mg + 2HCl = MgCl2 + H2↑
Ag + 2HNO3(конц) = AgNO3 + NO2 + H2О
2AgNO3 = 2Ag + NO2↑ + O2↑;
Остаток – серебро.
ω(Ag) = 10,8*100/15,43 = 70 %
Ответ: 2.
- При взаимодействии 16,56г неизвестного металла с горячим концентрированным раствором серной кислоты образуется сольдвухвалентного металла и выделяется 1792мл (н.у.) газа, содержащего по 50% серы и кислорода. Плотность газа по гелию равна 16,0. Определите неизвестный металл (в ответе укажите число нейтронов в атоме).
1) 46; 2) 77; 3) 84; 4) 125.
В первую очередь, определим формулу выделяющегося газа.
А(S) = 32 г/атом;
А(О) = 16 г/атом;
S:О = 50/32:50/16;
S:О = 1,5625:3,125 = 1:2;
По плотности по гелию найдем молекулярную массу газа:
А(He) = 4 г/атом;
DHe = М/4 = 16
М = 16*4 = 64
Неизвестный газ – SO2.
Напишем реакцию, обозначив неизвестный двухвалентный металл «Ме».
Ме + 2H2SO4(конц) = МеSO4 + SO2↑ + 2H2О
n(SO2) = n(Ме) = 1792/22400 = 0,08 моль;
Найдем атомную массу неизвестного металла:
А(Ме) = 16,56/0,08 = 207.
Это – свинец, его атомная масса – 207. Порядковый номер 82, в ядре атома – 82 протона и 207 – 82 = 125 нейтронов.
Ответ: 4.
- При обработке 48,5г смеси каустической соды, кальцинированной соды, и сульфата бария соляной кислотой выделилось 4,48л газа (н.у.) и осталось 23,3г твердого вещества. Определите состав смеси и в ответе укажите массу (г) каустической соды:
1) 4; 2) 8; 3) 20; 4) 12.
Решение:
С раствором соляной кислоты реагируют каустическая и кальцинированная соды, но газ (СО2) выделяется при реакции с кальцинированной (Na2CO3):
NaOH + HCl = NaCl + H2O
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
n(Na2CO3) = n(CO2) = 4,48/22,4 = 0,2 моль;
M(Na2CO3) = 106 г/моль;
m(Na2CO3) = 106*0,2 = 21,2г;
Непрореагировавшее вещество – сульфата бария, его масса – 23,3 г. Значит, масса каустической соды будет:
m(NaOH) = 48,5 – (21,2 + 23,3) = 4г.
Ответ: 1.
- При взаимодействии газообразного продукта реакции меди с концентрированной серной взаимодействии с избытком сероводорода получено 19,2г твердого вещества, имеющего желтый цвет. Какая масса меди в граммах, вступила в реакцию?
1) 6,4; 2) 12,8; 3) 3,2; 4) 10,6.
Решение:
Протекающие реакции:
Cu + 2H2SO4(конц) = CuSO4 + SO2↑ + 2H2O;
SO2 + 2H2S = 3S↓ +2H2O;
А(S) = 32 г/атом;
А(Cu) = 64 г/атом;
n(S) = 19,2/32 = 0,2 моль;
Из стехиометрии ракций можем написать:
n(Cu) = n(SO2) = n(S/3) = 4,48/22,4 = 0,2 моль;
m(Cu) = 64*0,2 = 12,8г;
Ответ: 2.
- Смесь алюминия, кальция и меди массой 23г обработали избытком разбавленной серной кислоты. При этом выделилось 11,2л (н.у.) газа. Нерастворившийся остаток растворили в концентрированной серной кислоте с выделением 3,36л газа (н.у.). Массовая доля алюминия (с точностью до десятых) в смеси равна:
1) 13,7; 2) 14,6; 3) 23,5; 4) 16,3.
Решение:
С концентрированной серной кислотой реагирует медь:
Cu + 2H2SO4(конц) = CuSO4 + SO2↑ + 2H2O;
Найдем массу меди в смеси:
n(Cu) = n(SO2) = 3,36/22,4 = 0,15 моль;
А(Cu) = 64 г/атом;
m(Cu) = 64*0,15 = 9,6г;
С разбавленной серной кислотой реагируют кальций и алюминий:
Cа + H2SO4(разб) = CаSO4 + H2↑;
2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2↑;
Масса алюминия и кальция в смеси равна:
23 – 9,6 = 13,4г;
А(Cа) = 40 г/атом;
А(Al) = 27 г/атом;
По условию задачи, при их взаимодействии с разбавленной серной кислотой
выделилось 11,2л водорода.
Обозначим массу Са в смеси «а», массу Al – «в».
Объем водорода, которая образуется в реакции с «а» Са обозначим через «х»л. Тогда объем водорода, образующаяся в реакции с «в» Al будет равна: (11,2 – х)л.
Исходя из изложенного, можно составить уравнения:
а = 40х/22,4; в = 27*2(11,2 – х)/3*22,4
а + в = 13,4
40х/22,4 + 27*2(11,2 – х)/3*22,4 = 13,4
Решение дает:
х = 4,48 л — в реакции с Са;
n(Cа) = n(H2) = 4,48/22,4 = 0,2 моль;
m(Ca) = 0,2*40 = 8г;
В реакции Al с H2SO4(разб) выделяется 11,2 – 4,48 = 6,72л водорода.
n(H2) = 6,72/22,4 = 0,3 моль – в реакции с Al;
Из стехиометрии реакции Al с H2SO4(разб) видно, что:
3n(Al) = 2n(Ca)
n(Al) = 2n(Ca)/3;
n(Al) = 2*0,3/3 = 0,2;
m(Al) = 0,2*27 = 5,4г;
m(смеси) = m(Cu) + m(Cа) + m(Al);
m(смеси) = 9,6 + 8 + 5,4 = 23г;
ω(Al) = 5,4*100/23 = 23,5 %
Ответ: 3.
- Какая реакция показывает процесс промышленного получения железа?
1) FeSO4 + Zn → ZnSO4 + Fe;
2) 2FeCl3 → 2Fe + 3Cl2;
3) 2Fe2O3 + 3C → 4Fe + 3CO2;
4) 3Fe3O4 + 8Al → 9Fe + 4Al2O3.
Решение:
Реакция 3
Ответ: 3.
- Какая реакция показывает процесс промышленного получения алюминия?
1) AlCl3 + 3K ↔ Al + 3KCl;
2) 2Al2O3 → 4Al + 3O2;
3) Al2(SO4)3 + 3Mg → 2Al + 3MgSO4;
4) Na3AlF6 → 3Na + Al + 3F2.
Решение:
Реакция 2
Ответ: 2.
- Разложение нитрата свинца (II) при нагревании описывается уравнением
1) Pb(NO3)2 → Pb(NO2)2 + O2↑;
2) 3 Pb(NO3)2 → 2Pb(NO3)2 + Pb;
3) Pb(NO3)2 → PbO + N2O5;
4) 4Pb(NO3)2 → 2Pb 2O3 + 8NO2 + O2↑.
Решение:
Cоли азотной кислоты – нитраты, в зависимости от положения в ряду активности металлов, при нагревании разлагаются по схеме:
левее Mg: MeNO3 → MeNO2 + O2↑
Mg – Cu: MeNO3 → MeO + NO2↑ + O2↑
правее Сu MeNO3 → Me + NO2↑ +O2↑
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Ответ: 4.
- Какое из уравнений описывает растворение ртути в 92%-ной серной кислоте при нагревании?
1) Hg + H2SO4 → HgSO4 + H2↑;
2) 2Hg + 3H2SO4 → Hg2(SO4)3 + 3H2↑;
3) Hg + 2H2SO4 → HgSO4 + SO2↑+ 2H2O;
4) 3Hg + 6H2SO4 → Hg2(SO4)3 + 3SO2↑ + 6H2O.
Решение:
Реакция 3
Ответ: 3.
- Растворение цинка в очень разбавленной азотной кислоте описывается уравнением …
1) Zn + 2HNO3 → Zn(NO3)2 + H2↑;
2) Zn + 6HNO3 → 2 Zn(NO3)2 + 3H2↑;
3) 3Zn + 8HNO3 → 3 Zn(NO3)3 + 2NO↑ + 4H2O;
4) 4Zn + 10HNO3 → 4 Zn(NO3)2 + NH4NO3 + 3H2O.
Решение:
Реакция 4
Ответ: 4.
- Сколько (г) оксида железа (III) можно получить, используя кислород, выделяющийся при термическом разложении 17 г нитрата натрия? Ответ округлите до сотых.
1) 10,66; 2) 17,63; 3) 24,57; 4) 34,58.
Решение:
Протекающие реакции:
2NaNO3 = 2NaNO2 + O2↑;
4Fe + 3O2 = 2Fe2O3
М(NaNO3) = 85 г/моль;
М(Fe2O3) = 160 г/моль;
n(NaNO3) = 17/85 = 0,2 моль;
n(O2) = n(NaNO3)/2 = 0,2/2 = 0,1 моль;
3n(Fe2O3) = 2n(O2);
n(Fe2O3) = 2n(O2)/3;
n(Fe2O3) = 2*0,1/3 = 0,0666 моль;
m(Fe2O3) = 160*0,0666 = 10,66г;
- Какая масса (г) пиролюзита (возьмите как MnO2) потребуется для получения 22г марганца алюминотермическим способом?
1) 28,5 2) 34,8 3) 42,6 4) 50,7
Решение:
Протекающие реакции:
4MnO2 = 2Mn2O3 + O2↑;
Mn2O3 + 2Al = 2Mn + Al2O3.
А(Mn) = 55 г/атом;
М(MnO2) = 87 г/моль;
n(Mn) = 22/55 = 0,4 моль;
Из протекающих реакций видно, что, n(MnO2) = n(Mn) = 0,4 моль;
m(MnO2) = 87*0,4 = 34,8г;
Ответ: 2.
- На две пластинки алюминия, очищенные от оксидной пленки, имеющие равные массы, подействовали избытками воды и разбавленной серной кислоты. Как относятся друг к другу объемы выделившегося газа?
1) 1:3; 2) 3:2; 3) 1:1; 4) 2:3.
Решение:
Протекающие реакции:
2Al + 6H2O → 2Al(OH)3↓ + 3H2↑;
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑.
Из стехиометрии реакций видно, что в обоих случаях вступают в реакции по 2 моля аюминия, и получаются по 3 моля водорода. Из этого следует, что в обоих реакциях, в реакции вступят равные массы алюминия и получатся равные объемы водорода, т.е. 3:3, или 1:1.
Ответ: 3.
- Смесь алюминия и неизвестного одновалентного металла обработали избытком соляной кислоты. При этом выделилось 13,44л водорода (н.у.), и масса металлов уменьшилась в два раза. При последующей обработке оставшегося вещества азотной кислотой выделилось 1г оксида азота (I). Каково молярное соотношение между алюминием и неизвестным металлом?
1) 3:2; 2) 4:1; 3) 1:2; 4) 3:4.
Решение:
Протекающие реакции:
2Al + 6HCl = 2AlCl3 + 3H2↑;
3Me + 4HNO3 = 3MeNO3 + 2H2O + NO↑.
n(H2) = 13,44/22,4 = 0,6 молей;
Из стехиометрии реакций видно, что
3n(Al) = 2n(H2)
n(Al) = 2n(H2)/3 = 0,6*2/3 = 0,4 моля;
А(Al) = 27 г/атом;
m(Al) = 0,4*27 = 10,8г;
Значит, неизвестного одновалентного металла тоже было 10,8г.
М(NO) = 30 г/моль;
n(NO) = 1/30 = 0,0333 моль;
n(Me) = 3n(NO) = 0,0999 ≈ 0,1 моль;
n(Al): n(Me) = 0,4:0,1 = 4:1.
Ответ: 2.
- Какой объем (мл) 0,5 М раствора серной кислоты потребуется для поной нейтрализации продукта растворения 7,8г пероксида натрия в избытке горячей воды?
1) 300; 2) 100; 3) 200; 4) 400.
Решение:
Протекающие реакции:
2Na2O2 + 2H2O (гор.) = 4NaOH + O2↑;
2NaOH + H2SO4 = Na2SO4 + 2H2O;
М(H2SO4) = 98 г/моль;
М(Na2O2) = 78 г/моль;
М(NaOH) = 40 г/моль;
n(Na2O2) = 7,8/78 = 0,1 моль;
n(NaOH) = 2n(Na2O2) = 0,1*2 = 02 моля;
n(H2SO4) = n(NaOH)/2 = 0,2/2 = 0,1 моль;
V(H2SO4) = 1000*0,1/0,5 = 200 мл.
Ответ: 2.
- С уменьшением атомной массы щелочных металлов от Cs к Li происходит:
1) уменьшение восстановительных свойств;
2) увеличение радиуса атома;
3) уменьшение электроотрицательности;
4) уменьшение энергии ионизации.
Решение:
С уменьшением атомной массы щелочных металлов от Cs к Li происходит уменьшение восстановительных свойств. При таком переходе, уменьшаются радиусы атомов, увеличиваются электроотрицательности и энергии ионизации атомов.
Ответ: 1.
- Щелочные металлы, в основном, получают:
1) восстановлением оксида водородом;
2) электролизом растворов солей;
3) электролизом растворов щелочей;
4) электролизом расплавов солей.
Решение:
Щелочные металлы, в основном, получают электролизом расплавов солей.
Ответ: 4.
Это был у нас урок химии 109 — Задачи и упражнения по металлам с решениями.
Подружитесь со мной:
Способы определения молекулярной формулы оксида и элемента металла, образующего данный оксид
Задача 115.
Некоторый элемент образует оксид вида Э2О3, где Э — неизвестный элемент. Массовая доля кислорода в нем составляет 30,08% . Определите элемент и формулу оксида.
Дано: формула оксида: Э2О3; массовая доля кислорода в оксиде: (О) = 30,08%.
(О) = 30,08%.
Найти: элемент и формулу оксида.
Решение:
Для выявления неизвестного элемента необходимо определить его молярную массу, по которой, пользуясь Периодической системой Д.И.Менделеева, возможно найти неизвестный элемент.
I способ (последовательно-разветвленный алгоритм).
Схематично этот алгоритм можно изобразить так:
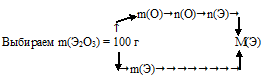
1) Произвольно выбираем некоторую массу образца. Наиболее удобная масса — 100 г, т.к. в условии фигурирует массовая доля. Тогда в 100 г Э2О3 содержится 30,08 г кислорода.
2) По разности находим массу неизвестного элемента:
m(Э) = 100 – m(О) = 100 – 30,08 = 69,92 г содержится в выбранном образце Э2О3.
3) Находим количество вещества атомарного кислорода:
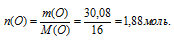
4) По известной общей формуле Э2О3 вычисляем количество вещества атомов неизвестного элемента. На каждые 3 моль атомов кислорода приходится 2 моль атомов неизвестного элемента.
Составим пропорцию:
3 моль атомов кислорода приходится на 2 моль атомов Э
1,88 моль атомов кислорода приходится на х моль атомов Э.
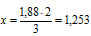 атомов элемента содержится в выбранном образце Э2О3.
атомов элемента содержится в выбранном образце Э2О3.
5) Теперь находим молярную массу атомов неизвестного элемента:
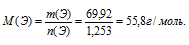
По таблице Д. И. Менделеева находим элемент, имеющий молярную массу 55,8 г/моль. Подходит железо. Этот элемент действительно проявляет степень окисления (+3) и образует оксид Fе2О3.
II способ (встречный алгоритм).
Схематично алгоритм можно изобразить таким образом:

Применим предложенный алгоритм.
1) Записываем выражение для молярной массы Э2О3:
М(Э2О3) = М(Э) . 2 + М(О) . 3 = (М(Э) . 2 + 48) г/моль.
2) Выбираем массу образца Э2О3, соответствующую 1 моль вещества. Она составит m(Э2О3) = (M(Э) . 2 + 48) г. Масса кислорода в этом образце будет 48 г.
3) Записываем выражение для массовой доли кислорода в выбранном образце:
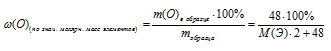
4) Приравниваем полученное выражение к значению массовой доли кислорода из условия:
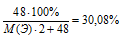
Получили одно уравнение с одним неизвестным М(Э). Решаем его и получаем М(Э) = 55,8 г/моль.
По таблице Д.И. Менделеева находим элемент, имеющий молярную массу 55,8 г/моль. Подходит железо. Этот элемент действительно проявляет степень окисления (+3) и образует оксид Fе2О3.
Ответ: искомый элемент — железо, формула Fе2О3.
Напишите мини-сочинение на тему школьных дней (на английском), по плану вступление,преимущества(школы),недостатки(школы),итог. Используя данные выражения: Some of the advantages:
to become smarter, to develop your mind, to take part in school activities, to have good sports facilities, to have good and experienced teachers, to have interesting school traditions, to develop your imagination, to study interesting subjects, to learn new things, to prepare for adult life, to have a lot of friends, to enjoy school life and friendship…
Some of the disadvantages:
not to need so much knowledge, to have no time for sports and hobbies, to get up early in the morning every day, to be tired of doing homework, to work too hard, not to be allowed to do what you want to, to have boring lessons, to be afraid of some teachers, to have too many extra subjects, to worry about getting good marks, to have many tests, school has nothing to do with real life…
