Вспоминаем формулу: A = N + Z, где N – число протонов, A – массовое число, Z – заряд ядра атома (число протонов или порядковый номер элемента). Число электронов численно равно заряду ядра или порядковому номеру элемента.
Натрий (Na)
A = 23, Z = 11
N = 23 – 11 = 12
Ответ: 11 протонов, 11 электронов и 12 нейтронов.
Фосфор (P)
A = 31, Z = 15
N = 31 – 15 = 16
Ответ: 15 протонов, 15 электронов и 16 нейтронов.
Золото (Au)
A = 197, Z = 79
N = 197 – 79 = 118
Ответ: 79 протонов, 79 электронов, 118 нейтронов.
Если это не совсем понятно, рекомендую мануал как определить число протонов и нейтронов в атоме
Лабораторный опыт № 3
1. Какие научные эксперименты доказали, что атом – сложная частица, что он делим?
3. Пользуясь этимологическим словарём, объясните, почему планетарную модель строения атома, предложенную Э. Резерфордом, называют также нуклеарной. Почему протоны и нейтроны вместе называют нуклонами?
4. Порядковый номер элемента в таблице Д. И. Менделеева равен 35. Какой это элемент? Чему равен заряд ядра его атома? Сколько протонов, электронов и нейтронов в его атоме?
5. На уроках биологии вы рассматривали клетки растений, используя световой микроскоп. Каков принцип действия этого микроскопа?
6. Что выступает в роли аналога света в сканирующем микроскопе? Каков принцип действия этого микроскопа?
7. Что такое нанотехнологии? Почему эта отрасль науки и производства получила такое название?
помогите мне по химии. определите число протонов, электронов и нейтронов в атомах элементов: натрия,фосфора,золота.
Ученик
(79),
закрыт
9 лет назад
Дополнен 11 лет назад
ПОРЯДКОВЫЙ НОМЕР ЭЛЕМЕНТА В ТАБЛИЦЕ Д. И. МЕНДЕЛЕЕВА РАВЕН 35.КАКОЙ ЭТО ЭЛЕМЕНТ? ЧЕМУ РАВЕН ЗАРЯД ЯДРА ЕГО АТОМЕ? СКОЛЬКО ПРОТОНОВ, ЭЛЕКТРОНОВ И НЕЙТРОНОВ В ЕГО АТОМЕ?
NiNa Martushova
Искусственный Интеллект
(153324)
11 лет назад
Берешь таблицу Менделеева и смотришь на порядковый номер элемета, -это и есть заряд ядра или число протонов в ядре. У натрия он 11,значит в его ядре 11 протонов. Поскольку атом заряда не имеет, значит число протонов равно числу электронов. +11-11=0. Здесь же находим массу атома натрия, она равна 23. Вся масса атома соредоточена в ядре и равна сумме протонов и нейтронов в ядре, значит в ядре атома натрия содержится 23-11=12нейтронов. Сделай тоже самое с фосфором и золотом. Удачи!
На чтение 12 мин Просмотров 2.4к. Опубликовано 28.04.2022
Фосфор — пятнадцатый элемент периодической таблицы. Фосфор — элемент 15-й группы. Его символ — «P». Через свои валентные электроны фосфат образует связи. В этой статье подробно объясняются валентные электроны для фосфора (P). Существуют две основные формы элементарного фосфора: белая и красная. Однако он очень реакционноспособен, поэтому фосфор не может быть найден в свободном виде на Земле. Он содержится в земной коре на уровне примерно одного грамма на килограмм (сравните с медью, которая составляет около 0,06 грамма). Фосфор является наиболее распространенной формой фосфора в минералах.
Содержание
- Истории
- Использование
- Влияние фосфора на здоровье
- Положение фосфора в периодической таблице.
- Аллотропы фосфора
- Белый фосфор
- Фиолетовый фосфор
- Черный фосфор
- Красный фосфор
- Природное изобилие
- Биологическая роль
- Каковы валентные электроны фосфора (P)?
- Каким числом электронов, протонов и нейтронов обладает P (фосфор)?
- Как найти число валентных нейтронов в атоме фосфора (Р)?
- Расчет количества электронов в фосфоре (P)
- Вам нужно будет выполнить электронную конфигурацию фосфора (P)
- Рассчитайте общее количество электронов и определите валентную оболочку
- Образование соединений фосфора (P)
- Каким числом валентных электронов обладает ион фосфора (P 3)?
- Какова валентность фосфора (P)?
- Факты о фосфоре:
- Рекомендации:
Истории
Арабские алхимики XII века могли случайно выделить элементарный фосфор, но записи не ясны. Хенниг Бранд был немецким купцом, открывшим фосфор в 1669 году. Его хобби была алхимия. 50 ведер мочи оставили для брожения, пока Бранд, немецкий купец, не позволил им остаться. Затем он нагрел пасту с песком, чтобы извлечь элементарный фосфор. В письме Готфриду Вильфрид Лейбниц Бранд сообщил о своем открытии. Впоследствии общественный интерес вызвала демонстрация способности элемента светиться в темноте или «фосфоресцировать» и последующие письма. Фосфор был химической диковинкой в течение столетия, пока не было обнаружено, что он входит в состав кости.
Использование
Белый фосфор можно использовать в сигнальных ракетах или зажигательных устройствах. Красный фосфор можно найти в спичечных коробках, приклеенных к бокам. Этот материал используется для зажигания безопасных спичек, чтобы они не зажглись. Удобрения являются наиболее распространенным применением соединений фосфора. Фосфатные руды являются основой фосфорнокислого аммония. Перед превращением в аммоний из руды производят фосфат.
Производство стали также зависит от фосфатов. Хотя фосфаты входят в состав моющих средств, в некоторых странах они постепенно выводятся из употребления. Они могут вызвать высокий уровень фосфатов в воде, что может привести к нежелательному росту. Также фосфаты используются при изготовлении тонкой фарфоровой посуды и специальных стекол.
Влияние фосфора на здоровье
Источником фосфора в окружающей среде чаще всего являются фосфаты. Поскольку фосфаты являются важной частью ДНК и распределения энергии, фосфоты являются важными веществами в организме человека. Кроме того, фосфаты распространены в растениях.
Природные запасы фосфатов резко изменились благодаря использованию человеком богатого фосфатами навоза и фосфатсодержащих моющих средств. Различные продукты питания, такие как сыр, колбасы и ветчина, также обрабатывались фосфатами.
Фосфаты должны быть частью вашего ежедневного рациона. Рекомендуемая доза составляет 800 мг в день. Нормальная диета обеспечивает от 1000 до 2000 мг в день в зависимости от того, сколько продуктов, богатых фосфатами, потребляется.
Положение фосфора в периодической таблице.
Аллотропы фосфора
Белый фосфор
Белый фосфор, самая опасная аллотропная форма этого элемента, — белый фосфор. Это полупрозрачное воскообразное вещество, которое светится в темноте. Белый фосфор может самовозгораться на воздухе. Контакт с кожей может вызвать сильные ожоги. Белый фосфор может гореть и образовывать пятиокись фосфора.
Белый фосфор может быть чрезвычайно опасным и причинить серьезный вред или даже смерть. Под воздействием тепла и света он медленно превращается в красный фосфор. Вот почему белый фосфор часто кажется желтым.
Четыре атома фосфора соединены друг с другом в замкнутые кольца ковалентными связями в молекулах белого фосфора. Эта конфигурация создает напряжение в молекуле и объясняет ее высокие реакционные свойства.
Фиолетовый фосфор
Фиолетовый фосфор является наиболее реакционноспособным из аллотропов. Медленно реагирует на галогены. Он выглядит почти полностью черным, но слегка пурпурным кристаллическим твердым веществом.
Нагревание красного фосфора или растворение белого фосфора расплавленным свинцом может создать фиолетовый фосфор. Ученые продолжают изучать его решетчатую структуру методами рентгеновской дифракции.
Черный фосфор
Красный фосфор имеет более высокий уровень реакционной способности, чем черный фосфор. Черный фосфор выглядит как черное блестящее кристаллическое твердое вещество. Эти молекулы состоят из кристаллических решеток, которые образуются за счет соединения существующих связей PP-P.
Черный фосфор бывает двух видов: а-черный и б-черный. Нагревание красного фосфора приводит к образованию более стабильной формы. Последний, более реакционноспособный, может быть синтезирован путем нагревания белого фосфора под высоким давлением.
Эта конфигурация придает черному фосфору большую степень стабильности из-за более высокого валентного угла. Черный фосфор является менее реакционноспособным аллотропом, чем сера, кислород и галогены.
Красный фосфор
Этот аллотроп более токсичен, чем его аналог. Выглядит как порошкообразная, красноватая, блестящая субстанция. Красный фосфор обладает большей устойчивостью и менее опасен, чем белый. Вы можете извлечь его из небольшого количества полосок на спичечных коробках.
Красный фосфор образуется, когда кольца белого фосфора полимеризуются через ковалентные связи с образованием прямых цепей. Эти цепи снижают внутримолекулярное напряжение и снижают реакционную способность.
| атомный номер | 15 |
|---|---|
| атомный вес | 30.9738 |
| точка кипения (белый) | 280 ° С (536 ° F) |
| температура плавления (белый) | 44,1 ° С (111,4 ° F) |
| плотность (белый) | 1,82 г/см 3 при 20 °C (68 °F) |
| степени окисления | −3, +3, +5 |
| электронная конфигурация | 1 с 2 2 с 2 2 т 6 3 с 2 3 т 3 |
Природное изобилие
Хотя фосфат часто встречается в природе в сложных смесях, его также часто можно найти в минеральных соединениях. Фосфор в больших количествах встречается и в США, в том числе в фосфатных породах. Возможно, пик фосфора мы увидим примерно в 2050 году.
В промышленной печи белый фосфор можно нагревать в фосфоритах с добавлением кремнезема и углерода. Это создает пары фосфора, которые затем собираются под водой. В отсутствие воздуха красный фосфор можно получить, осторожно нагревая белый фосфор до 250°C.
Биологическая роль
Все живые существа нуждаются в фосфатах. Это основа ДНК, сахаро-фосфатной структуры РНК. Он необходим для передачи энергии в клетках, как часть АТФ (аденозинтрифосфата). Его также можно найти во многих биологически важных молекулах. Поскольку наши кости и зубы в основном состоят из фосфата кальция, мы потребляем около 1 грамма в день. Мы также храним около 750 граммов его в нашем теле. Чрезмерное использование удобрений и моющих средств может привести к быстрому росту водорослей и загрязнению рек и озер. Водоросли блокируют свет, препятствуя дальнейшему фотосинтезу. Озеро вскоре умирает от избытка кислорода в воде.
P — второй элемент в группе 15. Общее количество электронов на последней орбите называется валентным электроном. Валентные электроны (P) – это общее количество электронов, оставшихся в оболочке после завершения электронной конфигурации. Свойства и образование связей контролируются валентными электронами. P — пятнадцатый элемент периодической таблицы.
Каким числом электронов, протонов и нейтронов обладает P (фосфор)?
Ядро можно найти в середине атома. Ядро является домом для протонов и нейтронов. 15. Число протонов в атоме фосфора называется атомным номером. Число протонов в фосфоре равно пятнадцати. Ядро содержит круглую оболочку, содержащую электроны, равные протонам. Атом фосфора состоит из 15 электронов.
Разница между числом атомных масс и числом атомов определяет число нейтронов в элементе. Это означает, что число нейтронов (n) = атомная масса (A) + атомный номер (Z).
Мы знаем, что атомное количество фосфора (n) равно 15, а его атомная масса равна 31 (30,97376200u). Нейтрон (n) = 31 – 15 = 16. Следовательно, число нейтронов в фосфоре (P) равно 16.
Валентность – это способность атома химического элемента образовывать определенное количество химических связей с другими атомами. Он принимает значения от 1 до 8 и не может быть равен 0. Он определяется количеством электронов атома, потраченных на образование химических связей с другим атомом. Валентность является реальной ценностью. Числовые значения валентности обозначены римскими цифрами (I,II,III,IV,V,VI,VII,VIII).
Как найти число валентных нейтронов в атоме фосфора (Р)?
Выполнив несколько шагов, вы сможете определить валентные электроны. Одной из них является электронная конфигурация. Без электронной конфигурации невозможно определить валентность электрона. Легко найти значение электронов для всех элементов, зная электронную конфигурацию. На этом сайте есть статья, в которой объясняется конфигурация электрона. Вы можете найти это здесь. Эта статья посвящена электронной конфигурации.
Однако можно идентифицировать валентные электроны, размещая электроны по принципу Бора. Теперь мы узнаем, как определить валентный электрон для фосфора (P).
Расчет количества электронов в фосфоре (P)
Во-первых , нам нужно знать общее количество электронов в атоме фосфора (P). Вам нужно знать, сколько протонов в фосфоре, чтобы определить число электронов. Чтобы узнать количество протонов, вы должны знать атомный номер элемента фосфора.
Периодическая таблица необходима для определения атомного номера. Периодическая таблица содержит атомные номера элементов фосфора (P). Число протонов называется атомным номером. Ядро также содержит электроны, равные протонам. Это означает, что количество электронов равно числу протонов в атоме фосфора. Атомный номер фосфора по периодической таблице равен 15. Это означает, что атом фосфора содержит пятнадцать электронов.
Термины « степень окисления » и « валентность » могут не совпадать, но численно они почти идентичны. Условный заряд атома атома называется степенью окисления. Он может быть как положительным, так и отрицательным. Валентность относится к способности атома образовывать связи. Он не может иметь отрицательное значение.
Вам нужно будет выполнить электронную конфигурацию фосфора (P)
Важный шаг 2. Этот шаг включает в себя расположение электронов для фосфора (P). Атом фосфора содержит пятнадцать электронов. Электронная конфигурация фосфора показывает, что в оболочке K есть два электрона, внутри оболочки L восемь и пять в оболочке M (орбита). Первая оболочка фосфора (P) имеет два электрона, тогда как вторая оболочка имеет восемь, а третья оболочка имеет пять электронов. В каждой оболочке фосфора 2,8 электрона. Электронная конфигурация фосфора на суборбите: 1s 2 2s 2 2p 6 3s 2 3p 3 . На этом сайте есть статья, в которой объясняется электронная конфигурация фосфора (P). Можете прочитать, если интересно.
Рассчитайте общее количество электронов и определите валентную оболочку
Третий шаг — определение орбиты валентной оболочки. Валентная оболочка является последней оболочкой после электронной конфигурации. Валентный электрон — это общее количество электронов, находящихся на валентной оболочке. Электронная конфигурация фосфора указывает на то, что последняя оболочка имеет пять электронов. Валентных электронов фосфора (P) пять.
- Валентность — числовая характеристика способности атомов данного элемента связываться с другими атомами.
- Валентность водорода постоянна и равна единице.
- Валентность кислорода также постоянна и равна двум.
- Валентность большинства других элементов непостоянна. Его можно определить по формулам их бинарных соединений с водородом или кислородом.
Образование соединений фосфора (P)
Через свои валентные электроны фосфат(Р) участвует в образовании связей. Этот валентный электрон участвует в образовании связей с атомами других элементов. Делясь электронами с другими элементами, атомы фосфатов создают связи. Электронная конфигурация хлора указывает на то, что в хлоре имеется семь стоимостных электронов. Разделяя электроны, три атома хлора образуют соединения трихлорида фосфора (PCl 3 ).
Таким образом, атом фосфора (P) завершает свою октаву и приобретает электронную конфигурацию аргона. Электронная конфигурация аргона также приобретается хлором.
Один элемент фосфора делит электроны с тремя атомами хлора, образуя сложный трихлорид фосфора (PCl 3 ). Это делается путем образования ковалентной связи. Трихлорид фосфора (PCl 3 ) имеет ковалентную связь.
Каким числом валентных электронов обладает ион фосфора (P 3 )?
При образовании связи элементы с 5, 6 или 7 электронами на последних оболочках получают электроны от содержащих их оболочек. Анионы – это элементы, которые имеют электроны и могут образовывать связи. Фосфор (P) является примером анионного элемента. Последняя оболочка фосфора принимает электроны при образовании связи и превращает их в фосфор (P 3 ).
ион(P 3- ) электронная конфигурация 1s 2 2s 2 2p 6 3s 2 3p 6 . Электронная конфигурация фосфора показывает, что ион имеет три оболочки, а третья оболочка содержит восемь электронов. Эта электронная конфигурация показывает, что фосфор имеет электронное расположение аргона. В данном случае валентность ионов фосфора (P 3 ) была равна -3. Валентные электроны фосфора (P 3 ) имеют восемь электронов, так как оболочка, содержащая последний изозон фосфора, имеет восемь.
Какова валентность фосфора (P)?
Валентность (или валентность) — это способность атома элемента присоединяться к другому атому при образовании молекулы. Валентность — это количество неспаренных электронов, находящихся на последней орбите элемента. Электронная конфигурация основного состояния фосфора: 1s 2 2s 2 2p 6 3s 1 3p x 1 3p y 1 3p z 1 3d xy 1 . Эта электронная конфигурация показывает, что на последней орбите фосфора присутствуют три неспаренных электрона. Таким образом, валентность атома фосфора равна 3.
Электронная конфигурация элемента в возбужденном состоянии определяет его ценность. В возбужденном состоянии электронная конфигурация фосфора (P*) будет иметь вид 1s 2 2s 2 2p 6 3s 1 3p x 1 3p y 1 3p z 1 3d xy 1 . Эта электронная конфигурация показывает нам, что последняя оболочка, содержащая атом фосфора, содержит пять неспаренных электронов. Образование связи определяет валентность фосфора.
Таким образом, валентность фосфора равна 5.
Факты о фосфоре:
- Седьмой наиболее часто встречающийся элемент – фосфор.
- Хенниг Бранд выделил фосфор из своей мочи. Вместо того, чтобы хранить свой секрет, он решил сделать процесс доступным для других алхимиков. Французская академия наук продала его процесс, сделав его более известным.
- Зеленое свечение возникает при окислении на воздухе белого фосфора. Хотя «фосфоресценция» используется для описания свечения элемента, на самом деле это относится только к его окислению. Хемилюминесценция – это свечение фосфора.
- Шестой по распространенности элемент в организме человека – фосфор.
- Фосфор, восемнадцатый по распространенности элемент в морской воде, также известен как фосфор.
- Метод Карла Вильгельма Шееле для извлечения фосфора из костей заменил метод Брэнда.
- Белый фосфор использовался в первых матчах. Когда рабочие подвергались чрезмерному воздействию, эта практика приводила к болезненной и изнурительной деформации челюстной кости, называемой «фосси».
Рекомендации:
- Мэри Эльвира Уикс, Открытие элементов. II. Элементы, известные алхимикам J. Chem. образования., 1932.
- Мэри Эльвира Уикс, Открытие элементов. XXI. Дополнительное примечание об открытии фосфора J. Chem. образования., 1933.
- Эгон Виберг; Нильс Виберг; Арнольд Фредерик Холлеман (2001). Неорганическая химия . Академическая пресса.
- Эллис, Бобби Д.; Макдональд, Чарльз Л.Б. (2006). «Йодид фосфора (I): универсальный реагент метатезиса для синтеза соединений фосфора с низкой степенью окисления». Неорганическая химия .
- Ван, Южун; Се, Яомин; Вэй, Пингронг; Кинг, Р. Брюс; Шефер, III; Шлейер, Пол против Р.; Робинсон, Грегори Х. (2008). «Карбен-стабилизированный дифосфор». Журнал Американского химического общества .
Автор статьи — профессиональный репетитор И. Давыдова (Юдина).
Атом — в переводе с древнегреческого – неделимый — это наименьшая частица химического элемента, являющаяся носителем его свойств. Современные представления о строении атома требуют для понимания знаний основ квантовой механики, поэтому мы ограничимся упрощенной моделью.
Атом состоит из ядра (в составе которого протоны и нейтроны) и электронов.
Количество протонов равно количеству электронов и равно номеру атома в периодической таблице. Число нейтронов равно разности атомной массы и номера элемента.
Бор – пятый элемент периодической таблицы, в его атоме 5 протонов и 5 электронов. Атомная масса ≈ 11, количество нейтронов равно 11 – 5 = 6.
Элементы, имеющие одинаковое количество протонов в ядре, но различающиеся числом нейтронов, называются изотопами.
Например, 35Cl и 37Cl – изотопы, различающиеся атомной массой и количеством нейтронов.
Вокруг ядра по различным траекториям — орбиталям движутся электроны.
Энергия орбиталей на уровнях и подуровнях изменяется следующим образом: 1s < 2s < 2р < Зs < Зр < 4s < 3d < 4р < 5s <4d < 5р < 6s < 4f ≈ 5d < 6p < 7s < 5f ≈6d < 7p . (●)
Перед оставшимися двумя принципами введем понятие спина электрона.
Рассмотрим заполнение орбиталей электронами на нескольких примерах. У каждого следующего элемента таблицы Менделеева на один протон и один электрон больше, чем у предыдущего. У элементов n-го периода заполнены предыдущие n-1 электронные уровни.
— магний – двенадцатый элемент, имеет по 12 протонов и электронов. Распределим эти электроны в соответствии с (●), не забывая, что на каждом подуровне может быть не более двух электронов.
Магний – элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены — 1s22s22p6.Магний находится во второй группе, значит, на третьем уровне у него два электрона — 3s2. Итого получаем1s22s22p63s2.
В атоме магния в основном состоянии нет неспаренных электронов.
Если атому сообщили дополнительную энергию (например, нагрели), то электронная пара может распарится и один из электронов переходит на свободную орбиталь того же энергетического уровня. В возбужденном состоянии атом магния имеет два неспаренных электрона и может образовать две связи (валентность II).
— фосфор – пятнадцатый элемент, распределяем 15 электронов: Фосфор — элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены — 1s22s22p6.Фосфор находится в пятой группе, значит, на третьем уровне у него пять электронов — 3s23p3.
В атоме фосфора в основном состоянии 3 неспаренных электрона. В возбужденном состоянии атом фосфора имеет пять неспаренных электронов и может образовать пять связей (валентность V).
— цирконий – сороковой элемент, распределяем 40 электронов. Цирконий — элемент пятого периода, следовательно, первые четыре энергетических уровня полностью заполнены — 1s22s22p63s23p64s23d104p6.Заполнение пятого уровня начинается с 5s2. Цирконий – второй d – элемент в пятом периоде, значит, он содержит 2 электрона на 4d – подуровне. Итого получаем: 1s22s22p63s23p64s23d104p65s24d2.
В атоме циркония в основном состоянии 2 неспаренных электрона.
В возбужденном состоянии цирконий имеет четыре неспаренных электрона.
Исключениями из общего порядка заполнения электронных подуровней являются хром, марганец, медь, серебро и золото – у них наблюдается «провал» электрона с внешного s – подуровня на предвнешний d. Например, электронные конфигурации хрома и меди вместо 4s23d4 и 4s23d9 имеют вид 4s13d5 и 4s13d10.
Фосфор — Протоны — Нейтроны — Электроны
Фосфор как элемент существует в двух основных формах — белый фосфор и красный фосфор, но из-за его высокой реакционной способности фосфор никогда не встречается на Земле в свободном виде.
Подавляющее большинство добываемых соединений фосфора потребляется в качестве удобрений. Фосфат необходим для замены фосфора, который растения удаляют из почвы, и его ежегодная потребность растет почти в два раза быстрее, чем рост населения.
Преобладающим источником фосфора в наше время является фосфатная порода (в отличие от предшествующего гуано).
Протоны и нейтроны в фосфоре
Фосфор — это химический элемент с атомным номером 15 , что означает, что в его ядре 15 протонов.
Общее число нейтронов в ядре атома называется числом нейтронов атома и обозначается символом N . Число нейтронов плюс атомный номер равняется атомному массовому числу: N+Z=A . Разница между числом нейтронов и атомным номером известна как избыток нейтронов : D = N – Z = A – 2Z.
Для стабильных элементов обычно используется множество стабильных изотопов. Изотопы — это нуклиды с одинаковым атомным номером и, следовательно, одним и тем же элементом, но различающиеся числом нейтронов. Массовые числа типичных изотопов Фосфора равны 31.
Основные изотопы Фосфора
23 известны изотопы фосфора в диапазоне от 25P до 47P.
Фосфор-31 состоит из 15 протонов, 16 нейтронов и 15 электронов. Полуцелый ядерный спин и высокое содержание 31P делают спектроскопию ЯМР фосфора-31 очень полезным аналитическим инструментом при исследовании фосфорсодержащих образцов.
Фосфор-32 состоит из 15 протонов, 17 нейтронов и 15 электронов. 32 P, бета-излучатель (1,71 МэВ) с периодом полураспада 14,3 дня, который обычно используется в медико-биологических лабораториях, в основном для производства ДНК- и РНК-зондов с радиоактивной меткой.
Фосфор-33 состоит из 15 протонов, 18 нейтронов и 15 электронов. 33P, бета-излучатель (0,25 МэВ) с периодом полураспада 25,4 дня. Он используется в медико-биологических лабораториях в приложениях, в которых выгодны более низкие энергетические бета-излучения, таких как секвенирование ДНК.
Стабильные изотопы
Типичные нестабильные изотопы
Электроны и электронная конфигурация
Количество электронов в электрически нейтральном атоме равно количеству протонов в ядре.
Поскольку количество электронов и их расположение ответственны за химическое поведение атомов, атомный номер идентифицирует различные химические элементы. Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Электронная конфигурация Фосфора : [Ne] 3s2 3p3 .
Возможные степени окисления +3,5/-3 .
Как элемент, фосфор существует в двух основных формах — белый фосфор и красный фосфор — но поскольку он очень реактивен, фосфор никогда не встречается на Земле в виде свободного элемента.
Наиболее распространенное соединение фосфора
Фосфорная кислота — это слабая кислота с химической формулой H 3 PO 4 . Пищевая фосфорная кислота используется для подкисления пищевых продуктов и напитков, таких как различные колы и джемы, для придания им острого или кислого вкуса. Безалкогольные напитки, содержащие фосфорную кислоту, в том числе кока-колу, иногда называют фосфатными газированными напитками или фосфатами.
О протонах
Протон — это одна из субатомных частиц, составляющих материю. Во Вселенной много протонов, составляющих около половины всей видимой материи. Он имеет положительный электрический заряд (+1e) и массу покоя, равную 1,67262 × 10 −27 кг ( 938,272 МэВ/с 2 ) — немного легче, чем у нейтрона, но почти в 1 836 раз больше, чем у нейтрона.
Протоны существуют в ядрах обычных атомов вместе с их нейтральными аналогами, нейтронами. Нейтроны и протоны, обычно называемые нуклонов связаны друг с другом в атомном ядре, где они составляют 99,9% массы атома. Исследования в области физики частиц высоких энергий в 20 веке показали, что ни нейтрон, ни протон не являются мельчайшими строительными блоками материи.
О нейтронах
Нейтрон – это одна из субатомных частиц, из которых состоит материя. Во Вселенной много нейтронов, составляющих больше половины всей видимой материи. не имеет электрического заряда и имеет массу покоя, равную 1,67493 × 10-27 кг, что немного больше, чем у протона, но почти в 1839 раз больше, чем у электрона. Нейтрон имеет средний квадратный радиус около 0,8 × 10–15 м или 0,8 фм и является фермионом со спином ½.
Атомные ядра состоят из протонов и нейтронов, которые притягиваются друг к другу ядерной силой , а протоны отталкиваются друг от друга электрической силой благодаря своему положительному заряду. Эти две силы конкурируют, что приводит к различной устойчивости ядер. Существуют только определенные комбинации нейтронов и протонов, которые образуют стабильных ядер .
Нейтроны стабилизируют ядро , потому что они притягивают друг друга и протоны , что помогает компенсировать электрическое отталкивание между протонами. В результате, по мере увеличения числа протонов для формирования стабильного ядра требуется возрастающее отношение нейтронов к числу протонов . Если нейтронов слишком много или слишком мало для данного количества протонов, полученное ядро не является стабильным и подвергается радиоактивному распаду. Нестабильные изотопы распадаются по различным путям радиоактивного распада, чаще всего альфа-распаду, бета-распаду или захвату электронов.
Об электронах и электронной конфигурации
Периодическая таблица представляет собой табличное отображение химических элементов, организованных на основе их атомных номеров, электронных конфигураций и химических свойств. Электронная конфигурация — это распределение электронов атома или молекулы (или другой физической структуры) на атомных или молекулярных орбиталях. Знание электронная конфигурация различных атомов полезна для понимания структуры периодической таблицы элементов.
Каждое твердое тело, жидкость, газ и плазма состоят из нейтральных или ионизированных атомов. Химические свойства атома определяются количеством протонов, фактически количеством и расположением электронов .
Это принцип запрета Паули , который требует, чтобы электроны в атоме занимали разные энергетические уровни вместо того, чтобы все они конденсировались в основном состоянии. Упорядочивание электронов в основном состоянии многоэлектронных атомов начинается с самого низкого энергетического состояния (основного состояния) и постепенно перемещается оттуда вверх по энергетической шкале, пока каждому из электронов атома не будет присвоен уникальный набор квантовых чисел. Этот факт имеет ключевое значение для построения периодической таблицы элементов.
Первые два столбца в левой части таблицы Менделеева занимают s подоболочки.
Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Электронная конфигурация может быть представлена в виде основных электронов, эквивалентных благородному газу предыдущего периода, и валентных электронов (например, [Xe] 6s2 для бария).
Степени окисления
Степени окисления обычно представляются целыми числами, которые могут быть положительными, нулевыми или отрицательными.
Текущее определение степени окисления в Золотой книге ИЮПАК:
«Степень окисления атома — это заряд этого атома после ионной аппроксимации его гетероядерных связей…»
, и термин «степень окисления» является почти синонимом. Элемент, который не сочетается ни с какими другими элементами, имеет степень окисления 0. Степень окисления 0 встречается у всех элементов — это просто элемент в его элементарной форме. Атом элемента в соединении будет иметь положительную степень окисления, если у него удалены электроны. Точно так же добавление электронов приводит к отрицательной степени окисления. Мы также различаем возможные и распространенные степени окисления каждого элемента. Например, кремний имеет девять возможных целочисленных степеней окисления от -4 до +4, но только -4, 0 и +4 являются обычными степенями окисления.
Сводка
| Элемент | Фосфор |
| Количество протонов | 15 |
| Число нейтронов (типичные изотопы) | 31 |
| Число электронов | 15 |
| Электронная конфигурация | [Не] 3s2 3p3 |
| Степени окисления | +3,5/-3 |
Источник: www.luciteria.com
Свойства других элементов
Другие свойства фосфора
Сколько протонов, нейтронов и электронов имеет фосфор?
Фосфор является классифицированным неметаллическим элементом, и его символ P. Фосфор является 15-м элементом периодической таблицы, поэтому его атомный номер равен 15.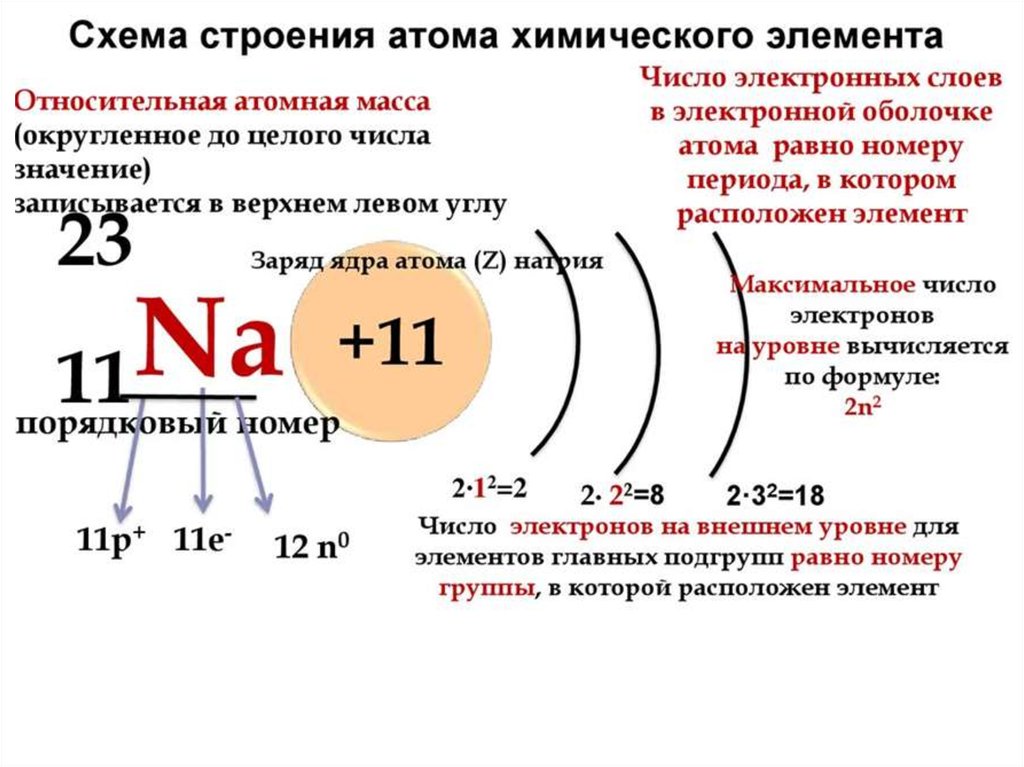
Разница между массовым числом атома фосфора и числом протонов равна шестнадцати. Следовательно, атом фосфора имеет шестнадцать нейтронов. Количество нейтронов зависит от изотопа элемента. Атом фосфора имеет один стабильный изотоп.
| Element Name | Phosphorus |
| Symbol | P |
| Atomic number | 15 |
| Atomic weight (average) | 30.974 |
| Protons | 15 |
| Neutrons | 16 |
| Electrons | 15 |
| Group | 15 |
| Period | 3 |
| Block | p-блок |
| Электроны на оболочку | 2, 8, 5 |
| Электронная конфигурация | [Ne] 3s 2 3p 5 3
40215 |
| Степени окисления | +5, +3, -3 |
Свойства атома фосфора
В этой статье подробно обсуждалось, как легко найти число протонов, нейтронов и электронов в атоме фосфора.
Содержание
Где находятся электроны, протоны и нейтроны в атоме?
Атом – это мельчайшая частица элемента, которая не существует самостоятельно, но непосредственно участвует в химических реакциях как мельчайшая единица. Атомы настолько малы, что их невозможно увидеть даже под мощным микроскопом. Диаметр атома водорода составляет 0,1 нм (1,0 нм = 10 — 9 м). Таким образом, если 1000 миллионов атомов водорода расположить рядом друг с другом, его длина составит 1 метр.
Атомная структура атома
Однако стало возможным обнаружить атомы, увеличив зрение очень мощного электронного микроскопа в два миллиона раз. В атоме существует множество постоянных и временных частиц. Электроны, протоны и нейтроны находятся в атоме как постоянные частицы. Также нейтрино, антинейтрино, позитрон и масон находятся в атоме как временные частицы.
Атомы обычно можно разделить на две части. Один — ядро, а другой — орбита. Эксперименты разных ученых показали, что ядро атома содержит протоны и нейтроны. Единственным исключением является водород, в ядре которого есть только протоны, но нет нейтронов. Электроны вращаются вокруг ядра по определенной орбите.
Как легко найти количество электронов, протонов и нейтронов в атоме фосфора?
Ученый Генри Гвинн Джеффрис Мосл исследовал рентгеновский спектр различных элементов в период с 1913 по 1914 год. Результаты его экспериментов показывают, что каждый элемент имеет уникальное целое число, равное количеству положительных зарядов в ядре этого элемента. Он назвал это число порядком атомов.
Таким образом, количество положительных зарядов, присутствующих в ядре элемента, называется атомным номером этого элемента. Атомный номер элемента обозначается буквой «Z». Это число равно порядковому номеру таблицы Менделеева. Мы знаем, что протоны находятся в ядре атома в виде положительного заряда.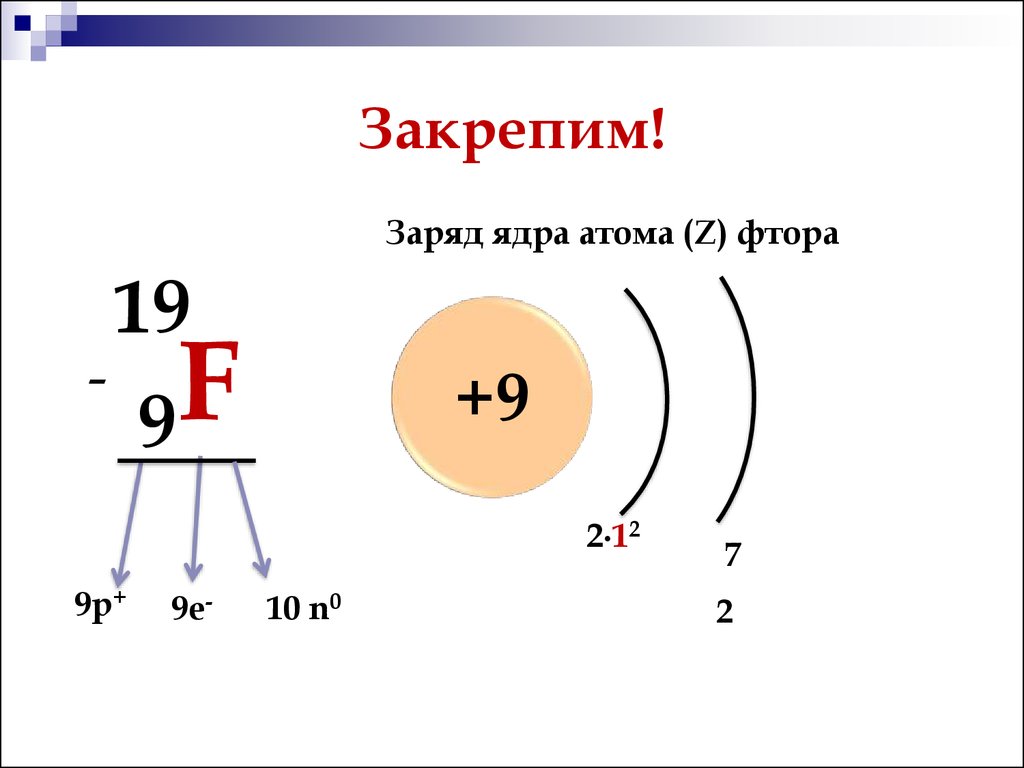
То есть атомный номер — это общее количество протонов. Атом в целом нейтрален по заряду. Следовательно, количество отрицательно заряженных электронов, обращающихся по своей орбите, равно количеству положительно заряженных протонов в ядре.
Атомный номер (Z) = количество зарядов в ядре (p)
Сколько протонов имеет атом фосфора?
Протоны — постоянные частицы ядра атома. Он находится в центре или ядре атома. Когда атом водорода удаляет электрон со своей орбиты, оставшаяся положительно заряженная частица называется протоном. Следовательно, протон выражается как H + . Относительная масса протонов равна 1, что примерно равно массе водорода (1,00757 а.е.м.).
Однако фактическая масса протона составляет 1,6726 × 10 −27 кг. То есть масса протона примерно в 1837 раз больше массы электрона. Протон — положительно заряженная частица. Его фактический заряд составляет +1,602 × 10 −19 кулонов. Диаметр протонной частицы составляет около 2,4 × 10 -13 см.
В периодической таблице 118 элементов, и 15-й из них — фосфор. Элементы в периодической таблице расположены в соответствии с их атомным номером. Поскольку фосфор является 15-м элементом периодической таблицы, атомный номер фосфора равен 15. Мы всегда должны помнить, что атомный номер и число протонов элемента равны. Следовательно, атом фосфора содержит пятнадцать протонов.
Сколько электронов у атома фосфора?
Электроны — постоянные частицы ядра атома. Он находится на определенной орбите атома и вращается вокруг ядра. Свойства элементов и их соединений зависят от электронной конфигурации. В 1897 году ученый Дж. Дж. Томсон обнаружил существование электронов с помощью электронно-лучевого исследования.
Наименьшая из частиц постоянного ядра атома — электрон. Его масса составляет примерно 1/1836 массы атома водорода. Фактическая масса электрона равна 90,1085 × 10 −28 г или 9,1093 × 10 −31 кг. Массой электрона часто пренебрегают, потому что эта масса слишком мала.
Протоны, нейтроны и электроны фосфора
Выражается e – . Заряд электронов составляет –1,609 × 10 –19 кулонов, а относительный заряд – –1. То есть заряд электрона равен заряду протона, но наоборот. Мы также должны помнить, что количество протонов и электронов в элементе одинаково. Следовательно, атом фосфора содержит на своей орбите пятнадцать электронов.
Сколько нейтронов у атома фосфора?
Ученый Чедвик открыл нейтрон в 1932 году. Он находится в ядре в центре атома. Нейтрон является частицей с нейтральным зарядом и выражается через n. Заряд нейтрона равен 0, и относительный заряд также равен 0. Масса нейтрона составляет 1,674 × 10 -27 кг. Количество электронов и протонов в атоме одинаково, но количество нейтронов разное.
Мы уже знаем, что ядро находится в центре атома. В ядре есть два типа частиц. Один из них представляет собой положительно заряженный протон, а другой — нейтрон с нейтральным зарядом.
Атомная масса (A) = Масса ядра = Суммарная масса протонов и нейтронов (p + n)
Опять же, масса каждого протона и нейтрона составляет около 1 а.е.м. Поэтому общее число протонов и нейтронов называется атомным массовым числом. То есть число атомной массы (А) равно p + n
Таким образом, число нейтронов в элементе получается из разницы между числом атомных масс и числом атомов. То есть число нейтронов (n) = атомное массовое число (A) – атомное число (Z)
| Mass number (A) | Atomic number (Z) | Neutron number = A – Z |
| 30.974 | 15 | 16 |
Number of neutrons in фосфор
Мы знаем, что атомный номер фосфора равен 15, а атомное массовое число около 31.
Основываясь на атомном номере, массовом числе и числе нейтронов элемента, можно рассмотреть три вещи. Это изотоп, изобар и изотон. Количество нейтронов зависит от изотопа атома. Атом фосфора имеет около двадцати трех изотопа.
Количество протонов, электронов и нейтронов для фосфора
Как определить количество нейтронов по изотопам фосфора?
Атомы, имеющие одинаковое количество протонов, но разные массовые числа, называются изотопами друг друга. Английский химик Фредерик Соди впервые выдвинул идею изотопов в 1912 году, а ученый Астон в 1919 году определил два атома неона с разными массами ( 20 Ne, 22 Ne).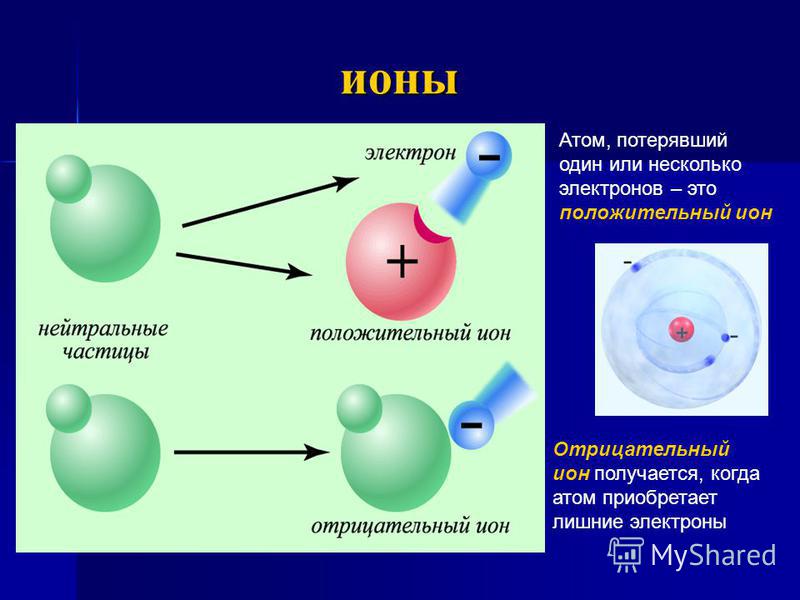
Количество протонов в атоме изотопа не меняется, но меняется количество нейтронов. Атом фосфора имеет около двадцати трех изотопа. Такие как 25 P, 26 P, 27 P, 28 P, 29 P, 30 P, 31 P, 32 P, 33 P, 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 P, 33 9002 П, 35 П, 36 П, 37 П, 38 П, 39 П, 40 П, 41 П, 0024 43 P, 44 P, 45 P, 46 P и 47 P. Среди изотопов 31 P стабилен и образуется естественным путем.
| Isotope | Mass number (A) | Atomic number (Z) | Neutron number = A – Z | ||||
| 25 P | 25. 02119 02119 |
15 | 10 | ||||
| 26 П | 26.01178 | 15 | 11 | ||||
| 27 P | 26.999224 | 15 | 12 | ||||
| 28 P | 27.9923266 | 15 | 13 | ||||
| 29 P | 28.9818004 | 15 | 14 | ||||
| 30 P | 29.97831349 | 15 | 15 | ||||
| 31 P | 30. 9737619986 9737619986 |
15 | 16 | ||||
| 32 P | 31.973 | ||||||
| 15 | 17 | ||||||
| 33 P | 32.9717257 | 15 | 18 | ||||
| 34 P | 33.9736459 | 15 | 19 | ||||
| 35 P | 34.9733141 | 15 | 20 | ||||
| 36 P | 35.978260 | 15 | 21 | ||||
| 37 P | 36.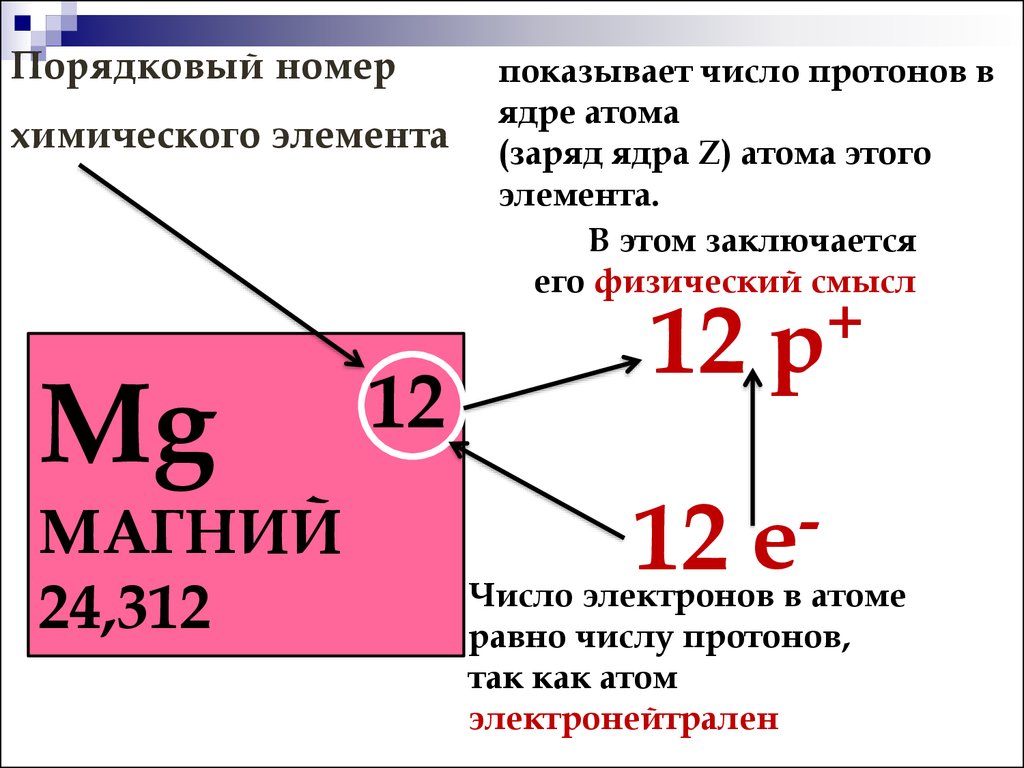 97961 97961 |
15 | 22 | ||||
| 38 P | 37.98430 | 15 | 23 | ||||
| 39 P | 38.98629 | 15 | 24 | ||||
| 40 P | 39.99129 | 15 | 25 | ||||
| 41 P | 40.99465 | 15 | 26 | ||||
| 42 P | 42.00108 | 15 | 27 | ||||
| 43 P | 43. 00502 00502 |
15 | 28 | ||||
| 44 P | 44.01122 | 15 | 29 | ||||
| 45 P | 45.01675 | 15 | 30 | .0281 46.02466 | 15 | 31 | |
| 47 P | 47.03190 | 15 | 32 |
Number of neutrons through isotopes of phosphorus
The remaining isotopes of phosphorus are highly unstable and their half-lives очень короткие. Из 23 радиоизотопов фосфора самым долгоживущим является радиоизотоп 33 P с периодом полураспада 25,34 дня и 32 P с периодом полураспада 14,268 дня.
Сколько протонов, нейтронов и электронов имеет фосфид-ион (P
3-)?
Когда атом несет отрицательный или положительный заряд, принимая или отталкивая электроны, он называется ионом. Ионные свойства элементов зависят от обмена электронами. В атомарном ионе изменяется только число электронов, но не изменяется число протонов и нейтронов. У фосфора на последней орбите пять электронов.
Атомный номер, атомный вес и заряд фосфид-иона (P 3- )
В этом случае атом фосфора может получить электроны на своей последней оболочке. При образовании связи последняя оболочка фосфора получает три электрона и превращается в фосфид-ион (P 3-). В этом случае атом фосфора несет отрицательный заряд.
P + 3e – → P 3-
Здесь электронная конфигурация фосфид-иона (P 3- ) равна 1s 2 2s 9 2 2s 9 2 00024 2 3p 6 .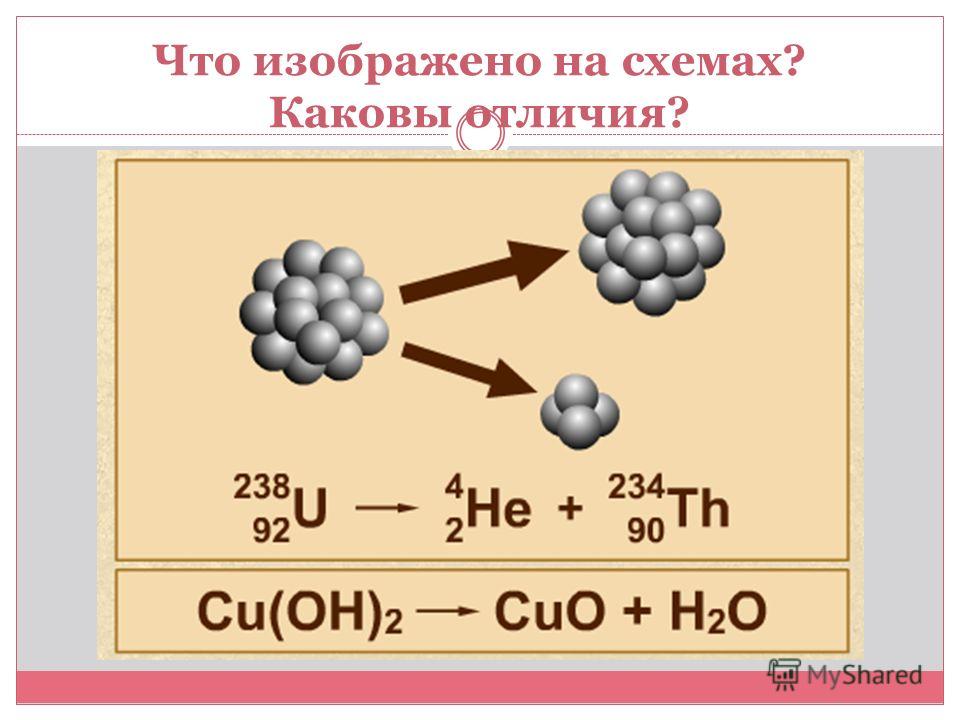
| Phosphorus ion | Protons | Neutrons | Electrons |
| P 3- | 15 | 16 | 18 |
Number of protons, нейтроны и электроны для фосфид-иона (P 3- ) Число протонов и электронов для фосфид-иона (P 3- )
Какими свойствами обладают протоны, нейтроны и электроны?
| Name | Symbol | Relative Mass (amu) | Relative Charge | Actual Mass(kg) | Actual Charge(C) | Location |
| Протон | p | 1. 00757 00757 |
+1 | 1.672×10 −27 | 1.602×10 −19 | Inside the nucleus |
| Neutron | n | 1.0089 | 0 | 1.674× 10 −27 | 0 | Inside the nucleus |
| Electron | e – | 5.488×10 −4 | –1 | 9.109×10 −31 | –1.6 ×10 –19 | Вне ядра |
Свойства электрона, протона и нейтрона
Почему нам важно знать количество электронов и протонов?
Атомный номер — это число, которое несет в себе свойства элемента.
Кроме того, валентность, валентные электроны и ионные свойства элементов определяются электронной конфигурацией. Чтобы определить свойства элемента, необходимо расположить электроны этого элемента. И чтобы расположить электроны, вы должны знать количество электронов в этом элементе.
Чтобы узнать количество электронов, вам нужно знать атомный номер этого элемента. Мы знаем, что в ядре элемента находится равное количество протонов с атомным номером, а электроны, равные протонам, находятся на орбите вне ядра.
Атомный номер (Z) = количество электронов
Атомный номер фосфора равен 15. То есть в атоме элемента фосфора пятнадцать электронов. Итак, по электронной конфигурации можно определить свойства фосфора. Теперь электронная конфигурация фосфора показывает, что на последней орбите пять электронов.
Последняя оболочка фосфора имеет три неспаренных электрона, поэтому валентность фосфора равна 3. Последний электрон фосфора выходит на p-орбиталь. Следовательно, это элемент p-блока. Чтобы знать эти свойства фосфора, нужно знать число электронов и протонов фосфора.
Ссылка
- Википедия
Сколько протонов в атоме фосфора
Содержание
Сколько протонов и электронов у фосфора?
Из таблицы Менделеева видно, что атомный номер фосфора (меньшее число) равен 15, значит, фосфор имеет 15 протонов . Атом не имеет заряда, поэтому количество протонов равно количеству электронов. Фосфор также имеет 15 электронов.
Сколько протонов электронов и нейтронов в атоме фосфора?
Основные изотопы фосфора
Фосфор-31 состоит из 15 протонов 16 нейтронов и 15 электронов .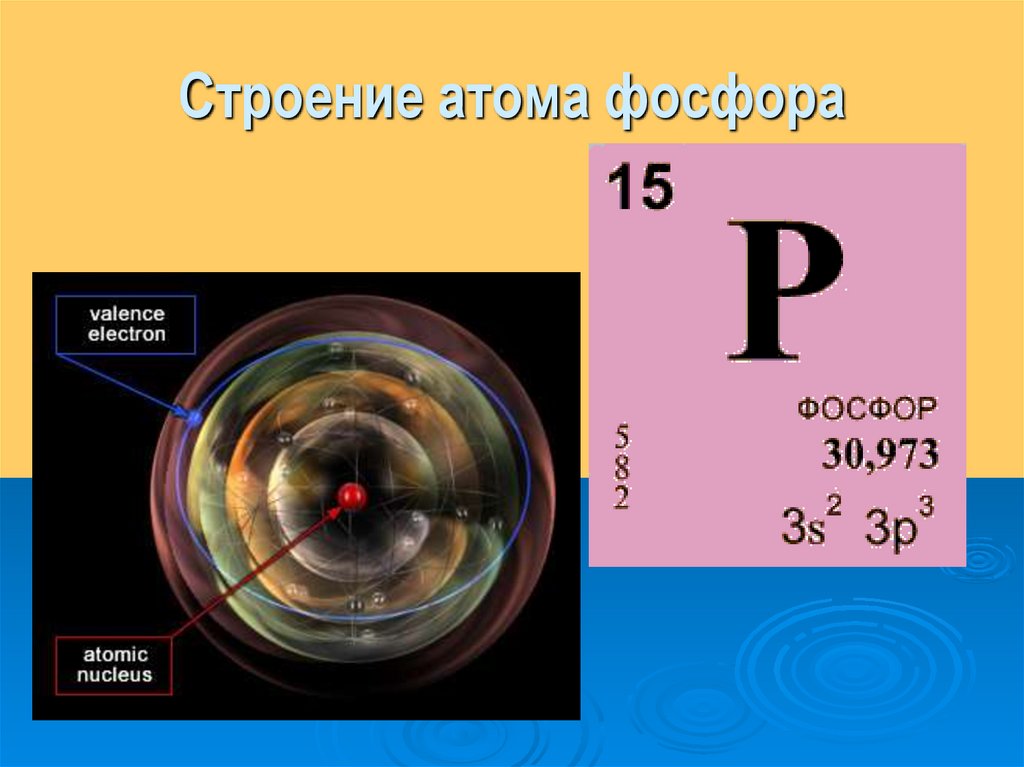
Сколько электронов в атоме фосфора?
2 8 5
Сколько протонов в фосфоре 31?
15 протонов
Это изотоп фосфор-31. В нем 15 протонов, 15 электронов и 16 нейтронов.
Сколько протонов у фосфора 32?
15 протонов
Фосфор 32 (P-32) — изотоп фосфора, ядро которого состоит из 15 протонов, и 17 нейтронов.
Сколько нейтронов в фосфоре P )?
То есть в ядре фосфора есть 15 протонов фундаментальных положительно заряженных массивных частиц. Этот атомный номер определяет идентичность элемента. Если имеется 15 протонов, то чтобы составить изотопную массу 31, в ядре элемента должно быть 16 нейтронов 16 массивных нейтрально заряженных частиц.
Сколько нейтронов у фосфата?
16 нейтронов
Фосфор имеет 16 нейтронов . Фосфор имеет номер 15 в периодической таблице, что означает, что атомный номер (число протонов) фосфора равен 15.
Сколько протонов в атоме хрома?
24
Сколько электронов присутствует в атоме фосфора 3+?
15 электронов
Фосфид представляет собой анионную форму элемента фосфора. Этот элемент имеет атомный номер 15. В нейтральном состоянии он также содержит 9.0095 15 электронов .
Как расположены 15 электронов в атоме фосфора?
Нейтральный атом фосфора имеет 15 электронов. Два электрона могут попасть в подоболочку 1s, 2 — в подоболочку 2s и 6 — в подоболочку 2p. Остается 5 электронов. Из этих 5 электронов 2 могут перейти в подоболочку 3s, а оставшиеся 3 электрона могут перейти в подоболочку 3p.
Как найти протоны?
Сколько нейтронов в фосфоре 33?
Члены этого набора (14)
Каково его массовое число? 17 протонов 17 электронов и 18 нейтронов .
Что имеет 16 протонов и нейтронов?
сера
(b) Обращаясь к периодической таблице или таблице элементов, мы видим, что сера (S) имеет атомный номер 16. Таким образом, каждый атом или ион серы должен содержать 16 протонов. Нам говорят, что ион также имеет 16 нейтронов, что означает, что массовое число иона равно 16 + 16 = 32.
Какой элемент содержит 28 протонов?
Никель — химический элемент с символом Ni и атомным номером 28.
Сколько протонов у бора?
5
Что имеет 15 протонов и 16 нейтронов?
фосфор
Ядро стабильного фосфора имеет 15 протонов и 16 нейтронов.
Как найти нейтроны в фосфоре?
Как найти протоны, нейтроны и электроны?
Для расчета количества субатомных частиц в атоме используйте его атомный номер и массовое число: число протонов = атомный номер .
Является ли фосфор атомом или ионом?
Фосфор — это химический элемент с символом P и атомным номером 15. Элементарный фосфор существует в двух основных формах: белый фосфор и красный фосфор, но из-за его высокой реакционной способности фосфор никогда не встречается в виде свободного элемента на Земле.
Сколько нейтронов у брома?
45 нейтронов
Бром имеет массовое число 80 и 35 протонов, поэтому 80-35 = 45 нейтронов .
Как найти нейтроны?
Вычесть атомный номер из атомной массы .
Поскольку подавляющее большинство массы атома состоит из его протонов и нейтронов, вычитание количества протонов (то есть атомного номера) из атомной массы даст вам расчетное количество нейтронов в атоме.
Сколько протонов в одном атоме 50cr?
Сводка
| Элемент | Хром |
|---|---|
| Количество протонов | 24 |
| Число нейтронов (типичные изотопы) | 50 52-54 |
| Число электронов | 24 |
| Электронная конфигурация | [Ар] 3d5 4s1 |
Сколько протонов в атоме углерода?
6
Сколько протонов у висмута?
83
Сколько электронов присутствует в атоме фосфора 2+?
Итак… для элемента ФОСФОР вы уже знаете, что атомный номер говорит вам о количестве электронов.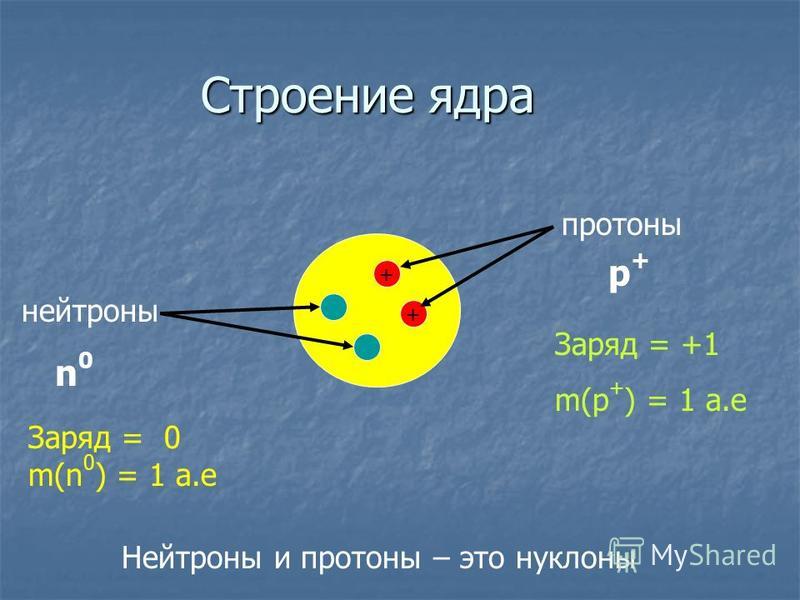
Сколько электронов и протонов в атоме фосфора, который имеет три избыточных электрона?
Какой изотоп имеет 15 протонов?
Фосфор-32
Фосфор-32 ( 32 P) — радиоактивный изотоп фосфора. Ядро фосфора-32 содержит 15 протонов и 17 нейтронов, на один нейтрон больше, чем у наиболее распространенного изотопа фосфора фосфора-31.
В какой группе находится атом с расположением электронов 2,8 1?
натрий
Электронное расположение натрия равно 2,8. 1.
Как найти количество электронов в фосфоре?
2 8 5
Чем похожи протоны и нейтроны?
Хотя аналогичны по массе , протоны заряжены положительно, а нейтроны заряда не имеют.
Что протоны делают для атома?
Функция в атоме
Протоны внутри ядра атома помогают связать ядро вместе . Они также притягивают отрицательно заряженные электроны и удерживают их на орбите вокруг ядра. Количество протонов в ядре атома определяет, какой это химический элемент.
Что входит в состав протона?
Протоны — это положительно заряженные частицы, содержащиеся в атомных ядрах. … Три кварка составляют каждый протон — два «верхних» кварка (каждый с положительным зарядом на две трети) и один «нижний» кварк (с отрицательным зарядом на одну треть) — и они удерживаются вместе другими субатомными частицами. называемые глюонами, которые не имеют массы.
Сколько протонов в атоме алюминия?
Алюминий/Атомный номер
Каждый атом алюминия содержит 18 протонов.
Сколько нейтронов имеет s 34?
Свойства изотопа серы-34:
Радиоактивность и радиоактивная маркировка – Неуклюжий биохимик
Жарко внутри – но я не виню погоду… Большую часть прошлой недели я провел в «горячей комнате». HVAC в этой комнате довольно привередлив, поэтому иногда она довольно холодная с точки зрения температуры, но мы все еще называем ее горячей, потому что температура, на которую ссылается название, НЕ! Вместо этого мы называем это «горячей комнатой», потому что мы проводим здесь наши РАДИОАКТИВНЫЕ эксперименты, и мы обычно называем радиоактивные вещества «горячими» 9.0003
На моей первой неделе в аспирантуре у нас было учебное собрание по технике безопасности – они сказали нам – мы должны научить вас работе с радиоактивностью, но в кампусе есть только 2 лаборатории, которые все еще активно ее используют – ну, моя первая смена лаборатории была в один из них (и я его использовал), и мое 3-е вращение было в одном из них (и я использовал его — и присоединился к лаборатории — и часто использую его для РАДИОМЕТЕКИ РНК, чтобы я мог визуализировать это.
Вчера мы видели, как мы можем атакуют «флуорофоры» на нуклеотиды (буквы ДНК или РНК). Флуорофоры — это молекулы, которые поглощают свет одной длины волны и выделяют свет другой, более низкой энергии длины волны. Помимо прикрепления флуорофоров непосредственно к буквам, которые затем встраиваются в растущие цепи, когда ДНК записывается, мы можем использовать флуоресцентные красители нуклеиновых кислот, такие как DAPI или бромид этидия, чтобы неспецифически фиксироваться на фрагментах ДНК и РНК, вклиниваясь между основаниями. Подробнее здесь: http://bit.ly/33RznDA
Эти красители действительно полезны для изучения фрагментов ДНК и РНК, которые мы разделили по размеру с помощью ГЕЛЬ-ЭЛЕКТРОФОРЕЗА. Эти пятна показывают вам ВСЕ ДНК или РНК. НО что, если вы заинтересованы только в том, чтобы увидеть определенный? RADIOLABELING *только* показывает вам конкретный(е) -> те, которые вы сначала модифицируете, заменяя их концевую фосфатную группу изотопом радиоактивного люминофора, чтобы вы могли отследить его (и посмотреть, взаимодействует ли он с веществом).
Вы можете подумать, что ДНК чертовски мала — тонны ее должны быть втиснуты в каждую из наших миллиардов клеток. Но она, как и все молекулы, состоит из еще более мелких элементов, АТОМОВ, которые состоят из еще более мелких элементов – СУБАТОМНЫХ ЧАСТИЦ
Эти субатомные частицы включают ПРОТОНЫ, НЕЙТРОНЫ И ЭЛЕКТРОНЫ. ПРОТОНЫ заряжены ПОЛОЖИТЕЛЬНО и тусуются с НЕЙТРОНАМИ (которые НЕЙТРАЛЬНЫ) в плотном центральном ядре. ЭЛЕКТРОНЫ ОТРИЦАТЕЛЬНО заряжены, и они свистят вокруг ядра в виде «электронного облака» — вы никогда точно не знаете, где они будут находиться, но мы можем описать «орбитали», где они, скорее всего, будут находиться.
Если вы измените количество протонов, вы измените тип ЭЛЕМЕНТА, потому что количество протонов ОПРЕДЕЛЯЕТ элемент — например, углерод (C) имеет 12 протонов, кислород (O) имеет 8, азот (N) имеет 7 и фосфор (P) 15.
НО количество нейтронов и электронов может быть разным и элемент все равно тот элемент. Это похоже на то, как вы можете набрать вес или похудеть, но при этом оставаться собой.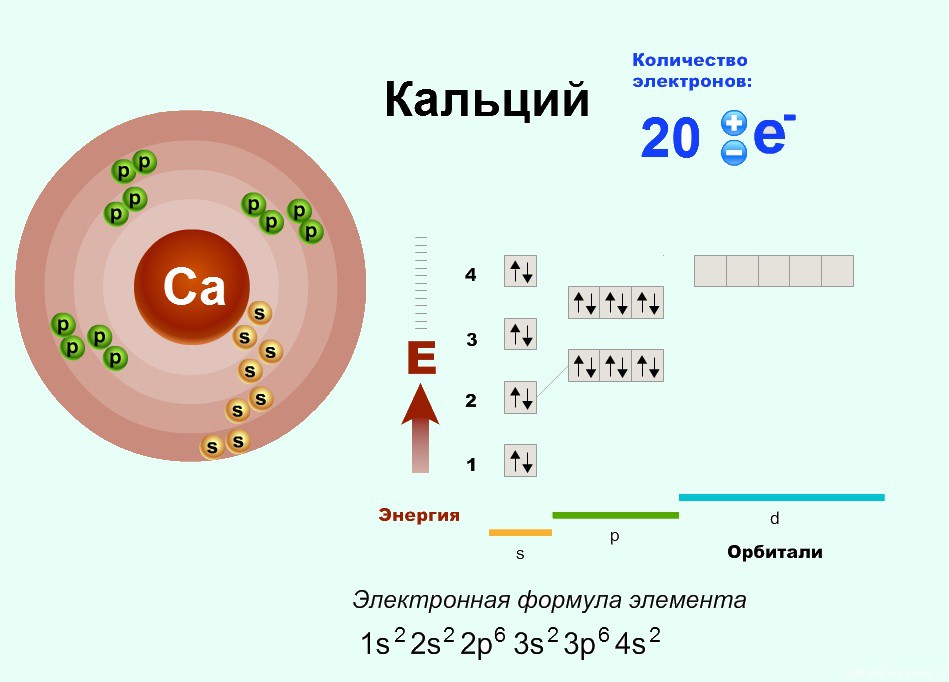
Протоны и электроны имеют одинаковые (но противоположные) заряды, поэтому атом нейтрален, если # протонов == # электронов. Но если у них неравномерное число, они *действительно* имеют заряд, и мы называем такие атомы ИОНАМИ. если # протонов> # электронов, у вас есть сеть +, и мы называем это КАТИОНОМ. Если наоборот, и у вас больше электронов, чем протонов, у вас есть сеть, и мы называем это АНИОНОМ. Эти разные формы атома могут иметь очень разную реакционную способность.
НО изменение числа нейтронов НЕ меняет заряд, потому что нейтроны не заряжены – это как прибавление или вычитание нулей.
НО они менее стабильны, чем «обычная версия». Если вы думаете о расположении атома, то оно довольно странное — противоположные заряды (как у протона (+) и электрона (-) притягиваются, и такие же заряды отталкиваются -> и у вас есть тонна положительного заряда, сконцентрированная вместе с уравновешивающий заряд, распределенный вокруг него.
Чтобы удержать эти протоны вместе, вам нужен «клей» в виде сильного ядерного взаимодействия. Это исходит от нейтронов, и вы хотите иметь хороший баланс протонов и нейтронов. Иногда такое расположение может показаться неудобным, но вы можете немного перетасовать нуклоны, чтобы сделать их более удобными, фактически не изменяя количество протонов или нейтронов.
При гамма-распаде меняется расположение протонов и нейтронов – они немного перетасовываются, чтобы реорганизоваться в более удобное положение и испускают извивающуюся энергию на пути к более расслабленному состоянию.
Но в других случаях требуются более радикальные изменения – изменения, которые фактически изменяют # и/или тип субатомных частиц. Есть 2 основных вида такого распада – альфа-распад и бета-распад.
При альфа-распаде, который обычно происходит в очень больших, тяжелых ядрах, атом испускает альфа-частицу 2 протона и 2 нейтрона (в основном он испускает ядро гелия)
атом-> атом 2 знака «влево» в периодической таблице + He2+, который может забрать пару электронов, чтобы стать элементарным гелием, He. (если вы привыкли к химическим уравнениям, где вы тщательно уравновешиваете полные заряды в своих уравнениях, уравнения ядерного распада часто кажутся «неправильными», потому что они часто игнорируют «нормальные» электроны и просто фокусируются на том, что происходит в ядре)
пример: Уран-238 -> Торий-234 + He
Это не очень полезно для нашей радиометки, тем более, что одно из основных преимуществ радиомаркировки состоит в том, что она может скрытно заменить то, что присутствует естественным образом и у вас есть.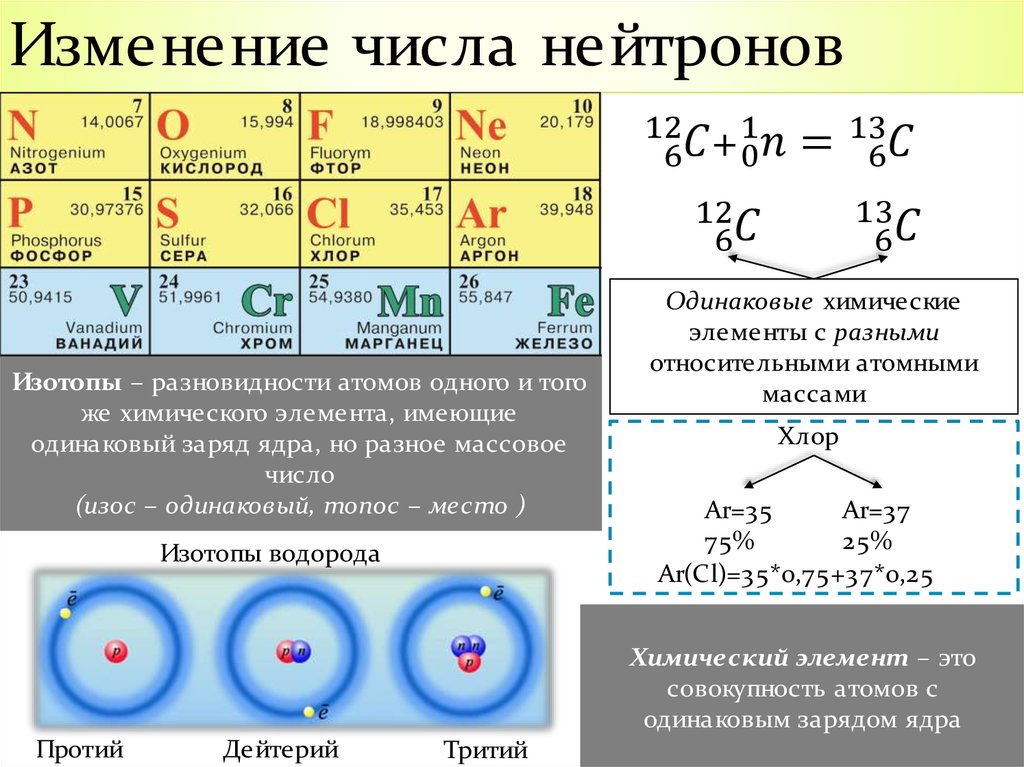
А пока давайте посмотрим, как мы можем выделить этот фосфор. Альфа-частицы — это большие, медленно движущиеся продукты распада, от которых легко защититься, но то, с чем я работаю, обладает большей энергией — тип излучения, который я использую, называется БЕТА-РАСПАД. Реальные детали субатомной физики довольно странные, но основная идея интуитивно понятна — если у вас слишком много протонов по сравнению с нейтронами, замените протон нейтроном.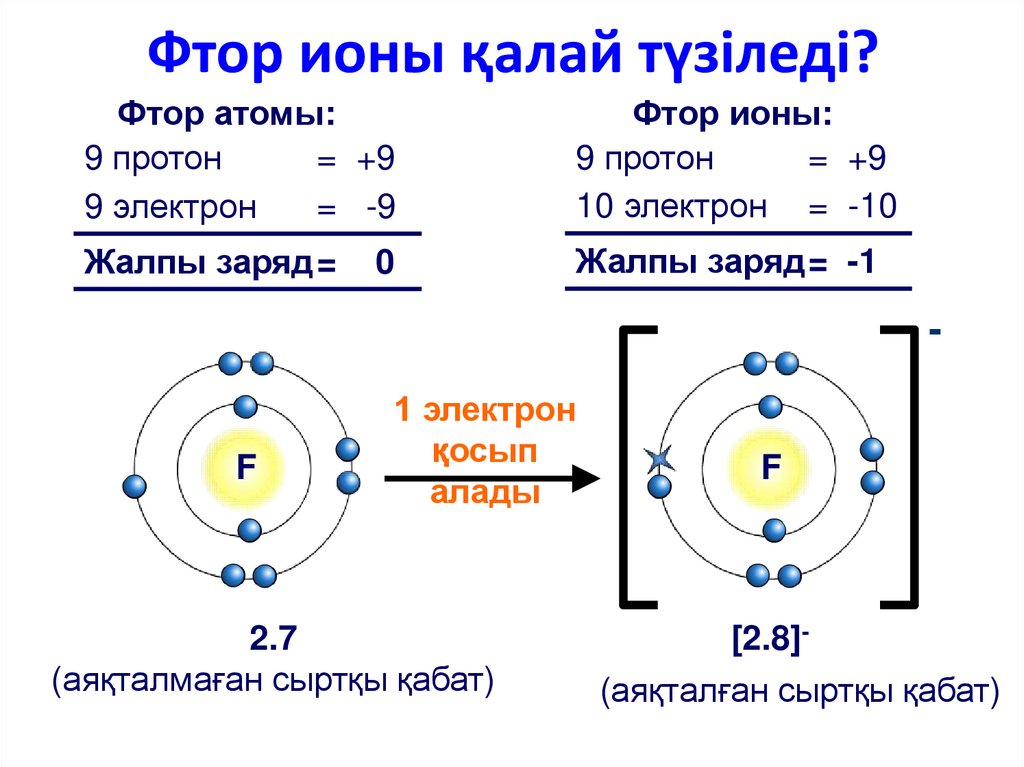
Давайте посмотрим, как я его использую. Я использую радиоизотоп фосфора, потому что он может «заменить» обычный фосфор в фосфате на 5′-конце РНК (вы также можете обозначить таким образом ДНК) — и если вы хотите изучить те киназы, о которых мы говорили, вы может использовать «горячую АТФ», в которой добавляемый фосфор имеет радиоактивную версию фосфора вместо «нормальной» формы
Что я имею в виду под нормальным? Если вы возьмете какую-нибудь случайную молекулу, содержащую фосфор, и измерите массу этого фосфора, скорее всего, вы получите 31 атомную единицу массы (а.е.м.). 15 а.е.м. от протонов (поскольку у фосфора ВСЕГДА 15 протонов) и 31-15 = 16 нейтронов (помните, что электроны слишком малы для подсчета по массе). Это не означает, что вы *никогда* случайно не найдете фосфор с большим или меньшим числом нейтронов, чем 16, но 16, безусловно, встречаются чаще всего.
Есть причина, по которой вы, скорее всего, найдете 31P — он самый стабильный. Некоторые элементы имеют более одной стабильной формы, поэтому вы можете случайно найти другой его изотоп (например, «нормальный» C (12C) друг 14C, который пригодится, когда ученые хотят датировать действительно старые вещи), но для P, 31 настолько преобладает, природный P считается «100%» 31P, с «следовыми количествами» пары других…
«Вы» *можете* добавить больше нейтронов (еще 1 для 32P и еще 2 для 33P), НО P идет «перегрузиться» нейтронами и произвести некоторые субатомные изменения, чтобы перейти в более стабильное состояние, что сопровождается выбросом радиации.
Я работаю с изотопом 32P (обычно произносится как «P тридцать два»). Вы также увидите, что он написан как P-32, Phosphorus-32. или 32р. Если вы сравните это с «нормальным» P, у него «слишком много» нейтронов.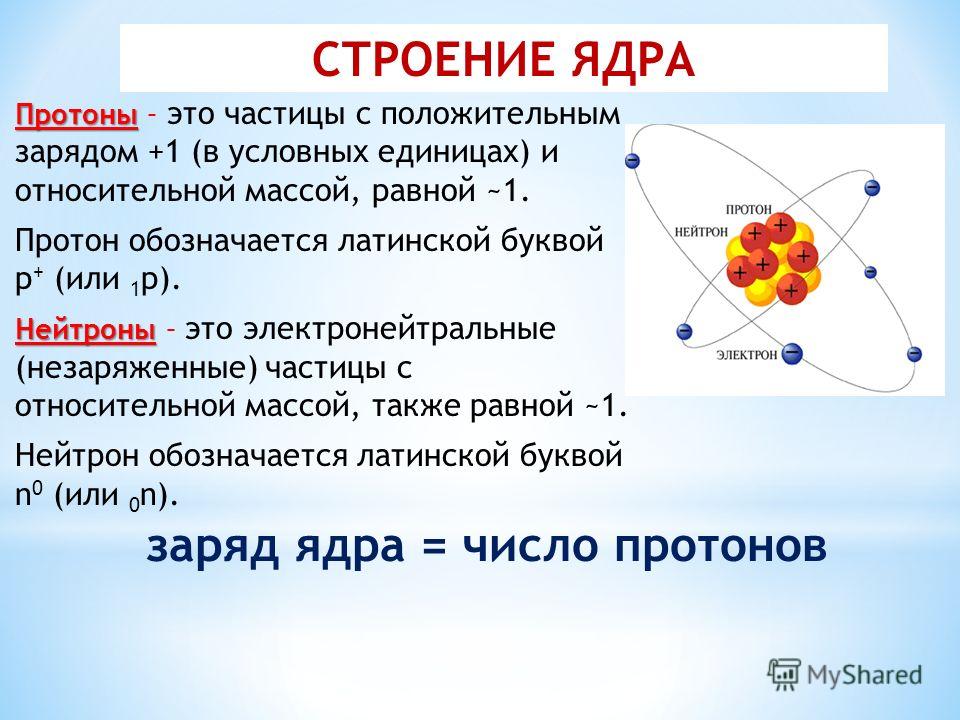
Когда P32 распадается, это происходит через БЕТА-МИНУС РАСПАД. Он испускает нечто, называемое бета-частицами
P32 -> 32S + e- + антинейтрино
Он получает ПРОТОН!!!! А поскольку количество протонов определяет элемент, это уже не фосфор — теперь у него 16 протонов и, следовательно, это сера!
Этот 32S работает стабильно и успешно, поэтому он остается таким, какой он есть. Но это получение протонов заставляет вас увеличивать заряд. Но законы физики говорят нам, что заряд должен сохраняться, поэтому также испускается электрон. Вы также испускаете что-то, называемое нейтрино, странную маленькую штуку, похожую на электрон с точки зрения того, что она очень маленькая и легкая, но отличается от электронов тем, что НЕ ЗАРЯЖЕНО.
Иногда атом нестабилен по противоположной причине – в нем слишком *мало* нейтронов. Вроде 30-П. Таким образом, он меняет протон на нейтрон, а не наоборот.
Разные ИЗОТОПЫ распадаются с разной скоростью, которую мы измеряем как ПЕРИОД ПОЛУРАСПАДА – время, необходимое для распада 1/2 его части. Для P32, который я использую, это 14,29 дней, поэтому у меня есть около 2 недель, прежде чем половина из них станет бесполезной. Тем временем мы можем обнаружить излучение, которое они испускают, улавливая его на люминофорном экране, который мы затем сканируем.
Вы можете пометить РНК или ДНК флуоресцентными метками, с которыми легче работать, НО эти метки увеличивают объем и изменяют свойства. Самое замечательное в радиоактивных метках то, что они одинакового размера и обладают одинаковыми связывающими и биохимическими свойствами, только с разным количеством нейтронов.
Кроме того, методы, основанные на радиоактивности, СУПЕР ЧУВСТВИТЕЛЬНЫ — вы можете обнаружить мизерные количества.
Этот пост является частью моих еженедельных «трансляций со скамейки» для Международного союза биохимиков и молекулярной биологии (@theIUBMB). Обязательно подписывайтесь на IUBMB, если интересуетесь биохимией! Это действительно крупная международная организация по биохимии.
подробнее об атомах: http://bit.ly/2G8SYax
подробнее о гель-электрофорезе: http://bit.ly/2XsNzQg
подробнее о РНК и ДНК: http://bit.ly/2yCisGq
подробнее о EMSA: http://bit.ly/2tJO3Uq
#365DaysOfScience Все (с перечислением тем) 👉 http://bit.ly /2OllAB0
-
26 Сколько электронов имеет фосфор?
Чтобы записать электронную конфигурацию фосфора, нам сначала нужно знать количество электронов у атома фосфора (их 9).
0095 15 электронов ). Когда мы запишем конфигурацию, мы поместим все 15 электронов на орбитали вокруг ядра атома фосфора.
Сколько электронов содержится в фосфоре?
Чтобы записать электронную конфигурацию фосфора, нам сначала нужно знать количество электронов для атома фосфора (есть 15 электронов ). Когда мы запишем конфигурацию, мы поместим все 15 электронов на орбитали вокруг ядра атома фосфора.
Сколько протонов нейтронов и электронов имеет атом фосфора?
Итак, этот элемент имеет 15 протонов (атомный номер), 15 электронов и 16 нейтронов (массовое число минус атомный номер). Это изотоп фосфора-31 с атомным номером 15.
Сколько протонов и электронов имеет фосфор P?
Из периодической таблицы видно, что атомный номер фосфора (меньшее число) равен 15, значит, фосфор имеет 15 протонов . Атом не имеет заряда, поэтому количество протонов равно количеству электронов. Фосфор также имеет 15 электронов.
Имеет ли фосфор 15 валентных электронов?
Фосфор относится к группе 15/VA.
Основываясь на номере группы, фосфор имеет 5 валентных электронов , как и все элементы этой группы.
Как найти электроны?
Чтобы рассчитать количество субатомных частиц в атоме, используйте его атомный номер и массовое число: количество протонов = атомный номер. число электронов = атомный номер .
Как найти электроны фосфора?
2, 8, 5
Имеет ли фосфор 16 нейтронов?
Объяснение: если вы посмотрите на периодическую таблицу, у фосфора 15 электронов и протонов, а у 16 нейтронов .
Сколько электронов имеет фосфор во внешней оболочке?
Сколько протонов у фосфора?
15
Сколько протонов у фосфора 32?
Ядро фосфора-32 содержит 15 протонов и 17 нейтронов, что на один нейтрон больше, чем у наиболее распространенного изотопа фосфора, фосфора-31.
Сколько протонов нейтронов и электронов в фосфоре 32?
Фосфор-32 (P-32) — изотоп фосфора, ядро которого состоит из 15 протонов и 17 нейтронов . Он распадается, испуская β- (1,71 МэВ) частицу в 32S с периодом полураспада 14,263 дня. Это искусственное радиоактивное вещество, полученное нейтронной бомбардировкой стабильного фосфора.
Какой элемент имеет 15 валентных электронов?
Элемент 15-й группы фосфор и его символ «P». Фосфор образует связи через свои валентные электроны.
Как найти валентные электроны фосфора?
Что такое валентный электрон фосфора?
[Ne] 3s² 3p³
Сколько электронов у бора?
2,3
Какое число электронов?
Определение числа электронов
число электронов в атоме равно порядковому номеру элемента , для нейтрально заряженных частиц. Это означает, что количество электронов и количество протонов в элементе равны.
Следовательно, число электронов в кислороде равно 8.
Как узнать, сколько электронов имеет ион?
Заряд иона говорит вам о количестве электронов. Если заряд положительный, вычтите это число из атомного номера, чтобы получили число электронов. У вас больше протонов. Если заряд отрицательный, добавьте количество заряда к атомному номеру, чтобы получить количество электронов.
Как расположены 15 электронов в атоме фосфора?
Нейтральный атом фосфора имеет 15 электронов. Два электрона могут попасть в подоболочку 1s, 2 — в подоболочку 2s и 6 — в подоболочку 2p. Остается 5 электронов. Из этих 5 электронов 2 могут перейти в подоболочку 3s, а оставшиеся 3 электрона могут перейти в подоболочку 3p.
Сколько стабильных электронов у фосфора?
Какой из следующих имеет 16 электронов?
Нейтральный сера имеет 16 электронов, потому что ее атомный номер равен 16.
Какой из следующих имеет 14 электронов и 16 нейтронов?
Элемент . Количество электронов в каждой оболочке Второй . Какой элемент имеет 8 электронов?
У фосфора 4 оболочки?
Ответ: Всего у нейтрального атома фосфора 15 электронов. На первую оболочку может попасть два электрона, на вторую — восемь, а на третью — еще пять.
Сколько снарядов в фосфоре?
З Элемент Количество электронов/оболочка 15 Фосфор 2, 8, 5 16 Сера 2, 8, 6 17 Хлор 2, 8, 7 18 Аргон 2, 8, 8 Сколько протонов, нейтронов и электронов должно быть у фосфора, чтобы иметь заряд?
Является ли фосфор 32 атомом или ионом?
Атом фосфора-32 является радиоактивным изотопом фосфора с относительной атомной массой 31,973907 и периодом полураспада 14,26 дня.
Фосфор Р-32 представляет собой радиоактивный изотоп фосфора с радиоцитотоксической активностью, испускающей бета-частицы.
Сколько протонов в фосфоре-31?
Атомный номер также представляет собой количество протонов в ядре всех атомов или ионов определенного элемента. Нам говорят, что фосфор-31 имеет атомный номер 15. Это означает, что атом фосфора-31 будет иметь 15 протонов . Вопрос задавался нам, сколько нейтронов в атоме фосфора-31.
Сколько нейтронов в фосфоре 33?
Термины в этом наборе (14)
Какой номер группы у фосфора?
Группа 15 Температура плавления Период 3 Температура кипения Блок р Плотность (г см − 3 ) Атомный номер 15 Относительная атомная масса Состояние при 20°C Твердый Ключевые изотопы Что такое число 32 в периодической таблице?
Германий – Информация об элементе, свойства и использование | Периодическая таблица.
Каким образом фосфор имеет валентность 3?
Фосфор (атомный номер 15) имеет электроны, расположенные в конфигурации 2,8,5. Таким образом, можно с одинаковой легкостью либо добавить 3 электрона на внешнюю орбиту, либо убрать 5 электронов. Итак, фосфор имеет валентность 9.0095 3 или 5 .
Имеет ли фосфор два валентных электрона?
Фосфор имеет 3 и 5 валентность . Это зависит от электронной конфигурации атома. Если на его трех p-орбиталях есть 3 неспаренных электрона, он имеет валентность 3.
Имеет ли фосфор валентность 5?
Почему фосфор имеет валентность 5+?
Это связано с тем, что фосфор имеет вакантную d-орбиталь, благодаря которой он может расширять свой октет, возбуждая электроны с p на d орбиталь и, следовательно, может иметь валентность 5.
.
Обзорный материал CHM1045
Обзорный материал CHM1045
Обзор материала CHM1045
Продолжая CHM1045, есть несколько тем, которые вы должны хорошо понимать, чтобы иметь возможность понять концепции, представленные в CHM1046.
1) Строение атома
2) Валентные электроны
3) Структуры Льюиса
4) Ионы и соли
5) Полярность
Давайте начнем с первой из этих тем: Структура атома.
Атом состоит из протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре атома, а электроны — в оболочках, окружающих ядро.
Атомный номер элемента равен количеству протонов, находящихся в его ядре. Если вы измените количество протонов, вы измените элемент, о котором говорите. Атомная масса элемента равна массе его протонов плюс нейтронов. По массе в периодической таблице и атомному номеру вы сможете определить количество нейтронов в атоме.
Пример:
Кислород имеет атомный номер 8 и массу ~16 а.е.м. Это указывает на то, что в ядре атома кислорода 16 — 8 = 8 нейтронов.
Количество электронов в атоме всегда равно количеству протонов, пока атом нейтрален. Когда количество протонов (+ зарядов) не равно количеству электронов (- зарядов), атом называется ионом. Отрицательно заряженные атомы называются анионами, а положительно заряженные атомы называются катионами.
Ионы формируются для повышения стабильности атома. Элементы группы VIII, благородные газы, являются наиболее стабильными элементами и имеют восемь валентных электронов (электроны самой внешней оболочки). Все остальные элементы групп I-VII образуют ионы и связи, стремясь получить восемь электронов на своей внешней оболочке.
Пример: Азот является элементом группы V. Чтобы стать похожим на благородный газ Неон, он должен получить 3 электрона. Таким образом, когда азот образует ионы, они имеют 3-заряд, а когда он образует связи, он обычно связывается с тремя другими элементами.
Структура аммиака, показанная выше, является структурой Льюиса. Структуры Льюиса представляют собой изображения молекул, которые используют линии для связей и показывают точки для неподеленных пар электронов. Есть несколько основных правил рисования структур Льюиса, с которыми вы должны быть знакомы:
Структуры Льюиса построены таким образом, чтобы удовлетворять правилу октетов для каждого из атомов в молекуле. Связи представлены «-», а неподеленные пары электронов представлены «:».
Существуют простые шаги для создания правильной структуры Льюиса:
1) Рассчитайте общее количество доступных валентных электронов.
2)Определить, какой атом будет центральным в молекуле.
3) Расположите атомы симметрично вокруг центрального атома.
4) Разместите связи/электроны вокруг атомов, пока правило октетов не будет выполнено для каждого атома.
При необходимости используйте двойные или тройные связи.
5) Покажите любые заряды молекулы с помощью скобок [ ] и поместите заряд в верхний правый угол сразу за скобками
Шаг 1: Рассчитайте общее количество доступных валентных электронов.
В качестве примера возьмем PO 4 3-.
Нам нужно знать, сколько электронов доступно для создания связей для фосфат-иона.
Фосфор находится в группе VA, поэтому у него 5 валентных электронов, а кислород находится в группе VIA, поэтому каждый кислород имеет 6 валентных электронов. Всего валентных электронов = 5 + 4(6) = 29. НО подождите, это нечетное количество электронов, и мы на самом деле не обсуждали этот вопрос, так что чего-то не хватает… О, заряд. На каждый отрицательный заряд иона нам нужно добавить 1 валентный электрон, так что всего получается 29+ 3 = 32 валентных электрона.
Это означает, что у нас есть 32 электрона, которые нужно распределить по связям, чтобы создать ион фосфата.
Шаг 2: Определите, какой атом будет центральным в молекуле.
Центральный атом в молекуле обычно является наименее электроотрицательным атомом. Также часто именно атом позволяет создать наиболее симметричную молекулу. Для фосфата PO 4 3- фосфат является наименее электроотрицательным атомом, и это позволит нам создать наиболее симметричную молекулу, поэтому он, скорее всего, является центральным атомом. Кстати, для других молекул, содержащих водород, мы знаем, что водород может образовывать только одну связь, поэтому атомы водорода НИКОГДА не могут быть центральным атомом.
Шаг 3: Расположите атомы симметрично вокруг центрального атома.
Большинство творений природы симметричны, и то же самое относится и к большинству химических соединений. При написании структур Льюиса лучше всего наиболее симметричное расположение атомов вокруг центрального атома.
Для фосфата: четыре атома кислорода расположены симметрично вокруг атома фосфора.
Шаг 4: Разместите связи/электроны вокруг атомов, пока для каждого атома не будет выполнено правило октетов. При необходимости используйте двойные или тройные связи . Вы должны израсходовать все валентные электроны. (Обратите внимание, что показанный заряд является формальным зарядом этих ионов)
Шаг 5: Покажите любые заряды молекулы с помощью скобок [ ] и поместите заряд в верхний правый угол сразу за скобками
Ион фосфата, показанный выше, может объединяться с положительными ионами с образованием солей. Соль — это ионное соединение (металл + неметалл), которое образуется, когда два противоположно заряженных иона объединяются, образуя нейтральное соединение.
Пример: Фосфат натрия = Na 3 PO 4 Это соль, состоящая из ионов Na + и PO 4 3-. На этом этапе вы должны быть в состоянии построить правильную соль из любой комбинации положительных и отрицательных ионов и назвать полученное соединение.
Если вы все еще не можете сделать это очень хорошо, вам следует потренироваться!!
Ионные соединения считаются наиболее полярной формой молекулы, поскольку все они в той или иной степени диссоциируют в воде. Другие молекулы, ковалентные молекулы, не распадаются на части в воде и поэтому считаются неполярными.
Третья группа молекул является одновременно ковалентной и полярной и поэтому в некоторой степени смешивается с водой. Большая часть материала в первых нескольких главах CHM1046 будет зависеть от ваших знаний об этих типах соединений, поэтому вам нужно будет уметь различать, является ли молекула полярной или нет.
Что вызывает полярность?
Полярные молекулы содержат электроотрицательный атом, который притягивает электроны в молекуле к себе и от других атомов в молекуле. Вы можете думать об этом как о конкурсе популярности, и самый электроотрицательный атом является самым популярным. Все электроны хотят проводить с ним больше времени.
Когда это происходит, распределение электронов (- зарядов) концентрируется в одной точке молекулы, а протоны (+ заряды) других атомов остаются несколько открытыми. Это неравномерное распределение создает то, что называется диполем, а молекулы, содержащие диполи, считаются полярными.
В этом случае атомы Cl более электроотрицательны, чем углерод, образуя частичные заряды на атомах и диполь.
Итак, какие элементы электроотрицательны? Наиболее электроотрицательным элементом является фтор, и тенденция электроотрицательности увеличивается слева направо и снизу вверх в периодической таблице.
Другими основными тенденциями, о которых вам следует знать, являются тенденции изменения энергии ионизации и атомного радиуса.
Энергия ионизации или потенциал ионизации — это энергия, необходимая для отрыва электрона от нейтрального атома. Обычно он увеличивается снизу вверх (легче отобрать электрон у атома с большим количеством электронов, чем у атома с небольшим количеством электронов) и слева направо в периодической таблице.
Двигаясь слева направо по периоду таблицы Менделеева, вы увеличиваете количество протонов в ядре, но остаетесь в той же орбитальной оболочке. Это означает, что притяжение к ядру увеличивается по мере продвижения слева направо, но экранирование (электроны во внутренних оболочках) остается постоянным. Если электроны удерживаются крепче, то энергия, необходимая для их освобождения, будет увеличиваться. Вот почему все элементы в крайней правой части таблицы (за исключением инертных газов) принимают электроны гораздо лучше, чем отдают их.
Атомный радиус увеличивается сверху вниз и справа налево в периодической таблице. Сверху вниз имеет смысл, потому что вы добавляете большое количество электронов, но увеличение размера справа налево часто сбивает с толку. Двигаясь слева направо по периоду таблицы Менделеева, вы увеличиваете количество протонов в ядре, но остаетесь в той же орбитальной оболочке. Это означает, что притяжение к ядру увеличивается по мере продвижения слева направо, но экранирование (электроны во внутренних оболочках) остается постоянным.
Определите число протонов, электронов и нейтронов в атомах элементов: натрия, фосфора, золота.
reshalka.com
ГДЗ учебник по химии 8 класс Габриелян. §7. Вопросы и задания. Номер №2
Решение
Получай решения и ответы с помощью нашего бота
| Элемент | Число протонов (
p + ) = номеру элемента |
Число электронов (
e − ) = номеру элемента |
Число нейтронов (
n 0 ) = массовое число (А) − номер элемента (Z) |
|---|---|---|---|
| Nа (натрий) | 11 | 11 | 23 − 11 = 12 |
| P (фосфор) | 15 | 15 | 31 − 15 = 16 |
| Au (золото) | 79 | 79 | 197−79 = 118 |







 0095 15 электронов ). Когда мы запишем конфигурацию, мы поместим все 15 электронов на орбитали вокруг ядра атома фосфора.
0095 15 электронов ). Когда мы запишем конфигурацию, мы поместим все 15 электронов на орбитали вокруг ядра атома фосфора. 
