Загрузить PDF
Загрузить PDF
В атомах одного и того же элемента число протонов неизменно, в то время как число нейтронов может меняться. Зная, сколько нейтронов содержится в конкретном атоме, вы сможете определить, является ли он обычным атомом или изотопом, который будет иметь меньшее или большее количество нейтронов.[1]
Определить количество нейтронов в атоме — довольно просто. Все, что вам нужно сделать для расчета количества нейтронов в атоме или изотопе, — это следовать нашим инструкциям и держать под рукой периодическую таблицу.
-

1
Найдите элемент в периодической таблице. Для примера мы будем рассматривать осмий (Os), который находится в шестом периоде (шестой ряд сверху).
-

2
Найдите атомный номер элемента. Это, как правило, наиболее заметное число в ячейке элемента и обычно находится над его символом (в варианте периодической системы, которую мы используем в нашем примере, других номеров и нет). Атомный номер — это количество протонов в одном атоме этого элемента. Для осмия это число 76, то есть в одном атоме осмия содержится 76 протонов.
- Число протонов неизменно, именно оно и делает элемент элементом.
-

3
Найдите атомную массу элемента. Это число обычно находится под символом элемента. Обратите внимание, что в варианте периодической системы в нашем примере атомная масса не приведена (это не всегда так; во многих вариантах периодической системы атомная масса указана). Атомная масса осмия — 190,23.
-

4
Округлите атомную массу до ближайшего целого числа. В нашем примере 190,23 округляется до 190.
- Атомная масса — среднее число изотопов конкретного элемента, обычно она не выражается целым числом.
-

5
Вычтите атомный номер из атомной массы. Поскольку абсолютная часть атомной массы приходится на протоны и нейтроны, вычитание числа протонов (то есть атомного номера, который равен числу протонов) из атомной массы дает число нейтронов в атоме. Цифры после десятичной запятой относятся к очень малой массе электронов в атоме. В нашем примере: 190 (атомный вес) – 76 (число протонов) = 114 (число нейтронов).
-

6
Запомните формулу. Чтобы найти число нейтронов в будущем, просто используйте эту формулу:
-
N = M – n
- N = количество нейтронов
- M = атомная масса
- n = атомный номер
Реклама
-
N = M – n
-

1
Найдите элемент в периодической таблице. В качестве примера мы будем рассматривать изотоп углерода 14С. Поскольку неизотопный углерод 14С есть просто углерод С, найдите углерод в периодической таблице (второй период или второй ряд сверху).
-

2
Найдите атомный номер элемента. Это, как правило, наиболее заметное число в ячейке элемента и обычно находится над его символом (в варианте периодической системы, которую мы используем в нашем примере, других номеров и нет). Атомный номер – это количество протонов в одном атоме этого элемента. Углерод находится под номером 6, то есть один атом углерода имеет шесть протонов.
-

3
Найдите атомную массу. В случае изотопов делать это очень просто, так как они названы в соответствии с их атомной массой. В нашем случае у углерода 14С атомная масса равна 14. Теперь мы знаем атомную массу изотопа; последующий процесс расчета такой же, как и для определения числа нейтронов в атомах (не изотопах).
-

4
Вычтите атомный номер из атомной массы. Поскольку абсолютная часть атомной массы приходится на протоны и нейтроны, вычитание числа протонов (то есть атомного номера, который равен числу протонов) из атомной массы дает число нейтронов в атоме. В нашем примере: 14 (атомная масса) – 6 (число протонов) = 8 (число нейтронов).
-

5
Запомните формулу. Чтобы найти число нейтронов в будущем, просто используйте эту формулу:
-
N = M – n
- N = количество нейтронов
- M = атомная масса
- n = атомный номер
Реклама
-
N = M – n
Советы
- Протоны и нейтроны составляют практически абсолютную массу элементов, в то время как электроны и прочие частицы составляют крайне незначительную массу (эта масса стремится к нулю). Так как один протон имеет примерно ту же массу, что и один нейтрон, а атомное число представляет собой число протонов, то можно просто вычесть число протонов от общей массы.
- Осмий — металл в твердом состоянии при комнатной температуре, получил свое название от греческого слова «osme» — запах.
- Если вы не уверены, что значит какое-то число в периодической таблице, запомните: таблица, как правило, строится вокруг атомного номера (то есть числа протонов), который начинается с 1 (водород) и растет на одну единицу слева направо, заканчиваясь на 118 (Оганесон). Это потому, что число протонов в атоме определяет сам элемент и такое число — наиболее легкий способ систематизации элементов (например, атом с 2 протонами — всегда гелий, так же, как и атом с 79 протонами — всегда золото).
Реклама
Об этой статье
Эту страницу просматривали 192 999 раз.
Была ли эта статья полезной?
Продолжаем наш разговор, посвящённый строению атома. В предыдущей серии мы узнали, как находить число протонов и электронов в атоме. Оно равно, как мы помним, порядковому номеру химического элемента в таблице Менделеева.
Таким образом, чтобы полностью определить состав атома, нам сталось ответить на вопрос, сколько в составе того или иного атома нейтронов?
Для этого вспомним, что частицами, входящими в состав атома и обладающими хоть сколько-нибудь значительной массой, являются протоны и нейтроны. Их масса условно принята равна одному. Это значит, что:
масса всего атома, так называемая атомная масса, есть сумма входящих в его состав протонов и нейтронов.
Число протонов мы знаем из таблицы Менделеева, оно равно порядковому номеру химического элемента, которому принадлежит атом. Там же, в таблице Менделеева, мы найдём и атомную массу! Так атомная масса серы (S) равна 32.
Итак, если нам известна атомная масса (её мы легко найдём в таблице Менделеева), если нам так же известно число протонов в атоме (оно равно порядковому номеру химического элемента в таблице), если атомная масса – это сумма протонов и нейтронов, можем ли мы найти число нейтронов? Ну, конечно, число нейтронов равно разнице между атомной массой и порядковым номером элемента:
То есть, число нейтронов в атоме кальция
будет: N = 40 (атомная масса) – 20 (порядковый номер) = 20.
Таким образом вторая серия нашего последовательного изложения химии подошла к концу. Подписывайтесь на канал. В следующей серии мы узнаем, почему атомная масса в таблице Менделеева имеет дробное значение.

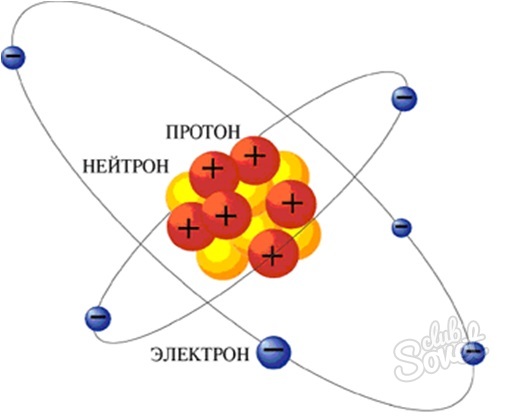
Как найти нейтроны
Под запросом “Как найти нейтроны” понимается метод поиска числа нейтронов в атоме. Нейтрон – это тяжелая частица, которая не имеет электрического заряда и вместе с протоном составляет атомное ядро элемента. Число нейтронов в атоме определяется с помощью таблицы Менделеева.
1
Как найти нейтроны – ищем число нейтронов в атомах
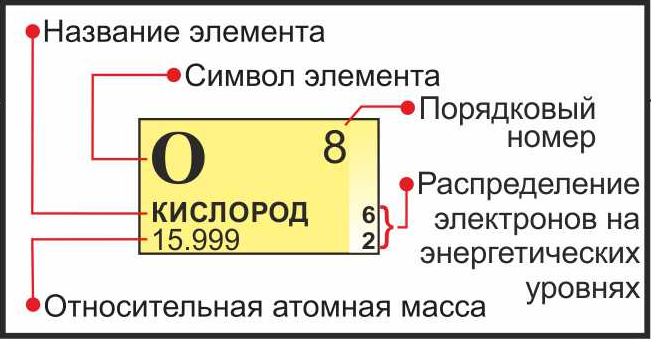
- Берем таблицу Менделеева и находим нужный элемент.
- Как вы знаете, химические элементы расположены не случайным образом. Порядковый номер элемента соответствует числу протонов, находящихся в одном атоме элемента – атомному номеру. Вот он нам и нужен. Это самое крупное число в ячейке, его нетрудно обнаружить, так как элементы следуют друг за другом практически по порядку (по возрастанию).
- Запоминаем атомный номер.
- Находим массу атома. Это значение также располагается в ячейке элемента периодической системы, чье количество нейтронов мы ищем. Как правило, масса записана более мелким шрифтом, чем номер атома, в виде десятичной дроби. У более сложных элементов заключена в квадратные скобки.
- Для расчетов атомную массу округляем до целого числа.
- Так как ядро атома состоит из нейтронов и протонов, то путем вычитания из массы атома протонов (атомного номера), мы получим величину содержания нейтронов в атоме данного элемента.
2
Как найти нейтроны – пример
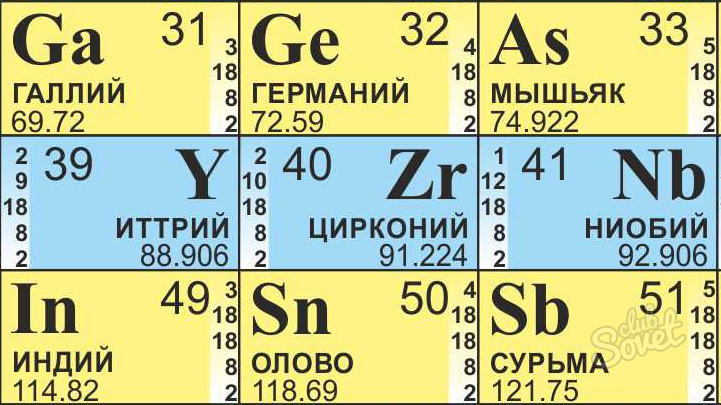
- Например, нам нужно найти, сколько нейтронов находится в атоме Циркония.
- Будем использовать формулу: N = M – n, где:
М – атомная масса, n – атомный номер (число протонов), N – число нейтронов.
- Находим Цирконий в таблице Менделеева, для химических расчетов она всегда должна быть под рукой.
- Его атомная масса равна 91,22, округляем до 91.
- Атомный номер равен 40.
- Получаем, что в атоме Циркония находится 51 (N = 91 – 40) нейтрон.
3
Как найти нейтроны – находим сколько нейтронов у изотопов
- Изотопы – это разновидности одного и того же элемента, но имеющие различную массу атомов. Но атомный номер, который мы научились искать выше, у них совпадает.
- Нужно знать, что все изотопы определенного элемента помещаются в одну ячейку в таблице Менделеева.
- Раз атомный номер у изотопов одного и того же элемента совпадает, значит нам нужно лишь найти атомную массу для расчета величины нейтронов.
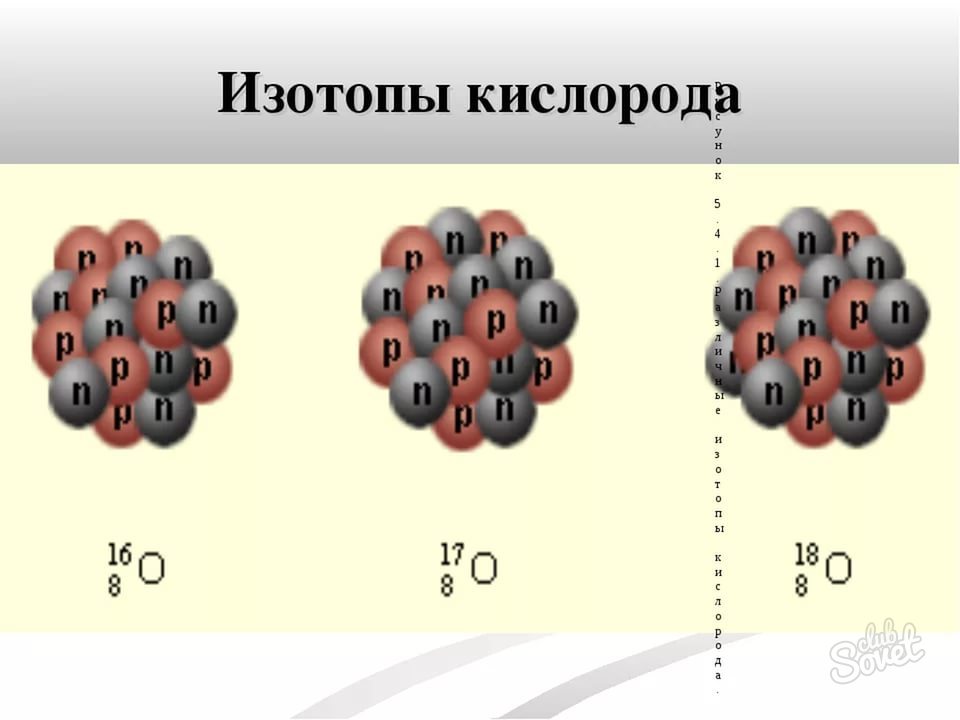
- Атомную массу изотопа найти очень просто – она заключена в самом названии изотопа. Например, О-16, О-17, О-18 – изотопы кислорода с атомной массой 16, 17 и 18 соответственно. Иногда атомную массу записывают как верхний индекс слева от символа хим. элемента.
- Таким образом, нам известны все составляющие для формулы. Нам не составит труда вычислить, какое количество нейтронов находится в изотопе.
4
Как найти нейтроны – пример, изотоп О-17
- Атомный номер всех изотопов кислорода, как и самого элемента равен 8.
- Атомная масса указана в названии изотопа – она равна 17.
- Вычисляем по формуле N = M – n, что количество нейтронов в атоме изотопа О-17 равно 9 (17 – 8).
Теперь вы знаете, как рассчитать число нейтронов в атоме любого элемента и изотопа. Конечно, для расчетов вам всегда понадобится иметь под рукой периодическую таблицу Менделеева.
Как определить число нуклонов в ядре атома?
Число нуклонов в ядре атома равно массовому числу атома (относительная атомная масса химического элемента) или сумме протонов и нейтронов.
Как определить число протонов в атоме?
Число протонов в атоме равно заряду его ядра (обозначается как Z) или порядковому номеру элемента в периодической таблице Менделеева.
Как определить число нейтронов в атоме?
Очень просто!
N = A – Z
Где N – число нейтронов, A – атомная масса элемента (в целых числах), Z – заряд ядра атома или порядковый номер атома в периодической таблице Менделеева.
Развернутый ответ
Масса атома складывается из двух величин: масса протонов + масса нейтронов. Дело в том, что масса электронов пренебрежимо мала.
Масса нейтрона = 1,674 927 498 04(95)⋅10⁻²⁷ кг= 1,008 664 915 60(57) а.е.м.
Масса протона = 1,672 621 923 69(51)⋅10⁻²⁷ кг = 1,007276466621(53) а.е.м.
Масса электрона = 9,109383 7015(28)⋅10⁻³¹ кг = 0,000548579909065 а.е.м.
То есть даже 100 электронов дадут в сумме всего 0,0548579909065 а.е.м.
Первоначально Д. И. Менделеев в построении своей периодической таблицы исходил из атомных весов элементов. Однако, дальнейшее развитие науки показало, что свойства химических элементов находятся в прямой зависимости не от атомной массы химического элемента, а от заряда ядра его атома. Таким образом, в периодической таблице химические элементы выстроены в порядке возрастания заряда ядра атома и номер элемента в таблице соответствует заряду его ядра. А заряд ядра равен сумме протонов. То есть № (элемента) = Z (заряд ядра или число протонов).
Остаток массы ядра приходится на нейтроны. Поэтому чтобы определить число нейтронов в атоме нужно всего лишь вычесть из атомной массы число протонов, которое равно заряду ядра или порядковому номеру элемента в таблице Менделеева.
Примеры
Сколько протонов и нейтронов в атоме натрия?
Ar (Na) = 23 а.е.м.
Z (Na) = 11 (протонов)
N = Ar (Na) – Z (Na) = 23 – 11 = 12 (нейтронов)
Ответ: число протонов в атоме натрия равно 11, а число нейтронов в атоме натрия равно 12.
Сколько протонов и нейтронов в атоме фосфора?
Ar (P) = 31 а.е.м.
Z (P) = 15 (протонов)
N = Ar (P) – Z (P) = 31 – 15 = 16 (нейтронов)
Ответ: число протонов в атоме фосфора равно 15, а число нейтронов в атоме фосфора равно 16.
Сколько протонов и нейтронов в атоме золота?
Ar (Au) = 197 а.е.м.
Z (Au) = 79 (протонов)
N = Ar (Au) – Z (Au) = 197 – 79 = 118 (нейтронов)
Ответ: число протонов в атоме золота равно 79, а число нейтронов в атоме золота равно 118.
Сколько протонов и нейтронов в атоме кремния?
Ar (Si) = 28 а.е.м.
Z (Si) = 14 (протонов)
N = Ar (Si) – Z (Si) = 28 – 14 = 14 (нейтронов)
Ответ: число протонов и нейтронов в атоме кремния равно 14.
Сколько протонов и нейтронов в атоме углерода?
Ar (C) = 12 а.е.м.
Z (C) = 6 (протонов)
N = Ar (C) – Z (C) = 12 – 6 = 6 (нейтронов)
Ответ: число протонов и нейтронов в атоме углерода равно 6.
Сколько протонов и нейтронов в атоме калия?
Ar (K) = 39 а.е.м.
Z (K) = 19 (протонов)
N = Ar (K) – Z (K) = 39 – 19 = 20 (нейтронов)
Ответ: число протонов в атоме калия равно 19, а число нейтронов в атоме калия равно 20.
Сколько протонов и нейтронов в атоме железа?
Ar (Fe) = 39 а.е.м.
Z (Fe) = 19 (протонов)
N = Ar (Fe) – Z (Fe) = 56 – 26 = 30 (нейтронов)
Ответ: число протонов в атоме железа равно 19, а число нейтронов в атоме железа равно 30.
Сколько протонов и нейтронов в атоме алюминия?
Ar (Al) = 27 а.е.м.
Z (Al) = 13 (протонов)
N = Ar (Al) – Z (Al) = 27 – 13 = 14 (нейтронов)
Ответ: число протонов в атоме алюминия равно 13, а число нейтронов в атоме алюминия равно 14 .
Сколько протонов и нейтронов в атоме фтора?
Ar (F) = 19 а.е.м.
Z (F) = 9 (протонов)
N = Ar (F) – Z (F) = 19 – 9 = 10 (нейтронов)
Ответ: число протонов в атоме фтора равно 9, а число нейтронов в атоме фтора равно 10.
Сколько протонов и нейтронов в атоме хлора?
Ar (Cl) = 35 а.е.м.
Z (Cl) = 17 (протонов)
N = Ar (Cl) – Z (Cl) = 35 – 17 = 18 (нейтронов)
Ответ: число протонов в атоме хлора равно 17, а число нейтронов равно 18.
Сколько протонов и нейтронов в атоме кислорода?
Ar (O) = 16 а.е.м.
Z (O) = 8 (протонов)
N = Ar (O) – Z (O) = 16 – 8 = 8 (нейтронов)
Ответ: число протонов и нейтронов в атоме кислорода равно 8.
Сколько протонов и нейтронов в атоме серы?
Ar (S) = 32 а.е.м.
Z (S) = 16 (протонов)
N = Ar (S) – Z (S) = 32 – 16 = 16 (нейтронов)
Ответ: число протонов и нейтронов в атоме серы равно 16.
Сколько протонов и нейтронов в атоме магния?
Ar (Mg) = 32 а.е.м.
Z (Mg) = 16 (протонов)
N = Ar (Mg) – Z (Mg) = 24 – 12 = 12 (нейтронов)
Ответ: число протонов в атоме магния равно 16, а число нейтронов равно 12.
Сколько протонов и нейтронов в атоме цинка?
Ar (Zn) = 65 а.е.м.
Z (Zn) = 30 (протонов)
N = Ar (Zn) – Z (Zn) = 65 – 30 = 35 (нейтронов)
Ответ: число протонов в атоме цинка равно 30, а число нейтронов в атоме цинка равно 35.
Похожие вопросы:
– Какие атомы имеют одинаковое число нейтронов?
– Как определить общее число электронов в атоме?
Мы знаем, что масса атома определяется массой ядра. Ядро состоит из протонов и нейтронов, относительные массы которых равны (1). Масса ядра равна сумме масс протонов и нейтронов. Число протонов определяем по порядковому номеру элемента. Значит, число нейтронов в ядре можно найти, если от относительной атомной массы отнять порядковый номер.
Пример:
фтор — элемент № (9). Его относительная атомная масса равна (19).
В ядре атома фтора — (9) протонов и (19) (–) (9) (=) (10) нейтронов.
Рубидий — элемент № (37). Его относительная атомная масса равна (85).
В ядре атома рубидия — (37) протонов и (85) (–) (37) (=) (48) нейтронов.
Нуклиды
Вид атомов с определённым числом протонов и нейтронов в ядре называется нуклидом.
Нуклид обозначается следующим образом: внизу слева записывается число протонов (Z) (порядковый номер), вверху слева указывается массовое число (A) (сумма чисел протонов и нейтронов) —
RZA
, например:
C612
,
Se3479
.
Для обозначения нуклидов используют и другие способы записи:
углерод — (12),
C
— (12),
C12
;
селен — (79),
Se
— (79),
Se79
.
Изотопы
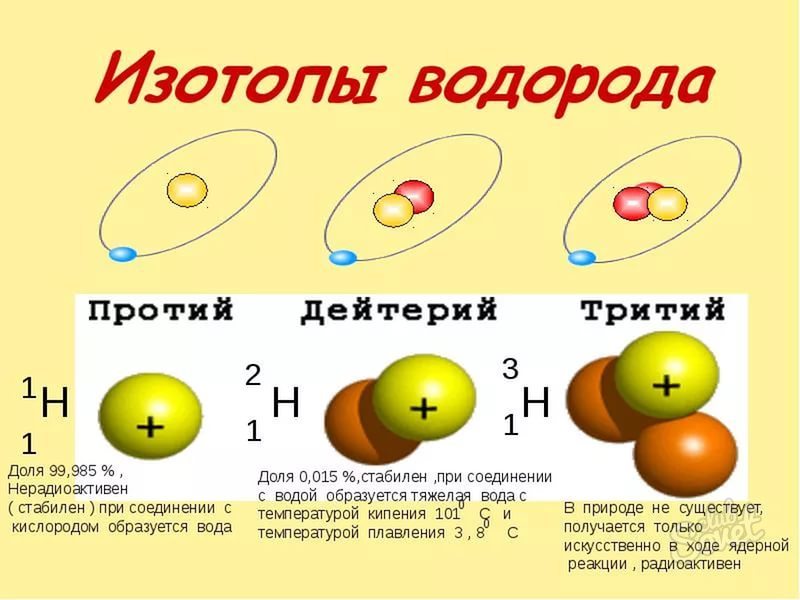
Атомы одного и того же химического элемента могут иметь разные массы. Существуют атомы водорода с массами (1), (2) и (3), атомы хлора с массами (35) и (37) и т. д.
Разновидности атомов одного химического элемента, имеющие разные атомные массы, называют изотопами.
С учётом знаний о строении ядра это определение можно сформулировать по-другому.
Изотопы — разновидности атомов с одинаковым числом протонов в ядре (зарядом ядра), но разным числом нейтронов.
Значит, изотопы отличаются только числом нейтронов.
Рис. (1). Изотопы водорода
Протоны определяют свойства атома, то есть придают ему индивидуальность. А нейтроны не влияют на свойства атома, а отражаются на его массе. Поэтому все изотопы одного и того же элемента химически неотличимы.
Химический элемент — это вид атомов с определённым зарядом ядра.
Относительная атомная масса элемента
Большинство химических элементов существуют в виде смеси изотопов. Приведённая в Периодической таблице относительная атомная масса элемента — это средняя величина атомных масс всех его изотопов.
Пример:
определим относительную атомную массу хлора. (25) % его атомов — это атомы с массой (37), а (75) % — с массой (35). Найдём среднее значение:
·25+35
·75)100
= 35,5.
Источники:
Рис. 1. Изотопы водорода © ЯКласс
