Как узнать число неспаренных электронов в хим. элементе?
Гуру
(2566),
закрыт
11 лет назад
Katherine
Профи
(721)
12 лет назад
элементарно, Ватсон.
допустим, возьмем элемент С (Карбон) . Сначала находим его в таблице, он у нас под номером 6, значит заряд ядра у него +6. Находится он во 2 периоде, значит, у него 2 энергетических уровня. Пишем его электронную формулу: 1s2 2s2 2p2
Если изобразить ее в виде квадратиков, то:
первый энергетический уровень (1s2) заполнен полностью электронами, т. е. в первом квадратике будут две стрелочки. Это – спаренные электроны.
во втором заполнен только s-подуровень (2s2), т. е. опять же в квадратике будут 2 стрелочки. Это тоже спаренные электоны.
а вот p заполнен только частично. Его мы изображаем 3 квадратиками. В каждый квадратик по стрелочке. Если стрелочка одна – это и есть неспаренные электроны. Вот у нас на р-подуровне 2 электрона, т. е. заполняем по 1 стрелочке в квадрат. Итого имеем ДВА неспаренных электрона в атоме Карбона:)
Источник: Привет))
Асмая ГашумоваЗнаток (289)
7 месяцев назад
а как , если квадратика 3 и в каждой по стрелочке , тогда же 3 неспаренных получается , я просто не понял
Как определить неспаренные и спаренные электроны?
Ева Р.
25 октября 2018 · 89,8 K
Если на орбитали находится один электрон, то он называется неспаренным, а если два – то это спаренные электроны. Легче всего определить, какие они, при помощи графической формулы. Эта схема размещения электронов в квантовых ячейках, которые являются графическим изображением атомной орбитали. Дляего составления следует знать:
1. Порядковый номер элемента, т.е. заряд его ядра и соответствующее ему число электронов в атоме.
2. Номер периода, определяющий число энергетических уровней атома.
3. Квантовые числа и связь между ними.
65,8 K
Комментировать ответ…Комментировать…
Имею естественно научное образование, в юношестве прикипел к литературе, сейчас активно… · 25 янв 2019
Число электронов определяется исходя из номера элемента, далее исходя из количества нужно рисовать уровни, на каждом уровне может быть 2 электрона, они будут спаренными, если на последнем уровне останется 1 электрон, то он и будет неспаренным.
40,5 K
Комментировать ответ…Комментировать…
Атомно-молекулярное учение
Мы приступаем к изучению химии – мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными
формулами элементов.
Атом (греч. а – отриц. частица + tomos – отдел, греч. atomos – неделимый) – электронейтральная частица вещества микроскопических
размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется “планетарной” и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом

Протон (греч. protos – первый) – положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов
элементов. Нейтрон (лат. neuter – ни тот, ни другой) – нейтральная (0) элементарная частица, присутствующая в ядрах всех
химических элементов, кроме водорода.
Электрон (греч. elektron – янтарь) – стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома –
порядковый номер в таблице Менделеева – равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20)
в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.

Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило:
порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим
электроны занимают различные энергетические уровни.
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
- Второй уровень
- Третий уровень
- Четвертый уровень
Состоит из s-подуровня: одной “1s” ячейки, в которой помещаются 2 электрона (заполненный электронами – 1s2)
Состоит из s-подуровня: одной “s” ячейки (2s2) и p-подуровня: трех “p” ячеек (2p6), на которых
помещается 6 электронов
Состоит из s-подуровня: одной “s” ячейки (3s2), p-подуровня: трех “p” ячеек (3p6) и d-подуровня:
пяти “d” ячеек (3d10), в которых помещается 10 электронов
Состоит из s-подуровня: одной “s” ячейки (4s2), p-подуровня: трех “p” ячеек (4p6), d-подуровня:
пяти “d” ячеек (4d10) и f-подуровня: семи “f” ячеек (4f14), на которых помещается 14
электронов

Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число
электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а
также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: “s”, “p” и “d”, которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или
атомным орбиталям, движутся электроны, создавая определенный “рисунок”.
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь – клеверный лист.

Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной “ячейке”) не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются
еще одним электроном с противоположным направлением - Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было
бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и
серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода – 6, у серы – 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.

Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил.
А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся
одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод – 1s22s22p2
- Серы – 1s22s22p63s23p4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне – это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда
для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод – 2s22p2 (4 валентных электрона)
- Сера -3s23p4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью – способностью атомов образовывать определенное число химических связей.

- Углерод – 2s22p2 (2 неспаренных валентных электрона)
- Сера -3s23p4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных
электронов. Ниже будет дано наглядное объяснение этой задаче.

Запишем получившиеся электронные конфигурации магния и скандия:
- Магний – 1s22s22p63s2
- Скандий – 1s22s22p63s23p64s23d1
В целом несложная и интересная тема электронных конфигураций отягощена небольшим исключением – провалом электрона, которое только подтверждает общее
правило: любая система стремится занять наименее энергозатратное состояние.
Провал электрона
Провалом электрона называют переход электрона с внешнего, более высокого энергетического уровня, на предвнешний, энергетически более
низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций.
Подобное явление характерно лишь для некоторых элементов: медь, хром, серебро, золото, молибден. Для примера выберем хром, и рассмотрим
две электронных конфигурации: первую “неправильную” (сделаем вид, будто мы не знаем про провал электрона) и вторую правильную, написанную
с учетом провала электрона.
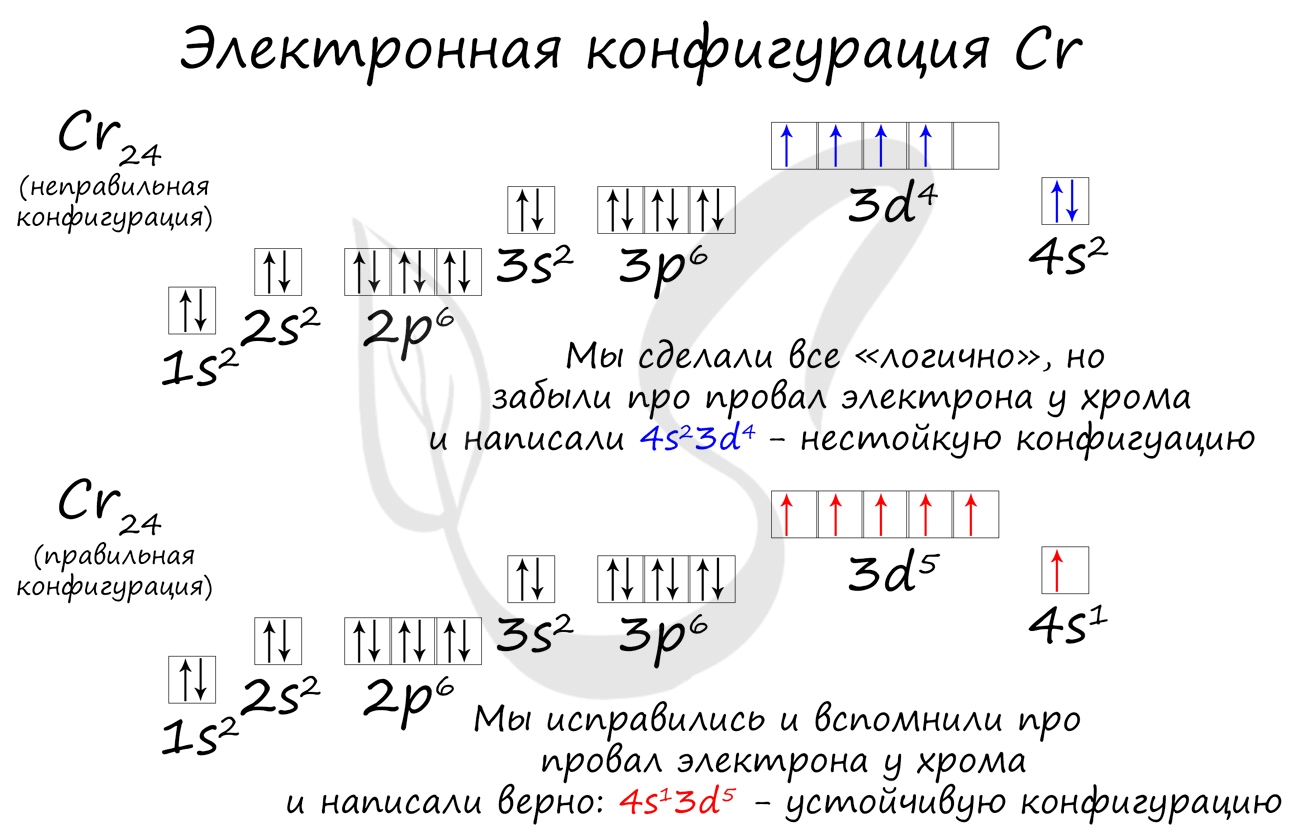
Теперь вы понимаете, что кроется под явлением провала электрона. Запишите электронные конфигурации хрома и меди самостоятельно еще раз и
сверьте с представленными ниже.

Основное и возбужденное состояние атома
Основное и возбужденное состояние атома отражаются на электронных конфигурациях. Возбужденное состояние связано с движением электронов
относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние является для атома нестабильным, поэтому долгое время в нем он пребывать не может. У некоторых атомов: азота,
кислорода , фтора – возбужденное состояние невозможно, так как отсутствуют свободные орбитали (“ячейки”) – электронам некуда перескакивать, к тому
же d-орбиталь у них отсутствует (они во втором периоде).
У серы возможно возбужденное состояние, так как она имеет свободную d-орбиталь, куда могут перескочить электроны. Четвертый энергетический
уровень отсутствует, поэтому, минуя 4s-подуровень, заполняем распаренными электронами 3d-подуровень.
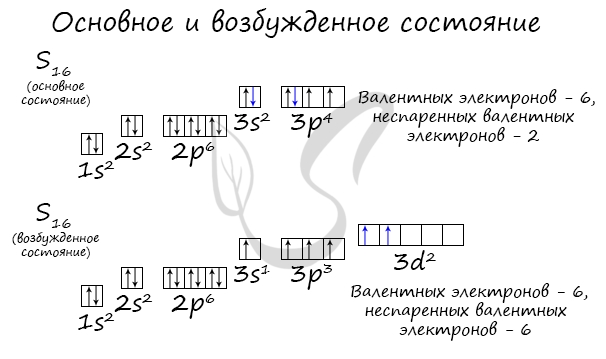
По мере изучения основ общей химии мы еще не раз вернемся к этой теме, однако хорошо, если вы уже сейчас запомните, что возбужденное состояние
связано с распаривание электронных пар.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Напомню, что любой энергетический уровень можно разделить на орбитали (подуровни) – области вокруг ядра, в которых с наибольшей вероятностью встречаются определенные электроны. Их распределение не случайно, а согласованно с их энергией.
Для начала, определим максимальное количество электронов на подуровнях:
Каждый уровень начинается с s-подуровня, далее, если количество электронов достаточно большое, заполняется p-подуровень, затем d- и f-орбитали.
Для лучшего понимания распределения электронов начните с построения планетарной модели атома. Рассмотрим на примере брома.
- Начинаем запись структуры электронной оболочки атома с обозначения номера уровня, к которому принадлежат электроны (на рисунке обозначено красной стрелкой).
- Затем называем подуровень (s, p, d, f).
- Определяем количество электронов на этом уровне (зеленая стрелка на рисунке).
Электронно-структурная формула брома может быть записана двумя распространенными методами
Способ 1. Каждый последующий уровень имеет большую энергию и записывается выше:
Способ 2. Более компактный, заключается в записи электронов каждого уровня с новой строки:
По электронно-структурной формуле легко понять, что у брома на внешнем уровне есть один неспаренный р-электрон и ему, до завершения внешнего энергетического уровня, не хватает одного электрона.
Попробуем применить полученные знания в решении первых заданий ЕГЭ по химии:
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
- P
- O
- Al
- As
- B
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Задание 1: определите, атомы каких из указанных в ряду элементов имеют три неспаренных электрона в основном состоянии.
Решение: у элементов А-подгрупп неспаренные электроны могут находиться только на внешнем уровне, поэтому далее будем рассматривать только его.
Верный ответ: 14
Обратите внимание на электронно-структурную формулу фтора и мышьяка. Их внешний энергетический уровень можно было записать и другим, к сожалению, неверным способом:
Всё, потому что есть еще одно правило, которым нужно пользоваться при построении структуры атома – правило Гунда (Хунда) , которое определяет порядок заполнения электронами внутри орбитали таким образом, чтобы было заполнено как можно больше ячеек.
Рассмотрим еще одно задание:
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
- K
- F
- Li
- Cl
- Al
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Задание 2: определите, атомам каких из указанных элементов до завершения внешнего энергетического уровня не хватает одного электрона.
Решение: для решения данного задания нет необходимости составлять структурные формулы, достаточно знать, что большинства элементов на внешнем уровне наиболее выгодным количеством электронов будет восемь (легко запомнить, так как количество электронов на внешнем уровне определяется по номеру группы, всего групп в ПС восемь, значит, максимум электронов на внешнем слое тоже восемь).
Таким образом, калий, находящийся в первой группе, имеет всего один электрон на внешнем уровне, до завершения внешней электронной оболочки ему не хватает целых семь электронов.
Фтор – элемент седьмой подгруппы, у него семь электронов на внешнем уровне, до «идеальной» оболочки ему не хватает одного электрона. Это первый правильный ответ.
Литий, как и калий относится к первой группе. Ему не хватает целых семь электронов.
Хлор, как же как и фтор, относится к седьмой группе, ему не хватает одного электрона до восьмиэлектронного внешнего энергетического уровня. Это наш второй верный ответ.
Алюминий – элемент третьей группы. До завершения внешнего слоя ему не хватает пять электронов.
Верный ответ: 24
Таким образом всем элементам IА-подгруппы не хватает семи электронов, IIА – шести, IIIА – пяти, IVА – четырех и так далее. Это может вам заметно сэкономить время на экзамене.
Решение задания ЕГЭ химия
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
- O
- F
- Rb
- As
- Bi
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Задание 3: определите, атомам каких из указанных элементов до завершения внешнего энергетического уровня не хватает трёх электронов.
Решение: исходя из вышенаписанного, трех электронов до завершения внешнего энергетического уровня может не хватать элементам пятой группы Периодической системы. Это мышьяк и висмут.
Верный ответ: 45
Пройдите тест на эту тему
На этой странице вы узнаете
- Какой паспорт у атомов?
- Что общего у электронов и студентов?
Всё, что окружает нас в повседневной жизни имеет сложное строение: от чайника на плите до улиц города. Не менее сложным строением обладает и крохотный атом. В этой статье поговорим о его электронных конфигурациях.
Общее об атоме
Вспомним самую важную информацию об атоме.
Долгое время ученые не могли выяснить, из чего состоит атом. Впоследствии было установлено, что атом состоит из элементарных частиц: протонов, нейтронов и электронов.
Чтобы объяснить расположение элементарных частиц была предложена планетарная модель атома. Она гласит следующее: вокруг каждого ядра находятся электроны, которые располагаются вокруг него определенным образом, как и планеты вокруг Солнца. Подробнее о строении атома можно почитать в статье «Строение атома и электронные конфигурации 1.0».
В это статье мы сфокусируемся на электронах в атоме.
Валентные и неспаренные электроны
Последний энергетический уровень называют внешним. На нем находятся валентные электроны, то есть электроны на внешней (валентной) оболочке атома.
Таким образом, можно сказать, что неспаренные и валентные электроны — близкие родственники: похожи, но не одинаковы.
Сравним, какая же связь существует между валентными и неспаренными электронами. При образовании химической связи возможны два механизма: обменный и донорно-акцепторный. Более распространен обменный механизм, благодаря которому атомы выделяют по одному электрону на внешнем электронном уровне и образуют “коннекшн” (общую электронную пару).
Из этого следует правило:
Все неспаренные электроны являются валентными, но не все валентные электроны должны быть неспаренными.

Какой паспорт у атомов?
У каждого атома или иона есть “паспорт” расположения электронов по энергетическим уровням. Такой паспорт называется электронной конфигурацией.
Электронная конфигурация — это формула, отражающая распределение электронов по электронным оболочкам атома.

Пусть электрон — это студент. А где обычно живут студенты? В общаге! Давайте нарисуем общежитие для электронов:
— В нём есть отдельные комнаты — максимум 2 электрона.
— Блоки с общей кухней, в которые эти комнаты собираются — их мы назовем энергетическими подуровнями.
— И целые этажи, в которые собираются отдельные блоки, которые являются энергетическими уровнями.

Более подробно про расположение электронов можно почитать в статье «Особенности строения электронных оболочек атомов элементов». .
Электронную конфигурацию ионов можно написать по тем же правилам, что и электронную конфигурацию атомов, только при этом нужно учитывать, какой заряд (положительный или отрицательный) у частицы.
Если атом принимает электроны, то он становится анионом, если отдаёт электроны – то катионом.

Атом может отдать или принять электроны таким образом, чтобы внешний энергетический уровень был максимально заполнен, так как это энергетически выгодно. Полностью заполненный подуровень является очень устойчивым — такую конфигурацию имеют все благородные газы, и к ней стремятся ионы.
Рассмотрим пример с образованием сульфид-аниона S2-.
- 3 энергетический уровень является внешним для атома серы, на нем располагается 6 электронов, 2 из которых являются неспаренными.
- К этим электронам могут добавиться два “соседа”, благодаря которым p-подуровень заполняется полностью и обретает стабильную конфигурацию.
- Так как каждый из электронов имеет заряд (-1), то суммарно после их присоединения к сере образуется сульфид-анион S2-

Фактчек
- Электроны заполняются определенным образом на энергетических уровнях вокруг атома.
- Электронная конфигурация помогает нам узнать, на каком уровне и подуровне располагается определенное число электронов.
- Если к нейтральному атому добавить электроны, то он превращается в анион, если же отобрать электроны — образуется катион.
- Атом стремится обладать наиболее устойчивой электронной конфигурацией, при которой энергетический уровень/подуровень является заполненным.
Проверь себя
Задание 1.
Внешним энергетическим уровнем называется :
- Первый энергетический уровень
- Последний энергетический уровень
- Энергетический уровень с наименьшей энергией
Задание 2.
Максимальное число электронов на внешнем энергетическом уровне равно:
- 5
- 6
- 7
- 8
Задание 3.
Количество валентных электронов, в большинстве случаев, равно:
- Номеру группы
- Номеру периода
- Порядковому номеру элемента
- Массовому числу элемента
Задание 4.
Сколько электронов необходимо для заполнения энергетического уровня атома углерода?
- 2
- 3
- 4
- 5
Задание 5.
Электронной конфигурации какого благородного газа будет соответствовать электронная конфигурация хлорид-иона?
- Аргона
- Неона
- Криптона
- Ксенона
Ответы: 1. — 2; 2. — 4; 3. — 1; 4. — 3; 5. — 1.
