Неорганическая, бинарная соль, образованная слабым основанием (NH4OH) и сильной кислотой (H2SO4).
Альтернативное название
Аммоний сернокислый
(NH4)2SO4(NH_4)_2SO_4
Свойства сульфата аммония
Физические свойства
| Свойство | Описание |
|---|---|
| Внешний вид | Бесцветные прозрачные кристаллы или белый порошок без запаха и слабой гигроскопичностью |
| Молярная масса | 132,14052 г/моль |
| Плотность | 1,769 г/см³ (20°C) |
| Температура плавления | 235-280°C |
| Температура разложения | 218°C |
| Растворимость | Растворим в воде (75,4 г/100 г при 20 °C), нерастворим в органических растворителях (ацетон, этанол, диэтиловый эфир) |
Химические свойства
В водном растворе сульфат аммония диссоциирует на ионы:
(NH4)2SO4↔SO42−+2NH4+(NH_4)_2SO_4 ↔ SO_4^{2-} + 2NH_4^+
Уравнение гидролиза:
NH4++SO42−+HOH↔NH4OH+SO42−+H+NH_4^+ + SO_4^{2-} + HOH ↔ NH_4OH + SO_4^{2-} + H^{+}
Гидролиз осуществляется по катиону, накапливающиеся в системе ионы водорода обуславливают кислую среду раствора (pH < 7).
Сульфат аммония вступают в обменную реакцию с кислотами и другими солями:
(NH4)2SO4+2HCl=2NH4Cl+H2SO4(NH_4)_2SO_4 + 2HCl = 2NH_4Cl + H_2SO_4
(NH4)2SO4+Ba(NO3)2=BaSO4↓+2NH4NO3(NH_4)_2SO_4 + Ba(NO_3)_2 = BaSO_4↓ + 2NH_4NO_3
Взаимодействие с солями нитрата выступает качественной реакцией на сульфат-ион, т.к. позволяет его идентифицировать по образовавшемуся белому осадку сульфата бария.
Сульфат аммония вступает в обменную реакцию с оксидами, щелочами и гидроксидами щелочноземельных металлов:
(NH4)2SO4+CaO=CaSO4+2NH3↑+Н2О(NH_4)_2SO_4 + CaO = CaSO_4 + 2NH_3↑ + Н_2О
(NH4)2SO4+2NaOH=Na2SO4+2NH3↑+2Н2О(NH_4)_2SO_4 + 2NaOH = Na_2SO_4 + 2NH_3↑ + 2Н_2О
Реакции, протекающие с выделением аммиака, позволяют качественно идентифицировать ион аммония по появлению едкого запаха аммиака и посинению лакмусовой бумаги.
Сульфат аммония вступает в реакцию разложения при нагревании до 147 °С:
(NH4)2SO4=NH4HSO4+NH3↑(NH_4)_2SO_4 = NH_4HSO_4 + NH_3↑
При повышении температуры выше 500 °С образованный гидросульфат аммония кипит с разложением на серный ангидрид, аммиак и воду:
NH4HSO4=NH3↑+SO3↑+H2ONH_4HSO_4 = NH_3↑ + SO_3↑ + H_2O
Сульфат аммония окисляется сильными окислителями, например, перманганатом калия, до молекулярного азота с образованием бурого осадка оксида марганца (IV):
(NH4)2SO4+2KMnO4=2MnO2↓+K2SO4+N2↑+4H2O(NH_4)_2SO_4 + 2KMnO_4 = 2MnO_2↓ + K_2SO_4 + N_2↑ + 4H_2O
Получение
Получение в лаборатории
Соль получают действием концентрированной серной кислоты на концентрированный раствор аммиака в приборе для получения растворимых веществ в твердом виде:
2NH3+H2SO4=(NH4)2SO42NH_3 + H_2SO_4 = (NH_4)_2SO_4
Промышленный синтез
К основным способам получения относят синтез при переработки отходов, остающихся после производства капролактама, получение в результате обработки гипса (CaSO4) растворами карбоната аммония или газами – аммиаком и диоксидом углерода:
CaSO4+(NH4)2CO3=(NH4)2SO4+CaCO3CaSO_4 + (NH_4)_2CO_3 = (NH_4)_2SO_4 + CaCO_3
CaSO4+2NH3+CO2+H2O=(NH4)2SO4+CaCO3CaSO_4 + 2NH_3 + CO_2 + H_2O = (NH_4)_2SO_4 + CaCO_3
Известен способ получения данной соли как побочный продукт синтеза соды (NaHCO3):
Na2SO4+2СO2+2NH3+2Н2O=2NaHCO3+(NH4)2SO4Na_2SO_4 + 2СO_2 + 2NH_3 + 2Н_2O = 2NaHCO_3 + (NH_4)_2SO_4
Применение
Сульфат аммония широко применяется в сельском хозяйстве в виде минерального удобрения, легко поглощаемого почвой. Аммонийный азот сульфата аммония легко усваивается растениями, а сера необходима для питания растительных культур, т.к. входит в состав некоторых синтезируемых растениями незаменимых аминокислот.
В биологической и токсикологической химии переосаждение сульфатом аммония является общим методом очистки белков.
В пищевой промышленности сульфат аммония зарегистрирован в качестве безопасной пищевой добавки E517, разрешенной к применению во всех странах.
Сульфат аммония применяют в производстве вискозного волокна, используют в технологии хлорирования воды с аммонизацией, благодаря чему сокращается расход хлора и образование вредной для человека хлорорганики, уменьшается коррозия труб.
Кроме того, сульфат аммония применяется для производства гербицидов, кормов для животных, выделки кож, строительной изоляции, а в средствах тушения пожаров выступает в качестве антипирена.
Примеры решения задач
Задача 1
Сколько сульфата аммония получается при производстве 1 т пищевой соды по аммиачному методу?
Решение
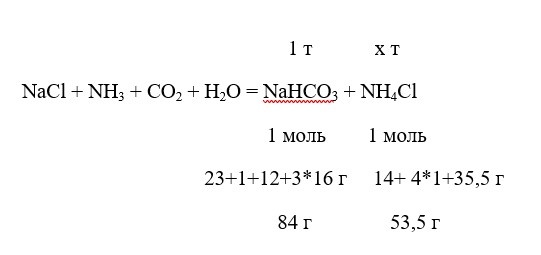
Составляем пропорцию:
84 г NaHCO3 – 53,5 г NH4Cl,
1 т NaHCO3 – х т NH4Cl
отсюда
х=1*53,5 / 84 = 0,637 т = 637 кг.
Ответ: 637 кг.
Задача 2
Сколько тепла выделится при сгорания 34 г аммиака в атмосфере хлора?
Решение
34 г
8NH3 + 3Cl2 = N2 + 6NH4Cl
8 моль
8 (1+16) г
136 г
Изменение энтальпии в ходе химической реакции:
∆Hхр0=∆Hпрод0−∆Hисх0=∆HN2(г)0+6∆HNH4Cl(к)0−8∆HNH3(г)0−3∆HCl2(г)0==0+6⋅(−314,2)−8⋅(−46,19)−3⋅0=−1515,68кДж∆Hхр_0= ∆H_{прод}^0-∆H_{исх}^0 = ∆HN_{2(г)}^0+ 6∆H_{NH4Cl(к)}^0-8 ∆H_{NH3(г)}^0-3 ∆HCl_{2(г)}^0=
= 0 + 6cdot(-314,2) – 8cdot(-46,19) -3cdot0 = -1515,68 кДж.
Составляем пропорцию:
136 г NH3 – 1515,68 кДж,
34 г NH3 – х кДж,
отсюда
х=34* 1515,68 / 136 = 378,92 кДж.
Ответ: 378,92 кДж.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 19 февраля 2021 года; проверки требует 21 правка.
| Сульфат аммония | |
|---|---|
 |
|
| Общие | |
| Систематическое наименование |
аммония сульфат |
| Традиционные названия | аммоний сернокислый |
| Хим. формула | (NH4)2SO4 |
| Рац. формула | H8N2O4S |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 132,14052 г/моль |
| Плотность | 1,769 г/см³ (20 °C) |
| Термические свойства | |
| Температура | |
| • плавления | 235-280 °C |
| • разложения | 218 °C |
| Мол. теплоёмк. | 187,4 Дж/(моль·К) |
| Энтальпия | |
| • образования | −1180,26 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 75,4 г/100 г (20 °C) |
| Классификация | |
| Рег. номер CAS | 7783-20-2 |
| PubChem | 24538 |
| Рег. номер EINECS | 231-984-1 |
| SMILES |
O=S(=O)(O)O.N.N |
| InChI |
InChI=1S/2H3N.H2O4S/c;;1-5(2,3)4/h2*1H3;(H2,1,2,3,4) BFNBIHQBYMNNAN-UHFFFAOYSA-N |
| Кодекс Алиментариус | E517 |
| ChEBI | 62946 |
| ChemSpider | 22944 |
| Безопасность | |
| ЛД50 | 2840 мг/кг(крысы; орально) |
| NFPA 704 |
1 1 0 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфа́т аммо́ния (аммоний серноки́слый, лат. ammonii sulfas), (NH4)2SO4 — неорганическое бинарное соединение, аммонийная соль серной кислоты. Это бесцветные прозрачные кристаллы (или белый порошок) без запаха. Получают сульфат аммония действием серной кислоты на раствор аммиака и обменными реакциями с другими солями. Применяется в качестве удобрения, при производстве вискозы, в пищевой промышленности, при очистке белков в биохимии, в качестве добавки при хлорировании водопроводной воды. Токсичность сульфата аммония очень низкая.
Физические свойства[править | править код]
Чистый сульфат аммония — бесцветные прозрачные кристаллы, в измельчённом виде — белый порошок[1]. Запаха не имеет. Гигроскопичность невысокая.
Образует кристаллы ромбической сингонии, пространственная группа Pnma, параметры ячейки a = 0,7782 нм, b = 0,5993 нм, c = 1,0636 нм, Z = 4.
Плотность (при 20 °C) — 1,766 г/см3[1].
Растворимость в воде (г/100 мл)[2]:
- 70,1 (0 °C)
- 72,7 (10 °C)
- 75,4 (20 °C)
- 76,9 (25 °C)
- 78,1 (30 °C)
- 81,2 (40 °C)
- 84,3 (50 °C)
- 87,4 (60 °C)
- 94,1 (80 °C)
- 102 (100 °C).
Растворимость в других растворителях (г/100 г):
- муравьиная кислота 95 %: 25,4 (16,5 °C);
- ацетон: нерастворим;
- этанол: нерастворим;
- диэтиловый эфир: нерастворим.
Сульфат аммония с солями некоторых других металлов (алюминий, железо и пр.) образует двойные соли, например алюмоаммиачные квасцы, соль Мора[1].
Химические свойства[править | править код]
При нагревании до 147 °С сульфат аммония разлагается на соответствующий гидросульфат NH4HSO4 и аммиак по схеме:
-
.
При повышении температуры выше 500 °С гидросульфат аммония кипит с разложением на серный ангидрид, аммиак и воду:
-
.
Сульфат аммония окисляется до молекулярного азота или оксида азота (I) сильными окислителями, например перманганатом калия, азотистой кислотой, азотной кислотой, нитритами, нитратами и смесью оксида азота (II) и оксида азота (IV):








Получение[править | править код]
В лаборатории получают действием концентрированной серной кислоты на концентрированный раствор аммиака.
Эту реакцию, как и все другие реакции взаимодействия аммиака с кислотами, проводят в приборе для получения растворимых веществ в твёрдом виде.
Среди основных способов получения сульфата аммония, которые наиболее часто используются в химической промышленности, имеются следующие: процесс нейтрализации серной кислоты синтетическим аммиаком; использование аммиака из газа коксовых печей для его химической реакции с серной кислотой; получение в результате обработки гипса растворами карбоната аммония; получение при переработке отходов, остающихся после производства капролактама. Вместе с тем имеются и другие способы производства сульфата аммония, например, получение этого вещества из дымовых газов электростанций и сернокислотных заводов. Для этого в горячие газы вводят газообразный аммиак, который связывает имеющиеся в газе окислы серы в различные соли аммония, в том числе и в сульфат аммония.
Очистка[править | править код]
Технический сульфат аммония часто загрязнен сульфатом железа. Избавиться от него простой перекристаллизацией невозможно, так как соли железа сокристаллизуются с сульфатом аммония, образуя двойную соль Мора.
Согласно Карякину[3], для очистки препарата 150 г его растворяют в 260 мл дистиллированной воды, нагревают до кипения, прибавляют 1-2 г пероксодисульфата аммония и кипятят до полного окисления железа(II) в железо(III). Полноту окисления необходимо проверить прибавлением к отфильтрованной пробе раствора гексацианоферрата(III) калия (красной кровяной соли) — синее окрашивание пробы указывает на неполноту окисления железа, в таком случае процесс очистки следует повторить.
После перехода всего железа в трехвалентное к раствору следует прибавить крепкий раствор аммиака до сильно щелочной реакции и отфильтровать. Полученный раствор упарить до консистенции жидкой кристаллической кашицы и дать охладиться до комнатной температуры. Кристаллы отсосать на воронке Бюхнера и промыть несколько раз дистиллированной водой.
В полученном реактиве может содержаться до 0,2 % сульфата кальция, который отделить никак не удастся.
Применение[править | править код]
Сульфат аммония широко применяется как азотное-серное минеральное удобрение (в РФ — по ГОСТ-9097-82) в легкоусвояемой форме, не содержащей NO3--групп и не едкое, его можно применять в любое время года. Содержит 21 % азота и 24 % серы. Подкисляет почву.
Также используется в производстве вискозного волокна как компонент осадительной ванны.
В биохимии переосаждение сульфатом аммония является общим методом очистки белков.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E517.
Сульфат аммония используется в технологии хлорирования воды с аммонизацией — его вводят в обрабатываемую воду за несколько секунд до хлора. С хлором он образует хлорамины, связывая свободный хлор, благодаря чему значительно сокращается образование хлорорганики, вредной для организма человека, сокращается расход хлора, уменьшается коррозия труб водопровода.
Сульфат аммония является компонентом порошковых огнетушителей и огнезащитных средств.
Кроме того, находит применение при получении марганца электролизом, в производстве аммониево-алюминиевых квасцов, корунда. Добавляется к стекольной шихте для улучшения её плавкости.
Воздействие на человека[править | править код]
Сульфат аммония признаётся безопасным для человека и используется в качестве пищевой добавки в России, на Украине и в странах ЕС. Сульфат аммония используется в качестве заменителя соли и носит название пищевой добавки Е517. В пищевой индустрии добавка сульфат аммония выступает в роли улучшителя качества муки и хлебобулочных изделий, увеличивая также их объём, является питанием для дрожжевых культур, применяется как стабилизатор и эмульгатор.
Примечания[править | править код]
- ↑ 1 2 3 Чукуров П. М. Сульфат аммония // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1: А — Дарзана. — С. 154. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
- ↑ Справочник по растворимости. — М.—Л.: ИАН СССР, 1961. — Т. 1.1. — С. 219—220.
- ↑ Карякин Ю. В. Чистые химические реактивы. Руководство по лабораторному приготовлению неорганических препаратов / Отв. ред. Г. Я. Бахаровский. — 2-е изд. — Л.: Полиграфкнига, 1947. — С. 51—52. — 576 с.
- Формула: (NH4)2SO4 или H8N2O4S
- Относительная молекулярная масса (NH4)2SO4: 132.13952
- Молярная масса (NH4)2SO4: 132.13952 г/моль (0.13214 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| H (водород) | 8 | 1.00794 | 8.06352 |
| N (азот) | 2 | 14.0067 | 28.0134 |
| O (кислород) | 4 | 15.9994 | 63.9976 |
| S (сера) | 1 | 32.065 | 32.065 |
| 132.13952 |
Расчёт молярной и относительной молекулярной массы (NH4)2SO4
- Mr[(NH4)2SO4] = Ar[H] * 8 + Ar[N] * 2 + Ar[O] * 4 + Ar[S] = 1.00794 * 8 + 14.0067 * 2 + 15.9994 * 4 + 32.065 = 132.13952
- Молярная масса (в кг/моль) = Mr[(NH4)2SO4] : 1000 = 132.13952 : 1000 = 0.13214 кг/моль
Расчёт массовых долей элементов в (NH4)2SO4
- Массовая доля водорода (H) = 8.06352 : 132.13952 * 100 = 6.102 %
- Массовая доля азота (N) = 28.0134 : 132.13952 * 100 = 21.2 %
- Массовая доля кислорода (O) = 63.9976 : 132.13952 * 100 = 48.432 %
- Массовая доля серы (S) = 32.065 : 132.13952 * 100 = 24.266 %
Калькулятор массы
Аммоний сульфат ГОСТ 3769-78
(NH4)2SO4
Сульфат аммония (аммоний сернокислый, лат. ammonium sulphate), (NH4)2SO4 — неорганическое бинарное соединение, аммонийная соль серной кислоты. Это бесцветные прозрачные кристаллы (или белый порошок) без запаха. Получают сульфат аммония действием серной кислоты на раствор аммиака и обменными реакциями с другими солями. Применяется в качестве удобрения, при производстве вискозы, в пищевой промышленности, при очистке белков в биохимии, в качестве добавки при хлорировании водопроводной воды. Токсичность сульфата аммония очень низкая.
Физические свойства
Чистый сульфат аммония — бесцветные прозрачные кристаллы, в мелко измельченном виде — белый порошок[1]. Запаха не имеет. Гигроскопичность невысокая.
Сингония орторомбическая, а = 0,7782 нм, b = 5993 нм, с = 1,0636 нм.
Плотность (при 20 °C) — 1,766 г/см3[1].
Растворимость в воде (г/100 мл)[2]:
- 70,1 (0 °C)
- 72,7 (10 °C)
- 75,4 (20 °C)
- 76,9 (25 °C)
- 78,1 (30 °C)
- 81,2 (40 °C)
- 84,3 (50 °C)
- 87,4 (60 °C)
- 94,1 (80 °C)
- 102 (100 °C).
Растворимость в других растворителях (г/100 г):
- муравьиная кислота 95 %: 25,4 (16,5 °C)
- ацетон: нерастворим
- этанол: нерастворим
- диэтиловый эфир: нерастворим.
Сульфат аммония с солями некоторых других металлов (алюминий, железо и пр.) образует двойные соли, например алюмоаммиачные квасцы, соль Мора[1].
Химические свойства
При нагревании до 147 °С сульфат аммония разлагается на соответствующий гидросульфат NH4HSO4 и аммиак по схеме:
-
- {displaystyle {mathsf {(NH_{4})_{2}SO_{4}rightarrow NH_{4}HSO_{4}+NH_{3}uparrow }}}
.
- {displaystyle {mathsf {(NH_{4})_{2}SO_{4}rightarrow NH_{4}HSO_{4}+NH_{3}uparrow }}}
При повышении температуры выше 500 °С гидросульфат аммония кипит с разложением на серный ангидрид, аммиак и воду:
-
- {displaystyle {mathsf {NH_{4}HSO_{4} {xrightarrow {>500^{o}C}} NH_{3}+SO_{3}+H_{2}O}}}
.
- {displaystyle {mathsf {NH_{4}HSO_{4} {xrightarrow {>500^{o}C}} NH_{3}+SO_{3}+H_{2}O}}}
Сульфат аммония окисляется до молекулярного азота сильными окислителями, например перманганатом калия.
Получение
В лаборатории получают действием концентрированной серной кислоты на концентрированный раствор аммиака.
Эту реакцию, как и все другие реакции взаимодействия аммиака с кислотами, проводят в приборе для получения растворимых веществ в твёрдом виде.
Среди основных способов получения сульфата аммония, которые наиболее часто используются в химической промышленности, имеются следующие: процесс нейтрализации серной кислоты синтетическим аммиаком; использование аммиака из газа коксовых печей для его химической реакции с серной кислотой; получение в результате обработки гипса растворами карбоната аммония; получение при переработке отходов, остающихся после производства капролактама. Вместе с тем имеются и другие способы производства сульфата аммония, например, получение этого вещества из дымовых газов электростанций и сернокислотных заводов. Для этого в горячие газы вводят газообразный аммиак, который связывает имеющиеся в газе окислы серы в различные соли аммония, в том числе и в сульфат аммония.
Очистка
Технический сульфат аммония часто загрязнен сульфатом железа. Избавиться от него простой перекристаллизацией невозможно, так как соли железа сокристаллизуются с сульфатом аммония, образуя двойную соль Мора.
Согласно Карякину[3], для очистки препарата 150 г его растворяют в 260 мл дистиллированной воды, нагревают до кипения, прибавляют 1-2 г пероксодисульфата аммония и кипятят до полного окисления железа(II) в железо(III). Полноту окисления необходимо проверить прибавлением к отфильтрованной пробе раствора гексацианоферрата(III) калия (красной кровяной соли) — синее окрашивание пробы указывает на неполноту окисления железа, в таком случае процесс очистки следует повторить.
После перехода всего железа в трехвалентное к раствору следует прибавить крепкий раствор аммиака до сильно щелочной реакции и отфильтровать. Полученный раствор упарить до консистенции жидкой кристаллической кашицы и дать охладиться до комнатной температуры. Кристаллы отсосать на воронке Бюхнера и промыть несколько раз дистиллированной водой.
В полученном реактиве может содержаться до 0,2 % сульфата кальция, который отделить никак не удастся.
Применение
Сульфат аммония широко применяется как азотное-серное минеральное удобрение (в РФ — по ГОСТ-9097-82) в легкоусвояемой форме, не содержащей NO3--групп и не едкое, его можно применять в любое время года. Содержит 21 % азота и 24 % серы. Подкисляет почву.
Также используется в производстве вискозного волокна.
В биохимии переосаждение сульфатом аммония является общим методом очистки белков.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E517.
Сульфат аммония используется в технологии хлорирования воды с аммонизацией — его вводят в обрабатываемую воду за несколько секунд до хлора. С хлором он образует хлорамины, связывая свободный хлор, благодаря чему значительно сокращается образование хлорорганики, вредной для организма человека, сокращается расход хлора, уменьшается коррозия труб водопровода.
Сульфат аммония является компонентом порошковых огнетушителей и огнезащитных средств.
Кроме того находит применение при получении марганца электролизом.
Воздействие на человека
Сульфат аммония признаётся безопасным для человека и используется в качестве пищевой добавки в России, на Украине и в странах ЕС. Сульфат аммония используется в качестве заменителя соли и носит название пищевой добавки Е517. В пищевой индустрии добавка сульфат аммония выступает в роли улучшителя качества муки и хлебобулочных изделий, увеличивая также их объём, является питанием для дрожжевых культур, применяется как стабилизатор и эмульгатор.
| Сульфат аммония | |
|---|---|
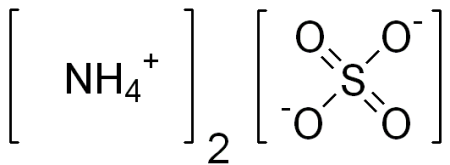 |
|
| Систематическое наименование |
аммония сульфат |
| Традиционные названия | аммоний сернокислый |
| Хим. формула | (NH4)2SO4 |
| Рац. формула | H8N2O4S |
| Состояние | твёрдое |
| Молярная масса | 132,14052 г/моль |
| Плотность | 1,769 г/см³ (20 °C) |
| Т. плав. | 235-280 °C |
| Т. разл. | 218 °C |
| Мол. теплоёмк. | 187,4 Дж/(моль·К) |
| Энтальпия образования | −1180,26 кДж/моль |
| Растворимость в воде | 75,4 г/100 г (20 °C) |
| ГОСТ | ГОСТ 9097-82 ГОСТ 3967-78 ГОСТ 10873-73 ГОСТ Р 51520-99 |
| Рег. номер CAS | 7783-20-2 |
| PubChem | 24538 |
| Рег. номер EINECS | 231-984-1 |
| SMILES |
O=S(=O)(O)O.N.N |
| InChI |
1S/2H3N.H2O4S/c;;1-5(2,3)4/h2*1H3;(H2,1,2,3,4) BFNBIHQBYMNNAN-UHFFFAOYSA-N |
| Кодекс Алиментариус | E517 |
| ChEBI | 62946 |
| ChemSpider | 22944 |
| ЛД50 | 2840 (крысы; орально) |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Сульфат аммония (аммоний сернокислый, лат. ammonium sulphate), (NH4)2SO4 — неорганическое бинарное соединение, аммонийная соль серной кислоты. Это бесцветные прозрачные кристаллы (или белый порошок) без запаха. Получают сульфат аммония действием серной кислоты на раствор аммиака и обменными реакциями с другими солями. Применяется в качестве удобрения, при производстве вискозы, в пищевой промышленности, при очистке белков в биохимии, в качестве добавки при хлорировании водопроводной воды. Токсичность сульфата аммония очень низкая.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Очистка
- 5 Применение
- 6 Воздействие на человека

Физические свойства
Чистый сульфат аммония — бесцветные прозрачные кристаллы, в измельчённом виде — белый порошок. Запаха не имеет. Гигроскопичность невысокая.
Образует кристаллы ромбической сингонии, пространственная группа Pnma, параметры ячейки a = 0,7782 нм, b = 0,5993 нм, c = 1,0636 нм, Z = 4.
Плотность (при 20 °C) — 1,766 г/см3.
Растворимость в воде (г/100 мл):
- 70,1 (0 °C)
- 72,7 (10 °C)
- 75,4 (20 °C)
- 76,9 (25 °C)
- 78,1 (30 °C)
- 81,2 (40 °C)
- 84,3 (50 °C)
- 87,4 (60 °C)
- 94,1 (80 °C)
- 102 (100 °C).
Растворимость в других растворителях (г/100 г):
- муравьиная кислота 95 %: 25,4 (16,5 °C);
- ацетон: нерастворим;
- этанол: нерастворим;
- диэтиловый эфир: нерастворим.
Сульфат аммония с солями некоторых других металлов (алюминий, железо и пр.) образует двойные соли, например алюмоаммиачные квасцы, соль Мора.

Химические свойства
При нагревании до 147 °С сульфат аммония разлагается на соответствующий гидросульфат NH4HSO4 и аммиак по схеме:
-
- (NH4)2SO4 → NH4HSO4 + NH3↑
При повышении температуры выше 500 °С гидросульфат аммония кипит с разложением на серный ангидрид, аммиак и воду:
-
- NH4HSO4 →>500oC NH3 + SO3 + H2O
Сульфат аммония окисляется до молекулярного азота сильными окислителями, например перманганатом калия.
Получение
В лаборатории получают действием концентрированной серной кислоты на концентрированный раствор аммиака.
-
- 2NH3 + H2SO4 → (NH4)2SO4
Эту реакцию, как и все другие реакции взаимодействия аммиака с кислотами, проводят в приборе для получения растворимых веществ в твёрдом виде.
Среди основных способов получения сульфата аммония, которые наиболее часто используются в химической промышленности, имеются следующие: процесс нейтрализации серной кислоты синтетическим аммиаком; использование аммиака из газа коксовых печей для его химической реакции с серной кислотой; получение в результате обработки гипса растворами карбоната аммония; получение при переработке отходов, остающихся после производства капролактама. Вместе с тем имеются и другие способы производства сульфата аммония, например, получение этого вещества из дымовых газов электростанций и сернокислотных заводов. Для этого в горячие газы вводят газообразный аммиак, который связывает имеющиеся в газе окислы серы в различные соли аммония, в том числе и в сульфат аммония.

Очистка
Технический сульфат аммония часто загрязнен сульфатом железа. Избавиться от него простой перекристаллизацией невозможно, так как соли железа сокристаллизуются с сульфатом аммония, образуя двойную соль Мора.
Согласно Карякину, для очистки препарата 150 г его растворяют в 260 мл дистиллированной воды, нагревают до кипения, прибавляют 1-2 г пероксодисульфата аммония и кипятят до полного окисления железа (II) в железо (III). Полноту окисления необходимо проверить прибавлением к отфильтрованной пробе раствора гексацианоферрата (III) калия (красной кровяной соли) — синее окрашивание пробы указывает на неполноту окисления железа, в таком случае процесс очистки следует повторить.
После перехода всего железа в трехвалентное к раствору следует прибавить крепкий раствор аммиака до сильно щелочной реакции и отфильтровать. Полученный раствор упарить до консистенции жидкой кристаллической кашицы и дать охладиться до комнатной температуры. Кристаллы отсосать на воронке Бюхнера и промыть несколько раз дистиллированной водой.
В полученном реактиве может содержаться до 0,2 % сульфата кальция, который отделить никак не удастся.
Применение
Сульфат аммония широко применяется как азотное-серное минеральное удобрение (в РФ — по ГОСТ-9097-82) в легкоусвояемой форме, не содержащей NO3--групп и не едкое, его можно применять в любое время года. Содержит 21 % азота и 24 % серы. Подкисляет почву.
Также используется в производстве вискозного волокна как компонент осадительной ванны.
В биохимии переосаждение сульфатом аммония является общим методом очистки белков.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E517.
Сульфат аммония используется в технологии хлорирования воды с аммонизацией — его вводят в обрабатываемую воду за несколько секунд до хлора. С хлором он образует хлорамины, связывая свободный хлор, благодаря чему значительно сокращается образование хлорорганики, вредной для организма человека, сокращается расход хлора, уменьшается коррозия труб водопровода.
Сульфат аммония является компонентом порошковых огнетушителей и огнезащитных средств.
Кроме того, находит применение при получении марганца электролизом, в производстве аммониево-алюминиевых квасцов, корунда. Добавляется к стекольной шихте для улучшения её плавкости.


Воздействие на человека
Сульфат аммония признаётся безопасным для человека и используется в качестве пищевой добавки в России, на Украине и в странах ЕС. Сульфат аммония используется в качестве заменителя соли и носит название пищевой добавки E517. В пищевой индустрии добавка сульфат аммония выступает в роли улучшителя качества муки и хлебобулочных изделий, увеличивая также их объём, является питанием для дрожжевых культур, применяется как стабилизатор и эмульгатор.


