Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 12 февраля 2020 года; проверки требуют 29 правок.
| Нитрат калия | ||
|---|---|---|
|
||
 |
||
| Общие | ||
| Систематическое наименование |
Нитрат калия | |
| Сокращения | в народе «КС» или «НК» | |
| Традиционные названия | Ка́лиевая селитра, кали́йная селитра, инди́йская селитра | |
| Хим. формула | KNO3 | |
| Рац. формула | KNO3 | |
| Физические свойства | ||
| Состояние | Твёрдое | |
| Молярная масса | 101,1032 г/моль | |
| Плотность | 2,109 (16 °C) | |
| Твёрдость | 2 | |
| Термические свойства | ||
| Температура | ||
| • плавления | 334 °C | |
| • кипения | с разложением °C | |
| • разложения | 400 °C | |
| Тройная точка | Отсутствует | |
| Мол. теплоёмк. | 95,06 Дж/(моль·К) | |
| Энтальпия | ||
| • образования | -494,00 кДж/моль | |
| • плавления | 9,80 кДж/моль | |
| • сублимации | 181,00 кДж/моль | |
| Химические свойства | ||
| Растворимость | ||
| • в воде |
13,3 (0 °C) 36 (25 °C) 247 (100 °C) |
|
| Классификация | ||
| Рег. номер CAS | 7757-79-1 | |
| PubChem | 24434 | |
| Рег. номер EINECS | 231-818-8 | |
| SMILES |
[N+](=O)([O-])[O-].[K+] |
|
| InChI |
InChI=1S/K.NO3/c;2-1(3)4/q+1;-1 FGIUAXJPYTZDNR-UHFFFAOYSA-N |
|
| Кодекс Алиментариус | E252 | |
| RTECS | TT3700000 | |
| ChEBI | 63043 | |
| Номер ООН | 1486 | |
| ChemSpider | 22843 | |
| Безопасность | ||
| ЛД50 | 3750 мг/кг | |
| Токсичность | Малотоксичен | |
| Краткие характер. опасности (H) |
H272 |
|
| Меры предостор. (P) |
P220 |
|
| Сигнальное слово | осторожно | |
| Пиктограммы СГС |
|
|
| NFPA 704 |
0 1 1 OX |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Нитра́т ка́лия (азотноки́слый ка́лий ка́лиевая сели́тра, кали́йная селитра, инди́йская селитра и др., химическая формула — KNO3) — неорганическая калиевая соль азотной кислоты.
В стандартных условиях, нитрат калия — это кристаллическое бесцветное вещество, нелетучее, слегка гигроскопичное, без запаха. Нитрат калия хорошо растворим в воде. Малотоксичен для живых организмов.
Физические свойства[править | править код]
Нитрат калия в нормальных условиях представляет собой бесцветные кристаллы (в измельчённом состоянии белый порошок) с ионной структурой и ромбической или гексагональной кристаллической решёткой. Слегка гигроскопичен, склонен несильно слеживаться со временем. Не имеет запаха, нелетуч.
Хорошо растворим в воде, в средней степени в глицерине, жидком аммиаке, гидразине, нерастворим в чистом этаноле и эфире (в разбавленных водой растворяется плохо). Таблица растворимости в некоторых растворителях, в граммах KNO3 на 100 г H2O[1]:
| Растворитель / Температура, °С |
0 | 10 | 20 | 25 | 30 | 40 | 60 | 80 | 100 |
|---|---|---|---|---|---|---|---|---|---|
| Вода | 13,9 | 21,2 | 31,6 | 37,9 | 46,0 | 61,3 | 106,2 | 166,6 | 245,0 |
| Жидкий аммиак | 10,52 | 10,4 | |||||||
| Гидразин | 14 |
При медленной кристаллизации вырастают очень длинные игольчатые кристаллы. Нитрат калия хорошо поддаётся очистке перекристаллизацией, причём с небольшими потерями, благодаря сильному повышению растворимости с ростом температуры.
Химические свойства[править | править код]
- Разлагается при 400—520 °C с образованием нитрита калия KNO2 и кислорода O2[2] (выделение последнего увеличивает пожароопасность нитрата калия):
- Является сильным окислителем, реагирует с горючими материалами и восстановителями, при измельчении активно и нередко со взрывом. Смеси нитрата калия с некоторыми органическими материалами склонны к самовоспламенению.
- Восстанавливается водородом в момент выделения (в реакции соляная кислота разбавленная)[2]:
- Расплав нитрата калия может быть использован для получения металлического калия электролизом, однако из-за высоких окислительных способностей нитрата калия в расплавленном состоянии предпочтительнее гидроксид калия.
Получение[править | править код]
В Средние Века и Новое Время (когда активно использовали порох) для получения нитрата калия служили селитря́ницы — кучи из смеси навоза (и других перегнивающих компонентов) с известняком, строительным мусором и прочим известняковым материалом с прослойками из соломы или хвороста, накрытые дёрном для удерживания образующихся газов.
При гниении навоза образовывался аммиак, который, накапливаясь в прослойках из соломы, подвергался нитрификации и превращался вначале в азотистую, а затем в азотную кислоту. Последняя, взаимодействуя с известняком, давала Ca(NO3)2, который выщелачивался водой. Добавка древесной золы (состоящей в основном из поташа) приводила к осаждению CaCO3 и получению раствора нитрата калия; нередко золу добавляли сразу в кучу вместо известняка, тогда калиевая селитра получалась сразу.
Реакция поташа с кальциевой селитрой (нитратом кальция) является самой древней из используемых человеком для получения нитрата калия и популярна до сих пор. Вместо поташа, впрочем, сейчас в лабораториях чаще всего используют сульфат калия, реакция очень похожа:
Первый способ применялся вплоть до 1854 г., когда немецкий химик К. Нёльнер изобрёл производство нитрата калия, основанное на реакции более доступных и дешевых хлорида калия и нитрата натрия, доступного в виде чилийской селитры:
Существует несколько других способов получения нитрата калия. Это взаимодействие нитрата аммония и хлорида калия с образованием нитрата калия и хлорида аммония, последний легко отделяется:
— наиболее применимая после реакции нитрата кальция с карбонатом или сульфатом калия.
— в основном, демонстрационная реакция соответствующей кислоты и основания
— тоже демонстрационная реакция соответствующих кислоты и металла.
— демонстрационная реакция соответствующего основного оксида с соответствующей кислотой.
Также:
Природные источники и месторождения[править | править код]
В природе нитрат калия распространён в виде минерала нитрокалита, в Ост-Индии находится одно из крупнейших месторождений, отсюда второе название — индийская селитра. Природный нитрат калия образуется в результате разложения азотсодержащих веществ с последующим связыванием медленно выделяющегося аммиака нитробактериями, чему способствует влага и тепло, поэтому наиболее крупные залежи находятся в странах с жарким климатом[3]. Наиболее известные месторождения нитрата калия находятся в Индии, Боливии, Австралии, Чили, ЮАР, России, США и Шри-Ланке. Он также встречается в Китае, Мексике, и других странах[4]
В очень малых количествах нитрат калия содержится в растениях[5], является промежуточным продуктом при переработке ими почвенных сульфата и карбоната калия.
Применение[править | править код]
Основное применение на сегодняшний день нитрат калия находит в качестве ценного удобрения, так как совмещает в себе два элемента, частично блокирующих усвоение друг друга растениями, когда находятся в составе отдельных соединений.
Применяется при изготовлении дымного пороха и некоторых других горючих смесей (например, карамельного ракетного топлива), которые почти полностью сейчас используются в производстве пиротехнических изделий.
Применяется также в электровакуумной промышленности и оптическом стекловарении для обесцвечивания и осветления технических хрустальных стёкол и придания прочности изделиям из стекла[6].
Расплав иногда используется в химических лабораториях и у любителей химии для получения металлического калия электролизом, наряду с гидроксидом калия.
Используется в качестве сильного окислителя в металлургии, в частности, при переработке никелевых руд.
В пищевой промышленности нитрат калия применяется в качестве консерванта E252[7]. Сам по себе он не имеет существенного антибактериального действия, но его оказывает образующийся в результате восстановления нитрит калия в мясных продуктах, в которых нитрат калия наиболее широко используется в качестве консерванта[8].
См. также[править | править код]
- Азотная кислота
- Нитраты
- Порох
Примечания[править | править код]
- ↑ Химия и технология редких и рассеянных элементов / Под ред. Большакова К. А.. — М.: Высшая школа, 1976. — Т. 1. — 91 с.
- ↑ 1 2 Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник. — 2-е изд., перераб. и доп.. — С. 251.
- ↑ Нитраты природные — Горная энциклопедия
- ↑ Калиевая селитра. Дата обращения: 10 апреля 2020. Архивировано 22 сентября 2020 года.
- ↑ С. П. Вуколов. Селитра // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1900. — Т. XXIX. — С. 357—362.
- ↑ Кубань-Агро-Альянс. Дата обращения: 13 декабря 2012. Архивировано 13 ноября 2012 года.
- ↑ Добавкам. Нет Архивная копия от 7 августа 2013 на Wayback Machine[неавторитетный источник]
- ↑ OPINIONS OF THE SCIENTIFIC COMMITTEE FOR FOOD ON: Nitrates and Nitrite Архивная копия от 6 марта 2015 на Wayback Machine / REPORTS OF THE SCIENTIFIC COMMITTEE FOR FOOD; European Commission, 1997
Ссылки[править | править код]
- Получение калиевой селитры
| Нитрат калия | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
Нитрат калия |
| Сокращения | в народе КС, НК |
| Традиционные названия | Калиевая селитра, калийная селитра, индийская селитра, Соль Петра (Salt of Peter, petersalt) |
| Хим. формула | KNO3 |
| Рац. формула | KNO3 |
| Состояние | твёрдое |
| Молярная масса | 101,1032 г/моль |
| Плотность | 2,109 (16 °C) |
| Твёрдость | 2 |
| Т. плав. | 334 °C |
| Т. кип. | с разложением °C |
| Т. разл. | 400 °C |
| Тройная точка | отсутствует |
| Мол. теплоёмк. | 95,06 Дж/(моль·К) |
| Энтальпия образования | -494,00 кДж/моль |
| Энтальпия плавления | 9,80 кДж/моль |
| Энтальпия сублимации | 181,00 кДж/моль |
| Растворимость в воде | 13,3 (0 °C) 36 (25 °C) 247 (100 °C) |
| ГОСТ | ГОСТ 4217-77 |
| Рег. номер CAS | 7757-79-1 |
| PubChem | 24434 |
| Рег. номер EINECS | 231-818-8 |
| SMILES |
[N+](=O)([O-])[O-].[K+] |
| InChI |
1S/K.NO3/c;2-1(3)4/q+1;-1 FGIUAXJPYTZDNR-UHFFFAOYSA-N |
| Кодекс Алиментариус | E252 |
| RTECS | TT3700000 |
| ChEBI | 63043 |
| Номер ООН | 1486 |
| ChemSpider | 22843 |
| ЛД50 | 3750 мг/кг |
| Токсичность | малотоксичен |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Нитрат калия, азотнокислый калий (калиевая селитра, калийная селитра, индийская селитра и др.) — неорганическое соединение, калиевая соль азотной кислоты с формулой KNO3. В кристаллическом состоянии — бесцветное вещество, нелетучее, слегка гигроскопичное, без запаха. Нитрат калия хорошо растворим в воде. Практически не токсичен для живых организмов.
Встречается в природе в виде минерала нитрокалита, в Ост-Индии находится одно из крупнейших месторождений, отсюда второе название — индийская селитра. В очень малых количествах содержится в растениях и животных.
Форма кристаллов игольчатая, сами кристаллы очень длинные. Легко поддается очистке перекристаллизацией с минимальными потерями.
Основное применение находит в пиротехнике (до XX века особенно широко, как компонент основного в то время взрывчатого вещества — дымного (чёрного) пороха) и как калий-азотное удобрение (очень удобное соединение двух обычно плохо сочетающихся при усваивании растениями элементов).
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Природные источники и месторождения
- 5 Применение

калиевая селитра – удобрение
Физические свойства
Нитрат калия в нормальных условиях представляет собой бесцветные кристаллы (в измельченном состоянии белый порошок) с ионной структурой и ромбической или гексагональной кристаллической решеткой. Слегка гигроскопичен, склонен несильно слеживаться со временем. Не имеет запаха, нелетуч.
Хорошо растворим в воде, в средней степени в глицерине, жидком аммиаке, гидразине, нерастворим в чистом этаноле и эфире (в разбавленных водой растворяется плохо). Таблица растворимости в некоторых растворителях, в граммах KNO3 на 100 г H2O[3]:
| Растворитель / Температура, °С |
0 | 10 | 20 | 25 | 30 | 40 | 60 | 80 | 100 |
|---|---|---|---|---|---|---|---|---|---|
| Вода | 13,9 | 21,2 | 31,6 | 37,9 | 46,0 | 61,3 | 106,2 | 166,6 | 245,0 |
| Жидкий аммиак | 10,52 | 10,4 | |||||||
| Гидразин | 14 |
При медленной кристаллизации вырастают очень длинные игольчатые кристаллы. Нитрат калия хорошо поддается очистке перекристаллизацией, причём с небольшими потерями, благодаря сильному повышению растворимости с ростом температуры.
Химические свойства
- Разлагается при 400—520 °C с образованием нитрита калия KNO2 и кислорода O2 (выделение последнего увеличивает пожароопасность нитрата калия):
- 2KNO3 ⟶ 2KNO2 + O2↑
- Является сильным окислителем, реагирует с горючими материалами и восстановителями, при измельчении активно и нередко со взрывом. Смеси нитрата калия с некоторыми органическими материалами склонны к самовоспламенению.
- Восстанавливается водородом в момент выделения (в реакции соляная кислота разбавленная)[4]:
- Zn + 2HCl ⟶ ZnCl2 + 2H0,
- KNO3 + 2H0 ⟶ KNO2 + H2O.
- Расплав нитрата калия может быть использован для получения металлического калия электролизом, однако из-за высоких окислительных способностей нитрата калия в расплавленном состоянии предпочтительнее гидроксид калия.

Получение
В Средние Века и Новое Время (когда активно использовали порох) для получения нитрата калия служили селитряницы — кучи из смеси навоза (и других перегнивающих компонентов) с известняком, строительным мусором и прочим известняковым материалом с прослойками из соломы или хвороста, накрытые дёрном для удерживания образующихся газов. При гниении навоза образовывался аммиак, который накапливаясь в прослойках из соломы, подвергался нитрификации и превращался вначале в азотистую, а затем в азотную кислоту. Последняя, взаимодействуя с известняком, давала Ca(NO3)2, который выщелачивался водой. Добавка древесной золы (состоящей в основном из поташа) приводила к осаждению CaCO3 и получению раствора нитрата калия; нередко золу добавляли сразу в кучу вместо известняка, тогда калиевая селитра получалась сразу.
- Ca(NO3)2 + K2CO3 ⟶ 2KNO3 + CaCO3↓
Реакция поташа с кальциевой селитрой (нитратом кальция) является самой древней из используемых человеком для получения нитрата калия и популярна до сих пор. Вместо поташа, впрочем, сейчас в лабораториях чаще всего используют сульфат калия, реакция очень похожа:
- Ca(NO3)2 + K2SO4 ⟶ 2KNO3 + CaSO4↓
Первый способ применялся вплоть до 1854 г., когда немецкий химик К. Нёльнер изобрел производство нитрата калия, основанное на реакции более доступных и дешевых хлорида калия и нитрата натрия, доступного в виде чилийской селитры:
- KCl + NaNO3 ⟶ KNO3 + NaCl
Существует несколько других способов получения нитрата калия. Это взаимодействие нитрата аммония и хлорида калия с образованием нитрата калия и хлорида аммония, последний легко отделяется:
- KCl + NH4NO3 ⟶ KNO3 + NH4Cl
— наиболее применимая после реакции нитрата кальция с карбонатом или сульфатом калия.
- KOH + HNO3 ⟶ KNO3 + H2O — в основном, демонстрационная реакция соответствующей кислоты и основания
- 21K + 26HNO3 ⟶ 21KNO3 + NO↑ + N2O↑ + N2↑ + 13H2O — тоже демонстрационная реакция соответствующих кислоты и металла.
- K2O + 2HNO3 ⟶ 2KNO3 + H2O — демонстрационная реакция соответствующего щелочного оксида с соответствующей кислотой.
Также:
- 2KOH + N2O5 ⟶ 2KNO3 + H2O
- NH4NO3 + KOH ⟶ NH3 ↑ + KNO3 + H2O
- K2CO3 + 2HNO3 ⟶ 2KNO3 + H2O + CO2↑

Природные источники и месторождения
В природе нитрат калия распространен в виде минерала нитрокалита. Крупнейшее его месторождение находится в Индии. Природный нитрат калия образуется в результате разложения азотсодержащих веществ с последующим связыванием медленно выделяющегося аммиака нитробактериями, чему способствует влага и тепло, поэтому наиболее крупные залежи находятся в странах с жарким климатом.
В очень малых количествах содержится в растениях и животных, является промежуточным продуктом при переработке ими почвенных сульфата и карбоната калия.

Применение
Основное применение на сегодняшний день нитрат калия находит в качестве ценного удобрения, так как совмещает в себе два элемента, частично блокирующих усвоение друг друга растениями, когда находятся в составе отдельных соединений.
Применяется при изготовлении дымного пороха и некоторых других горючих смесей (например, карамельного ракетного топлива), которые почти полностью сейчас используются в производстве пиротехнических изделий.
Применяется также в электровакуумной промышленности и оптическом стекловарении для обесцвечивания и осветления технических хрустальных стекол и придания прочности изделиям из стекла.
Расплав иногда используется в химических лабораториях и у любителей химии для получения металлического калия электролизом, наряду с гидроксидом калия.
Используется в качестве сильного окислителя в металлургии, в частности, при переработке никелевых руд.
В пищевой промышленности нитрат калия применяется в качестве консерванта E252. Сам по себе он не имеет существенного антибактериального действия, но его оказывает образующийся в результате восстановления нитрит калия в мясных продуктах, в которых нитрат калия наиболее широко используется в качестве консерванта.
Физические свойства
Нитрат калия KNO3 — соль щелочного металла калия и азотной кислоты. Белый. Плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 101,10; относительная плотность для тв. и ж. состояния d = 2,109; tпл = 334, 5º C;
Способ получения
1. Нитрат калия можно получить при 70º С путем взаимодействия надпероксида калия и оксида азота (IV), образуется нитрат калия и кислород:
2KO2 + 2NO2 = 2KNO3 + O2
2. В результате взаимодействия разбавленной азотной кислоты и гидроксида калия образуется нитрат калия и вода:
KOH + HNO3 = KNO3 + H2O
3. В результате реакции между горячим гидроксидом калия, оксидом азота (IV) и кислородом, происходит образование нитрата калия и воды:
4KOH + 4NO2 + O2 = 4KNO3 + 2H2O
4. В результате взаимодействия горячего и разбавленного раствора нитрита калия и кислорода образуется нитрат калия:
2KNO2 + O2 = 2KNO3
5. При смешивании горячего пероксида водорода и нитрита калия в разбавленной серной кислоте происходит образование нитрата калия и воды:
KNO2 + H2O2 = KNO3 + H2O
Качественная реакция
Качественная реакция на нитрат калия — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат калия образует сульфат калия, нитрат меди, газ оксид азота и воду:
Cu + 4KNO3 + 2H2SO4 = Cu(NO3)2 + 2K2SO4 + 2NO2 + 2H2O
Химические свойства
1. Hитрат калия разлагается при температуре 400–520º С с образованием нитрита калия и кислорода:
2KNO3 = 2KNO2 + O2
2. Нитрат калия может реагировать с простыми веществами:
2.1. Нитрат калия реагирует со свинцом при температуре 350–400 ºС. При этом образуется нитрит калия и оксид свинца:
KNO3 + Pb = KNO2 + PbO
2.2. Нитрат калия реагирует при температуре 400º С с алюминием с образованием алюмината калия, оксида алюминия и азота:
6KNO3 + 10Al = 6KAlO2 + 2Al2O3 + 3N2
2.3. Нитрат калия взаимодействует с атомным водородом в присутствии цинка и разбавленной соляной кислоты при этом образуются нитрит калия и вода:
KNO3 + Zn + 2HCl = KNO2 + ZnCl2 + H2O,
при взаимодействии нитрата калия и водорода при кипении в присутствии алюминия и концентрированного гидроксида калия образуется газ аммиак, вода и гидроксид калия:
3KNO3 + 8Al + 5KOH+ 18H2O = 3NH3↑ + 8K[Al(OH)4]
3. Возможны реакции между нитратом калия и сложными веществами:
3.1. Нитрат калия вступает в реакцию с кислотами:
3.1.1. В результате реакции в вакууме между нитратом калия и концентрированной серной кислотой образуется гидросульфат калия и азотная кислота:
KNO3 + H2SO4 = HNO3↑ + KHSO4
3.2. Нитрат калия взаимодействует с солями:
3.2.1. Нитрат калия реагирует с сульфатом аммония при нагревании. В результате данной реакции образуются сульфат калия, оксид азота (I) и вода:
2KNO3 + (NH4)2SO4 = K2SO4 + 2N2O + 4H2O
-
Вы здесь:
- Главная
- Продукция
- Реактивы
- Калий азотнокислый
Поиск
Каталог
Калий азотнокислый ГОСТ 4217-77
KNO3
Азотнокислый калий, еще называют индийской селитрой, калиевой или калийной селитрой. Формула нитрата калия и формула калиевой селитры: KNO3.
Это неорганическое химическое соединение, нелетучее, бесцветное вещество, гигроскопичное, не имеющее специфического запаха. Хорошо растворяется в воде, не токсично. Нерастворимо в эфире и чистом этаноле. Молярная масса вещества = 101,1 грамм на моль.
В природе соединение можно встретить в виде минерала нитрокалита, основное месторождение которого находится в Индии. Входит в состав некоторых растений и животных. Кристаллы имеют характерную игольчатую форму, достаточно длинные, их легко очистить от примесей путем перекристаллизации. У кристаллов ионная структура решетки, гексагональная или ромбическая.
По химическим свойствам – это сильный окислитель. При высокой температуре от 400 до 520 градусов вещ-во разлагается до нитрита калия и кислорода. Средство вступает в реакцию с восстановителями и горючими материалами, иногда, после измельчения, возникает взрыв, смеси самовоспламеняются. Реакция нитрата меди и йодида калия: 2Cu(NO3)2 + 4KI = I2 + 4KNO3 + 2CuI (выпадает в осадок).
| Общие | |
|---|---|
| Систематическое наименование |
Нитрат калия |
| Сокращения |
в народе КС, НК |
| Традиционные названия |
Калиевая селитра, калийная селитра, индийская селитра, Соль Петра (Salt of Peter) |
| Хим. формула |
KNO3 |
| Рац. формула |
KNO3 |
| Физические свойства | |
| Состояние |
твёрдое |
| Молярная масса |
101,1032 г/моль |
| Плотность |
2,109 (16 °C) |
| Твёрдость |
2 |
| Термические свойства | |
| Т. плав. |
334 °C |
| Т. кип. |
с разложением °C |
| Т. разл. |
400 °C |
| Тройная точка |
отсутствует |
| Мол. теплоёмк. |
95,06 Дж/(моль·К) |
| Энтальпия образования |
-494,00 кДж/моль |
| Энтальпия плавления |
9,80 кДж/моль |
| Энтальпия сублимации |
181,00 кДж/моль |
| Химические свойства | |
| Растворимость в воде |
13,3 (0 °C) |
| Нитрат калия | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Нитрат калия |
| Сокращения | в народе КС, НК |
| Традиционные названия | Ка́лиевая селитра, кали́йная селитра, индийская селитра, Соль Петра (Salt of Peter)[источник?] |
| Химическая формула | KNO3 |
| Эмпирическая формула | KNO3 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Отн. молек. масса | 101,1032 а. е. м. |
| Молярная масса | 101,1032 г/моль |
| Плотность | 2,109 (16 °C) г/см³ |
| Твёрдость | 2 |
| Термические свойства | |
| Температура плавления | 334 °C |
| Температура кипения | с разложением °C |
| Температура разложения | 400 °C |
| Тройная точка | отсутствует |
| Молярная теплоёмкость (ст. усл.) | 95,06 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -494,00 кДж/моль |
| Энтальпия плавления | 9,80 кДж/моль |
| Энтальпия сублимации | 181,00 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 13,3 (0 °C) 36 (25 °C) 247 (100 °C) |
| Классификация | |
| Рег. номер CAS | 7757-79-1 |
| RTECS | TT3700000 |
| Безопасность | |
| ЛД50 | 3750 мг/кг |
| Токсичность | малотоксичен |
| NFPA 704 |
0 1 0 OX |
Нитра́т ка́лия, азотноки́слый ка́лий (ка́лиевая сели́тра, кали́йная селитра, индийская селитра и др.) — неорганическое бинарное соединение, калиевая соль азотной кислоты с формулой KNO3. В кристаллическом состоянии — бесцветное вещество, нелетучее, слегка гигроскопичное, без запаха. Нитрат калия хорошо растворим в воде. Практически не токсичен для живых организмов.
Встречается в природе в виде минерала нитрокалита, в Ост-Индии находятся одно из крупнейших месторождений, отсюда второе название — индийская селитра. В очень малых количествах содержится в растениях и животных[1].
Форма кристаллов игольчатая, сами кристаллы очень длинные. Легко поддается очистке перекристаллизацией с минимальными потерями.
Основное применение находит в пиротехнике (до XX века особенно широко, как компонент основного в то время взрывчатого вещества — дымного (черного) пороха) и как калий-азотное удобрение (очень удобный комплекс двух обычно плохо сочетающихся при усваивании растениями элементов).
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Природные источники и месторождения
- 5 Применение
- 6 См. также
- 7 Примечания
- 8 Ссылки
Физические свойства
Нитрат калия в нормальных условиях представляет собой бесцветные кристаллы (в измельченном состоянии белый порошок) с ионной структурой и ромбической или гексагональной кристаллической решеткой. Слегка гигроскопичен, склонен несильно слеживаться со временем. Не имеет запаха, нелетуч.
Хорошо растворим в воде, в средней степени в глицерине, жидком аммиаке, гидразине, нерастворим в чистом этаноле и эфире (в разбавленных водой растворяется плохо). Таблица растворимости в некоторых растворителях, в граммах KNO3 на 100 г H2O[2][3]:
| Растворитель / Температура | 0 °С | 10 °С | 20 °С | 25 °С | 30 °С | 40 °С | 50 °С | 60 °С | 70 °С | 80 °С | 90 °С | 100 °С |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Вода | 13,9 | 21,2 | 31,6 | 37,9 | 46,0 | 61,3 | 106,2 | 166,6 | 245,0 | |||
| Жидкий аммиак | 10,52 | 10,4 | ||||||||||
| Гидразин | 14 | |||||||||||
| Диэтиловый эфир | ||||||||||||
| Этанол | ||||||||||||
| Метанол | ||||||||||||
| Глицерин |
При медленной кристаллизации вырастают очень длинные игольчатые кристаллы. Нитрат калия хорошо поддается очистке перекристаллизацией, причем с небольшими потерями, благодаря сильному повышению растворимости с ростом температуры.
Химические свойства
Разлагается при 400 °C с образованием нитрита калия KNO2 и кислорода O2 (выделение последнего увеличивает пожароопасность нитрата калия):
Является сильным окислителем, реагирует с горючими материалами и восстановителями, при измельчении активно и нередко со взрывом. В смеси с некоторыми органическими материалами склонен самовоспламенять их.
Расплав может быть использован для получения калия электролизом, однако из-за высоких окислительных способностей нитрата калия в этом состоянии предпочтительнее гидроксид калия.
Получение
В Средние Века и Новое Время (когда активно использовали порох) для получения нитрата калия служили селитря́ницы — кучи из смеси навоза (и других перегнивающих компонентов) с известняком, строительным мусором и прочим известняковым материалом с прослойками из соломы или хвороста, накрытые дерном для удерживания образующихся газов. При гниении навоза образовывался аммиак, который накапливаясь в прослойках из соломы, подвергался нитрификации и превращался вначале в азотистую, а затем в азотную кислоту. Последняя, взаимодействуя с известняком, давала Ca(NO3)2, который выщелачивался водой. Добавка древесной золы (состоящей в основном из поташа) приводила к осаждению CaCO3 и получению раствора нитрата калия; нередко золу добавляли сразу в кучу вместо известняка, тогда калиевая селитра получалась сразу. Реакция поташа с кальциевой селитрой (нитратом кальция)
является самой древней из используемых человеком для получения нитрата калия и популярна до сих пор. Вместо поташа впрочем, сейчас в лабораториях чаще всего используют сульфат калия, реакция очень похожа:
Первый способ применялся до 1854 г., когда немецкий химик К. Нёльнер изобрел производство нитрата калия, основанное на реакции более доступных и дешевых хлорида калия и нитрата натрия:
Существует несколько других способов получения нитрата калия. Это взаимодействие нитрата аммония и хлорида калия с образованием нитрата калия и хлорида аммония, последний легко отделяется:
 — популярнейшая после реакции нитрата кальция с карбонатом или сульфатом калия
— популярнейшая после реакции нитрата кальция с карбонатом или сульфатом калия
 — в основном демонстративная реакция соответствующей кислоты и основания
— в основном демонстративная реакция соответствующей кислоты и основания
 — тоже демонстративная реакция соответствующих кислоты и металла
— тоже демонстративная реакция соответствующих кислоты и металла
 — демонстр. реакция соотв. щелочного оксида с соотв. кислотой
— демонстр. реакция соотв. щелочного оксида с соотв. кислотой
Природные источники и месторождения
В природе калия нитрат распространен в виде минерала нитрокалита. Крупнейшие его месторождения находятся в Ост-Индии и в Чили (вместе с основным минералов — нитронатритом). Природный нитрат калия является результатом разложения азотистых веществ с последующим связыванием медленно выделяющегося аммиака нитробактериями, чему способствует влага и тепло, поэтому наиболее крупные залежи находятся в странах с жарким климатом[4].
В очень малых количествах содержится в растениях и животных[1], является промежуточным продуктом при переработке ими почвенных сульфата и карбоната калия.
Применение
Основное применение на сегодняшний день нитрат калия находит в качестве ценного удобрения, так как совмещает в себе два частично блокирующих усвоение друг друга растениями элемента.
Незаменим он при изготовлении дымного пороха и некоторых других составов (например, карамельного ракетного топлива), которые почти полностью сейчас идут на производство пиротехники.
Применяется также в электровакуумной промышленности и оптическом стекловарении для обесцвечивания и осветления технических хрустальных стекол и придания прочности изделиям из стекла[5].
Расплав часто используется в лабораториях и у любителей для получения элементарного калия электролизом, наряду с гидроксидом калия.
Используется в качестве сильного окислителя в металлургии, в частности при переработке никелевых руд.
См. также
- Азотная кислота
- Нитраты
- Порох
Примечания
- ↑ 1 2 ЭСБЕ
- ↑ Химия и технология редких и рассеянных элементов / Под ред. Большакова К. А.. — М.: Высшая школа, 1976. — Т. 1. — 91 с.
- ↑ База данных Химистера
- ↑ Нитраты природные — Горная энциклопедия
- ↑ Кубань-Агро-Альянс
Ссылки
- Получение калиевой селитры
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Нитраты |
|
|---|---|
|
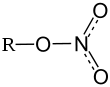
Динитрат гидразина (N2H6(NO3)2) • Изопентилнитрат ((CH3)2CHCH2CH2ONO2) • Метилнитрат (CH3ONO2) • Нитрат актиния(III) (Ac(NO3)3) • Нитрат алюминия (Al(NO3)3) • Нитрат аммония (NH4NO3) • Нитрат бария (Ba(NO3)2) • Нитрат берилия (Be(NO3)2) • Нитрат висмута (Bi(NO3)3) • Нитрат гадолиния (Gd(NO3)3) • Нитрат гидразина (N2H5NO3) • Нитрат гидроксиламина ((NH3OH)NO3) • Нитрат гуанидина (C(NH2)3NO3) • Нитрат железа(III) (Fe(NO3)3) • Нитрат кадмия (Cd(NO3)2) • Нитрат калия (KNO3) • Нитрат кальция (Са(NО3)2) • Нитрат кобальта(II) (Co(NO3)2) • Нитрат кобальта(III) (Co(NO3)3) • Нитрат лития (LiNO3) • Нитрат магния (Mg(NO3)2) • Нитрат марганца (Mn(NO3)2) • Нитрат меди(II) (Cu(NO3)2) • Нитрат мочевины ((NH2)2CO•HNO3) • Нитрат натрия (NaNO3) • Нитрат неодима (Nd(NO3)3) • Нитрат никеля(II) (Ni(NO3)2) • Нитрат палладия(II) (Pd(NO3)3) • Нитрат ртути(I) (Hg2(NO3)2) • Нитрат ртути(II) (Hg(NO3)2) • Нитрат рубидия (RbNO3) • Нитрат свинца(II) (Pb(NO3)2) • Нитрат серебра(I) (AgNO3) • Нитрат скандия(III) (Sc(NO3)3) • Нитрат стронция (Sr(NO3)2) • Нитрат урана (U(NO3)2) • Нитрат уранила (UO2(NO3)2) • Нитрат хлорина (ClONO3) • Нитрат хрома (Cr(NO3)3) • Нитрат цезия (CsNO3) • Нитрат цинка (Zn(NO3)2) • Нитраты целлюлозы ([C6H7O2(OH)3-x(ONO2)x]n) • Нитроглицерин (O2NOCH(CH2ONO2)2) • Пропилнитрат (C3H7ONO2) • Церий-аммоний нитрат ((NH4)2Ce(NO3)6) • Этилнитрат (C2H5ONO2) |
 |
|
Соединения калия |
|---|
|
Азид калия (KN3) • Амид калия (KNH2) • Ацесульфам (C4H4KNO4S) • Ацетат калия (CH3COOK) • Ацетиленид калия (K2C2) • Бензоат тригидрат калия (Брутто-формула:C7H11KO5) • Бромат калия (KBrO3) • Бромид калия (KBr) • Гексагидроксоплатинат(IV) калия (K2[Pt(OH)6]) • Гексагидроксостибат калия (K[Sb(OH)6]) • Гексанитрокобальтат(III) калия (K3[Co(NO3)6]) • Гексаоксибензол калия (C6(OK)6) • Гексафторогерманат калия (K2[GeF6]) • Гексафторокупрат(III) калия (K3CuF6) • Гексафторомолибдат(III) калия (K3MoF6) • Гексафтороплатинат(V) калия (K[PtF6]) • Гексафторосиликат(IV) калия (K2[SiF6]) • Гексафторфосфат калия (KPF6) • Гексахлоропалладат(IV) калия (K2[PdCl6]) • Гексахлороплатинат(IV) калия (K2[PtCl6]) • Гексахлоростаннат(IV) калия (K2[SnCl6]) • Гексахлорплатинат калия (K2PtCl6) • Гексацианоферрат(II) калия (K4[Fe(CN)6]) • Гексацианоферрат(II) тригидрат калия (K4[Fe(CN)6]•3H2O) • Гексацианоферрат(III) калия (K3[Fe(CN)6]) • Гептафторониобат(V) калия (K2[NbF7]) • Гидрид калия (KH) • Гидрокарбонат калия (KHCO3) • Гидроксид калия (KOH) • Гидроортофосфат калия (K2HPO4) • Гидросульфат калия (KHSO4) • Гидросульфид калия (KHS) • Гидросульфит калия (KHSO3) • Гидрофторид калия (KHF2) • Дигидроарсенат калия (KH2AsO4) • Дигидроортофосфат калия (KH2PO4) • Динитрамид калия (KN(NO2)2) • Дисульфат калия (K2S2O7) • Дисульфит калия (K2S2O5) • Дисульфонатнитроксил калия ((KO3S)2NO) • Дитионат калия (K2S2O6) • Дихлородиамминпалладий ([Pd(NH3)2]Cl2) • Дихромат калия (K2Cr2O7) • Дицианоаргентат(I) калия (K[Ag(СN)2]) • Дицианоаурат(I) калия (K[Au(СN)2]) • Иодат калия (KIO3) • Иодид калия (KI) • Карбонат калия (K2CO3) • Манганат калия (K2MnO4) • Метаванадат калия (KVO3) • Метасиликат калия (K2SiO3) • Метафосфат калия (KPO3) • Надпероксид калия (KO2 или K2O4) • Нитрат калия (KNO3) • Нитрит калия (KNO2) • Озонид калия (KO3) • Оксалат калия (K2C2O4) • Оксалат моногидрат калия (K2C2O4•H2O) • Оксид калия (K2O) • Октахлоромолибдат калия (K4Mo2Cl8) • Ортофосфат калия (K3PO4) • Пербромат калия (KBrO4) • Периодат калия (KIO4) • Перманганат калия (KMnO4) • Пероксид калия (K2O2) • Пероксодикарбонат калия (К2С2О6) • Пероксомоносульфат калия (K2SO5) • Пероксодисульфат калия (K2S2O6(O2)) • Перренат калия (KReO4) • Перхлорат калия (KClO4) • Полисульфиды калия (K2Sn) • Политионаты калия (K2SnO6) • Сегнетова соль (NaKC4H4O6) • Соль Джонсона (K[I(I)2]•H2O) • Соль Цейзе (K[Pt(C2H4)Cl3]•H2O) • Сорбат калия (C6H7KO2) • Сульфат гидрат калия-гадолиния • Сульфат гидрат калия-кальция (K2Ca(SO4)2•H2O) • Сульфат калия (K2SO4) • Сульфат калия-кальция (K2Ca(SO4)2) • Сульфат хрома(III)-калия (KCr(SO4)2) Сульфид калия (K2S) • Сульфит дигидрат калия (K2SO3•2H2O) • Сульфит калия (K2SO3) • Тетрагидроалюминат калия (KAlH4) • Тетрагидроксодиоксоосмат(VI) калия (K2[OsO2(OH)4]) • Тетрагидроортотеллурат калия (K2H4TeO6) • Тетраиодомеркурат(II) калия (K2[HgI4]) • Тетранитроплатинат(II) калия (K2[Pt(NO2)4]) • Тетраоксорутенат(VI) калия (K2RuO4) • Тетрапероксохромат(V) калия (K3CrO8) • Тетрасиликат калия (K2Si4O9•H2O) • Тетрахлоромолибдат(III) калия (KMoCl4) • Тетрахлоропалладат(II) калия (K2[PdCl4]) • Тетрахлороплатинат(II) калия (K2[PtCl4]) • Тетрахлороферрат(III) калия (K[FeCl4]) • Тетрахлорплатинат калия (K2PtCl4) • Тетрацианоникколат(II) калия (K2[Ni(CN)4]) • Тетрацианоплатинат(II) калия (K2[Pt(CN)4]) • Тиосульфат калия (K2SO3S) • Тиоцианат калия (KSCN) • Феррат калия (K2FeO4) • Феррооксалат калия (K3[Fe(C2O4)3]) • Формиат калия (HCOOK) Фталимид калия • Фторид калия (KF) • Фторсульфит калия (KSO2F) • Хлорат калия (KClO3) • Хлорид калия (KCl) • Хлорид-триэтилалюминий калия ((C2H5)3Al•KCl) • Хромат калия (K2CrO4) • Хромит калия (KCrO2) • Цианат калия (KOCN) • Цианид калия (KCN) • Цианоаурат калия (K[Au(CN)2] • Этилксантогенат калия (C2H5OC(S)SK) • |