Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 9 марта 2022 года; проверки требуют 4 правки.
| Нитрат серебра | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование |
Нитрат серебра(I) |
| Традиционные названия | Серебро азотнокислое; нитрат серебра; адский камень, ляпис |
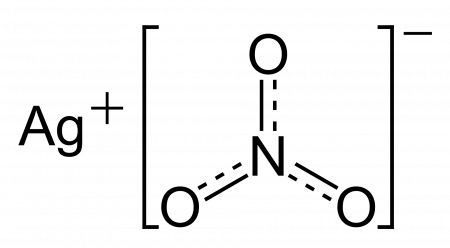
| Хим. формула | AgNO3 |
| Рац. формула | AgNO3 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 169,87 г/моль |
| Плотность | 4,352[1] |
| Термические свойства | |
| Температура | |
| • плавления | 209,7[1] |
| • разложения | 440[1] |
| Мол. теплоёмк. | 93,1[1] Дж/(моль·К) |
| Энтальпия | |
| • образования | −124,4[1] кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 122,2 (0 °C); 222,5 (20 °C); 373 (40 °C); 912 (100 °C)[1] |
| Оптические свойства | |
| Показатель преломления | 1,744 |
| Классификация | |
| Рег. номер CAS | 7761-88-8 |
| PubChem | 24470 |
| Рег. номер EINECS | 231-853-9 |
| SMILES |
[N+](=O)([O-])[O-].[Ag+] |
| InChI |
InChI=1S/Ag.NO3/c;2-1(3)4/q+1;-1 SQGYOTSLMSWVJD-UHFFFAOYSA-N |
| RTECS | VW4725000 |
| ChEBI | 32130 |
| Номер ООН | 1493 |
| ChemSpider | 22878 |
| Безопасность | |
| Предельная концентрация | 0,5 мг/м³ (в воздухе) |
| ЛД50 |
20 мг/кг (собака, орально) 130 мг/кг (кролик, орально) |
| Токсичность | ядовит, коррозионно-активен |
| Пиктограммы СГС |
|
| NFPA 704 |
0 3 3 OX |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитра́т серебра́(I), также азотноки́слое серебро́, «а́дский ка́мень», ля́пис (от итал. lapis «карандаш» ← лат. lapis «камень») — неорганическое соединение, соль переходного металла серебра и неорганической азотной кислоты с формулой AgNO3, бесцветные ромбические кристаллы, легко растворимые в воде. Весьма токсичен, как и все растворимые соли серебра. Не образует кристаллогидратов.
Получение[править | править код]
Нитрат серебра может быть получен растворением серебра в азотной кислоте по реакции:
.
Этот способ применяют и в промышленности, используют рудное или вторичное серебро с последующей кристаллизацией нитрата серебра из раствора[2].
Физические свойства[править | править код]
Плотность — 4,352 г/см³. Температура плавления — 209,7 °C, энтальпия плавления 12,1 кДж/моль[2]. При температуре выше 300 °C начинает разлагаться на серебро, кислород и оксид азота(IV), при 440 °C разлагается полностью[1]. Теплоёмкость 93,0 Дж/(моль·К). Энтальпия образования −124,5 кДж/моль. Энтропия 140,9 Дж/(моль·К) при 298 К[2].
Хорошо растворим в воде, растворимость 215,5 г/100 г при 20 °C; с ростом температуры растворимость растёт (471,4 г/100 г при 60 °C, 651,9 г/100 г при 80 °C), в присутствии азотной кислоты резко снижается[2].
Другие растворимости (при 20 °C): в метиловом спирте — 3,6 г/100 г; в этиловом спирте — 2,12 г/100 г; в ацетоне — 0,44 г/100 г; в пиридине — 33,6 г/100 г. Растворим в ацетонитриле.
Нитрат серебра(I) обладает жгуче-кислым вкусом.
При комнатной температуре образует кристаллы ромбической сингонии, пространственная группа Pbca, параметры ячейки a = 0,6995 нм, b = 0,7328 нм, c = 1,0118 нм, Z = 8, d = 4,35 г/см3. При температуре выше 159,5 °C переходит в кристаллы тригональной сингонии, параметры ячейки a = 0,6287 нм, α = 48,5°, Z = 2. Энтальпия полиморфного перехода 2,47 кДж/моль[2].
Химические свойства[править | править код]
Нитрат серебра является реактивом на соляную кислоту и соли соляной кислоты, поскольку взаимодействует с ними с образованием белого творожистого осадка хлорида серебра, нерастворимого в азотной кислоте[3]:
,
.
Образует осадки с водными растворами бромидов, иодидов, фосфатов, тиоцианатов, цианидов, сульфидов и сульфатов.
При нагревании разлагается, выделяя металлическое серебро:
.
- Реагирует с щёлочью с образованием оксида:
- в этаноле, при -50 °C, образуется гидроксид серебра
Применение[править | править код]
Нитрат серебра применяется:
- в гальванотехнике, производстве зеркал и неорганическом синтезе как источник ионов серебра;
- в аналитической химии как реактив на хлориды;
- в фотографии как компонент проявителей, усилителей и других растворов[4], в производстве фотоэмульсий[2];
- в медицине, как средство для прижигания кожи и бактерицидное средство.
Использование в медицине[править | править код]

Пятна от нитрата серебра на коже
Нитрат серебра используется в медицине в виде сплава нитрата серебра и нитрата калия, иногда отлитый в виде палочек — ляписного карандаша для прижигания и стерилизации ран, удаления мелких бородавок[5][6].
Лечебное действие нитрата серебра заключается в подавлении жизнедеятельности микроорганизмов, в небольших концентрациях он действует как прижигающее, противовоспалительное и вяжущее средство, а концентрированные растворы, как и кристаллы AgNO3, прижигают живые ткани.
Впервые ляпис (адский камень) применили врачи Ян-Баптист ван Гельмонт и Франциск де ла Бое Сильвий, которые научились получать нитрат серебра взаимодействием металла с азотной кислотой. Они обнаружили, что прикосновение к кристаллам полученного вещества приводит к появлению на коже чёрных пятен, а при длительном контакте — глубоких ожогов.
Особенности обращения, биологическое действие[править | править код]
- Нитрат серебра(I) в высоких концентрациях ядовит. Минимальная смертельная доза (ЛД50) для собак — 20 мг/кг, для кроликов — 130 мг/кг.
- ПДК нитрата серебра(I) в воздухе рабочей зоны — 0,5 мг/м³, ПДК в воде — 0,05 мг/дм³ (с обязательным контролем по ионам серебра).
- Класс опасности — 2 (вещества высокоопасные) согласно ГОСТ 12.1.007-76.
- Как и все нитраты, является сильным окислителем.
- Вещество коррозионно-активно, при контакте с кожей может вызывать химические ожоги. Оставляет на коже чёрные пятна.
Галерея[править | править код]
- Изображения нитрата серебра
-
-
Примечания[править | править код]
- ↑ 1 2 3 4 5 6 7 CRC Handbook of Chemistry and Physics / D. R. Lide (Ed.). — 90th edition. — CRC Press; Taylor and Francis, 2009. — 2828 p. — ISBN 1420090844.
- ↑ 1 2 3 4 5 6 Чукуров П. М. Серебра нитрат // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1995. — Т. 4: Полимерные — Трипсин. — С. 322. — 639 с. — 40 000 экз. — ISBN 5-85270-039-8.
- ↑ Ходаков Ю. В., Эпштейн Д. А., Глориозов П. А. § 82. Соляная кислота // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 195—196. — 240 с. — 1 630 000 экз.
- ↑ Гурлев, 1988, с. 149—150, 300—301.
- ↑ Бельских С. А. Эффективен ли ляписный карандаш при лечении бородавок, отзывы Архивная копия от 2 марта 2017 на Wayback Machine. — dermatolog.guru.
- ↑ Аптечные старожилы Архивная копия от 31 января 2009 на Wayback Machine // alhimik.ru
Литература[править | править код]
- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — Киев: Тэхника, 1988.
Ссылки[править | править код]
- Аптечные старожилы Архивная копия от 31 января 2009 на Wayback Machine.
| Нитрат серебра | |
|---|---|
 |
|
| Систематическое наименование |
Нитрат серебра |
| Традиционные названия | Адский камень, ляпис |
| Хим. формула | AgNO3 |
| Рац. формула | AgNO3 |
| Состояние | твёрдое |
| Молярная масса | 169,87 г/моль |
| Плотность | 4,352 |
| Температура | |
| • плавления | 209,7 |
| • разложения | 440 |
| Мол. теплоёмк. | 93,1 Дж/(моль·К) |
| Энтальпия | |
| • образования | −124,4 кДж/моль |
| Растворимость | |
| • в воде | 122,2 (0 °C); 222,5 (20 °C); 373 (40 °C); 912 (100 °C) |
| Показатель преломления | 1,744 |
| Рег. номер CAS | 7761-88-8 |
| PubChem | 24470 |
| Рег. номер EINECS | 231-853-9 |
| SMILES |
[N+](=O)([O-])[O-].[Ag+] |
| InChI |
1S/Ag.NO3/c;2-1(3)4/q+1;-1 SQGYOTSLMSWVJD-UHFFFAOYSA-N |
| RTECS | VW4725000 |
| ChEBI | 32130 |
| Номер ООН | 1493 |
| ChemSpider | 22878 |
| ЛД50 |
20 мг/кг (собака, орально) 800 мг/кг (кролик, орально) |
| Токсичность | ядовит, коррозионно-активен |
| Пиктограммы СГС |     |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Нитрат серебра (азотнокислое серебро, «адский камень», ляпис от итал. lapis «карандаш» /лат. lapis «камень») — неорганическое соединение, соль металла серебра и азотной кислоты с формулой AgNO3, бесцветные ромбические кристаллы, растворимые в воде. Не образует кристаллогидратов.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
- 4.1 Использование в медицине
- 5 Токсичность
- 6 Галерея
Получение
Нитрат серебра может быть получен растворением серебра в азотной кислоте по реакции:
- Ag + 2 HNO3 ⟶ AgNO3 + NO2 ↑ + H2O

Физические свойства
Плотность — 4,352 г/см³. Температура плавления — 209,7 °C. При температуре выше 300 °C начинает разлагаться на серебро, кислород и оксид азота(IV), при 440 °C разлагается полностью. Хорошо растворим в воде, растворимость 222,5 г/100 г; растворимость в метиловом спирте — 3,6 г/100 г; в этиловом спирте — 2,12 г/100 г; в ацетоне — 0,44 г/100 г; в пиридине — 33,6 г/100 г , ацетонитриле (все растворимости — при 20 °C).
Нитрат серебра(I) обладает жгуче-кислым вкусом.
Химические свойства
Нитрат серебра является реактивом на соляную кислоту и соли соляной кислоты, поскольку взаимодействует с ними с образованием белого творожистого осадка хлорида серебра, нерастворимого в азотной кислоте:
- HCl + AgNO3 ⟶ AgCl ↓ + HNO3
- NaCl + AgNO3 ⟶ AgCl ↓ + NaNO3
Образует осадки с водными растворами бромидов, йодидов, фосфатов, тиоцианатов, цианидов, сульфидов.
При нагревании разлагается, выделяя металлическое серебро:
- 2 AgNO3 →350∘C 2 Ag + 2 NO2 + O2
- Реагирует с щелочью с образованием оксида:
- 2 AgNO3 + 2 NaOH ⟶ Ag2O + 2 NaNO3 + H2O
- в этаноле, при -50 градусах, образуется гидроксид серебра
- AgNO3 + NaOH →C2H5OH−50 AgOH ↓ + KNO3 ↓
Применение
Нитрат серебра применяется:
- в гальванотехнике как источник ионов серебра;
- в аналитической химии как реактив на хлориды;
- в фотографии как компонент проявителей, усилителей и других растворов;
- в медицине, как средство для прижигания кожи.
Использование в медицине


Пятна от нитрата серебра на коже
Нитрат серебра используется в медицине в виде сплава нитрата серебра и нитрата калия) иногда отлитый в виде палочек — ляписного карандаша для прижигания и стерилизации ран, удаления мелких бородавок.
Лечебное действие нитрата серебра заключается в подавлении жизнедеятельности микроорганизмов, в небольших концентрациях он действует как прижигающее, противовоспалительное и вяжущее средство, а концентрированные растворы, как и кристаллы AgNO3, прижигают живые ткани.
Впервые ляпис (адский камень) применили врачи Ян-Баптист ван Гельмонт и Франциск де ла Бое Сильвий, которые научились получать нитрат серебра взаимодействием металла с азотной кислотой. Они обнаружили, что прикосновение к кристаллам полученного вещества приводит к появлению на коже чёрных пятен, а при длительном контакте — глубоких ожогов.

Токсичность
Нитрат серебра ядовит. Минимальная смертельная доза ЛД50 для собак — 20 мг/кг, для кроликов — 800 мг/кг. Класс опасности — 2.
Коррозионно-активен, при контакте с кожей может вызывать химические ожоги. Оставляет на коже чёрные пятна.
Галерея
- Изображения нитрата серебра
-

Загрузить PDF
Загрузить PDF
Нитрат серебра является полезным химическим соединением для многих экспериментов, включая проявление галогенидов, осаждение галогенов, серебрение зеркала и вытеснение металлов.[1]
Покупка нитрата серебра может требовать больших денежных затрат, но зато азотная кислота и серебряные слитки стоят относительно недорого и могут быть использованы для создания нитрата серебра. Поскольку в результате реакции образуются токсичные пары, обязательно следуйте технике безопасности и наденьте все необходимые средства защиты.
-

1
Используйте надлежащие средства защиты. Задействованные в этом процессе химические реагенты очень токсичны и при неправильном обращении могут вызвать проблемы со здоровьем. В целях безопасности наденьте защиту для глаз, перчатки и лабораторный халат. Для защиты от разливов советуем надеть длинные брюки и закрытую обувь (желательно без шнурков).[2]
- Чтобы защитить глаза от брызг, защитные очки должны полностью закрывать их спереди и по бокам.
- Для защиты рук наденьте латексные или нитриловые перчатки.
- Наденьте халат или второй слой одежды, который можно будет легко снять, если вы прольете на себя раствор.
- Вместо контактных линз наденьте очки, чтобы под ними не скапливались токсичные пары.
-

2
Работайте в хорошо проветриваемом помещении. Пар, который выделяется при изготовлении нитрата серебра, чрезвычайно токсичен и при вдыхании может нести смертельную угрозу. Данную процедуру лучше проводить в вытяжном шкафу, но если у вас нет такой возможности, работайте на улице в хорошо проветриваемом месте. Если вы решили устроиться в гараже, откройте дверь и все окна.
- Включите несколько вентиляторов, чтобы обеспечить циркуляцию воздуха.
- Не наклоняйтесь над химической реакцией и не вдыхайте пары.
-

3
Расскажите знакомым о своем эксперименте. Прежде чем приступать к работе, уведомьте кого-нибудь из своих знакомых о потенциальной опасности вашего занятия. Ваш друг сможет проведать вас, а если что-либо пойдет не так, он будет знать, с чем вы работали, и передаст эти сведения медработникам.
Реклама
-

1
Подготовьте все необходимое. Для производства нитрата серебра вам понадобится вытяжной шкаф или рабочее место снаружи дома, концентрированная азотная кислота (70 %), чистая стеклянная емкость, кусок чистого серебра, алюминиевая проволока и нагревательная плита. Размер стеклянной емкости и необходимое количество азотной кислоты и серебра зависят от того, сколько нитрата серебра вы пытаетесь получить. Пары, выделяющиеся в ходе химической реакции, чрезвычайно токсичны, поэтому рабочая зона должна хорошо проветриваться.[3]
- Азотную кислоту можно приобрести в магазине химических реактивов.
- Если азотную кислоту нужно разбавить, обязательно добавляйте кислоту в воду (осторожно помешивая), а не наоборот. Если добавить воду в кислоту, то это может вызвать бурную реакцию и привести к травме.[4]
- Чистое серебро можно купить в интернет-магазине, у продавца драгоценных металлов или в местном нумизматическом магазине.[5]
-

2
Заполните чистую стеклянную емкость концентрированной азотной кислотой. Стеклянная емкость должна быть чистой, чтобы нитрат серебра не был загрязнен. Добавьте достаточно азотной кислоты, чтобы практически полностью покрыть кусок серебра.
- Аккуратно налейте азотную кислоту в емкость, стараясь не пролить ее.
- При работе с азотной кислотой обязательно надевайте защитные перчатки, очки и лабораторный халат.
-

3
Оберните алюминиевую проволоку вокруг серебра. Алюминий не начнет реагировать с азотной кислотой, что позволит вам лучше контролировать реакцию. Оберните алюминий вокруг серебра и выведите конец проволоки наружу, чтобы вы могли достать серебро из раствора при слишком бурной реакции.[6]
-

4
Поместите обернутый алюминием кусок серебра в азотную кислоту. Работайте на улице или в вытяжном шкафу. Когда будете готовы, погрузите серебро в азотную кислоту. Когда начнется реакция, на поверхности появится несколько пузырьков.[7]
-

5
Нагревайте кислоту, пока серебро не начнет пузыриться. В результате химической реакции кислота начнет выделять токсичные пары, поэтому ни в коем случае не проводите этот эксперимент в помещении. Не наклоняйтесь над раствором и не вдыхайте пары. Работайте в надлежаще вентилируемом вытяжном шкафу, на улице или наденьте противогаз. Поставьте емкость на плиту и нагревайте раствор, пока серебро не начнет пузыриться.[8]
- В ходе реакции раствор перестанет быть прозрачным, так что вы не увидите, что будет происходить.
- Убавьте огонь на плите, пока продолжается реакция, чтобы раствор не закипел.
-

6
Подождите, пока серебро полностью не растворится. В зависимости от размеров куска серебра, этот процесс может занять несколько часов. Возможно, вам также придется снова подогреть раствор, чтобы реакция продолжалась.
- Следите за емкостью, пока протекает реакция. Потяните за алюминиевую проволоку, чтобы вытащить серебряный кусок из раствора и оценить степень растворения серебра.
- Когда серебро полностью растворится, снимите емкость с плиты.
-

7
Подождите, пока раствор полностью не испарится. Последний шаг требует терпения и займет несколько дней. По мере охлаждения раствора нитрат серебра начнет оседать в нижней части емкости. Через несколько дней, когда остатки раствора испарятся, в емкости останутся лишь кристаллы нитрата серебра.[9]
- Образовавшиеся кристаллы представляют собой чистый нитрат серебра, хранить которые необходимо в герметичном контейнере вдали от света.
Реклама
Предупреждения
- Азотная кислота сама по себе чрезвычайно опасна, поэтому при работе с ней надевайте перчатки и защитные очки и будьте осторожны.
- В результате этой реакции выделяется токсичный газ — двуокись азота! Работайте снаружи или в вытяжном шкафу.
Реклама
Об этой статье
Эту страницу просматривали 12 432 раза.
Была ли эта статья полезной?
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
ПОЛУЧЕНИЕ НИТРАТА СЕРЕБРА ИЗ ВТОРИЧНОГО СЫРЬЯ
- Авторы
- Руководители
- Файлы работы
- Наградные документы
Дудников Д.Ю. 1
1МБОУ Агинская СОШ № 2
Рубцова Е.А. 1
1МБОУ Агинская СОШ № 2
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке “Файлы работы” в формате PDF
В настоящее время в современных школах (особенно в сельских и деревенских) существует проблема заказа и доставки химических реактивов. Одним из наиболее дорогостоящих и используемых в школьном химическом практикуме является нитрат серебра (I). Стоимость его за 1 г составляет от 25 до 45 рублей. Цена колеблется в зависимости от изготовителя и удалённости фирмы производителя от заказчиков.
Нитрат серебра (I) в школьном химическом практикуме используется при проведении ярких качественных реакций в неорганической и органической химии [1]. Поэтому отсутствие его в школьной лаборатории – это огромный минус «химической наглядности».
Таким образом, целью работы являлось получение нитрата серебра (I) в условиях школьной лаборатории.
Где же взять такой драгоценный металл как серебро?! Известно, что серебро содержится в рентгеновских снимках, проявленных фотоплёнках, в фотографиях [2]. Именно из них, в несколько стадий, был получен нитрат серебра (I).
Задачи исследования:
1. Используя литературные источники, определить вторичное сырье для получения нитрата серебра
2. Получить нитрат серебра из различных объектов
3. Сравнить выход продуктов реакции
4. Провести качественные реакции с полученным в условиях школьной лаборатории нитратом серебра (I).
Глава I. Литературный обзор
1. 1 Серебро и его свойства
Серебро стало известно значительно позднее золота, хотя так же встречается в самородном состоянии. В Египте археологами найдены серебреные украшения, относящиеся ещё к додинастическому периоду (5000 – 3400 до н. э.). Однако долгое время серебро было большой редкостью и ценилось дороже золота.
Чистое серебро не темнеет на воздухе, а вот серебро с примесью может достаточно быстро потемнеть (рис. 1) [2].
А. Б.
Рис. 1. Серебреное изделие из ювелирного магазина (А) и после некоторого ношения человеком (Б).
Потемнение указывает на наличие серы в воздухе, например, при загрязнении воздуха или болезни обладателя серебреного предмета. После золота серебро является самым лёгким по обработке металлом. Из 30 граммов серебра можно вытянуть проволоку длиной более 50 км. Это также самый лучший из известных проводников тепла и электроэнергии [4].
Соединения серебра часто не устойчивы к нагреванию и действию света. Открытие светочувствительности солей серебра привело к появлению фотографии и быстрому увеличению спроса на серебро. Ещё в середине 20 века почти половина всего добытого серебра шла на изготовление кино- и фотоматериалов. Одним из соединений серебра является ляпис [5].
1.2 Применение нитрата серебра в медицине
Нитрат серебра, ляпис (AgNO3) − бесцветный (белый) порошок, хорошо растворимый в воде, на свету он чернеет с выделением металлического серебра (рис. 2) [3].
Рис. 2. Внешний вид нитрата серебра
Впервые ляпис был применён в XVII веке врачами-алхимиками: голландец Ян-Батист Ван Гельмонт и немец Франциск де ла Бое Сильвий. Они научились получать нитрат серебра взаимодействием металла с азотной кислотой. Учёные обнаружили, что прикосновение к кристаллам полученной серебряной соли приводит к появлению на коже чёрных пятен, а при длительном контакте – глубоких ожогов (рис. 3). Поэтому это вещество прозвали «адским камнем».
Рис. 3. Образование чёрных пятен при прикосновении к нитрату серебра.
Адский камень – не чистый нитрат серебра, а его сплав с нитратом калия, иногда отливается в виде палочек – ляписного карандаша. Лечебное действие нитрата серебра заключается в подавлении жизнедеятельности микроорганизмов; в небольших концентрациях он действует как противовоспалительное и вяжущее средство.
Фармакологическое действие – антисептическое, вяжущее, противовоспалительное, прижигающее, противомикробное, бактерицидное. Связывает сульфгидрильные и карбоксильные группы, что может обусловливать изменение конформации белка, его структуры, или вызывать денатурацию. При диссоциации нитрата серебра ионы серебра вызывают преципитацию белков и обусловливают бактерицидное действие. Альбуминат серебра, образующийся при взаимодействии нитрата серебра с тканевыми белками, постепенно приобретает черную окраску (это связано с восстановлением из альбумината металлического серебра), что, в свою очередь, приводит к взаимодействию с активными группами ферментов. Блокирует некоторые ферментные системы, нарушая тем самым метаболические процессы в микробной клетке. В связи с этим нитрат серебра после кратковременного бактерицидного оказывает длительное бактериостатическое действие. Серебра нитрат при разведении 1:1000 уничтожает большинство микроорганизмов.
Ранее серебра нитрат применяли при хроническом гастрите и язвенной болезни желудка и двенадцатиперстной кишки (внутрь, в виде 0,05% раствора). Раствор (2%) может использоваться для профилактики гонококковой инфекции глаз у новорожденных [2].
1.3 Вторичное серебросодержащее сырьё
Основными поставщиками серебросодержащего сырья являются химическая, радио- и электротехническая промышленности; производства: ювелирное, часовое и зеркальное, а также рентгеновские кабинеты в медицинских поликлиниках.
Серебросодержащие отходы фото- и кинопромышленности образуются в процессе изготовления, обработки и порчи светочувствительных материалов или износа кинолент и фотоотпечатков.
Отходы химической промышленности поступают в виде отработанных контактных масс (20-80% Ag); отработанных катализаторов (более 80% Ag); шламов (от 60 до 80% Ag); лома серебряной аппаратуры (20-25% Ag).
Образование серебросодержащих отходов в зеркальной промышленности происходит в процессе серебрения зеркал, елочных украшений и так далее [3].
Часовое производство направляет на переработку следующие виды сырья, содержащего Ag, %: серебряные припои – от 15 до 99; серебряные контакты 20-80; опилки и стружку – от 10 до 70.
От лечебных учреждений на извлечение серебра поступают, %: зола рентгенопленки и фотоотпечатков – от 0,5 до 50; сернистое серебро 45-65.
Большое количество серебросодержащего сырья (до 30-40% Ag) перерабатывается в виде отходов электронной и электротехнической отраслей промышленности: вышедшие из строя серебряно-цинковые и серебряно-кадмиевые аккумуляторы (от 30 до 60%); сплавы-контакты, серебряные припои (от 5 до 99%); металлокерамические композиции 25-50.
Кроме перечисленных отходов на переработку поступают другие виды сырья, резко различающиеся химическими и физическими свойствами.
Глава II. Объекты и методы исследования
2.1 Объекты исследования
В качестве объектов исследования для получения реактива нитрата серебра были использованы рентгеновские снимки, фотоплёнка, ёлочная игрушка, зеркало (рис. 4).
А. Б.
Рис. 4. Вторичное серебросодержащее сырьё:
А. Рентгеновские снимки. Б. Фотоплёнка.
2.2 Методика получения нитрата серебра из рентгеновских снимков и фотоплёнок
Рентгеновские снимки и фотоплёнку резали на мелкие кусочки и отмеряли на весах по 17 граммов каждого. Далее подготовленный материал растворяли в азотной кислоте (концентрированной) (рис. 5).
Рис. 5. Растворение рентгеновских снимков в азотной кислоте.
После растворения объектов приливали раствор поваренной соли. Полученный осадок промывали водой и заливали раствором хлороводородной кислоты. После чего в осадок клали гранулы цинка для проведения реакции замещения. По завершении реакции, полученный порошок промывали и высушивали. Высушенное серебро растворяли в растворе азотной кислоты, затем выпаривали и растворяли в дистиллированной воде [1].
2.3 Методика получения нитрата серебра из серебросодержащих изделий
Ёлочную игрушку и зеркало очищали от различного рода загрязнений и заливали раствором азотной кислоты до растворения (рис. 6). Полученный раствор выпаривали и получали порошок, который прокаливали в фарфоровой чашке. К остуженному расплаву приливали воды, и полученный раствор нитрата серебра сливали.
Рис. 6. Растворение ёлочной игрушки в растворе азотной кислоты.
2.4 Методика проведения качественных реакций на галогенид-ионы
К растворам солей, содержащих хлорид-ионы, бромид-ионы, иодид-ионы приливали раствор полученного нитрата серебра. Наблюдали выпадение осадков.
2.5 Методика проведения реакции «серебряного зеркала»
К раствору аммиачного нитрата серебра добавляли примерно столько же глюкозы и нагревали содержимое пробирки до образования осадка на стенках.
Глава III. Результаты и их обсуждение
3.1 Результаты получения нитрата серебра из рентгеновских снимков и фотоплёнок
После добавления концентрированной азотной кислоты ионы серебра выделились в раствор. Далее при приливании к полученному раствору хлорида натрия происходило образование белого осадка (1) (рис. 7):
Ag+ + NaCl → AgCl↓ + Na+ (1).
Рис. 7. Образование белого осадка хлорида серебра.
После окончательного промывания и осаждения хлорида серебра к осадку с соляной кислотой добавляли гранулы цинка, что способствовало образованию серебра (2):
2AgCl↓ + Zn → ZnCl2 + 2Ag↓ (2)
После добавления к образовавшемуся серебру разбавленной азотной кислоты происходило образование нитрата серебра и выделение газа (3):
3Ag + 4HNO3(разб)→ 3AgNO3 + NO + 2H2O (3)
После выпаривания нитрата серебра, в случае с рентгеновской плёнкой его масса составила 1,2 грамма. В случае с фотоплёнкой масса нитрата серебра составила 0,8 граммов.
3.2 Результаты получения нитрата серебра из серебросодержащих изделий
Содержащееся на поверхности изделий серебро растворилось в растворе азотной кислоты полностью: от зеркала осталось прозрачное стекло. Теперь в растворе находятся соли серебра и меди. Чтобы избавиться от примеси солей меди, раствор выпарили и прокалили до образования оксида меди (II) (4) (рис. 8):
2Cu(NO3)2 → 2CuO↓+4NO2+O2 (4).
Рис. 11. Выпаривание раствора солей серебра и меди.
После приливали воду, нитрат серебра растворялся, а оксид меди оставался в виде осадка. Полученный раствор слили в склянку с надписью AgNO3.
3.3 Результаты проведения качественных реакций на галогенид-ионы с полученным нитратом серебра
После приливания нитрата серебра к растворам солей, содержащих хлорид-ионы, бромид-ионы, иодид-ионы происходило образование белого (5), светло-жёлтого (6) и жёлтого осадков (7) соответственно (рис. 9):
Cl– + AgNO3 → AgCl↓ + NO–3 (5)
Br– + AgNO3 → AgBr↓ + NO–3 (6)
I– + AgNO3 → AgI↓ + NO–3 (7).
А. Б. В.
Рис. 9. Качественные реакции на галогенид-ионы. А. Хлорид-ионы. Б. Бромид-ионы. В. Иодид-ионы
3.4 Результаты проведения реакции «серебряного зеркала»
После добавления к аммиачному раствору серебра глюкозы и нагревании смеси, произошло выпадение осадка серебра на стенках пробирки (8):
НОСН2(СНОН)4HС=O + 2[Ag(NH3)2]OH →
НОСН2(CHОН)4СООH + 2Ag↓ + 3NH3↑ + H2O (8)
Это свидетельствует о том, что в ходе исследования действительно был получен нитрат серебра.
ВЫВОДЫ
1. Исходя из литературных источников, сырьём для получения нитрата серебра являются рентгеновские снимки, фотоплёнки, ёлочные игрушки, зеркала.
2. Чистый нитрат серебра был получен из рентгеновских снимков и фотоплёнок.
3. Выход нитрата серебра, полученного из рентгеновских снимков оказался больше, чем при получении из фотоплёнок.
4. Были проведены качественные реакции с помощью полученного нитрата серебра.
5. При острой необходимости, нитрат серебра можно получить в школьной лаборатории.
СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ
1. Мосина Т. А. Нитрат серебра для ретро // Сделай сам. – 1990. – №4. С.141
2. Польза серебра для здоровья [Электронный ресурс]. – Лаборатория омоложения – Режим доступа: http://www.deus1.com/serebro.html
3. Серебряные лекарства [Электронный ресурс]. – Аптечные сторожилы. – Режим доступа: http://www.alhimik.ru/apteka/apt2N-Ag.html#4.31
4. Харитонов Ю. Я. Аналитическая химия. – М.: Высшая школа, 2001.
5. Химики называют ляпис азотнокислое серебро [Электронный ресурс]. – Искусство фотографии. – Режим доступа: http://premier-foto.ru/books/kvchmutov/khimiki-nazyvayut-lyapis
Просмотров работы: 3117


![{displaystyle {ce {AgNO3 +KOH->[{-50~^{circ }{text{C}}}][{C_{2}H_{5}OH}]AgOH +KNO3v}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3cbc14be6b6b7072f3a821180a0f555f848f69d9)


