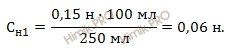Определите нормальную концентрацию (молярная концентрация эквивалента) раствора соляной кислоты (HCl), если на нейтрализацию 250 миллилитров ее потребовалось 100 миллилитров 0,15 н раствора гидроксида натрия (NaOH).
Решение задачи
Напомню, что под нормальной концентрацией понимают количество грамм-эквивалентов данного вещества, содержащегося в 1 л раствора. Нормальную концентрацию выражают в моль-экв/л или используют сокращение «н», «N»
По условию задачи протекает реакция нейтрализации соляной кислоты (HCl) раствором гидроксида натрия (NaOH):
Существует правило: растворы разной нормальности реагируют между собой в объемах обратно пропорциональных их нормальностям:
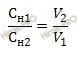
CH1 – нормальная концентрация раствора соляной кислоты (HCl);
V1 – объем раствора соляной кислоты (HCl);
CH2 – нормальная концентрация раствора гидроксида натрия (NaOH);
V2 – объем раствора гидроксида натрия (NaOH).
Запишем формулу расчета нормальной концентрации раствора соляной кислоты (HCl):
Таким образом, получаем:
Ответ: нормальная концентрация раствора соляной кислоты равна 0,06 н.
Загрузить PDF
Загрузить PDF
Нормальность отображает концентрацию кислоты или щелочи в растворе. Чтобы узнать нормальность раствора, в расчетах можно использовать как молярность, так и эквивалентную массу молекулы. Если вы решили использовать молярность, используйте формулу N = M(n), где M — это молярность, а n — количество молекул водорода или гидроксида. Если же вы решили использовать эквивалентную массу, используйте формулу N = eq ÷ V, где eq — это количество эквивалентов, а V — объем раствора.
-
1
Сложите молярную массу всех компонентов раствора. Найдите элементы химической формулы на периодической таблице, чтобы узнать их атомную массу, которая соответствует молярной. Запишите молярную массу каждого элемента и умножьте ее на количество этих элементов. Сложите молярную массу всех компонентов, чтобы узнать общую молярную массу.[1]
- Например, если необходимо узнать молярную массу серной кислоты (H2SO4), узнайте молярную массу водорода (1 г), серы (3 г) и кислорода (16 г).
- Умножьте массу на количество компонентов в составе. В нашем примере присутствует 2 атома водорода и 4 атома кислорода. Общая молярная масса водорода равна 2 x 1 г = 2 г. Молярная масса кислорода в этом растворе будет равна 4 x 16 г = 64 г.
- Сложите все молярные массы вместе. У вас получится 2 г + 32 г + 64 г = 98 г/моль.
- Если вы уже знаете молярность искомого раствора, перейдите сразу к Шагу 4.
-
2
Разделите фактическую массу раствора на молярную массу. Узнайте фактическую массу раствора. Она будет указана либо на емкости с раствором, либо в самой задаче. После этого разделите массу раствора на общую молярную массу, найденную ранее. Результатом станет количество молей в растворе, после которого должно быть написано «моль».[2]
- Например, если вы пытаетесь узнать нормальность 100 г H2SO4, которую растворили в 12 литрах жидкости, используйте фактическую массу и разделите ее на молярную. В результате у вас выйдет: 100 г ÷ 98 г/моль = 1,02 моль.
- 1 моль равен 6.02 x 1023 атомам или молекулам раствора.
-
3
Разделите результат на объем раствора в литрах, чтобы узнать молярность. Возьмите только что вычисленное количество молей в растворе и разделите его на общий объем измеряемого раствора. В результате вы узнаете молярность (M), с помощью которой можно узнать концентрацию раствора.[3]
- Исходя из нашего примера, получится такая формула: 1.02 моль ÷ 12 л = 0.085 M.
Совет: обязательно переведите объем раствора в литры, если еще этого не сделали. В противном случае вы получите неправильный ответ.
-
4
Умножьте молярность на количество молекул водорода или гидроксида. Взгляните на химическую формулу, чтобы узнать количество атомов водорода (H) в кислоте или молекул гидроксида в (ОН) в основании. Затем умножьте молярность раствора на количество молекул водорода или гидроксида в этом растворе, чтобы узнать нормальную концентрацию, или нормальность. В конце ответа напишите сокращение «N».[4]
- В нашем примере у серной кислоты (H2SO4) 2 атома водорода. Значит формула будет такой: 0,085 M x 2 = 0,17 N.
- В другом примере у гидроксида натрия (NaOH) с молярностью 2 M всего 1 молекула гидроксида. Следовательно, формула будет следующей: 2 M x 1 = 2 N.
Реклама
-
1
Узнайте общую молярную массу раствора. Взгляните на химическую формулу раствора и найдите каждый элемент в периодической таблице. Запишите молярную массу каждого элемента и умножьте ее на количество этих элементов в формуле. Сложите вместе все молярные массы, чтобы узнать общую молярную массу в граммах.[5]
- Например, если вы хотите узнать молярную массу Ca(OH)2,тогда узнайте молярную массу кальция (40 г), кислорода (16 г) и водорода (1 г).
- В формуле 2 атома кислорода и водорода. Общая масса кислорода будет следующей: 2 x 16 г = 32 г. Молярная масса водорода будет равна: 2 x 1 г = 2 г.
- Сложите вместе все молярные массы, чтобы получить 40 г + 32 г + 2 г = 74 г/моль.
-
2
Разделите молярную массу на количество молекул водорода или гидроксида. Узнайте количество атомов водорода (H) в кислоте или молекул гидроксида (ОН) в основании. Разделите только что полученную общую молярную массу на количество атомов или молекул, чтобы узнать вес 1 эквивалента, который будет равен массе 1 моли водорода или гидроксида. В конце ответа напишите сокращение «Г.-э.», означающее массу эквивалента.[6]
- В нашем примере у Ca(OH)2 2 две молекулы водорода, значит, масса эквивалента будет равна 74 г/моль ÷ 2 = 37 Г.-э.
-
3
Разделите фактическую массу раствора на массу эквивалента. После того, как вы узнаете массу эквивалента, разделите ее на массу раствора, которая указана на емкости с раствором или в решаемой задаче. Ответом станет количество эквивалентов в растворе, чтобы вы потом смогли рассчитать нормальность. В конце ответа поставьте сокращение «э.»[7]
- Если в нашем примере 75 г Ca(OH)2, то формула будет такой: 75 г ÷ 37 Г.-э = 2,027 э.
-
4
Разделите число эквивалентов на объем раствора в литрах. Узнайте общий объем раствора и запишите ответ в литрах. Возьмите только что полученное количество эквивалентов и разделите его на объем раствора, чтобы узнать нормальность. В конце ответа поставьте сокращение «N».[8]
- Если в растворе объемом 8 л находится 75 г Ca(OH)2, тогда разделите количество эквивалентов на объем следующим способом: 2,027 э. ÷ 8 л = 0,253 N.
Реклама
Советы
- Нормальная концентрация, или нормальность, обычно используется для измерения кислот и оснований. Если вам нужно определить концентрацию другого раствора, для этого, как правило, измеряют молярность.
Реклама
Что вам понадобится
- Периодическая таблица
- Калькулятор
Об этой статье
Эту страницу просматривали 91 932 раза.
Была ли эта статья полезной?
Normality of a solution determines the concentration of solutes in the solution. It is expressed as number of equivalents per litre. (Normality = gram equivalents/ litres solution). The easiest way to find normality is from molarity. All you need to know are how many moles of ions dissociate. Normality can also be calculated by multiplying molarity with gram equivalent Normality (N) = Molarity(M) x Equivalent (N/M).
-
Normality is not an appropriate unit of concentration in all situations. It requires a defined equivalence factor and is not a set value for a chemical solution. The value of normality can change according to the chemical reaction under examination.
First, determine the equivalent of HCl. An equivalent is the number of moles of hydrogen ions one molecule of an acid will donate or one mole of base will accept.
Equivalent of HCl= 1 (as each molecule of HCl will donate only one mole of hydrogen ion)
For example, let’s consider 2M solution of HCl.
Gram equivalent of HCl is 1 Normality (N) = Molarity(M) x Equivalent(N/M) Normality = 2 x 1= 2N
For all solutions which have gram equivalent value of 1, the normality of the solution is always equal to the molarity of the solution.
Tips
Расчет концентрации, объема и процентного содержания определяемого вещества
Задача 116.
42. Какой объём 0,15 Н. раствора NaOH пойдёт на титрование:
а) 21,00 см3 0,1133 СН раствора HCl;
б) 21,00 см3 раствора HCl с титром 0,003810 г/см3?
Решение:
Уравнение реакции:
NaOH + HCl = NaCl + H2O
NaOH – определяемое вещество (А); HCl – титрант (В).
а)
V(HCl) = 21,00 см3;
Э(NaОН) = 40 г/моль;
CН(HCl) = 0,1133 Н;
CН(NaОН) = 0,15 Н;
V(NaOH) = ?
Определяемое вещество – NaОН; титрант – HCl.
1. Рассчитаем массу гидроксида натирия
Массу NaОН рассчитаем по формуле:
m = (СН · V · Э)/1000, где
CH – нормальность раствора; V – объем раствора, см3; Э – эквивалентная масса определяемого вещества.
Тогда
m(NaОН) = [CH(HCl) · V(p-pa) · Э(NaОН)]/1000 = (0,1133 · 21,00 · 40)/1000 = 0,095172 г.
2. Рассчитаем объем раствора NaOH, пошедшего на титрование раствора HCl
Объем раствора NaOH определим по формуле:
V = (m · 1000)/(CH · Э), где
m – масса определяемого вещества; СН – нормальность раствора определяемого вещества; Э – эквивалентная масса определяемого вещества.
Тогда
V(NaOH) = [m(NaОН) · 1000]/[CН(NaОН) · Э(NaОН)] = (0,095172 · 1000)/(0,15 · 40) = 95,172/6 = 15,862 см3.
б)
V(HCl) = 21,00 см3;
Э(NaОН) = 40 г/моль;
T(HCl) = 0,003810 г/см3;
CН(NaОН) = 0,15 Н;
V(NaOH) = ?
1. Рассчитаем нормальность раствора HCl
Нормальность раствора HCl рассчитаем по формуле:
Т(В) = [CH(B) · Э(B)]/1000, где
CH(B) – нормальность раствора; Т(В) – титр раствора; Э(B) – масса эквивалента вещества.
Тогда
СН(А) = [Т(B) · 1000]/Э(B) = СН(HCl) = [Т(HCl) · 1000]/Э(HCl) = (0,095172 · 1000)/36,5 = 0,1044 H.
2. Рассчитаем массу гидроксида натирия
Массу NaОН рассчитаем по формуле:
m = (СН · V · Э)/1000, где
CH – нормальность раствора; V – объем раствора, см3; Э – эквивалентная масса определяемого вещества.
Тогда
m(NaОН) = [CH(HCl) · V(p-pa) · Э(NaОН)]/1000 = (0,1044 · 21,00 · 40)/1000 = 0,087682 г.
2. Рассчитаем объем раствора NaOH, пошедшего на титрование раствора HCl
Объем раствора NaOH определим по формуле:
V = (m · 1000)/(CH · Э), где
m – масса определяемого вещества; СН – нормальность раствора определяемого вещества; Э – эквивалентная масса определяемого вещества.
Тогда
V(NaOH) = [m(NaОН) · 1000]/[CН(NaОН) · Э(NaОН)] = (0,087682 · 1000)/(0,15 · 40) = 14.614 см3.
Ответ: а) 15,862 см3.; б) 14,614 см3.
Задача 117.
На титрование 20,00 см3 HNO3 затрачено 15,00 см3 0,12 М раствора NaOH. Вычислите нормальную концентрацию, титр раствора HNO3 и массу HNO3 в 250 см3 раствора.
Решение:
V1(HNO3) = 20,00 см3;
V2(HNO3) = 250,00 см3;
V(NaOH) = 15,00 см3;
М(HNO3) = Э(HNO3) = 63 г/моль;
CМ(NaOH) = CН(NaOH) = 0,12 моль/дм3;
CН(HNO3) = ?
Т(HNO3) = ?
m(HNO3) = ?
Уравнение реакции имеет вид:
HNO3 + NaOH > NaNO3 + H2O
HNO3 – определяемое вещество (А); NaOH – титрант (В).
1. Определение нормальности раствора
Нормальность HNO3 определяем по формуле:
СН(А) = [СН(В) · V(B)]/V(A), где
СН(А) – нормальность раствора определяемого вещества; СН(В) – нормальность раствора титранта; V(A) – объем раствора определяемого вещества; V(B) – объем раствора титранта.
Тогда
CН(HNO3) = [CН(NaOH) · V(NaOH)]/V1(HNO3) = (0,12 · 15,00)/20,00 = 0,09 Н.
2. Определение титра раствора HNO3
Титр раствора определяемого вещества рассчитаем по формуле:
Т(А) = [СН(А) · Э(А)]/1000, где
СН(А) – нормальность раствора определяемого вещества; Э(А) – масса эквивалента определяемого вещества.
Тогда
Т(HNO3) = [СН(HNO3) · Э(HNO3)]/1000 = (0,09 · 63)/1000 = 0,005670 г/см3.
3. Определение массы азотной кислоты в 250 см3 раствора
Массу кислоты рассчитаем по формуле:
m(A) = [V(A) · СН(А) · Э(А)]/1000, где
СН(А) – нормальность раствора определяемого вещества; Э(А) – масса эквивалента определяемого вещества; V(A) – объем раствора определяемого вещества.
Тогда
m(HNO3) = [V2(HNO3) · СН(HNO3) · Э(HNO3)]/1000 = (250 · 0,09 · 63)/1000 = 1,4175 г.
Ответ: 0,09 моль/дм3; 0,005670 г/см3; 1,4175 г.
Задача 118.
На титрование образца технической соды массой 0,2240 г в присутствии метилового оранжевого израсходовано 18,00 см3 стандартного раствора HCl с титром 0,003646 г/см3. Рассчитайте содержание Na2CO3 в исходном образце соды (w, %).
Решение:
а = 0,2240 г;
V(HCl) = 18,00 см3;
T(HCl) = 0,003646 г/см3;
Э(HCl) = 36,46 г/моль;
М(Na2CO3) = 106 г/моль;
Э(Na2CO3) = 53 г/моль;
w%(Na2CO3) = ?
Уравнение реакции имеет вид:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
А – определяемое вещество; NaC1
1. Рассчет массы определяемого вещества (Na2CO3), участвующего в реакции
Массу Na2CO3 рассчитаем по формуле:
m(А) = [Э(A) · T(В) · V(B)]/Э(B), где
m(А) – масса определяемого вещества; Э(A) – эквивалентная масса определяемого вещества; Э(В) – эквивалентная масса титранта; V(B) – объём раствора титранта; Т(В) – титр раствора титранта.
Тогда
m(Na2CO3) = [Э(Na2CO3) · T(HCl) · V(HCl)]/Э(HCl) = (53 · 0,003646 · 18,00)/36,46 = 0,0954 г.
2. Рассчет содержания определяемого вещества в образце навески
Искомую величину w, %, находим по формуле:
w% = [m(А) · 100%]/a, где
m(А) – масса определяемого вещества; a – масса навески определяемого вещества.
Тогда
w% = [0,0954 · 100%]/0,2240 = 42,589%.
Ответ: 42,589%.
Цель работы:
изучить способы выражения концентрации
растворов, научиться рассчитывать
концентрацию растворов.
Задание:
приготовить приблизительно 0,1 н раствор
соляной кислоты и установить нормальность
и титр кислоты. Выполнить требования к
результатам работы, оформить отчет,
решить задачу.
Теоретическое введение
Один из методов
определения концентрации растворов –
объемный анализ. Он сводится к измерению
объемов реагирующих веществ, концентрация
одного из которых известна.
Такое измерение
производится постепенным прибавлением
одного раствора к другому до окончания
реакции. Этот процесс называется
титрованием. Окончание реакции
определяется с помощью индикатора.
При определении
объемов растворов целесообразно
использовать следующие способы выражения
концентрации растворов:
Молярная
концентрация эквивалентов вещества В
или нормальность
(
(В)
или н) – отношение
количества эквивалентов растворенного
вещества к
объему
раствора:
,
моль/л,
где nэк(В)
– количество эквивалентов вещества В,
моль; mB
– масса вещества В, г; Мэк(В)
– молярная масса эквивалентов вещества
В, г/моль; Vр
– объем раствора, л.
Массовая доля
растворенного вещества В (ωВ)
– отношение
(обычно –
процентное)
массы
растворенного
вещества к
массе раствора:
,
где mB
– масса вещества В, г; mр
– масса раствора, г.
Если выражать
массу раствора через его плотность (ρ)
и объем (Vр),
то
Титр раствора
вещества В (ТВ)
показывает массу
растворенного
вещества,
содержащегося в 1 мл (см3)
раствора:
,
г/мл,
где
mB
– масса растворенного вещества В, г;
Vp
– объем раствора, мл.
Титр также можно
рассчитать по формуле:
,
г/мл,
где Мэк(В)
– молярная масса эквивалентов вещества
В, г/моль;
(В)
– молярная концентрация эквивалентов,
моль/л.
Выполнение работы Опыт 1. Приготовление приблизительно 0,1 н раствора соляной кислоты
Налить (под тягой)
в цилиндр концентрированный раствор
соляной кислоты и ареометром определить
его плотность. По измеренной плотности
по таблице 1 найти массовую долю (%)
кислоты в растворе. Рассчитать массу
кислоты, необходимую для приготовления
250 мл 0,1 н раствора HCl по
формуле:
,
откуда m = сэк ·
Мэк(HCl) · V,
где m
– масса кислоты, г; Мэк(HCl)
– молярная масса эквивалентов кислоты,
г/моль; сэк – молярная концентрация
эквивалентов, моль/л; V –
объем кислоты, л.
Полученную величину
(m) пересчитать на объем,
который требуется для приготовления
250 мл 0,1 н раствора кислоты по формуле:
,
откуда V =
,
где V
– объем кислоты, мл; m –
масса кислоты, г; ω – массовая доля
в % HCl, найденная по таблице
1; ρ – плотность
кислоты, г/см3, измеренная ареометром.
Пипеткой отобрать
рассчитанный объем раствора кислоты,
перенести его в мерную колбу, разбавить
водой до метки и хорошо перемешать.
Опыт 2. Установление нормальности и титра кислоты
Отмерить пипеткой
10 мл приготовленного раствора кислоты,
перенести его в коническую колбу,
добавить 1-2 капли фенолфталеина.
В бюретку налить
0,1 н раствор NaOH. Оттитровать
раствор кислоты. Для этого медленно
приливать из бюретки щелочь в колбу с
раствором кислоты, непрерывно перемешивая
его в процессе титрования. Место, в
которое падают капли щелочи, окрашивается
в розовый цвет, исчезающий при взбалтывании.
Титрование проводить до тех пор, пока
от одной капли щелочи раствор примет
неисчезающую окраску. Титрование
повторить. Результаты не должны отличаться
более чем на 0,1 мл.
Требования к
результату опыта:
Данные опыта
занести в таблицу:
|
№ п/п |
V (HCl) (объем |
V (объем |
Vср (среднее |
|
1 |
|||
|
2 |
|||
|
3 |
Вычислить:
1. Молярную
концентрацию эквивалентов раствора
кислоты по закону эквивалентов:
сэк (HCl)∙V(HCl)
= сэк (NaOH)∙V(NaOH),
откуда
,
моль/л
где сэк
(HCl) и сэк (NaOH)
– молярные концентрации эквивалентов
растворов; V(HCl)
и V(NaOH) –
объемы реагирующих растворов.
2. Титр раствора
НСl по формуле:
,
г/мл
Таблица 1.
Плотность раствора
соляной кислоты
|
Плотность ρ, |
Массовая доля |
|
1,100 |
20,01 |
|
1,105 |
20,97 |
|
1,110 |
21,92 |
|
1,115 |
22,86 |
|
1,120 |
23,82 |
|
1,125 |
24,78 |
|
1,130 |
25,75 |
|
1,135 |
26,70 |
|
1,140 |
27,66 |
|
1,145 |
28,61 |
|
1,150 |
29,57 |
|
1,155 |
30,55 |
|
1,160 |
31,52 |
|
1,165 |
32,49 |
|
1,170 |
33,46 |
|
1,175 |
34,42 |
|
1,180 |
35,39 |
|
1,185 |
36,31 |
|
1,190 |
37,23 |
|
1,195 |
38,16 |
|
1,200 |
39,11 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #