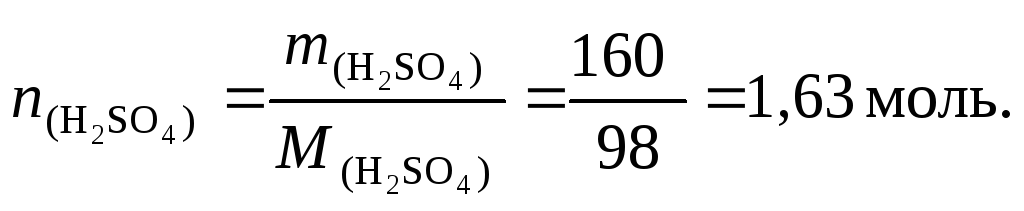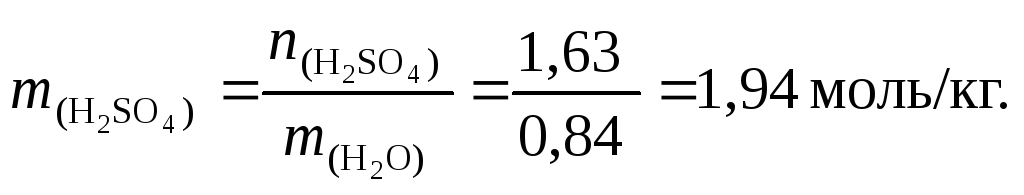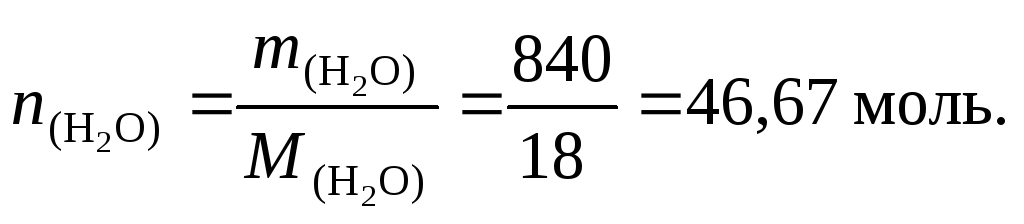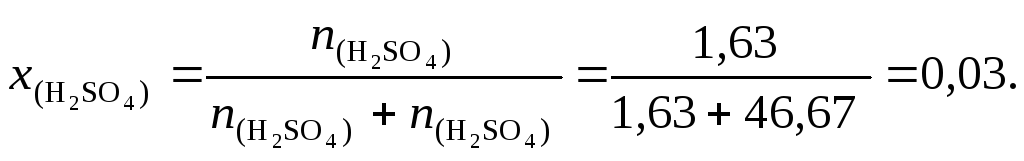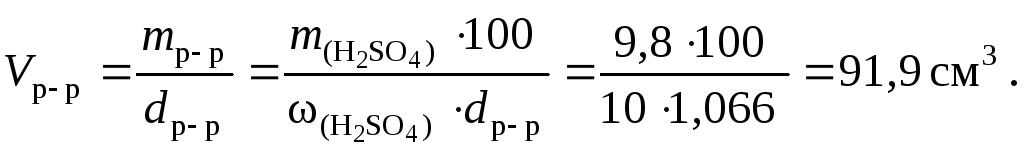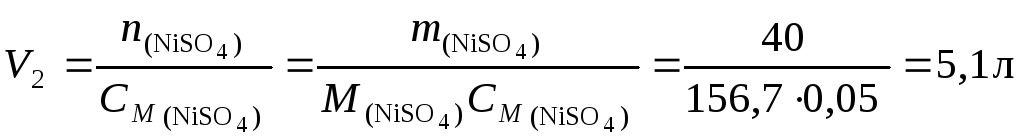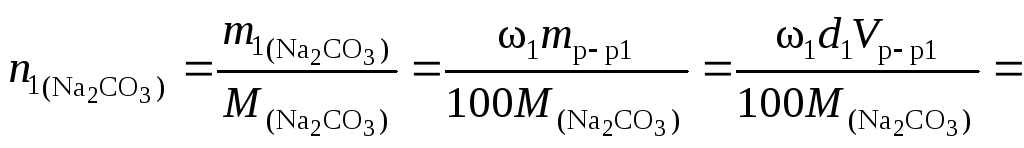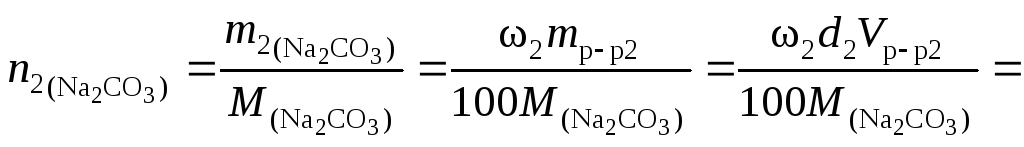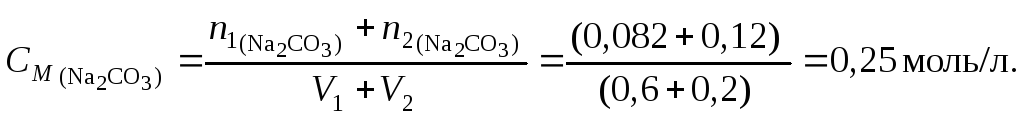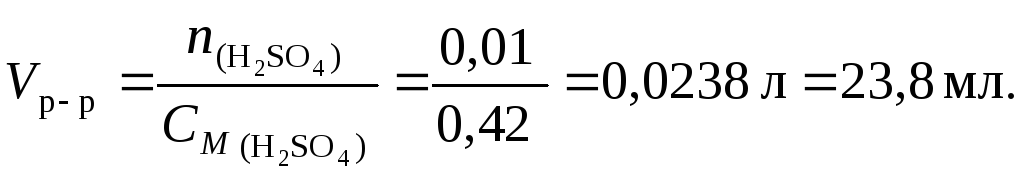Способы выражения концентрации растворов
Существуют
различные способы выражения состава раствора. Наиболее часто используют
массовую долю растворённого вещества, молярную и нормальную
концентрацию.
Массовая доля растворённого вещества w(B) – это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m:
w(B)= m(B) / m
Массовую долю растворённого вещества w(B) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества – CaCl2
в воде равна 0,06 или 6%. Это означает,что в растворе хлорида кальция
массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
Пример
Сколько грамм сульфата натрия и воды нужно для приготовления 300 г 5% раствора?
Решение
m(Na2SO4) = w(Na2SO4) / 100 = (5300) / 100 = 15 г
где w(Na2SO4) – массовая доля в %,
m – масса раствора в г
m(H2O) = 300 г – 15 г = 285 г.
Таким образом, для приготовления 300 г 5% раствора сульфата натрия надо взять 15 г Na2SO4 и 285 г воды.
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
C(B) = n(B) / V = m(B) / (M(B)V),
где М(B) – молярная масса растворенного вещества г/моль.
Молярная концентрация измеряется в
моль/л и обозначается “M”. Например, 2 MNaOH – двухмолярный раствор
гидроксида натрия. Один литр такого раствора содержит 2 моль вещества
или 80 г (M(NaOH) = 40 г/моль).
Пример
Какую массу хромата калия K2CrO4 нужно взять для приготовления 1,2 л 0,1 М раствора?
Решение M(K2CrO4) = C(K2CrO4)
V M(K2CrO4) = 0,1 моль/л 1,2 л 194 г/моль = 23,3 г.
Таким образом, для приготовления 1,2 л 0,1 М раствора нужно взять 23,3 г K2CrO4 и растворить в воде, а объём довести до 1,2 литра.
Концентрацию раствора можно выразить
количеством молей растворённого вещества в 1000 г растворителя. Такое
выражение концентрации называют моляльностью раствора.
Нормальность
раствора обозначает число грамм-эквивалентов данного вещества в одном
литре раствора или число миллиграмм-эквивалентов в одном миллилитре
раствора.
Грамм – эквивалентом вещества
называется количество граммов вещества, численно равное его
эквиваленту. Для сложных веществ – это количество вещества,
соответствующее прямо или косвенно при химических превращениях 1 грамму
водорода или 8 граммам кислорода.
Эоснования = Моснования / число замещаемых в реакции гидроксильных групп
Экислоты = Мкислоты / число замещаемых в реакции атомов водорода
Эсоли = Мсоли / произведение числа катионов на его заряд
Пример
Вычислите значение грамм-эквивалента (г-экв.) серной кислоты, гидроксида кальция и сульфата алюминия.
Э H2SO4 = М H2SO4 / 2 = 98 / 2 = 49 г
Э Ca(OH)2 = М Ca(OH)2 / 2 = 74 / 2 = 37 г
Э Al2(SO4)3 = М Al2(SO4)3 / (23) = 342 / 2= 57 г
Величины нормальности обозначают буквой “Н”. Например, децинормальный раствор серной кислоты обозначают “0,1 Н раствор H2SO4“.
Так как нормальность может быть определена только для данной реакции,
то в разных реакциях величина нормальности одного и того же раствора
может оказаться неодинаковой. Так, одномолярный раствор H2SO4 будет однонормальным, когда он предназначается для реакции со щёлочью с образованием гидросульфата NaHSO4, и двухнормальным в реакции с образованием Na2SO4.
Пример
Рассчитайте молярность и нормальность 70%-ного раствора H2SO4 (r = 1,615 г/мл).
Решение
Для вычисления молярности и нормальности надо знать число граммов H2SO4 в 1 л раствора. 70% -ный раствор H2SO4 содержит 70 г H2SO4 в 100 г раствора. Это весовое количество раствора занимает объём
V = 100 / 1,615 = 61,92 мл
Следовательно, в 1 л раствора содержится 701000 / 61,92 = 1130,49 г H2SO4
Отсюда молярность данного раствора равна: 1130,49 / М (H2SO4) =1130,49 / 98 =11,53 M
Нормальность этого раствора (считая, что кислота используется в реакции в качестве двухосновной) равна 1130,49 / 49 =23,06 H
Пересчет концентраций растворов из одних единиц в другие
При пересчете процентной
концентрации в молярную и наоборот, необходимо помнить, что процентная
концентрация рассчитывается на определенную массу раствора, а молярная
и нормальная – на объем, поэтому для пересчета необходимо знать
плотность раствора. Если мы обозначим: с – процентная концентрация; M –
молярная концентрация; N – нормальная концентрация; э – эквивалентная
масса, r – плотность раствора; m – мольная масса, то формулы для пересчета из процентной концентрации будут следующими:
M = (cp 10) / m
N = (cp 10) / э
Этими же формулами можно воспользоваться, если нужно пересчитать нормальную или молярную концентрацию на процентную.
Пример 1
Какова молярная и нормальная концентрация 12%-ного раствора серной кислоты, плотность которого р = 1,08 г/см3?
Решение
Мольная масса серной кислоты равна 98. Следовательно,
m(H2SO4) = 98 и э(H2SO4) = 98 : 2 = 49.
Подставляя необходимые значения в формулы, получим:
а) Молярная концентрация 12% раствора серной кислоты равна
M = (121,08 10) / 98 = 1,32 M
б) Нормальная концентрация 12% раствора серной кислоты равна
N = (121,08 10) / 49 = 2,64 H.
Иногда в лабораторной практике
приходится пересчитывать молярную концентрацию в нормальную и наоборот.
Если эквивалентная масса вещества равна мольной массе (Например, для
HCl, KCl, KOH), то нормальная концентрация равна молярной концентрации.
Так, 1 н. раствор соляной кислоты будет одновременно 1 M раствором.
Однако для большинства соединений эквивалентная масса не равна мольной
и, следовательно, нормальная концентрация растворов этих веществ не
равна молярной концентрации.
Для пересчета из одной концентрации в другую можно использовать формулы:
M = (NЭ) / m
N = (Mm) / Э
Пример
Нормальная концентрация 1 М раствора серной кислоты N = (198) / 49 = 2 H.
Пример
Молярная концентрация 0,5 н. Na2CO3
M = (0,553) / 106 = 0,25 M.Упаривание, разбавление, концентрирование,
смешивание растворов
Имеется mг исходного раствора с массовой долей растворенного вещества w1 и плотностью r1.
Упаривание раствора
В результате упаривания исходного раствора его масса уменьшилась на Dm г. Определить массовую долю раствора после упаривания w2
Решение
Исходя из определения массовой доли, получим выражения для w1 и w2 (w2 > w1):
w1 = m1 / m
(где m1 – масса растворенного вещества в исходном растворе)
m1 = w1m
w2 = m1 / (m – Dm) = (w1m) / (m – Dm)
Пример
Упарили 60 г 5%-ного раствора сульфата меди до 50 г. Определите массовую долю соли в полученном растворе.
m = 60 г; Dm = 60 – 50 = 10 г; w1 = 5% (или 0,05)
w2 = (0,0560) / (60 – 10) = 3 / 50 = 0,06 (или 6%-ный)
Концентрирование раствора
Какую массу вещества (X г) надо
дополнительно растворить в исходном растворе, чтобы приготовить раствор
с массовой долей растворенного вещества w2?
Решение
Исходя из определения массовой доли, составим выражение для w1 и w2:
w1 = m1 / m2, (где m1 – масса вещества в исходном растворе).
m1 = w1m
w2 = (m1+x) / (m + x) = (w1m + x) / (m+x)
Решая полученное уравнение относительно х получаем:
w2m + w2 x = w1 m + x
w2m – w1 m = x – w2 x
(w2 – w1)
m = (1 – w2) x
x = ((w2 – w1)m) / (1 – w2)
Пример
Сколько граммов хлористого калия надо растворить в 90 г 8%-ного раствора этой соли, чтобы полученный раствор стал 10%-ным?
m = 90 г
w1 = 8% (или 0,08), w2 = 10% (или 0,1)
x = ((0,1 – 0,08) 90) / (1 – 0,1) = (0,02 90) / 0,9 = 2 г
Смешивание растворов с разными концентрациями
Смешали m1 граммов раствора №1 c массовой долей вещества w1 и m2 граммов раствора №2 c массовой долей вещества w2. Образовался раствор (№3) с массовой долей растворенного вещества w3. Как относятся друг к другу массы исходных растворов?
Решение
Пусть w1 > w2, тогда w1 > w3 > w2. Масса растворенного вещества в растворе №1 составляет w1
m1, в растворе №2 – w2 m2. Масса образовавшегося раствора (№3) – (m1 – m2). Сумма масс растворенного вещества в растворах №1 и №2 равна массе этого вещества в образовавшемся растворе (№3):
w 1m1 + w 2 m2 = w3 (m1 + m2)
w1m1 + w 2 m2 = w3 m1 + w3 m2
w 1m1 – w 3 m1 = w3 m2 – w2 m2
(w1– w3)m1 = (w3– w2) m2
m1 / m2 = (w3– w2 ) / (w1– w3)
Таким образом, массы смешиваемых растворов m1 и m2 обратно пропорциональны разностям массовых долей w1 и w2 смешиваемых растворов и массовой доли смеси w3. (Правило смешивания).
Для облегчения использования правила смешивания применяют правило креста :
| w1 | (w3 – w2) / |
m1 | |
| w3 | |||
| / w2 |
(w1 – w3) | m2 |
m1 / m2 = (w3 – w2) / (w1 – w3)
Для этого по диагонали из большего значения концентрации вычитают меньшую, получают (w1 – w3), w1 > w3 и (w3 – w2), w3 > w2. Затем составляют отношение масс исходных растворов m1 / m2 и вычисляют.
Пример
Определите массы исходных растворов
с массовыми долями гидроксида натрия 5% и 40%, если при их смешивании
образовался раствор массой 210 г с массовой долей гидроксида натрия 10%.
| 40% | 5% / |
m1 | |
| 10% | |||
| / 5% |
30% | m2=210-m1 |
5 / 30 = m1 / (210 – m1)
1/6 = m1 / (210 – m1)
210 – m1 = 6m1
7m1 = 210
m1 =30 г; m2 = 210 – m1 = 210 – 30 = 180 г
Разбавление раствора
Исходя из определения массовой доли,
получим выражения для значений массовых долей растворенного вещества в
исходном растворе №1 (w1) и полученном растворе №2 (w2):
w1 = m1 / (r1V1) откуда V1= m1 /( w1 r1)
w2 = m2 / (r2V2)
m2 = w2r2 V2
Раствор №2 получают, разбавляя раствор №1, поэтому m1 = m2. В формулу для V1 следует подставить выражение для m2. Тогда
V1= (w2r2 V2) / (w1 r1)
m2 = w2 • r2 • V2
или
| w1 • r1 • V1 | = | w2 • r2 • V2 |
| m1(раствор) | m2(раствор) |
m1(раствор) / m2(раствор) = w2 / w1
При одном и том же количестве растворенного вещества массы растворов и их массовые доли обратно пропорциональны друг другу.
Пример
Определите массу 3%-ного раствора пероксида водорода, который можно получить разбавлением водой 50 г его 3%-ного раствора.
m1(раствор) / m2(раствор) = w2 / w1
50 / x = 3 / 30
3x = 50
30 = 1500
x = 500 г
Последнюю задачу можно также решить, используя “правило креста”:
| 30% | 3% / |
50 | |
| 3% | |||
| / 0% |
27% | X |
3 / 27 = 50 / x
x = 450 г воды
450 г + 50 г = 500 г
Загрузить PDF
Загрузить PDF
Нормальность отображает концентрацию кислоты или щелочи в растворе. Чтобы узнать нормальность раствора, в расчетах можно использовать как молярность, так и эквивалентную массу молекулы. Если вы решили использовать молярность, используйте формулу N = M(n), где M — это молярность, а n — количество молекул водорода или гидроксида. Если же вы решили использовать эквивалентную массу, используйте формулу N = eq ÷ V, где eq — это количество эквивалентов, а V — объем раствора.
-
1
Сложите молярную массу всех компонентов раствора. Найдите элементы химической формулы на периодической таблице, чтобы узнать их атомную массу, которая соответствует молярной. Запишите молярную массу каждого элемента и умножьте ее на количество этих элементов. Сложите молярную массу всех компонентов, чтобы узнать общую молярную массу.[1]
- Например, если необходимо узнать молярную массу серной кислоты (H2SO4), узнайте молярную массу водорода (1 г), серы (3 г) и кислорода (16 г).
- Умножьте массу на количество компонентов в составе. В нашем примере присутствует 2 атома водорода и 4 атома кислорода. Общая молярная масса водорода равна 2 x 1 г = 2 г. Молярная масса кислорода в этом растворе будет равна 4 x 16 г = 64 г.
- Сложите все молярные массы вместе. У вас получится 2 г + 32 г + 64 г = 98 г/моль.
- Если вы уже знаете молярность искомого раствора, перейдите сразу к Шагу 4.
-
2
Разделите фактическую массу раствора на молярную массу. Узнайте фактическую массу раствора. Она будет указана либо на емкости с раствором, либо в самой задаче. После этого разделите массу раствора на общую молярную массу, найденную ранее. Результатом станет количество молей в растворе, после которого должно быть написано «моль».[2]
- Например, если вы пытаетесь узнать нормальность 100 г H2SO4, которую растворили в 12 литрах жидкости, используйте фактическую массу и разделите ее на молярную. В результате у вас выйдет: 100 г ÷ 98 г/моль = 1,02 моль.
- 1 моль равен 6.02 x 1023 атомам или молекулам раствора.
-
3
Разделите результат на объем раствора в литрах, чтобы узнать молярность. Возьмите только что вычисленное количество молей в растворе и разделите его на общий объем измеряемого раствора. В результате вы узнаете молярность (M), с помощью которой можно узнать концентрацию раствора.[3]
- Исходя из нашего примера, получится такая формула: 1.02 моль ÷ 12 л = 0.085 M.
Совет: обязательно переведите объем раствора в литры, если еще этого не сделали. В противном случае вы получите неправильный ответ.
-
4
Умножьте молярность на количество молекул водорода или гидроксида. Взгляните на химическую формулу, чтобы узнать количество атомов водорода (H) в кислоте или молекул гидроксида в (ОН) в основании. Затем умножьте молярность раствора на количество молекул водорода или гидроксида в этом растворе, чтобы узнать нормальную концентрацию, или нормальность. В конце ответа напишите сокращение «N».[4]
- В нашем примере у серной кислоты (H2SO4) 2 атома водорода. Значит формула будет такой: 0,085 M x 2 = 0,17 N.
- В другом примере у гидроксида натрия (NaOH) с молярностью 2 M всего 1 молекула гидроксида. Следовательно, формула будет следующей: 2 M x 1 = 2 N.
Реклама
-
1
Узнайте общую молярную массу раствора. Взгляните на химическую формулу раствора и найдите каждый элемент в периодической таблице. Запишите молярную массу каждого элемента и умножьте ее на количество этих элементов в формуле. Сложите вместе все молярные массы, чтобы узнать общую молярную массу в граммах.[5]
- Например, если вы хотите узнать молярную массу Ca(OH)2,тогда узнайте молярную массу кальция (40 г), кислорода (16 г) и водорода (1 г).
- В формуле 2 атома кислорода и водорода. Общая масса кислорода будет следующей: 2 x 16 г = 32 г. Молярная масса водорода будет равна: 2 x 1 г = 2 г.
- Сложите вместе все молярные массы, чтобы получить 40 г + 32 г + 2 г = 74 г/моль.
-
2
Разделите молярную массу на количество молекул водорода или гидроксида. Узнайте количество атомов водорода (H) в кислоте или молекул гидроксида (ОН) в основании. Разделите только что полученную общую молярную массу на количество атомов или молекул, чтобы узнать вес 1 эквивалента, который будет равен массе 1 моли водорода или гидроксида. В конце ответа напишите сокращение «Г.-э.», означающее массу эквивалента.[6]
- В нашем примере у Ca(OH)2 2 две молекулы водорода, значит, масса эквивалента будет равна 74 г/моль ÷ 2 = 37 Г.-э.
-
3
Разделите фактическую массу раствора на массу эквивалента. После того, как вы узнаете массу эквивалента, разделите ее на массу раствора, которая указана на емкости с раствором или в решаемой задаче. Ответом станет количество эквивалентов в растворе, чтобы вы потом смогли рассчитать нормальность. В конце ответа поставьте сокращение «э.»[7]
- Если в нашем примере 75 г Ca(OH)2, то формула будет такой: 75 г ÷ 37 Г.-э = 2,027 э.
-
4
Разделите число эквивалентов на объем раствора в литрах. Узнайте общий объем раствора и запишите ответ в литрах. Возьмите только что полученное количество эквивалентов и разделите его на объем раствора, чтобы узнать нормальность. В конце ответа поставьте сокращение «N».[8]
- Если в растворе объемом 8 л находится 75 г Ca(OH)2, тогда разделите количество эквивалентов на объем следующим способом: 2,027 э. ÷ 8 л = 0,253 N.
Реклама
Советы
- Нормальная концентрация, или нормальность, обычно используется для измерения кислот и оснований. Если вам нужно определить концентрацию другого раствора, для этого, как правило, измеряют молярность.
Реклама
Что вам понадобится
- Периодическая таблица
- Калькулятор
Об этой статье
Эту страницу просматривали 91 777 раз.
Была ли эта статья полезной?
Содержание
Массовая доля растворённого вещества (ω)
Молярная концентрация (c)
Нормальность раствора
Существуют различные способы выражения состава раствора. Наиболее часто используют массовую долю растворённого вещества, молярную и нормальную концентрацию.
Массовая доля растворённого вещества (ω)
Массовая доля растворённого вещества ωB – это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m:
ωB = mB / m
Массовую долю растворённого вещества ωB обычно выражают в долях единицы или в процентах.
Например, массовая доля растворённого вещества – CaCl2 в воде равна 0,06 или 6%. Это означает, что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
Пример:
Сколько грамм сульфата натрия и воды нужно для приготовления 300 г 5% раствора?
Решение:
m (Na2SO4) = ω (Na2SO4) / 100 = (5 × 300) / 100 = 15 г
где ω (Na2SO4) – массовая доля в %,
m – масса раствора в г
m (H2O) = 300 г – 15 г = 285 г.
Таким образом, для приготовления 300 г 5% раствора сульфата натрия надо взять 15 г Na2SO4 и 285 г воды.
Вернуться к содержанию
Молярная концентрация (c)
Молярная концентрация cB показывает, сколько моль растворённого вещества содержится в 1 литре раствора:
cB = nB / V = mB / (MB × V)
где МB – молярная масса растворенного вещества, г/моль.
Молярная концентрация измеряется в моль/л и обозначается «M». Например, 2 M NaOH – двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г (M (NaOH) = 40 г/моль).
Пример:
Какую массу хромата калия K2CrO4 нужно взять для приготовления 1,2 л 0,1 М раствора?
Решение:
M (K2CrO4) = c (K2CrO4) × V × M (K2CrO4) = 0,1 моль/л × 1,2 л × 194 г/моль = 23,3 г.
Таким образом, для приготовления 1,2 л 0,1 М раствора нужно взять 23,3 г K2CrO4 и растворить в воде, а объём довести до 1,2 литра.
Концентрацию раствора можно выразить количеством молей растворённого вещества в 1000 г растворителя. Такое выражение концентрации называют моляльностью раствора.
Вернуться к содержанию
Нормальность раствора (нормальная концентрация, молярная концентрация эквивалента)
Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора. Грамм-эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ – это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода.
Эоснования = Моснования / число замещаемых в реакции гидроксильных групп;
Экислоты = Мкислоты / число замещаемых в реакции атомов водорода;
Эсоли = Мсоли / произведение числа катионов на его заряд.
Пример:
Вычислите значение грамм-эквивалента (г-экв) серной кислоты, гидроксида кальция и сульфата алюминия.
Решение:
Э (H2SO4) = М (H2SO4) / 2 = 98 / 2 = 49 г
Э (Ca(OH)2) = М (Ca(OH)2) / 2 = 74 / 2 = 37 г
Э (Al2(SO4)3) = М (Al2(SO4)3) / (2 × 3) = 342 / 2= 57 г
Величины нормальности обозначают буквой «Н». Например, децинормальный раствор серной кислоты обозначают «0,1 Н раствор H2SO4». Так как нормальность может быть определена только для данной реакции, то в разных реакциях величина нормальности одного и того же раствора может оказаться неодинаковой. Так, одномолярный раствор H2SO4 будет однонормальным, когда он предназначается для реакции со щёлочью с образованием гидросульфата NaHSO4, и двухнормальным в реакции с образованием Na2SO4.
Пример:
Рассчитайте молярность и нормальность 70%-ного раствора H2SO4 (ρ = 1,615 г/мл).
Решение:
Для вычисления молярности и нормальности надо знать число граммов H2SO4 в 1 л раствора. 70% -ный раствор H2SO4 содержит 70 г H2SO4 в 100 г раствора. Это весовое количество раствора занимает объём:
V = 100 / 1,615 = 61,92 мл
Следовательно, в 1 л раствора содержится 70 × 1000 / 61,92 = 1130,49 г H2SO4. Отсюда, молярность данного раствора равна:
1130,49 / М (H2SO4) =1130,49 / 98 = 11,53 M
Нормальность этого раствора (считая, что кислота используется в реакции в качестве двухосновной) равна 1130,49 / 49 = 23,06 H.
Вернуться к содержанию
14.12.2021 0:37:23 | Автор статьи: Усачёва Вера
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Растворы. Способы выражения концентрации растворов
Способы выражения концентрации растворов
Существуют различные способы выражения концентрации растворов.
Массовая доля ω компонента раствора определяется как отношение массы данного компонента Х, содержащегося в данной массе раствора к массе всего раствора m. Массовая доля – безразмерная величина, её выражают в долях от единицы:
ωр.в. = mр.в./mр-ра (0 < ωр.в. < 1) (1)
Массовый процент представляет собой массовую долю, умноженную на 100:
ω(Х) = m(Х)/m · 100% (0% < ω(Х) < 100%) (2)
где ω(X) – массовая доля компонента раствора X; m(X) – масса компонента раствора X; m – общая масса раствора.
Мольная доля χ компонента раствора равна отношению количества вещества данного компонента X к суммарному количеству вещества всех компонентов в растворе.
Для бинарного раствора, состоящего из растворённого вещества Х и растворителя (например, Н2О), мольная доля растворённого вещества равна:
χ(X) = n(X)/(n(X) + n(H2O)) (3)
Мольный процент представляет мольную долю, умноженную на 100:
χ(X), % = (χ(X)·100)% (4)
Объёмная доля φ компонента раствора определяется как отношение объёма данного компонента Х к общему объёму раствора V. Объёмная доля – безразмерная величина, её выражают в долях от единицы:
φ(Х) = V(Х)/V (0 < φ(Х) < 1) (5)
Объёмный процент представляет собой объёмную долю, умноженную на 100.
φ(X), % = (φ(X)·100)%
Молярность (молярная концентрация) C или Cм определяется как отношение количества растворённого вещества X, моль к объёму раствора V, л:
Cм(Х) = n(Х)/V (6)
Основной единицей молярности является моль/л или М. Пример записи молярной концентрации: Cм(H2SO4) = 0,8 моль/л или 0,8М.
Нормальность Сн определяется как отношение количества эквивалентов растворённого вещества X к объёму раствора V:
Cн(Х) = nэкв.(Х)/V (7)
Основной единицей нормальности является моль-экв/л. Пример записи нормальной концентрации: Сн(H2SO4) = 0,8 моль-экв/л или 0,8н.
Титр Т показывает, сколько граммов растворённого вещества X содержится в 1 мл или в 1 см3 раствора:
T(Х) = m(Х)/V (8)
где m(X) – масса растворённого вещества X, V – объём раствора в мл.
Моляльность раствора μ показывает количество растворённого вещества X в 1 кг растворителя:
μ(Х) = n(Х)/mр-ля (9)
где n(X) – число моль растворённого вещества X, mр-ля – масса растворителя в кг.
Мольное (массовое и объёмное) отношение – это отношение количеств (масс и объёмов соответственно) компонентов в растворе.
Необходимо иметь ввиду, что нормальность Сн всегда больше или равна молярности См. Связь между ними описывается выражением:
См = Сн · f(Х) (10)
Для получения навыков пересчёта молярности в нормальность и наоборот рассмотрим табл. 1. В этой таблице приведены значения молярности См, которые необходимо пересчитать в нормальность Сн и величины нормальности Сн, которые следует пересчитать в молярность См.
Пересчёт осуществляем по уравнению (10). При этом нормальность раствора находим по уравнению:
Сн = См/f(Х) (11)
Результаты расчётов приведены в табл. 2.
Таблица 1. К определению молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2 M Na2SO4 | ? | 6 н FeCl3 | ? |
| 1,5 M Fe2(SO4)3 | ? | 0,1 н Ва(ОН)2 | ? | |
| Реакции окисления-восстановления | 0,05 М KMnO4
в кислой среде |
? | 0,03 М KMnO4
в нейтральной среде |
? |
Таблица 2
Значения молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2M Ma2SO4 | 0,4н | 6н FeCl3 | 2М |
| 1,5M Fe2(SO4)3 | 9н | 0,1н Ва(ОН)2 | 0,05М | |
| Реакции окисления-восстановления | 0,05М KMnO4 в кислой среде | 0,25н | 0,03М KMnO4
в нейтральной среде |
0,01М |
Между объёмами V и нормальностями Сн реагирующих веществ существует соотношение:
V1 Сн,1 =V2 Сн,2 (12)
Примеры решения задач
Задача 1. Рассчитайте молярность, нормальность, моляльность, титр, мольную долю и мольное отношение для 40 мас.% раствора серной кислоты, если плотность этого раствора равна 1,303 г/см3.
Решение.
Масса 1 литра раствора равна М = 1000·1,303 = 1303,0 г.
Масса серной кислоты в этом растворе: m = 1303·0,4 = 521,2 г.
Молярность раствора См = 521,2/98 = 5,32 М.
Нормальность раствора Сн = 5,32/(1/2) = 10,64 н.
Титр раствора Т = 521,2/1000 = 0,5212 г/см3.
Моляльность μ = 5,32/(1,303 – 0,5212) = 6,8 моль/кг воды.
Обратите внимание на то, что в концентрированных растворах моляльность (μ) всегда больше молярности (См). В разбавленных растворах наоборот.
Масса воды в растворе: m = 1303,0 – 521,2 = 781,8 г.
Количество вещества воды: n = 781,8/18 = 43,43 моль.
Мольная доля серной кислоты: χ = 5,32/(5,32+43,43) = 0,109. Мольная доля воды равна 1– 0,109 = 0,891.
Мольное отношение равно 5,32/43,43 = 0,1225.
Задача 2. Определите объём 70 мас.% раствора серной кислоты (r = 1,611 г/см3), который потребуется для приготовления 2 л 0,1 н раствора этой кислоты.
Решение.
2 л 0,1н раствора серной кислоты содержат 0,2 моль-экв, т.е. 0,1 моль или 9,8 г.
Масса 70%-го раствора кислоты m = 9,8/0,7 = 14 г.
Объём раствора кислоты V = 14/1,611 = 8,69 мл.
Задача 3. В 5 л воды растворили 100 л аммиака (н.у.). Рассчитать массовую долю и молярную концентрацию NH3 в полученном растворе, если его плотность равна 0,992 г/см3.
Решение.
Масса 100 л аммиака (н.у.) m = 17·100/22,4 = 75,9 г.
Масса раствора m = 5000 + 75,9 = 5075,9 г.
Массовая доля NH3 равна 75,9/5075,9 = 0,0149 или 1,49 %.
Количество вещества NH3 равно 100/22,4 = 4,46 моль.
Объём раствора V = 5,0759/0,992 = 5,12 л.
Молярность раствора См = 4,46/5,1168 = 0,872 моль/л.
Задача 4. Сколько мл 0,1М раствора ортофосфорной кислоты потребуется для нейтрализации 10 мл 0,3М раствора гидроксида бария?
Решение.
Переводим молярность в нормальность:
0,1 М Н3РО4 0,3 н; 0,3 М Ва(ОН)2 0,6 н.
Используя выражение (12), получаем: V(H3P04)=10·0,6/0,3 = 20 мл.
Задача 5. Какой объем, мл 2 и 14 мас.% растворов NaCl потребуется для приготовления 150 мл 6,2 мас.% раствора хлорида натрия?
Плотности растворов NaCl:
| С, мас.% | 2 | 6 | 7 | 14 |
| ρ, г/см3 | 2,012 | 1,041 | 1,049 | 1,101 |
Решение.
Методом интерполяции рассчитываем плотность 6,2 мас.% раствора NaCl:
6,2% =6% + 0,2(7% —6% )/(7 – 6) = 1,0410 + 0,0016 = 1,0426 г/см3.
Определяем массу раствора: m = 150·1,0426 = 156,39 г.
Находим массу NaCl в этом растворе: m = 156,39·0,062 = 9,70 г.
Для расчёта объёмов 2 мас.% раствора (V1) и 14 мас.% раствора (V2) составляем два уравнения с двумя неизвестными (баланс по массе раствора и по массе хлорида натрия):
156,39 = V1 1,012 + V2 1,101 ,
9,70 = V1·1,012·0,02 + V2·1,101·0,14 .
Решение системы этих двух уравнений дает V1 =100,45 мл и V2 = 49,71 мл.
Задачи для самостоятельного решения
3.1. Рассчитайте нормальность 2 М раствора сульфата железа (III), взаимодействующего со щёлочью в водном растворе.
12 н.
3.2. Определите молярность 0,2 н раствора сульфата магния, взаимодействующего с ортофосфатом натрия в водном растворе.
0,1 M.
3.3. Рассчитайте нормальность 0,02 М раствора KMnO4, взаимодействующего с восстановителем в нейтральной среде.
0,06 н.
3.4. Определите молярность 0,1 н раствора KMnO4, взаимодействующего с восстановителем в кислой среде.
0,02 M.
3.5. Рассчитать нормальность 0,2 М раствора K2Cr2O7, взаимодействующего с восстановителем в кислой среде.
1,2 M.
3.6. 15 г CuSO4·5H2O растворили в 200 г 6 мас.% раствора CuSO4. Чему равна массовая доля сульфата меди, а также молярность, моляльность и титр полученного раствора, если его плотность составляет 1,107 г/мл?
0,1; 0,695М; 0,698 моль/кг; 0,111 г/мл.
3.7. При выпаривании 400 мл 12 мас.% раствора KNO3 (плотность раствора 1,076 г/мл) получили 2М раствор нитрата калия. Определить объём полученного раствора, его нормальную концентрацию и титр.
255 мл; 2 н; 0,203 г/мл.
3.8. В 3 л воды растворили 67,2 л хлороводорода, измеренного при нормальных условиях. Плотность полученного раствора равна 1,016 г/мл. Вычислить массовую, мольную долю растворённого вещества и мольное отношение растворённого вещества и воды в приготовленном растворе.
0,035; 0,0177; 1:55,6.
3.9. Сколько граммов NaCl надо добавить к 250 г 6 мас.% раствору NaCl, чтобы приготовить 500 мл раствора хлорида натрия, содержащего 16 мас.% NaCl? Плотность полученного раствора составляет 1,116 г/мл. Определить молярную концентрацию и титр полученного раствора.
74,28 г; 3,05 М; 0,179 г/мл.
3.10. Определить массу воды, в которой следует растворить 26 г ВaCl2·2H2O для получения 0,55М раствора ВaCl2 (плотность раствора 1,092 г/мл). Вычислить титр и моляльность полученного раствора.
192,4 г; 0,111 г/мл; 0,56 моль/кг.
4.1. Концентрации растворов
Раствор– гомогенная (однородная) система,
состоящая из двух или более компонентов,
состав которой может непрерывно
изменяться в определенных пределах. По
агрегатному состоянию растворы могут
быть газообразными, жидкими и твердыми.
В
растворах выделяют растворитель и
растворенное вещество. Растворителем
называют компонент, который образует
непрерывную среду. остальные
компоненты, которые распределены в
среде растворителя в виде дискретных
частиц, называются растворенными
веществами. Состав раствора (концентрация)
чаще всего выражается следующими
способами.
Массовая
доля или процентное содержание–
соотношение масс растворенного веществаmви раствораmр-р,
выраженное в долях или процентах:
.
(4.1)
Концентрация,
выраженная в граммах на литр, показывает,
какая масса растворенного веществаmв,
выраженная в граммах, содержится в
единице объема раствораVр-р:
(4.2)
Молярная
концентрация, илимолярность, –
число молей растворенного веществаnвв 1 дм3 (1 л) раствора:
.
(4.3)
Моляльная
концентрация, илимоляльность, –
число молей растворенного вещества,
приходящееся на 1 кг растворителя:
.
(4.4)
Мольнаядоляили мольные проценты–
число молей компонента (растворителя
или растворенного вещества), содержащееся
в одном моле раствора:
.
(4.5)
Нормальная
концентрация, илинормальность,
– количество эквивалентовnэврастворенного вещества, содержащееся
в 1 л раствора:
,
(4.6)
где
z– количество обменных
эквивалентов растворенного вещества,
содержащееся в 1 моль вещества.
Для
кислот zсоответствует
основности кислоты, т.е. числу атомов
водорода в составе кислоты, обмениваемых
в данной реакции на металл или
нейтрализуемых основанием.
Для
оснований zсоответствует
кислотности основания, т.е. числу
гидроксильных групп в составе основания,
обмениваемых на кислотный остаток или
нейтрализуемых кислотой.
Для
солей zрассчитывают
как произведение числа атомов и степени
окисления металла в составе соли.
Для
окислителей и восстановителей в
окислительно-восстановительных реакциях
z– изменение их степени
окисления в ходе реакции.
Пример
1. Раствор серной кислоты
в воде с концентрацией 16 % (по массе)
имеет плотностьd= 1,109 г/см3.
Выразить концентрацию этого раствора
всеми возможными способами.
Решение.1.
Выделим мысленно 1 кг раствора и
установим его объем:
.
2. Определим
массу растворенного вещества (H2SO4)
по формуле (4.1):
3. По
формуле (4.2) рассчитаем концентрацию
раствора серной кислоты
4. Найдем
число молей серной кислоты:
5. По
формуле (4.3) вычислим молярную концентрацию
раствора серной кислоты:
6. Найдем
массу растворителя (Н2О):
7. По
формуле (4.4) вычислим моляльную концентрацию
раствора серной кислоты:
8. Найдем
число молей воды:
9. По
формуле (4.5) вычислим мольную долю серной
кислоты:
10. По
формуле (4.6) определим нормальную
концентрацию раствора серной кислоты
(для серной кислоты количество обменных
эквивалентов в 1 моль вещества z= 2):
Пример
2.Какой объем раствора серной
кислоты концентрацией 10 % (d= 1,066 г/см3)
требуется для приготовления 200 мл
1 н. раствора?
Решение.
1. найдем
массу серной кислоты, содержащейся в
200 мл 1 н. раствора. Для этого вычислим
молярную концентрацию раствора по
формуле (4.3):
а также количество вещества серной
кислотыи ее массу
.
2. Подставим
найденную массу серной кислоты в
уравнение (4.1) и вычислим объем
10-процентного раствора:
Пример
3. Какой объем воды следует добавить
к 500 мл раствора, содержащего 40 г
сульфата никеля, чтобы понизить его
концентрацию до 0,05 моль/л?
Решение.
По уравнению (4.3) вычислим объем 0,05 М
раствора:
и
объем воды:
.
Пример
4. Найти молярную концентрацию раствора
карбоната натрия, полученную при
смешивании 600 мл 2,15-процентного
раствора (d = 1,02 /см3)
и 200 мл 8,82-процентного раствора
(d= 1,09 г/см3).
Решение.
Количество вещества карбоната натрия
в каждом из смешиваемых растворов
соответственно
Молярная
концентрация полученного раствора
Пример
5.Какой объем раствора серной кислоты
концентрацией 0,42 моль/л потребуется
для нейтрализации 20 мл раствора
гидроксида калия концентрацией 6 %
(d= 1,053 г/см3)?
Решение1. Составим
уравнение реакции:
2KOH + H2SO4 K2SO4 + 2H2O.
2. С
учетом уравнения (4.1) найдем количество
вещества KOH
3. По
уравнению реакции на 2 моль KOHприходится 1 моль Н2SO4,
следовательно, для реакции с 0,02 моль
гидроксида калия требуется 0,01 моль
серной кислоты.
4. По
уравнению (4.3) найдем объем раствора
серной кислоты:
Задание I. Выразить
концентрацию заданного в табл.4.1 раствора
всеми возможными способами.
Таблица
4.1
|
Задача |
Вещество |
Концентрация |
Плотность раствора, |
|
1 |
H2SO4 |
15 % |
1,1 |
|
2 |
H3PO4 |
2,79 моль/л |
1,115 |
|
3 |
BaCl2 |
1,69 моль/л |
1,28 |
|
4 |
FeSO4 |
0,3 экв/л |
1,02 |
|
5 |
AlCl3 |
0,55 % |
1,007 |
|
6 |
CaCl2 |
22 % |
1,203 |
|
7 |
Na2CO3 |
0,39 моль/л |
1,019 |
|
8 |
HCl |
0,4 мол. % |
1,002 |
|
9 |
KOH |
3 мол. % |
1,073 |
|
10 |
NaOH |
13 % |
1,142 |
|
11 |
Al2(SO4)3 |
0,15 экв/л |
1,009 |
|
12 |
KMnO4 |
0,25 экв/л |
1,027 |
|
13 |
K2Cr2O7 |
0,18 |
1,033 |
|
14 |
CrCl3 |
0,6 |
1,022 |
|
15 |
CdCl2 |
0,5 |
1,08 |
|
16 |
MnCl2 |
10 |
1,086 |
|
17 |
Hg(NO3)2 |
0,25 |
1,174 |
|
18 |
ZnSO4 |
1,374 |
1,107 |
|
19 |
KOH |
34 |
1,336 |
|
20 |
MgSO4 |
20 |
1,219 |
|
21 |
H2SO4 |
1,56 |
1,095 |
|
22 |
H3PO4 |
7,3 |
1,181 |
|
23 |
NaBr |
5,8 |
1,21 |
|
24 |
NaCl |
7,1 |
1,147 |
|
25 |
HCl |
17,4 |
1,149 |
|
26 |
H2SO4 |
3,4 |
1,109 |
|
27 |
KOH |
6,3 |
1,147 |
|
28 |
H2SO4 |
5,9 |
1,18 |
|
29 |
KOH |
8,107 |
1,336 |
|
30 |
Pb(NO3)2 |
30 |
1,328 |
|
31 |
H3PO4 |
30 % |
1,181 |
|
32 |
NaBr |
26 % |
1,21 |
|
33 |
NaCl |
15 % |
1,109 |
|
34 |
КОН |
560 г/л |
1,411 |
|
35 |
H3PO4 |
855 г/л |
1,426 |
Окончание табл.4.1
|
Задача |
Вещество |
Концентрация |
Плотность раствора, |
|
36 |
H3PO4 |
3 мол. |
1,08 |
|
37 |
HNO3 |
10,4 |
1,31 |
|
38 |
H2SO4 |
40 |
1,303 |
|
39 |
ZnSO4 |
87 г/л |
1,084 |
|
40 |
H2SO4 |
30 |
1,218 |
|
41 |
КОН |
0,12 моль/кг |
1,0 |
|
42 |
HNO3 |
10,4 н. |
1,31 |
|
43 |
NH4OH |
9 % |
0,961 |
|
44 |
NaCl |
4,5% |
1,03 |
|
45 |
CuSO4 |
1,037 |
1,206 |
|
46 |
FeCl3 |
1,9 моль/л |
1,234 |
|
47 |
NH4OH |
10 % |
0,957 |
|
48 |
H2SO4 |
20 % |
1,139 |
|
49 |
H3PO4 |
24 % |
1,14 |
|
50 |
BaCl2 |
10 % |
1,092 |
Задание
II. Решить задачи.
51. Какой
объем 88-процентного раствора серной
кислоты плотностью 1,8 г/см3надо
взять, чтобы приготовить 2 л этой же
кислоты концентрацией 2,36 моль/л?
52.
Какое количество миллилитров 12 н.
раствора едкого кали (КОН) надо взять,
чтобы приготовить 500 мл 15-процентного
раствора едкого кали плотностью
1,14 г/см3?
53. Какое
количество воды надо добавить к 200 мл
52-процентного раствора едкого натра
плотностью 1,35 г/см3, чтобы
получить раствор с концентрацией
2,78 моль/л?
54. Раствор
серной кислоты концентрацией 3 моль/л
имеет плотность 1,18 г/см3. Какое
количество воды надо добавить к 118 г
этого раствора, чтобы получить раствор
с концентрацией 12 %?
55. Сколько
воды надо добавить к 125 мл 26-процентного
раствора соляной кислоты плотностью
1,13 г/см3, чтобы получить раствор
с концентрацией 14,5 %?
56. Какое
количество воды надо добавить к 150 г
раствора хлорида бария в воде (концентрация
2 экв/л, плотность 1,2 г/см3),
чтобы получить раствор с концентрацией
8 %?
57. Какое
количество миллилитров раствора
фосфорной кислоты, мольная доля которого
0,01 (плотность раствора 1,025 г/см3),
надо взять, чтобы получить 200 г раствора
с концентрацией 2,6 %?
58. Сколько
миллилитров 2,25 М раствора хлорида
калия надо взять, чтобы приготовить
1,5 л 6-процентного раствора плотностью
1,04 г/см3?
59. Какой
объем раствора соляной кислоты
(концентрация 38 %, плотность 1,189 г/см3)
потребуется для приготовления 250 мл
0,08 н. раствора?
60. Сколько
миллилитров раствора серной кислоты
(концентрация 96 %, плотность 1,84 г/см3)
потребуется для приготовления 2 л
0,25 н. раствора?
61. Сколько
граммов едкого кали надо взять для
приготовления 2 л раствора концентрацией
10 % и плотностью 1,09 г/см3?
62. Какой
объем раствора серной кислоты (концентрация
98 %, плотность 1,837 г/см3) надо
взять для приготовления 500 мл 0,1 н.
раствора?
63. Какой
объем 3 н. раствора фосфорной кислоты
надо взять для приготовления 1 л 0,5 М
раствора?
64. Как
приготовить 500 мл 0,5 н. раствора
соды из 2 н. ее раствора?
65. Сколько
миллилитров воды надо прибавить к 300 мл
раствора едкого кали, (концентрация
25 %, плотность 1,236 г/см3), чтобы
получить 8-процентный раствор?
66. Какой
объем азотной кислоты (концентрация
56 %, плотность 1,345 г/см3)
потребуется для приготовления 1 л
0,1 М раствора?
67. Сколько
миллилитров воды надо прибавить к 100 мл
раствора серной кислоты (концентрация
48 %, плотность 1,376 г/см3), чтобы
получить 0,5 н. раствор?
68. До
какого объема надо разбавить 200 мл
1 н. раствора хлорида натрия, чтобы
получить раствор концентрацией 4,5 %
и плотностью 1,029 г/см3?
69. Сколько
граммов сульфата натрия надо прибавить
к 1 л раствора (концентрация 10 %,
плотность 1,09 г/см3), чтобы
получить 15-процентный раствор?
70. Сколько
воды надо прибавить к 200 мл раствора
азотной кислоты (концентрация 32 %,
плотность 1,193 г/см3), чтобы
получить 10-процентный раствор?
71. Сколько
раствора соляной кислоты (концентрация
36 %, плотность 1,179 г/см3)
потребуется для приготовления 1 л
0,5 н. раствора?
72. Сколько
воды надо добавить к 50 мл 2 н.
раствора, чтобы получить 0,25 н. раствор?
73. Сколько
граммов хлорида аммония надо добавить
к 5 л 2,1 М раствора плотностью
1,054 г/см3, чтобы получить
20-процентный раствор?
74. Сколько
граммов едкого натра надо взять для
приготовления 2 л раствора концентрацией
10 % и плотностью 1,080 г/см3?
75. Как
приготовить 1 л 1 н. раствора KOH из
49-процентного раствора той же щелочи
плотностью 1,5 г/см3?
76. Имеется
раствор серной кислоты (концентрация
80 %, плотность 1,732 г/см3). Как
из него приготовить 2 л 6 М раствора
H2SO4?
77. Сколько
серной кислоты (концентрация 60 %,
плотность 1,503 г/см3)
надо взять для приготовления 10 л
0,1 н. ее раствора?
78. Сколько
воды надо испарить, чтобы из 10 л 0,25 М
раствора ортофосфорной кислоты получить
6 М раствор?
79. В
лаборатории имеется 20 кг 12-процентного
раствора поташа K2CO3. Сколько
килограммов технического поташа,
содержащего 8 % посторонних примесей,
надо взять для повышения концентрации
имеющегося раствора до 20 %?
80. Какой
объем раствора карбоната натрия
(концентрация 10 %, плотность 1,105 г/см3)
требуется для приготовления 5 л
2-процентного раствора плотностью
1,02 г/см3?
81. Сколько
граммов хлористого аммония потребуется
для приготовления 600 мл
0,5 М раствора?
82. Какую
массу нитрата свинца (II)
надо взять для приготовления 300 мл
0,2 н. раствора?
83. Сколько
граммов медного купороса (пентагидрата
сульфата меди (II)) надо взять для
приготовления 1 л 2 н. раствора?
84. Какой
процентной концентрации получится
соляная кислота, если к 100 мл раствора
HCl (концентрация 36 %, плотность
1,179 г/см3) прибавить 200 мл
воды?
85. Сколько
граммов азотной кислоты содержится в
1 л 36-процентного раствора плотностью
1,221 г/см3?
86. Какой
процентной концентрации получится
раствор, если к 500 мл 30-процентного
раствора КОН плотностью 1,288 г/см3прибавить 500 мл воды?
87. Какой
объем аммиака следует растворить в воде
при 25 °С и 120 кПа для получения 2 л
10-процентного раствора гидроксида
аммония, плотностью 0,96 г/см3?
88. Какая
масса сульфита натрия потребуется для
приготовления 5 л 8-процентного
раствора плотностью 1,075 г/см3?
89. Сколько
воды надо прибавить к 50 мл 2 М
раствора ортофосфорной кислоты, чтобы
получить 0,25 н. раствор?
90. Какой
объем воды потребуется для растворения
67,2 л хлороводорода, приведенного к
нормальным условиям, для получения
9-процентного раствора плотностью
1,04 г/мл?
91. Сколько
граммов десятиводного сульфата натрия
нужно растворить в 800 мл воды для
получения раствора с концентрацией по
безводному сульфату натрия 10 %?
92. Какая
масса хлорида калия потребуется для
приготовления 200 мл раствора с
концентрацией 1,455 моль/л?
93. Необходимо
приготовить 100 г раствора хлорида
бария с концентрацией 5 %. Какая масса
дигидрата хлорида бария потребуется
для этого?
94. Какой
объем раствора серной кислоты (концентрация
30 %, плотность 1,12 г/см3)
потребуется для приготовления 2 л
раствора концентрацией 0,4 н.?
95. Какой
объем аммиака при температуре 25 °С
и давлении 1 атм следует растворить
в 1 л воды для получения раствора
гидроксида аммония концентрацией 20 %?
96. Рассчитать,
какой объем воды следует взять для
растворения 16 г СН3ОН
для получения раствора метанола с
мольной долей 0,02.
97. Раствор
хлорида алюминия в воде имеет концентрацию
2 экв/л и плотность 1,08 г/см3.
К 50 г этого раствора добавили 35 мл
воды, и его плотность стала 1,035 г/см3.
Найти массовую долю хлорида алюминия
в новом растворе.
98. Сколько
5-процентного раствора можно приготовить
из 1 т плавленого сульфида натрия,
содержащего 30 % примесей?
99. Раствор
хлорида алюминия в воде имеет концентрацию
2,18 экв/л и плотность 1,08 г/см3.
К 50 г этого раствора добавили 35 мл
воды и его плотность стала 1,044 г/см3.
Найти концентрацию нового раствора в
процентах.
100. К
200 мл 0,7 н. раствора серной кислоты
прибавили 300 г воды. Рассчитать
конечную концентрацию серной кислоты
в граммах на литр.
101. Смешали
20 мл 0,5 н. раствора соляной кислоты
и 10 мл 0,2 н. раствора гидроксида
бария. Какое вещество и в каком количестве
будет находиться в растворе в избытке?
102.
Раствор хлорида бария содержит 2,3 г
бария. Сколько миллилитров 0,5 н.
раствора серной кислоты потребуется
для осаждения всего бария в виде сульфата?
103. Сколько
и какого вещества останется в избытке,
если к 75 мл 0,3 н. раствора серной
кислоты прибавить 125 мл 0,2 н. раствора
калиевой щелочи?
104. Для
осаждения в виде хлорида всего серебра,
содержащегося в 100 мл раствора нитрата
серебра, потребовалось 50 мл 0,2 н.
раствора соляной кислоты. Какова
нормальность раствора нитрата серебра,
и какая масса хлорида серебра выпала в
осадок?
105. На
нейтрализацию 31 мл 0,16 н. раствора
щелочи требуется 217 мл раствора серной
кислоты. Чему равна нормальность раствора
серной кислоты?
106. Какой
объем 0,3 н. раствора кислоты требуется
для нейтрализации раствора, содержащего
0,32 г гидроксида натрия в 40 мл?
107. На
нейтрализацию 1 л раствора, содержащего
1,4 г гидроксида калия, требуется 50 мл
раствора кислоты. Вычислить нормальность
раствора кислоты.
108. Какая
масса азотной кислоты содержалась в
растворе, если на нейтрализацию его
потребовалось 35 мл 0,4 н. раствора
гидроксида натрия?
109. Сколько
миллилитров 1 н. раствора едкого натра
потребуется для полной нейтрализации
300 мл 0,1 М раствора серной кислоты?
110. Смешали
1 л раствора соляной кислоты
(концентрация 20 %, плотность 1,098 г/см3)
и 1 л раствора соляной кислоты
(концентрация 12,5 %, плотность
1,06 г/см3). Какой молярной
концентрации раствор получится после
смешивания?
111. Сколько
миллилитров 0,1 н. едкого натра (NaOH)
потребуется для осаждения меди в виде
гидроксида из 20 мл раствора сульфата
меди, в 1 л которого содержится 10 г
меди?
112. Сколько
миллилитров соляной кислоты (концентрация
10 %, плотность 1,047 г/ см3)
потребуется для нейтрализации раствора,
содержащего 8,5 г гидроксида бария?
113. Сколько
миллилитров раствора соды, содержащего
в 1 л 21,2 г соли, надо добавить к
30 мл 0,2 н. раствора хлорида кальция
для полного осаждения кальция в виде
карбоната?
114. Сколько
граммов гидроксида железа выпадет в
осадок, если к 500 мл 0,2 н. раствора
хлорида железа (III) добавить избыток
щелочи?
115. В
каком объемном отношении надо смешать
растворы гидроксида бария с концентрацией
95,5 г/л и 0,5 н. соляной кислоты для
получения раствора с нейтральной средой?
116. На
нейтрализацию 20 мл раствора едкого
кали потребовалось 13 мл 0,2 н.
раствора кислоты. Сколько граммов едкого
кали содержится в 1 л раствора?
117. Сколько
миллилитров раствора нитрата серебра,
содержащего 5 г/л серебра, надо добавить
к 10 мл 0,2 н. раствора хлорида натрия,
чтобы полностью удалить из раствора
ионы хлора?
118. Сколько
миллилитров 2 н. серной кислоты
потребуется для превращения 1,56 г
гидроксида алюминия в сульфат алюминия?
119. Сколько
граммов карбоната кальция можно
растворить в 100 мл соляной кислоты
(концентрация 20 %, плотность 1,1 г/см3)?
Вычислить объем, который займет
выделившийся газ при нормальных условиях.
120. К
5 г цинка прибавили 100 мл 10,2-процентной
соляной кислоты (плотность раствора
1,05 г/см3). Какое вещество и в
каком количестве осталось в избытке?
Вычислить объем водорода, выделившегося
при 20 ºС и 750 мм рт. ст.
121. На
нейтрализацию 20 мл раствора гидроксида
калия (концентрация 5,66 %, плотность
1,053 г/см3) пошло 12,1 мл раствора
серной кислоты плотностью 1,052 г/см3.
Определить процентную концентрацию
раствора серной кислоты.
122. Какое
количество миллилитров 0,5 н. раствора
сульфата натрия надо долить к 100 мл
раствора хлорида бария (концентрация
16 %, плотность 1,156 г/см3),
чтобы полностью осадить сульфат-ион?
123. На
нейтрализацию 50 мл раствора фосфорной
кислоты плотностью 1,01 г/см3израсходовано 31,2 г 1 н. раствора
гидроксида натрия плотностью 1,04 г/см3.
Определить процентную концентрацию
фосфорной кислоты.
124. 10 г
сплава меди с цинком обработали соляной
кислотой. При этом выделилось 570 мл
водорода, измеренных при температуре
27 ºС и давлении 105Па. Определить
состав сплава и выразить его в массовых
и мольных долях.
125. При
растворении 15 г сплава серебра с
алюминием раствором едкого натра
выделилось 13 мл водорода, измеренного
при температуре 57 ºС и давлении
15105Па.
Определить состав сплава и выразить
его в массовых и мольных долях.
126. При
растворении в азотной кислоте 5 г
сплава меди и золота выделилось 0,99 мл
оксида азота (II), измеренных при
температуре 37 ºС и давлении 1,2105Па.
Определить состав сплава и выразить
его в массовых и мольных долях.
127. Для
нейтрализации 20 мл 0,1 н. раствора
кислоты потребовалось 8 мл раствора
гидроксида натрия. Сколько граммов NaOH
содержит 1 л этого раствора?
128. Какой
объем 0,2 н. раствора кислоты требуется
для нейтрализации раствора, содержащего
0,51 г гидроксида калия в 30 мл?
129. Сколько
и какого вещества останется в избытке,
если к 150 мл 0,4 н. раствора соляной
кислоты прибавить 250 мл 0,2 н. раствора
гидроксида натрия?
130. Смешали
100 мл 1,5 н. раствора и 100 мл 0,5 н.
раствора серной кислоты. Рассчитать
молярность полученного раствора.
131. К
100 мл раствора едкого натра (концентрация
10 %, плотность 1,109 г/см3)
прибавили 200 мл раствора NaOH (концентрация
20 %, плотность 1,219 г/см3).
Рассчитать нормальность полученного
раствора.
132. К
500 мл раствора хлорида натрия
(концентрация 6 %, плотность 1,04 г/см3)
прибавили 1 л раствора хлорида калия
концентрацией 8 % и
плотностью 1,05 г/см3.
Рассчитать молярную концентрацию
хлорид-иона в растворе после смешения.
133. Смешали
два раствора нитрата натрия концентрацией
0,8 и 0,2 моль/л в пропорции
2:1. Рассчитать молярную концентрацию
полученного раствора.
134. Определить
эквивалентную массу кислоты, если на
нейтрализацию раствора, содержащего
0,63 г кислоты, израсходовано
20 мл 0,5 н. раствора
щелочи.
135. Смешали
2 л раствора сульфата меди (II)
концентрацией 2 % и
плотностью 1,02 г/см3и 1 л раствора хлорида меди (II)
концентрацией 0,1 н. Рассчитать молярную
концентрацию меди в полученном растворе.
136. К
50 мл раствора NaCl концентрацией 10 г/л
прибавили 100 мл раствора NaCl концентрацией
2 г/л. Рассчитать молярную концентрацию
полученного раствора.
137. К
100 л раствора соли железа с содержанием
по железу 5 г/л прибавили 50 л раствора
нитрата железа (III) концентрацией
0,3 моль/л. Рассчитать молярную
концентрацию железа в полученном
растворе.
138. На
нейтрализацию раствора, содержащего
4,05 г кислоты, израсходовано 40 мл
раствора едкого натра (NaOH) концентрацией
10 % и плотностью 1,109 г/см3.
Определить эквивалентную массу кислоты.
139. К
50 л раствора фосфорной кислоты
концентрацией 8 % и плотностью
1,042 г/см3прибавили 2 л фосфата
натрия концентрацией 5 г/л. Рассчитать
молярную концентрацию фосфат-иона в
полученном растворе.
140. Смешали
54 мл раствора NaOH концентрацией 0,5 %
и плотностью 1 г/см3
и 10 мл 2-процентного раствора NaOH
плотностью 1,02 г/см3.
Рассчитать концентрацию полученного
раствора (в процентах).
141. Смешали
120 л раствора с содержанием никеля
0,8 моль/л, 500 л раствора с содержанием
никеля 1 г/л и 50 л раствора
(концентрация NiSO414 %, плотность
1,158 г/см3). Рассчитать молярную
концентрацию никеля в полученном
растворе.
142. На
нейтрализацию 10 мл раствора серной
кислоты концентрацией 22 % и плотностью
1,155 г/см3потребовалось 50 мл
раствора щелочи концентрацией 41,6 г/л.
Определить эквивалентную массу щелочи.
143. Смешали
4 мл серной кислоты (концентрация
40 %, плотность 1,303 г/см3) и
200 мл серной кислоты концентрацией
0,001 моль/л. Рассчитать нормальную
концентрацию полученного раствора.
144. Смешали
8 л раствора соляной кислоты
концентрацией 4 моль/л и 11 л раствора
той же кислоты концентрацией 2 г/л.
Рассчитать концентрацию полученного
раствора в граммах на литр.
145. Сколько
известняка с содержанием карбоната
кальция 70 % потребуется для полной
нейтрализации 10 л серной кислоты
концентрацией 5 г/л?
146. Смешали
7 л раствора магния концентрацией
0,1 моль/л и 5 л раствора соли кальция
концентрацией по кальцию 4 г/л.
Рассчитать общее содержание металлов
в растворе (в молях на литр).
147. К
раствору, содержащему 5 г сульфата
цинка, объемом 2 л добавили 3 л
раствора сульфата меди (II) концентрацией
0,3 моль/л. Рассчитать молярную
концентрацию сульфат-иона в полученном
растворе.
148. Смешали
растворы нитрата аммония концентрацией
0,3 моль/кг и 0,08 моль/л в соотношении
1:3. Рассчитать моляльную концентрацию
полученного раствора. Плотность всех
растворов принять равной 1 г/см3.
149. К
раствору объемом 30 мл, содержащему
10 г серной кислоты в 100 мл раствора,
прибавили 40 мл раствора NaOH, содержащего
9 г гидроксида натрия в 100 мл
раствора. Найти молярную концентрацию
вещества, которое останется в избытке.
150. Смешали
раствор нитрата серебра (концентрация
1 %, плотность 1,01 г/см3) и
раствор соляной кислоты (концентрация
5 %, плотность 1,02 г/см3) в
соотношении 3:4. Рассчитать молярную
концентрацию нитрат-иона в полученном
растворе.
151. Какой
объем раствора серной кислоты (концентрация
10 %, плотность 1,07 г/см3)
потребуется для полной нейтрализации
0,5 л раствора NaOH концентрацией 16 г/л?
152. Смешали
10 мл раствора HCl (концентрация 10 %,
плотность 1,047 г/см3) и 10 мл
раствора HCl (концентрация 6 %, плотность
1,028 г/см3). Рассчитать массовую
долю и молярную концентрацию соляной
кислоты в полученном растворе.
153. Из
раствора нитрата серебра (концентрация
2 %, плотность 1,015 г/см3)
по реакции с хлоридом натрия образуется
14,35 г хлорида серебра. Вычислить
исходный объем раствора нитрата серебра.
154. Смешали
1 л 1 М раствора CuSO4и 2 л
0,5 М раствора CuSO4. Рассчитать
содержание меди в полученном растворе
в граммах на литр.
155. Сколько
миллилитров 0,5 н. раствора сульфата
натрия нужно добавить к 100 мл раствора
хлорида бария (концентрация 16 %,
плотность 1,156 г/см3),
чтобы полностью осадить сульфат-ионы?
156. Металл
вытеснил из 100 мл соляной кислоты
348 мл водорода, измеренного при 20 °С
и 99,5 кПа. Рассчитать нормальную
концентрацию хлорида металла в полученном
растворе.