Как определить число нуклонов в ядре атома?
Число нуклонов в ядре атома равно массовому числу атома (относительная атомная масса химического элемента) или сумме протонов и нейтронов.
Как определить число протонов в атоме?
Число протонов в атоме равно заряду его ядра (обозначается как Z) или порядковому номеру элемента в периодической таблице Менделеева.
Как определить число нейтронов в атоме?
Очень просто!
N = A – Z
Где N – число нейтронов, A – атомная масса элемента (в целых числах), Z – заряд ядра атома или порядковый номер атома в периодической таблице Менделеева.
Развернутый ответ
Масса атома складывается из двух величин: масса протонов + масса нейтронов. Дело в том, что масса электронов пренебрежимо мала.
Масса нейтрона = 1,674 927 498 04(95)⋅10⁻²⁷ кг= 1,008 664 915 60(57) а.е.м.
Масса протона = 1,672 621 923 69(51)⋅10⁻²⁷ кг = 1,007276466621(53) а.е.м.
Масса электрона = 9,109383 7015(28)⋅10⁻³¹ кг = 0,000548579909065 а.е.м.
То есть даже 100 электронов дадут в сумме всего 0,0548579909065 а.е.м.
Первоначально Д. И. Менделеев в построении своей периодической таблицы исходил из атомных весов элементов. Однако, дальнейшее развитие науки показало, что свойства химических элементов находятся в прямой зависимости не от атомной массы химического элемента, а от заряда ядра его атома. Таким образом, в периодической таблице химические элементы выстроены в порядке возрастания заряда ядра атома и номер элемента в таблице соответствует заряду его ядра. А заряд ядра равен сумме протонов. То есть № (элемента) = Z (заряд ядра или число протонов).
Остаток массы ядра приходится на нейтроны. Поэтому чтобы определить число нейтронов в атоме нужно всего лишь вычесть из атомной массы число протонов, которое равно заряду ядра или порядковому номеру элемента в таблице Менделеева.
Примеры
Сколько протонов и нейтронов в атоме натрия?
Ar (Na) = 23 а.е.м.
Z (Na) = 11 (протонов)
N = Ar (Na) – Z (Na) = 23 – 11 = 12 (нейтронов)
Ответ: число протонов в атоме натрия равно 11, а число нейтронов в атоме натрия равно 12.
Сколько протонов и нейтронов в атоме фосфора?
Ar (P) = 31 а.е.м.
Z (P) = 15 (протонов)
N = Ar (P) – Z (P) = 31 – 15 = 16 (нейтронов)
Ответ: число протонов в атоме фосфора равно 15, а число нейтронов в атоме фосфора равно 16.
Сколько протонов и нейтронов в атоме золота?
Ar (Au) = 197 а.е.м.
Z (Au) = 79 (протонов)
N = Ar (Au) – Z (Au) = 197 – 79 = 118 (нейтронов)
Ответ: число протонов в атоме золота равно 79, а число нейтронов в атоме золота равно 118.
Сколько протонов и нейтронов в атоме кремния?
Ar (Si) = 28 а.е.м.
Z (Si) = 14 (протонов)
N = Ar (Si) – Z (Si) = 28 – 14 = 14 (нейтронов)
Ответ: число протонов и нейтронов в атоме кремния равно 14.
Сколько протонов и нейтронов в атоме углерода?
Ar (C) = 12 а.е.м.
Z (C) = 6 (протонов)
N = Ar (C) – Z (C) = 12 – 6 = 6 (нейтронов)
Ответ: число протонов и нейтронов в атоме углерода равно 6.
Сколько протонов и нейтронов в атоме калия?
Ar (K) = 39 а.е.м.
Z (K) = 19 (протонов)
N = Ar (K) – Z (K) = 39 – 19 = 20 (нейтронов)
Ответ: число протонов в атоме калия равно 19, а число нейтронов в атоме калия равно 20.
Сколько протонов и нейтронов в атоме железа?
Ar (Fe) = 39 а.е.м.
Z (Fe) = 19 (протонов)
N = Ar (Fe) – Z (Fe) = 56 – 26 = 30 (нейтронов)
Ответ: число протонов в атоме железа равно 19, а число нейтронов в атоме железа равно 30.
Сколько протонов и нейтронов в атоме алюминия?
Ar (Al) = 27 а.е.м.
Z (Al) = 13 (протонов)
N = Ar (Al) – Z (Al) = 27 – 13 = 14 (нейтронов)
Ответ: число протонов в атоме алюминия равно 13, а число нейтронов в атоме алюминия равно 14 .
Сколько протонов и нейтронов в атоме фтора?
Ar (F) = 19 а.е.м.
Z (F) = 9 (протонов)
N = Ar (F) – Z (F) = 19 – 9 = 10 (нейтронов)
Ответ: число протонов в атоме фтора равно 9, а число нейтронов в атоме фтора равно 10.
Сколько протонов и нейтронов в атоме хлора?
Ar (Cl) = 35 а.е.м.
Z (Cl) = 17 (протонов)
N = Ar (Cl) – Z (Cl) = 35 – 17 = 18 (нейтронов)
Ответ: число протонов в атоме хлора равно 17, а число нейтронов равно 18.
Сколько протонов и нейтронов в атоме кислорода?
Ar (O) = 16 а.е.м.
Z (O) = 8 (протонов)
N = Ar (O) – Z (O) = 16 – 8 = 8 (нейтронов)
Ответ: число протонов и нейтронов в атоме кислорода равно 8.
Сколько протонов и нейтронов в атоме серы?
Ar (S) = 32 а.е.м.
Z (S) = 16 (протонов)
N = Ar (S) – Z (S) = 32 – 16 = 16 (нейтронов)
Ответ: число протонов и нейтронов в атоме серы равно 16.
Сколько протонов и нейтронов в атоме магния?
Ar (Mg) = 32 а.е.м.
Z (Mg) = 16 (протонов)
N = Ar (Mg) – Z (Mg) = 24 – 12 = 12 (нейтронов)
Ответ: число протонов в атоме магния равно 16, а число нейтронов равно 12.
Сколько протонов и нейтронов в атоме цинка?
Ar (Zn) = 65 а.е.м.
Z (Zn) = 30 (протонов)
N = Ar (Zn) – Z (Zn) = 65 – 30 = 35 (нейтронов)
Ответ: число протонов в атоме цинка равно 30, а число нейтронов в атоме цинка равно 35.
Похожие вопросы:
– Какие атомы имеют одинаковое число нейтронов?
– Как определить общее число электронов в атоме?
Содержание
- Число нуклонов (протонов и нейтронов) в атоме
- Как определить число нуклонов в ядре атома?
- Как определить число протонов в атоме?
- Как определить число нейтронов в атоме?
- Развернутый ответ
- Примеры
- Сколько протонов и нейтронов в атоме натрия?
- Сколько протонов и нейтронов в атоме фосфора?
- Сколько протонов и нейтронов в атоме золота?
- Сколько протонов и нейтронов в атоме кремния?
- Сколько протонов и нейтронов в атоме углерода?
- Сколько протонов и нейтронов в атоме калия?
- Сколько протонов и нейтронов в атоме железа?
- Сколько протонов и нейтронов в атоме алюминия?
- Сколько протонов и нейтронов в атоме фтора?
- Сколько протонов и нейтронов в атоме хлора?
- Сколько протонов и нейтронов в атоме кислорода?
- Сколько протонов и нейтронов в атоме серы?
- Сколько протонов и нейтронов в атоме магния?
- Сколько протонов и нейтронов в атоме цинка?
- 3_6. ЯДРА АТОМОВ
Число нуклонов (протонов и нейтронов) в атоме
Как определить число нуклонов в ядре атома?
Число нуклонов в ядре атома равно массовому числу атома (относительная атомная масса химического элемента) или сумме протонов и нейтронов.
Как определить число протонов в атоме?
Число протонов в атоме равно заряду его ядра (обозначается как Z) или порядковому номеру элемента в периодической таблице Менделеева.
Как определить число нейтронов в атоме?
Где N – число нейтронов, A – атомная масса элемента (в целых числах), Z – заряд ядра атома или порядковый номер атома в периодической таблице Менделеева.
Развернутый ответ
Масса атома складывается из двух величин: масса протонов + масса нейтронов. Дело в том, что масса электронов пренебрежимо мала.
Масса нейтрона = 1,674 927 498 04(95)⋅10⁻²⁷ кг= 1,008 664 915 60(57) а.е.м.
Масса протона = 1,672 621 923 69(51)⋅10⁻²⁷ кг = 1,007276466621(53) а.е.м.
Масса электрона = 9,109383 7015(28)⋅10⁻³¹ кг = 0,000548579909065 а.е.м.
То есть даже 100 электронов дадут в сумме всего 0,0548579909065 а.е.м.
Первоначально Д. И. Менделеев в построении своей периодической таблицы исходил из атомных весов элементов. Однако, дальнейшее развитие науки показало, что свойства химических элементов находятся в прямой зависимости не от атомной массы химического элемента, а от заряда ядра его атома. Таким образом, в периодической таблице химические элементы выстроены в порядке возрастания заряда ядра атома и номер элемента в таблице соответствует заряду его ядра. А заряд ядра равен сумме протонов. То есть № (элемента) = Z (заряд ядра или число протонов).
Остаток массы ядра приходится на нейтроны. Поэтому чтобы определить число нейтронов в атоме нужно всего лишь вычесть из атомной массы число протонов, которое равно заряду ядра или порядковому номеру элемента в таблице Менделеева.
Примеры
Сколько протонов и нейтронов в атоме натрия?
Ar (Na) = 23 а.е.м.
Z (Na) = 11 (протонов)
N = Ar (Na) – Z (Na) = 23 – 11 = 12 (нейтронов)
Ответ: число протонов в атоме натрия равно 11, а число нейтронов в атоме натрия равно 12.
Сколько протонов и нейтронов в атоме фосфора?
Ar (P) = 31 а.е.м.
Z (P) = 15 (протонов)
N = Ar (P) – Z (P) = 31 – 15 = 16 (нейтронов)
Ответ: число протонов в атоме фосфора равно 15, а число нейтронов в атоме фосфора равно 16.
Сколько протонов и нейтронов в атоме золота?
Ar (Au) = 197 а.е.м.
Z (Au) = 79 (протонов)
N = Ar (Au) – Z (Au) = 197 – 79 = 118 (нейтронов)
Ответ: число протонов в атоме золота равно 79, а число нейтронов в атоме золота равно 118.
Сколько протонов и нейтронов в атоме кремния?
Ar (Si) = 28 а.е.м.
Z (Si) = 14 (протонов)
N = Ar (Si) – Z (Si) = 28 – 14 = 14 (нейтронов)
Ответ: число протонов и нейтронов в атоме кремния равно 14.
Сколько протонов и нейтронов в атоме углерода?
Ar (C) = 12 а.е.м.
Z (C) = 6 (протонов)
N = Ar (C) – Z (C) = 12 – 6 = 6 (нейтронов)
Ответ: число протонов и нейтронов в атоме углерода равно 6.
Сколько протонов и нейтронов в атоме калия?
Ar (K) = 39 а.е.м.
Z (K) = 19 (протонов)
N = Ar (K) – Z (K) = 39 – 19 = 20 (нейтронов)
Ответ: число протонов в атоме калия равно 19, а число нейтронов в атоме калия равно 20.
Сколько протонов и нейтронов в атоме железа?
Ar (Fe) = 39 а.е.м.
Z (Fe) = 19 (протонов)
N = Ar (Fe) – Z (Fe) = 56 – 26 = 30 (нейтронов)
Ответ: число протонов в атоме железа равно 19, а число нейтронов в атоме железа равно 30.
Сколько протонов и нейтронов в атоме алюминия?
Ar (Al) = 27 а.е.м.
Z (Al) = 13 (протонов)
N = Ar (Al) – Z (Al) = 27 – 13 = 14 (нейтронов)
Ответ: число протонов в атоме алюминия равно 13, а число нейтронов в атоме алюминия равно 14 .
Сколько протонов и нейтронов в атоме фтора?
Ar (F) = 19 а.е.м.
Z (F) = 9 (протонов)
N = Ar (F) – Z (F) = 19 – 9 = 10 (нейтронов)
Ответ: число протонов в атоме фтора равно 9, а число нейтронов в атоме фтора равно 10.
Сколько протонов и нейтронов в атоме хлора?
Ar (Cl) = 35 а.е.м.
Z (Cl) = 17 (протонов)
N = Ar (Cl) – Z (Cl) = 35 – 17 = 18 (нейтронов)
Ответ: число протонов в атоме хлора равно 17, а число нейтронов равно 18.
Сколько протонов и нейтронов в атоме кислорода?
Ar (O) = 16 а.е.м.
Z (O) = 8 (протонов)
N = Ar (O) – Z (O) = 16 – 8 = 8 (нейтронов)
Ответ: число протонов и нейтронов в атоме кислорода равно 8.
Сколько протонов и нейтронов в атоме серы?
Ar (S) = 32 а.е.м.
Z (S) = 16 (протонов)
N = Ar (S) – Z (S) = 32 – 16 = 16 (нейтронов)
Ответ: число протонов и нейтронов в атоме серы равно 16.
Сколько протонов и нейтронов в атоме магния?
Ar (Mg) = 32 а.е.м.
Z (Mg) = 16 (протонов)
N = Ar (Mg) – Z (Mg) = 24 – 12 = 12 (нейтронов)
Ответ: число протонов в атоме магния равно 16, а число нейтронов равно 12.
Сколько протонов и нейтронов в атоме цинка?
Ar (Zn) = 65 а.е.м.
Z (Zn) = 30 (протонов)
N = Ar (Zn) – Z (Zn) = 65 – 30 = 35 (нейтронов)
Ответ: число протонов в атоме цинка равно 30, а число нейтронов в атоме цинка равно 35.
Источник
3_6. ЯДРА АТОМОВ
Запустите программу компьютерного моделирования. Выберите модель «6.6. Энергия связи ядер».
Знакомство с основными свойствами ядер атомов. Исследование состава ядер и его влияния на количество изотопов.
ПОДГОТОВКА К ВЫПОЛНЕНИЮ РАБОТ
Прочитайте по учебнику соответствующий материал [1] – §§41.1 – 41.4 [2] — §§ 251 — 254. Законспектируйте краткую теорию. Рассмотрите изображение на рис. 1 и зарисуйте основные элементы в отчет по лабораторной работе. Подготовьте таблицы для заполнения в процессе измерений.
Получите допуск у преподавателя.
Ядром называется центральная часть атома, которая имеет очень малый размер и в которой сосредоточена основная масса атома . Оно в 2-4 тыс. раз массивнее, чем электроны, заполняющие основной объем атома.
В состав ядра входят частицы, называемые «нуклонами» (в переводе – ядерные частицы).
A – массовое число ядра равно количеству нуклонов в данном ядре. Нуклоны подразделяют на протоны и нейтроны.
Протоном называется нуклон, имеющий положительный заряд, равный элементарному.
Z – зарядовое число ядра, равное количеству протонов в данном ядре. Оно же равно порядковому номеру данного химического элемента в таблице Менделеева.
Символ протона «p». Заряд протона Q p = +e, где е – элементарный заряд, равный 1,6·10 -19 Кл. Масса протона m p = 1839.7 m e .
Протон обладает собственным моментом импульса — спином , модуль которого равен
называется спиновым квантовым числом протона.
Протон – это фермион (подчиняется принципу Паули).
Протон имеет магнитный момент : M p = 1.3 M Б.ЯД , где ядерный магне-
Нейтроном называется нуклон, не имеющий заряда (нейтральный
– отсюда и название).
Его символ «n». Заряд нейтрона Q n = 0 . Количество нейтронов
Масса нейтрона чуть больше массы протона m n = m p + 2.5 m e .
Нейтрон – это тоже фермион (подчиняется принципу Паули), т.к. его спиновое квантовое число s n = 1/2.
Нейтрон имеет магнитный момент, несмотря на то, что он незаряжен.
Отношение магнитных моментов нуклонов очень близко к отношению целых чисел:
ХАРАКТЕРИСТИКИ ЯДРА В ЦЕЛОМ
Форма ядра близка к сферической (точнее, эллипсоид вращения).
Несферичность ядра определяется отклонением b/a от 1, которое для всех известных ядер не превышает 20% .
Размер 10 -15 м. Эмпирическая формула для радиуса ядра, которая выполняется с достаточной точностью R = 1 . 3 3 A10 − 15 м.
Такая зависимость является следствием того, что ядро состоит из частиц, которые плотно упакованы, т.е. расположены вплотную .
Плотность ядра практически однородна вплоть до его границ, т.е. вещество заполняет ядро без «пустот». В этом ядро коренным образом отличается от атома, у которого центральная часть (ядро) имеет плотность в 10 18 раз больше, чем плотность остальной части атомов (электронных облаков).
Любое ядро имеет электрический заряд (положительный и кратный элементарному заряду е = 1.6 10 -19 Кл).
Q яд = Ze, где Z – зарядовое число ядра (количество протонов в данном
Ядро имеет спин
и магнитный момент
Модуль спина ядра квантован:
где S – спиновое квантовое число ядра .
Проекция спина ядра на выделенную ось также квантуется. Количество протонов Z в ядре может принимать любое целочисленное
значение вплоть до наибольшего известного (104). Количество протонов
равно количеству электронов в атоме и, следовательно, определяет порядковый номер элемента в таблице Менделеева и химические свойства данного элемента.
При фиксированном количестве протонов возможное количество нейтронов N в ядре не может быть любым! Количество нейтронов у легких ядер примерно равно количеству протонов, а у самых тяжелых – примерно на 60% больше. Только у одного элемента — водорода — в ядре отсутствуют нейтроны.
Изотопами данного элемента называются вещества, ядра которых имеют одно и то же количество протонов, но разное количество нейтронов.
Изотоп водорода, ядро которого содержит один нейтрон, называется дейтерием , а его ядро – дейтоном. Изотоп водорода, ядро которого содер-
жит два нейтрона, называется тритием , а его ядро – тритоном.
Самым необычным свойством ядер является наличие неустойчивых ядер, которые самопроизвольно превращаются в другие ядра и элементарные частицы.
Стабильными (устойчивыми) называются ядра, которые могут существовать бесконечно долго, не превращаясь в другие. У некоторых веществ имеется несколько стабильных изотопов, у которых наблюдается отличие на 1 – 10 нейтронов. Были обнаружены также и нестабильные ядра, которые, как и стабильные, могут иметь изотопы. К настоящему времени известно 104 химических элемента, около 300 устойчивых изотопов и свыше 1000 неустойчивых.
Наиболее теоретически разработанными моделями ядер являются капельная и оболочечная модели.
В КАПЕЛЬНОЙ МОДЕЛИ ядро моделируется, как капля жидкости, ча-
стицы которой (нуклоны) участвуют в ядерном взаимодействии (вне контакта нуклонов между ними действуют силы притяжения, при контакте и сжатии — отталкивания). Нуклоны несжимаемы, расположены почти вплотную, но обладают подвижностью. Эту модель мы не будем рассматривать.
Согласно ОБОЛОЧЕЧНОЙ модели ядра каждый нуклон ядра движется колебательно в общем поле ядерных сил, создаваемом всеми нуклонами ядра. Усредненный потенциал этого поля можно аппроксимировать потенциалом трехмерного осциллятора. Решение уравнения Шредингера дает доступные квантовые состояния колебательного движения, которое определяется как суперпозиция трех независимых одномерных колебаний по осям X, Y и Z, имеющих энергию
E Xn = ω n X 1 2 , E Yn = ω n Y 1 2 , E Zn = ω n Z 1 2 ,
где n X,Y,Z — целые числа, принимающие значения 0, 1, 2, …, есть квантовые числа для каждого одномерного колебания вдоль соответствующей оси де-
картовой системы координат. Произвольно движущийся нуклон имеет энергию, равную сумме этих энергий, которая квантована с помощью квантового числа n:
где целое число n = n X + n Y + n Z = 0, 1, 2, 3, . является квантовым числом, определяющим энергию движения нуклона. Таким образом, тройка целых
чисел n X , n Y , n Z совместно с m S = ± 1 2 (магнитное спиновое квантовое число
нуклона) дают четверку чисел, полностью определяющую состояние ну-
Количество доступных состояний с фиксированным квантовым числом n можно вычислить по формуле
По аналогии с атомом, совокупность доступных состояний с фиксированным числом n , принято называть оболочкой .
Подоболочкой можно называть совокупность состояний, имеющих данную тройку чисел n X n Y n Z . Любая подоболочка имеет 2 доступных квантовых состояния, отличающихся магнитным спиновым квантовым числом m S (+1/2 и -1/2).
Первая оболочка (n = 0) имеет 2 доступных состояния (0,0,0,1/2) и (0,0,0,-1/2) и одну подоболочку и (0,0,0,±1/2);
вторая (n = 1) имеет 6 доступных состояний и 3 подоболочки
третья (n = 2) имеет 12 доступных состояний и 6 подоболочек (2,0,0,±1/2), (0,2,0,±1/2), (0,0,2,±1/2), (1,1,0,±1/2), (1,0,1,±1/2) и (0,1,1,±1/2).
Совокупность протонов и совокупность нейтронов в ядре являются самостоятельными квантовыми системами, поэтому доступные квантовые состояния заполняются нуклонами по отдельности : отдельно протонами, отдельно нейтронами. При этом выполняются известные основные принципы:
∙ принцип минимальности энергии, т.е. сначала заполняются самые нижние уровни энергии (квантовые состояния с минимальной энергией), затем – расположенные выше, т.е. имеющие большую энергию;
∙ принцип Паули: в одной квантовой системе в одном квантовом состоянии может находиться не более одной частица с полуцелым
Подоболочка заполнена, если в ней находится 2 нуклона. Все сказанное относится как к протонам, так и к нейтронам, входящим в состав ядра.
Ядра с заполненными протонными подоболочками содержат четное количество протонов и будут иметь повышенную устойчивость и, следовательно, больше изотопов, чем ядра с нечетным количеством протонов. В лабораторной работе вы убедитесь в этом на опыте.
Для элемента, у которого 2 протона (гелий), первая оболочка полностью заполнена протонами (а остальные пусты).
Для элемента, у которого 8 протонов (кислород), заполнены первая (2 состояния) и вторая (6 состояний) оболочки.
Для элемента, имеющего 20 протонов (кальций), заполнены протонами первая, вторая и третья оболочки (12 состояний).
Ядра данных химических элементов обладают особой устойчивостью, количество протонов в них называют «магическими числами» , а сами ядра называют «магическими». Химические элементы с магическими ядрами имеют особенно большое количество изотопов.
Дважды магическими называют ядра, у которых и количество протонов и количество нейтронов равно магическому числу. У них полностью заполнены оболочки, как для протонов, так и для нейтронов.
Экспериментальные значения магических чисел образуют следующий ряд: 2, 8, 20, 28, 50, 82, 126 .
В упрощенной модели магическими являются числа 2, 8, 20, 40, 70 и
112. Число 28 не предсказывается в упрощенной модели ядра, но получается в уточненной модели. Последующие числа хотя и отличаются, но довольно близки.
Дважды магическими ядрами обладают гелий 2 He 4 , кислород 8 O 16 , кальций 20 Ca 40 и свинец 82 Pb 208 .
МЕТОДИКА И ПОРЯДОК ПРОВЕДЕНИЯ ИЗМЕРЕНИЙ
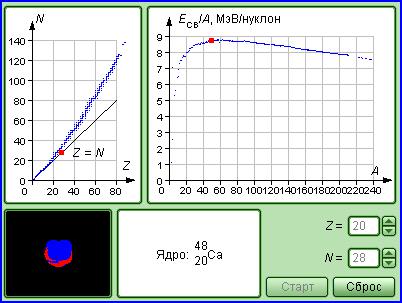
Рис.1. Модель для исследования устойчивости ядер.
На рис.1 представлено изображение экрана компьютера, на котором даны результаты экспериментальных исследований устойчивости ядер и удельной энергии связи нуклонов в ядре в зависимости от состава ядра.
На левом графике представлена совокупность точек, соответствующих составу ядер (Z и N) всех химических элементов, встречающихся в природе (включая изотопы). Фиксируя количество протонов Z, входящих в состав ядра, мы задаем химические свойства вещества, состоящего из атомов с такими ядрами. Изменяя количество нейтронов N при фиксированном количестве протонов, получаем изотопы данного химического элемента. Ядра полученного изотопа могут быть как стабильными, так и нестабильными. Это свойство ядер можно наблюдать на изображении, помещенном в левом нижнем углу модели. Каждый стабильный изотоп при наведении маркера мыши изображается в виде красной точки.
При исследованиях на данной компьютерной модели требуется определить количество стабильных изотопов для химических элементов, заданных для каждой бригады студентов.
ЗАМЕЧАНИЕ: по графику, приведенному сверху справа на рис. 1, вы можете наблюдать, как зависит удельная энергия связи нуклонов в ядре Е СВ от его состава (количества нуклонов А).
Источник
Как найти количество протонов, электронов,нуклонов и нейтронов?Напишите формулы и разьясните что к чему.
Daria
Знаток
(258),
закрыт
9 лет назад
Алла Калінчук
Мыслитель
(5437)
12 лет назад
число протонов=числу электронов =номеру в таблице Менделеева
чтоб найти число нейтронов, надо от массы-номер
напимер., Литий№3,масса 7.протонов, электронов будет по 3,нейтронов 7-3=4
Нуклоны это протоны+нейтроны (они в ядре) число нуклонов=массе, у лития 7
Введённое нами понятие атома рассматривает его как систему, в которой положительно заряженное ядро (состоит из протонов и нейтронов) окружено вращающимися вокруг него электронами. Рассмотрим само ядро (рис. 1). Контуры ядра не настолько округлые, но всё же ядром можно назвать область пространства в условном геометрическом центре ядра, где сосредоточены протоны и нейтроны. Протон — положительно заряженная частица, нейтрон — нейтральная частица. Вместе их удерживают внутриядерные силы (лучше пока о них много не знать) и внеядерное присутствие отрицательно заряженных электронов.
Рис. 1. Ядро
Ядра различных веществ содержат различное количество протонов. Данный факт является основой для таблицы Менделеева. В данной таблице у водорода () — первый элемент таблицы, присутствует один протон, далее ядро гелия (
) — второй элемент, имеет два протона и так далее. При этом количество нейтронов в одном и том же веществе может быть разным.
Введём некоторые понятия ядерной физики:
Количество нуклонов — суммарное количество протонов и нейтронов.
Изотопы — ядра одного и того же вещества, имеющие одно и то же количество протонов, но разное количество нейтронов.
Рис. 2. Обозначение ядра
Для рассмотрения элементов в курсе ядерной физики вводят специальные обозначения (рис. 2). Рассмотрим гипотетический элемент . В предложенной форме записи число снизу указывает на количество протонов, а сверху — количество нуклонов (протонов+нейтронов).
Примеры:
— ядро лития, состоящее из 3 протонов и 7-3=4 нейтронов,
— ядро алюминия, состоящее из 13 протонов и 27-13=14 нейтронов,
— ядро меди, состоящее из 29 протонов и 63-29=34 нейтронов.
Таким образом, исходя из таблицы Менделеева, можно сформировать внешний вид элемента (рис. 2) или, исходя из внешнего вида, определить сам элемент.
Исходя из введённых нами понятий и изображений, в ядерной физике школьного уровня выделяют три типа задач:
- задачи на уравнение радиоактивного распада
- задачи на ядерные реакции
- задачи, касающиеся энергии ядерных реакций