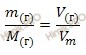Этот калькулятор завершает тему с молярным объемом газа, начатую калькулятором Перевод молей в литры и литров в моли. Мы можем перевести литры газа в моли, так как молярный объем газа величина постоянная для всех идеальных газов. Зная формулу газа мы может посчитать его молярную массу, а зная и молярную массу и количество моль – найти массу газа. Логика конвертации описана после калькулятора
Перевод литров газа в граммы и наоборот
Точность вычисления
Знаков после запятой: 1
Как перевести граммы газа в литры газа
Чтобы перевести граммы газа в литры газа, мы должны выполнить следующие шаги:
- по химической формуле газа найти его молярную массу
- поделить массу газа в граммах на молярную массу и найти число моль газа
- умножить число моль на молярный объем газа и найти объем газа в литрах.
Как перевести литры газа в граммы газа
Чтобы перевести литры газа в граммы газа мы должны выполнить следующие шаги:
- поделить объем газа в литрах на молярный объем и найти число моль
- по химической формуле газа найти его молярную массу
- умножить число моль на молярную массу газа и найти массу газа в граммах
Обратите внимание что калькулятор использует значение молярного объема газа при нормальных условиях. Если нужно перести к стандартным условиям от молярного объема газа при других условиях, можно воспользоваться калькулятором Молярный объем газа
Объем грамм молекулы газа Закон Авогадро
Что такое грамм молекула газа
Грамм молекула любого вещества в твердом, жидком или газообразном состоянии представляет собой некоторое количество вещества, занимающее в пространстве определенный объем. Другими словами, грамм-молекула имеет не только вес, но и объем. Этот объем довольно легко рассчитать, пользуясь для этого формулой
P = V · d
где Р — вес, в данном случае вес грамм-молекулы (М), V— объем грамм-молекулы, а а d- удельный вес, или плотность. Для твердых тел мы выражаем объем в граммах на 1 см3, а для газообразных — в граммах на 1 л. Исходя из этой формулы, нетрудно определить объем грамм-молекулы: V = M : d ; М — легко-узнать, подсчитав молекулярный вес вещества, ad — воспользовавшись таблицей плотностей. Будем рассматривать объем при нормальных условиях (температура 0° и давление 760 мм рт. ст.).
Из табл. 1 видно, что грамм-молекула каждого из перечисленных веществ занимает различный объем, так как размер молекул каждого вещества неодинаков, а число молекул в грамм-молекуле одно и то же.
Из приведенных в табл. 2 данных видно, что грамм-молекулярные объемы газов равны между собой: грамм-молекула любого газа при нормальных условиях занимает объем 22,4 л.
• Запишите эту цифру в тетрадь и хорошо запомните.
Чем же это объясняется? Оказывается, у газов промежутки между молекулами настолько велики, что величина молекул по сравнению с этими расстояниями ничтожна, и мы ею можем пренебречь. Таким образом, измеряя объем, мы фактически измеряем объем суммы промежутков между молекулами.
Таблица 1. Грамм-молекулярные объемы и плотность жидкостей и твердых веществ
Таблица 2. Грамм-молекулярные объемы и плотность газов
Что касается расстояния между молекулами, то оно зависит только от условий (температуры и давления) и совершенно не зависит от природы газа и размеров его молекул, поэтому при одинаковых условиях мы получаем одинаковые объемы.
Отсюда напрашивается следующий вывод: при одинаковых условиях грамм-молекулы любых газов занимают равные объемы.
• Запишите этот вывод в тетрадь.
Полученные результаты логически подводят нас к следующему: так как в грамм-молекуле любого вещества содержится одинаковое число молекул,а грамм-молекулы газов занимают одинаковые объемы при одних и тех же условиях, можно сделать следующий вывод: в равных объемах газов при одинаковых условиях содержится одно и то же число молекул. Этот вывод был сделан в 1811 г. итальянским химиком Авогадро и поэтому получил название закона Авогадро.
• Запишите формулировку закона в тетрадь.
■ 1. Как вычислить объем грамм-молекулы твердого вещества для жидкости? (См. Ответ)
2. Почему объемы грамм-молекул жидкостей и твердых тел различны?
3. Что такое «нормальные условия»?
4. Почему объемы грамм-молекул газов при одинаковых условиях равны?
5. Чему равен объем грамм-молекулы любого газа при нормальных условиях?
6. Как формулируется закон Авогадро? (См. Ответ)
Расчеты по химическим формулам с использованием объема грамм-молекулы газа
Зная, что объемы грамм-молекул газов при одинаковых условиях равны, легко высчитать объем любого количества газа, что иногда гораздо важнее, чем знание его веса.
Пример 1. Какой объем займут 6 г водорода Н2 при нормальных условиях?
Дано:
6г Н2
Найти:
VH2 (л) ?
Решение:
Так как грамм-молекула любого газа, а значит, и водорода при нормальных условиях занимает объем 22,4 л, а 1 моль водорода Н2 — это 2 г, то 2 г Н2 занимают объем, равный (при нормальных условиях) 22,4 л, а 6 г Н2 займут объем х л. Составим пропорцию: 2 : 6 = 22,4 : х
x = (6 · 22,4) : 2 = 67,2 л.
Ответ: 6 г водорода при нормальных условиях занимают объем 67,2 л.
Пример 2. Сколько весят 5,6 л двуокиси углерода СО2?
Дано:
5,6 л СО2
Найти:
РСО2 (г) ?
Решение:
Исходим снова из того, что грамм-молекула любого газа при нормальных условиях занимает объем 22,4 л и прежде всего высчитываем, чему равна грамм-молекула СО2. Она рав на:
22 + 16 · 2 = 44 гг
44 г СО2 занимают объем 22,4 л, а х г СО2 — объем 5,6 л. Составим и решим пропорцию:
44 : х = 22,4 : 5,6;
х = (44 · 5,6) : 22,4 = 11 г СО2
Ответ: 5,6 л двуокиси углерода весят 11 г.
■ 7. Рассчитайте, сколько весит 1 л следующих газов: (См. Ответ)
а) азота N2; б) аммиака NH3; в) хлора Сl2; г) окиси углерода СО.
8. Определите, какой объем займет 1 г каждого газа из перечислен-
ных в вопросе 7.
9. Сколько весит 1 м3 газовой смеси, состоящей на 50% из хлора Сl2 и на 50% из кислорода 02?
10. Сколько весит смесь 2 л азота N2 и 3 л кислорода 02?
11. Вычислите вес 1 л воздуха, допуская, что он состоит на 79% из азота N2 и на 21% из кислорода О2. (См. Ответ)
Расчеты по уравнениям реакций с использованием объема грамм-молекулы газа
Часто приходится определять объем газа, вступающего в реакцию или образующегося в результате реакции.
Пример 1. Какой объем СО2 получится при разложении 200 г известняка СаСО3 (условия нормальные)?
Дано:
200 г СаСО3
Найти:
VСО2 (л) ?
Решение:
Уравнение реакции разложения следующее:
СаСО3 = СаО + СО2.
Здесь подсчеты грамм-молекул несколько изменят свою обычную форму. Для СаСО3, так как это твердое вещество, грамм-молекулу вычисляют, как и всегда, исходя из атомных весов элементов. Что касается двуокиси углерода, то в задаче требуется определить ее объем, поэтому мы будем брать для подсчета не вес грамм-молекулы СО2, а ее объем, который, как известно, при нормальных условиях равен 22,4 л. Таким образом, наше уравнение будет выглядеть так:
CaCO3 : 100г = СаО + СО2 : 22,4 л.
Итак, из 100 г СаСО3 можно получить 22,4 л (1 моль) СО2, а из 200 г СаСО3 — х л СО2. Отсюда:
x = (22,2 · 200) : 22,4 = 11,2 л Н2.
Ответ: из 200 г известняка можно получить 44,8 л двуокиси углерода.
Пример 2. Какой объем водорода Н2 потребуется для реакции с 5,6 л кислорода при получении воды?
Дано:
5,6 л О2
Найти:
Н2 (л) ?
Решение:
(2Н2 : 44,8 л) + (О2 : 22,4 л) = 2Н2О
Здесь оба вещества — данное и искомое — газы, поэтому их количество должно быть выражено в объемах. Далее рассуждаем, как обычно: на 44,8 л Н2 расходуется 22,4 л О2, а на х л Н2 — 5,6 л О2. Отсюда
x = (5,6 · 44,8) : 22,4 = 11,2 л Н2.
Ответ. Для реакции потребуется 11,2 л водорода.
■ 12. Какой объем водорода Н2 может быть вытеснен из соляной кислоты 130 г цинка (нормальные условия)? (См. Ответ)
13. Какой объем хлористого водорода НСl получится при взаимодействии 67,2 л водорода Н2 с хлором Сl2 (нормальные условия)?
14. При восстановлении окиси меди водородом образовалось 8 г меди. Какой объем водорода израсходовался на реакцию (нормальные условия)?
15. Сероводород H2S сгорает по уравнению:
2H2S + 3O2 = 2SO2 + 2Н2O
Вычислите объем кислорода и двуокиси серы, если сгорает 5 молей сероводорода (нормальные условия).
16. Какой объем двуокиси углерода израсходуется на взаимодействие с 37 г гидроокиси кальция Са(ОН)2, если в результате реакции образуется карбонат СаСO3 (нормальные условия)? (См. Ответ)
Абсолютная и относительная плотность газов. Определение молекулярного веса газов по абсолютной и относительной плотности
Понятие об абсолютной и относительной плотности газов непосредственно вытекает из уже рассмотренного нами материала об объеме грамм-молекулы газа.
Абсолютная плотность (или удельный вес) газа — это вес 1л газа. Ее легко определить по формуле:
где М — грамм-молекулярный вес газа, а V — объем грамм-молекулы газа, равный при нормальных условиях 22,4 л.
Следовательно,
Зная молекулярный вес, можно найти абсолютную плотность. По этой же формуле, если известна абсолютная плотность, можно определить молекулярный вес по формуле М = 22,4m · d (нормальные условия).
Относительная плотность — это отвлеченное число, показывающее, во сколько раз один газ тяжелее (или легче) другого (при одинаковых условиях).
Определить это можно, сравнивая вес 1 л одного газа (d1) и 1 л другого газа (d2), т. е. сравнивая абсолютные плотности этих газов.
Формула относительной плотности будет выглядеть как отношение абсолютной плотности одного газа к абсолютной плотности другого газа:
но так как
а
то
Фактически относительная плотность представляет собой отношение молекулярных весов двух газов. При обозначении относительной плотности справа внизу ставится химический знак того газа, с которым сравнивается молекулярный вес искомого газа. Например, если ставится dH, это значит, что данная относительная плотность показывает, во сколько раз молекулярный вес искомого газа больше молекулярного веса водорода. Если стоит dB, это значит, что молекулярный вес искомого газа сравнивается со средним молекулярным весом воздуха, который равен 29 у. е.
Исходя из формулы относительной плотности
можно определить любую из трех величин, если известны остальные. Например, можно найти молекулярный вес газа по формуле:
M1 = dотн. · М2
■ 17. Что такое абсолютная плотность? (См. Ответ)
18. Как можно определить молекулярный вес, пользуясь абсолютной плотностью?
19. Что такое относительная плотность?
20. Выведите формулу относительной плотности.
21. Как определить молекулярный вес газа, если известна его относительная плотность? (См. Ответ)
Расчеты с учетом понятий об абсолютной и относительной плотности газов. Нахождение молекулярного веса и формулы газа
Если известна абсолютная плотность газа, то по выведенной нами выше формуле абсолютной плотности можно легко найти его молекулярный вес.
Пример 1. Каков молекулярный вес газа, если его абсолютная плотность равна 3,21 г/л?
Дано:
dнорм. = 3,21 г/л
Найти:
М (у. е.) ?
Решение:
dнорм. = M : 22,4 ; M = dнорм. · 22,4
М = 3,21 · 22,4 = 71,9 г.
Здесь 71,9 — грамм-молекула газа в граммах, а 71,9 — молекулярный вес газа в углеродных единицах.
Ответ: молекулярный вес газа 71,9 у.е.
Если известно, что искомый газ представляет собой простое вещество, то легко узнать его формулу, так как известно, что большинство газов (кроме инертных) имеют молекулы, состоящие из двух атомов.
Пример 2. Какова формула газа, вес 1 л которого равен 1,25 г?
Дано:
dнорм. = 1,25 г/л
Найти:
М (г) ?
Решение:
Находим вес грамм-молекулы по формуле
М = dнорм. · 22,4 = 1,25 · 22,4 = 28 г.
Грамм-молекула газа — 28 г. Молекулярный вес 28 у.е. Поскольку молекула двухатомна, один атом весит 28 : 2 = 14 у.е. Если обратиться к таблице атомных весов, то можно убедиться, что 14 — это атомный вес азота. Следовательно, формула искомого газа N2.
Если газ представляет собой сложное вещество, то для нахождения его формулы нужно знать, помимо плотности, процентное содержание составляющих его элементов.
Пример 3. Определив формулу газа, если его абсолютная плотность равна 2,019 г/л, а процентный состав: С — 81,8% и Н — 18,1%.
Дано:
dнорм. = 2,019 г /л
С = 81,8%
Н = 18,1%
Найти:
М (г) ?
формула
Решение:
Сначала находим по известной нам формуле молекулярный вес газа: Молекулярный вес равен 45 у.е.
М = 22,4 · d = 22,4 · 2,019 = 45,2 г. Теперь определим, сколько углеродных единиц приходится на углерод. Для этого вес всей молекулы мы принимаем за 100% .
45 у. е. — 100%. х » —81,8%.
отсюда
45 : x = 100 : 81.8; x = (81,8 · 45) : 100 = 36 у.е.
Поскольку атомный вес углерода равен 12 у.е., можно высчитать, сколько в молекуле атомов углерода. 36 : 12 = 3 (атома).
Так же находим число атомов водорода:
45 у. е. — 100% х » -18,1%.
x = (45 · 18,1) : 100 = 8 у.е.
Зная,что атомный вес водорода 1 у. е., высчитываем число атомов водорода:
8 : 1 = 8 (атомов) Следовательно, формула газа С3Н8. Этот газ—органическое вещество — пропан.
Можно найти молекулярный вес, пользуясь и относительной плотностью.
Можно найти молекулярный вес, пользуясь и относительной плотностью.
Пример 4. Найти молекулярный вес газа, если его плотность по водороду равна 16.
Дано:
dH = 16
Найти:
М = ?
Решение:
М = dH · MH
Молекулярный вес Н2 равен 2 у.е.
М = 16 · 2 = 32 у. е.
Пример 5. Определите, во сколько раз хлор тяжелее воздуха.
Решение: молекулярный вес хлора равен 35,5 · 2 = 71. Средний молекулярный вес воздуха равен 29.
dотн. = MCl2 : MB = 71 : 29 = 2,4
Ответ: хлор тяжелее воздуха в 2,4 раза.
■ 22. Вычислите молекулярный вес газа, если вес газа равен 1,696 г. (См. Ответ)
23. Какова формула газа, если известно, что его абсолютная плотность 1,25 г/л, а состав следующий: углерода C ∼43%, кислорода 0 ∼ 57%.
24. Какова формула газа, если его плотность по водороду равна 15, а состав следующий: углерода 80%, водорода 20%.
25. Какие из перечисленных ниже газов тяжелее воздуха: сероводород H2S, фтор F2, двуокись углерода СO2, аммиак NH3, аргон Аr? (См. Ответ)
Статья на тему Грамм молекула газа
Выберите подписку для получения дополнительных возможностей Kalk.Pro
Любая активная подписка отключает
рекламу на сайте
-
-
Доступ к скрытым чертежам -
Безлимитные сохранения расчетов
-
Доступ к скрытым чертежам -
Безлимитные сохранения расчетов
-
-
-
Доступ к скрытым чертежам -
Безлимитные сохранения расчетов
-
Доступ к скрытым чертежам -
Безлимитные сохранения расчетов
-
Более 10 000 пользователей уже воспользовались расширенным доступом для успешного создания своего проекта. Подробные чертежи и смета проекта экономят до 70% времени на подготовку элементов конструкции, а также предотвращают лишний расход материалов.
Подробнее с подписками можно ознакомиться здесь.
Молярный объем газа

4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
Для того, чтобы узнать состав любых газообразных веществ необходимо уметь оперировать такими понятиями, как молярный объем, молярная масса и плотность вещества. В данной статье рассмотрим, что такое молярный объем, и как его вычислить?
Количество вещества
Количественные расчеты проводят с целью, чтобы в реальности осуществить тот или иной процесс или узнать состав и строение определенного вещества. Эти расчеты неудобно производить с абсолютными значениями массы атомов или молекул из-за того, что они очень малы. Относительные атомные массы также в большинстве случаев невозможно использовать, так как они не связаны с общепринятыми мерами массы или объема вещества. Поэтому введено понятие количество вещества, которое обозначается греческой буквой v (ню) или n. Количество вещества пропорционально числу содержащихся в веществе структурных единиц (молекул, атомных частиц).
Единицей количества вещества является моль.
моль – это такое количество вещества, которое содержит столько же структурных единиц, сколько атомов содержится в 12 г изотопа углерода.
Масса 1 атома равна 12 а. е. м., поэтому число атомов в 12 г изотопа углерода равно:
Na= 12г/12*1,66057*10в степени-24г=6,0221*10 в степени 23
Физическая величина Na называется постоянной Авогадро. Один моль любого вещества содержит 6,02*10 в степени 23 частиц.
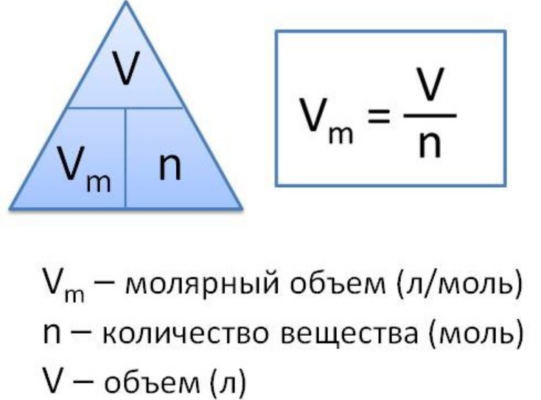
Молярный объем газа
Молярный объем газа – это отношение объема вещества к количеству этого вещества. Эту величину вычисляют при делении молярной массы вещества на его плотность по следующей формуле:
Vm=M/p,
где Vm – молярный объем, М – молярная масса, а p – плотность вещества.
В международной системе Си измерение молярного объема газообразных веществ осуществляется в кубических метрах на моль (м3 /моль)
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа. Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм3 /м.
Таблица «молярный объем газов»
В следующей таблице представлен объем некоторых газов:
| Газ | Молярный объем, л |
| H2 | 22,432 |
| O2 | 22,391 |
| Cl2 | 22,022 |
| CO2 | 22,263 |
| NH3 | 22,065 |
| SO2 | 21,888 |
| Идеальный | 22,41383 |
Что мы узнали?
Молярный объем газа, изучаемый по химии (8 класс) наряду с молярной массой и плотностью являются необходимыми величинами для определения состава того или иного химического вещества. Особенностью молярного газа является то, что в одном моле газа всегда содержится одинаковый объем. Этот объем называется молярным объемом газа.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Аэлита Коробка
5/5
-
Александр Котков
5/5
-
Настя Бабич
5/5
-
Александр Котков
5/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
А какая ваша оценка?
Известно, что масса углекислого газа (CO2) 35 грамм. Определите объём углекислого газа (CO2).
Решение задачи
Так как, углекислый газ (CO2) – газообразное вещество, то для нахождения объема углекислого газа (CO2) массой 35 г будем использовать формулу перерасчета, которая устанавливает связь между массой и объемом газа:
Откуда выразим объем произвольной массы газа:
Учитывая, что молярная масса углекислого газа (CO2) равна:
M (CO2) = 12 + 2 ∙ 16 = 44 (г/моль)
Рассчитаем объем углекислого газа (CO2):
Ответ:
объем углекислого газа равен 17,82 литра.