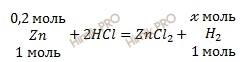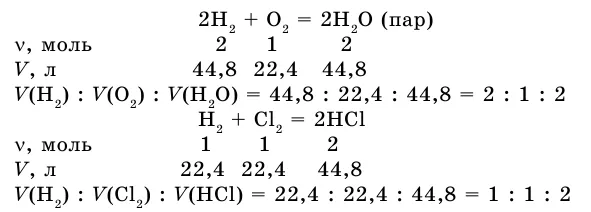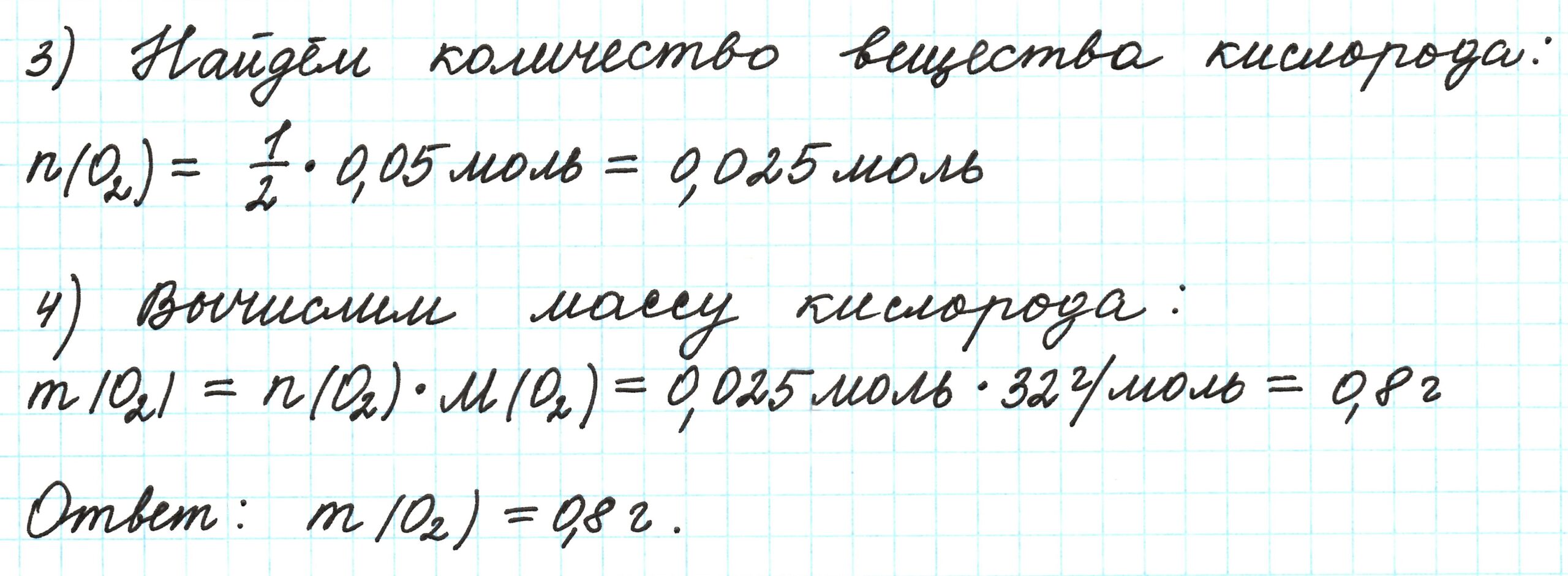Вычислить объем водорода
13,5 грамм цинка (Zn) взаимодействуют с соляной кислотой (HCl). Объемная доля выхода водорода (H2) составляет 85 % . Вычислить объем водорода, который выделился?
Решение задачи
Запишем уравнение реакции взаимодействия цинка (Zn) с соляной кислотой (HCl):
Напомню, что под выходом продукта реакции понимают отношение массы (объема, числа молей) практически полученного вещества к массе (объему, числу молей), теоретически рассчитанной по уравнению реакции.
Учитывая, что молярная масса цинка (Zn) равна 65 г/моль (смотри таблицу Менделеева), найдем химическое количество цинка (Zn) по формуле, устанавливающей связь между химическим количеством вещества и массой:
Получаем:
n (Zn) = 13,5 / 65 = 0,2 (моль).
Вычислить объем водорода. По уравнению реакции найдем химическое количество водорода (H2) (теоретический выход), который выделяется в ходе реакции:
1 моль Zn вытесняет 1 моль водорода (H2)
0,2 моль Zn вытесняет х моль водорода (H2)
Откуда:
По формуле, устанавливающей связь между химическим количеством вещества и объемом, вычислим объем водорода, который образуется в ходе реакции:
Получаем:
V теор.(H2) = 0,2 ∙ 22,4 = 4,48 (л).
Вычислим объем водорода практический по формуле:
Получаем:
V практ. (H2) = 85 ⋅ 4,48 / 100 = 3,81 (л).
Ответ:
объем водорода равен 3,81 литра.
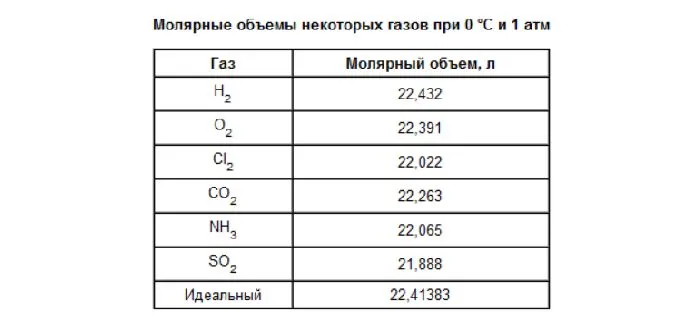
Таблица молярных объёмов химических элементов.
Молярный объём – отношение объёма вещества к его количеству при определенной температуре и давлении.
Молярный объём имеет обозначение Vm.
Молярный объём численно равен объёму одного моля вещества.
Молярный объём в Международной системе единиц (СИ) измеряется в кубических метрах на моль, русское обозначение: м3/моль; международное: m3/mol.
Термин «молярный объём» может быть применён к простым веществам, химическим соединениям и смесям.
Молярный объём зависит от температуры, давления и агрегатного состояния вещества.
Молярный объём вещества вычисляется по формуле:
Vm = V/n = M/ρ,
где
V – объем вещества,
n – количество вещества,
M – молярная масса,
ρ – плотность вещества.
Таблица молярных объёмов химических элементов (1 часть):
| Атомный номер | Химический элемент | Символ | Молярный объём, см3/моль |
| 1 | Водород | H | 11,21 |
| 2 | Гелий | He | 22,42354 |
| 3 | Литий | Li | 12,97383 |
| 4 | Бериллий | Be | 4,8767 |
| 5 | Бор | B | 4,3947 |
| 6 | Углерод | C | 5,314469 – графит,
3,42 – алмаз |
| 7 | Азот | N | 11,196 |
| 8 | Кислород | O | 11,196 |
| 9 | Фтор | F | 11,202 |
| 10 | Неон | Ne | 22,42 |
| 11 | Натрий | Na | 23,74976 |
| 12 | Магний | Mg | 13,984 |
| 13 | Алюминий | Al | 9,993 |
| 14 | Кремний | Si | 12,05386 |
| 15 | Фосфор | P | 16,99054 |
| 16 | Сера | S | 16,35969 |
| 17 | Хлор | Cl | 11,0308 |
| 18 | Аргон | Ar | 22,392 |
| 19 | Калий | K | 45,675584 |
| 20 | Кальций | Ca | 25,85677 |
| 21 | Скандий | Sc | 15,060606 |
| 22 | Титан | Ti | 10,62059 |
| 23 | Ванадий | V | 8,3373977 |
| 24 | Хром | Cr | 7,282 |
| 25 | Марганец | Mn | 7,35449 |
| 26 | Железо | Fe | 7,0923 |
| 27 | Кобальт | Co | 6,6217 |
| 28 | Никель | Ni | 6,58884 |
| 29 | Медь | Cu | 7,12399 |
| 30 | Цинк | Zn | 9,16092 |
Таблица молярных объёмов химических элементов (2 часть):
| 31 | Галлий | Ga | 11,80945 |
| 32 | Германий | Ge | 13,6464 |
| 33 | Мышьяк | As | 13,082 |
| 34 | Селен | Se | 16,3851 |
| 35 | Бром | Br | 25,610256 |
| 36 | Криптон | Kr | 22,34613 |
| 37 | Рубидий | Rb | 55,78838 |
| 38 | Стронций | Sr | 33,315589 |
| 39 | Иттрий | Y | 19,88 |
| 40 | Цирконий | Zr | 14,01075 |
| 41 | Ниобий | Nb | 10,84 |
| 42 | Молибден | Mo | 9,33 |
| 43 | Технеций | Tc | 8,5217 |
| 44 | Рутений | Ru | 8,17057 |
| 45 | Родий | Rh | 8,2655 |
| 46 | Палладий | Pd | 8,851 |
| 47 | Серебро | Ag | 10,282955 |
| 48 | Кадмий | Cd | 12,995 |
| 49 | Индий | In | 15,7 |
| 50 | Олово | Sn | 16,239398 |
| 51 | Сурьма | Sb | 18,181275 |
| 52 | Теллур | Te | 20,4487 |
| 53 | Йод | I | 25,689 |
| 54 | Ксенон | Xe | 22,253 |
| 55 | Цезий | Cs | 70,732 |
| 56 | Барий | Ba | 39,1245 |
| 57 | Лантан | La | 22,6 |
| 58 | Церий | Ce | 20,9472 |
| 59 | Празеодим | Pr | 21,221 |
| 60 | Неодим | Nd | 20,5763 |
Таблица молярных объёмов химических элементов (3 часть):
| 61 | Прометий | Pm | 19,961 |
| 62 | Самарий | Sm | 20,4487964 |
| 63 | Европий | Eu | 28,978642 |
| 64 | Гадолиний | Gd | 19,9 |
| 65 | Тербий | Tb | 19,3363 |
| 66 | Диспрозий | Dy | 19,0 |
| 67 | Гольмий | Ho | 18,7527 |
| 68 | Эрбий | Er | 18,449 |
| 69 | Тулий | Tm | 18,124 |
| 70 | Иттербий | Yb | 26,33789 |
| 71 | Лютеций | Lu | 17,77939 |
| 72 | Гафний | Hf | 13,41 |
| 73 | Тантал | Ta | 10,86774 |
| 74 | Вольфрам | W | 9,55 |
| 75 | Рений | Re | 8,858563 |
| 76 | Осмий | Os | 8,42 |
| 77 | Иридий | Ir | 8,52 |
| 78 | Платина | Pt | 9,249786 |
| 79 | Золото | Au | 10,2 |
| 80 | Ртуть | Hg | 14,821 |
| 81 | Таллий | Tl | 17,247535 |
| 82 | Свинец | Pb | 18,2716 |
| 83 | Висмут | Bi | 21,3681 |
| 84 | Полоний | Po | 22,727272 |
| 85 | Астат | At | 32,94 − предположительно |
| 86 | Радон | Rn | 22,816 |
| 87 | Франций | Fr | нет данных |
| 88 | Радий | Ra | 45,2 |
| 89 | Актиний | Ac | 22,5422 |
| 90 | Торий | Th | 19,791717 |
Таблица молярных объёмов химических элементов (4 часть):
| 91 | Протактиний | Pa | 15,03 |
| 92 | Уран | U | 12,4949559 |
| 93 | Нептуний | Np | 11,5892 |
| 94 | Плутоний | Pu | 12,313 |
| 95 | Америций | Am | 17,77615 |
| 96 | Кюрий | Cm | 18,28275 |
| 97 | Берклий | Bk | 16,71 |
| 98 | Калифорний | Cf | 16,62 |
| 99 | Эйнштейний | Es | нет данных |
| 100 | Фермий | Fm | нет данных |
| 101 | Менделевий | Md | нет данных |
| 102 | Нобелий | No | нет данных |
| 103 | Лоуренсий | Lr | нет данных |
| 104 | Резерфордий (Курчатовий) | Rf | нет данных |
| 105 | Дубний (Нильсборий) | Db | нет данных |
| 106 | Сиборгий | Sg | нет данных |
| 107 | Борий | Bh | нет данных |
| 108 | Хассий | Hs | нет данных |
| 109 | Мейтнерий | Mt | нет данных |
| 110 | Дармштадтий | Ds | нет данных |
Источник: https://www.schoolmykids.com
Коэффициент востребованности
3 834
Просмотров 3.3к. Опубликовано 28.06.2022
Единицей измерения молекулярной опухоли является л/моль, и эта величина постоянна при нормальных условиях, поэтому молекулярная опухоль составляет 22,4 л/моль.
Как найти объем в химии ℹ️
Вы знаете, что один и тот же химикат любого вещества содержит одинаковое количество структурных единиц. Однако у каждого вещества есть своя структурная единица массы. Поэтому масса одной и той же химической массы разных веществ также отличается.
Молекулярная масса — это масса той части вещества, которая приходится на один моль химической массы.
Молекулярная масса вещества X обозначается символом m(x). Она равна отношению массы конкретного вещества M(x) (г или кг) к химической массе N(x) (моль).
В Международной системе единиц молекулярный вес выражается в кг/моль. В химии чаще используется единица измерения Г/моль.
Определите молекулярную массу углерода. Масса углерода в одном моле стехиометрической массы составляет 0,012 кг или 12 г. Поэтому:.
Молекулярная масса любого вещества численно равна его относительной молекулярной массе, выраженной в Г/моль.
На рисунке 47 показан пример веществ (H2O, CACO3и Zn) с одинаковой химической массой — 1 моль. Как видите, массы различных веществ с одним молем химической массы различны.
Молекулярный вес является важной характеристикой всех индивидуальных веществ. Она отражает взаимосвязь между массой вещества и его химическим количеством. Знание одной из этих величин позволяет определить массу другой — химической — величины.
И наоборот, химическое количество по массе:.
А также количество структурных подразделений:.
Связь между свойствами этих трех веществ в их кумулятивном состоянии можно представить с помощью простой диаграммы.
Формула и алгоритм нахождения объёма
Сегодня мы изучаем важный навык в химии — как находить количество различных растворов и других веществ. Эти знания необходимы, потому что они помогут вам решить многие проблемы как в тетради, так и в жизни. Все, что вам нужно знать, — это состоявшийся человек.
Важно понимать, что тип опухоли, которую нужно найти, может варьироваться в зависимости от сущности, которую нужно найти, а точнее, от общего состояния этой сущности. Типы нахождения объемов газа и жидкости противоположны друг другу.
Точный и правильный вид для нахождения объема жидкости: C = n/v.
- C – молярная масса раствора (моль на литр).
- n – количество вещества (моль).
- V – объём вещества-жидкости (литры).
Используя другую задачу и другие данные, существует второй тип для нахождения объема жидкости: v = m/p.
- V – объём и измеряется он в миллилитрах.
- m – масса, измеряется в граммах.
- p – плотность, измеряется в граммах, делённых на миллилитры.
Если в дополнение к объему вам нужно найти массу, вы можете сделать это, зная тип и количество интересующего вас вещества. Используя тип вещества, найдите его молекулярную массу, сложив атомные массы всех элементов, входящих в его состав.
Например, возьмем M(AUSO2). В наших расчетах мы должны получить 197 + 32 + 16 * 2 = 261 г/моль. После этих вычислений находим массу по типу m = n*m: где
- m – масса.
- n – количество вещества, которое измеряется в молях (моль).
- M – молярная масса вещества: граммы, делённые на моль.
Количество вещества обычно указывается в задаче. Если нет, то это может быть опечатка или ошибка в задаче, и вместо того, чтобы пытаться самостоятельно вычислить несуществующую цену, следует обратиться за помощью и объяснениями к преподавателю. В этой статье приведены основные алгоритмы типов и разрешений.
Существует также тип для определения количества газа. Это: v= n*vm:.
- V – объём газа (литры).
- n – количество вещества (моль).
- Vm – молярный объём газа (литры/моль).
Однако существуют определенные исключения. Исключением является то, что при нормальных условиях, т.е. при определенном давлении и температуре, объем газа постоянен и составляет 22,3 л/моль.
Также возможен третий вариант. Если сама задача содержит уравнения реакций, то решение должно проходить по-другому. Из полученных уравнений вы можете найти количество каждого вещества, равное коэффициенту. Например, Ch4 + 2O2 = CO2+H2O. Из этого уравнения следует, что при взаимодействии 1 моль метана и 2 моль кислорода образуется 1 моль углерода и 1 моль воды. Учитывая, что речь идет о количестве вещества одного компонента, нетрудно найти количества всех остальных веществ. Если количество метана составляет 0,3 моль, то n(Ch4) = 0,6 моль, n(CO2) = 0,3 моль и n(H2O) = 0,3 моль.
б) Газовые законы объем газа
В дополнение к приведенным выше формулам, для решения задач вычислительной химии часто необходимо использовать газовые законы, известные из физики.
При постоянной температуре объем данного количества газа обратно пропорционален давлению, при котором он находится.
При постоянном давлении изменение объема газа прямо пропорционально температуре.
Комбинированный закон Бойля-Мариотта и Гей-Люссака для газов.
Кроме того, если известна масса или количество газа, его объем можно рассчитать по формуле Менделеева-Клапейрона
где n — число молекул вещества, m — масса (г), b — молекулярная масса газа (г/моль) и R — глобальная газовая постоянная, равная 8,31 Дж/(моль х К).
4. определение объема газа очень примитивно, если это газ при почти стандартных условиях. Помните, что один моль газа при этих условиях занимает 22,4 литра. Затем можно произвести расчеты, исходя из заданных условий.
Ключевые слова: решение задач на количество вещества, решение задач по химии на массу и объем, количество содержащегося вещества, количество содержащихся молекул, определение объема (v.o.), обнаружение массы, ее массовые частицы, масса определенных молекул, названия веществ, обнаружение массы молекул, определение абсолютной массы молекул, количество содержащихся атомов, относительная плотность. Определение.
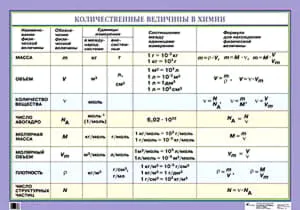
Количество вещества — это число строительных блоков (атомов, молекул, ионов), содержащихся в конкретном образце этого вещества. Единицей измерения количества вещества является моль. Количество вещества (n) связано с числом строительных блоков (N), массой (m) и объемом (V) (для газообразных веществ при температуре нулевой концентрации), содержащихся в образце вещества, следующей формулой
В котором.
Vm = 22,4 л/моль (мл/моль, м 3/кмоль) в н.у., Na = 6,02-10 23 (постоянная Авогадро) и молекулярная масса (М) численно равна относительной молекулярной массе вещества:.
Существование такой связи означает, что знание одной из величин (количества, массы, объема или числа структурных единиц вещества) позволяет определить все остальные величины.
РЕШЕНИЯ ПРОСТЫХ ЗАДАЧ
Вопрос 1: Сколько вещества содержится в 33 г оксида углерода (IV)?
Ответ: ν(CO2) = 0,75 моль.
Задача № 2. Сколько молекул содержится в 2,5 моль кислорода?
Ответ: n (O2) = 1,505-1024.
Внимание. В этом сборнике лекций вы будете решать задачи общей сложности. Решения сложных задач и задач с кратким ответом см. в конспекте лекций «Решение упражнений по количественным свойствам».
Задача №3. Определите объем (н.у.), занимаемый 0,25 моль водорода.
Задача № 4. Какова масса куска оксида серы (IV) в объеме 13,44 л (об.)?
Вопрос № 5. Если 3 моль кислорода O2Чтобы. Определите массу кислорода, его количество и число молекул кислорода.
Ответ: m = 96 g- v = 67. 2 l- n(o2) = 1.81-10 24.
Работа №6. масса водорода h2. Определите количество водорода, его количество se. Количество доступных молекул водорода.
Ответ: 5 моль-112 L- 3,01- 10 24.
Работа № 7. Пример количества хлора.2 Н.О.С. Найдите количество хлора, его массу и число молекул хлора.
Ответ: 2,5 моль- 177,5 г- 1,5- 10 24.
Работа № 8. 2.4-10 23. Есть молекулы монооксида углерода (IV) CO2. Определите количество углекислого газа, его массу и количество углекислого газа (Н.С.).
Ответ: 0,4 моль — 17,6 г — 8,96 л.
Вопрос нет. 9. какова масса участка оксида азота (IV), содержащего 4,816-10 23 точки? Каков его объем (Н.С.)?
Вопрос нет. 10. 1,806-10 Масса простого отрезка вещества, содержащего 24 точки, равна 6 г. Определите молекулярный вес вещества и назовите его.
Внимание. В данном пособии рассматриваются задачи нормальной сложности. Нажмите на кнопку ниже, чтобы перейти к решению задач на количество и краткому ответу …
Решайте задачи на количество, массу и объем. Выберите следующие шаги: 1.
4. определение объема газа очень примитивно, если это газ при почти стандартных условиях. Помните, что один моль газа при этих условиях занимает 22,4 литра. Затем можно произвести расчеты, исходя из заданных условий.
Молярный объем: общая информация
Чтобы рассчитать молекулярный вес химического вещества, молекулярный вес вещества делится на его плотность. Таким образом, молекулярный вес рассчитывается по следующему типу
где VM — молекулярный вес вещества, m — молекулярная масса, p — плотность. В международной системе СИ это количество измеряется в кубических метрах на моль (м 3 /моль).
Рисунок 1.Типы молекулярных опухолей.
Молекулярная масса газов отличается от молекулярной массы жидкостей и твердых тел тем, что один молярный элемент газа всегда занимает один и тот же объем (при соблюдении одинаковых параметров).
При расчете объема газа при нормальных условиях, так как объем газа зависит от температуры и давления. Нормальными условиями являются температура 0°C и давление 101 325 кПа.
Молекулярный объем одного моля газа при нормальных условиях всегда одинаков и равен 22,41 DM3 /моль. Этот объем называется молекулярным весом идеального газа. Это означает, что для одного моля газа (кислорода, водорода, воздуха) объем составляет 22,41 дм3 /м.
Молекулярная масса при нормальных условиях может быть получена с помощью законного уравнения для идеального газа, называемого уравнением Клайперона-Менделеева
Где r — глобальная постоянная газа, r = 8,314 дж/моль*k = 0,0821 л*атм/моль k
Объем молярного газа v = rt/p = 8,314*273,15/101,325 = 22,413 л/моль, где t и p — значения температуры (к) и давления при нормальных условиях.
Рисунок 2.Таблица молекулярных опухолей.
Закон Авогадро
В 1811 году А. Авогадро предположил, что равные объемы различных газов (температура и давление) содержат одинаковые молекулы. Впоследствии этот случай был подтвержден и стал законом, названным в честь великого итальянского ученого.
Рисунок 3: Амедео Авогадро.
Закон становится понятным, если вспомнить, что расстояние между частицами в виде газа несравненно больше, чем размер самих частиц.
Таким образом, из закона Авогадро можно сделать следующие выводы.
- В равных объёмах любых газов, взятых при одной и той же температуре и при одном и том же давлении, содержится одно и то же число молекул.
- 1 моль совершенно различных газов при одинаковых условиях занимает одинаковый объем.
- Один моль любого газа при нормальных условиях занимает объем 22,41 л.
Следствия закона Авогадро и понятие молекулярного объема основаны на том, что молекулы любого вещества содержат число частиц (в случае газов и молекул), равное постоянной Авогадро.
Чтобы найти количество молей растворенного вещества в литре раствора, необходимо определить молекулярную концентрацию вещества по формуле c = n / V Где n — количество растворенного вещества, выраженное в молях; V — объем раствора, выраженный в литрах C — молекулярный.
При расчетах газа часто необходимо преобразовать заданные условия в нормальные и наоборот. Таким образом, полезно использовать уравнения, полученные из законов газовой связи Бойля-Мариотта и Гей-Люссака.
Молярный объем
В этом видео учащиеся вспоминают основные формулы и физические величины, знакомятся с новыми понятиями молекулярного объема и учатся решать задачи на основе новых материалов. Это значительно облегчает изучение новых тем.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к видеоурокам этого и других наборов, необходимо приобрести их в каталоге и добавить в личный кабинет.
Конспект урока «Молярный объем»
Молекулярный объем — это объем одного моля вещества. Понятие молекулярного объема применимо к газам. Например, если взять 1 моль воды, то 18 г воды не взвешивают на весах, потому что это совершенно неудобно. Зная, что плотность воды составляет 1 г/мл, мы измеряем ее объем в цилиндре или мензурке.
В этом случае молекулярный объем воды составит 18 мл/моль. Молекулярный объем твердых тел и жидкостей зависит от их плотности. Вода, кислота, сахар и соль имеют разную плотность и, следовательно, разный молекулярный объем.
Если проглотить одну молекулу кислорода, одну молекулу углекислого газа и одну молекулу водорода, то при одинаковых нормальных условиях они занимают одинаковый объем, равный 22,4 л. Эти газы также содержат одинаковое число частиц, т.е. 6,02-1023. Нормальные условия или a.c. — это температура 0°C (градусов Цельсия) и давление 760 мм рт.ст. (миллиметров рт.ст.) или 101,3 кПа (килопаскалей).
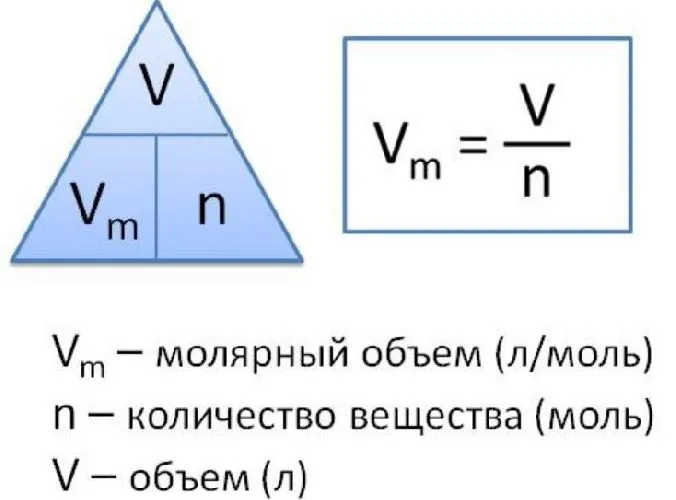
Таким образом, молекулярный объем — это объем одного моля газа. Как и другие объемы, он обозначается как молекулярный объем, но с символом V.m .
Молекулярный объем — это также физическая величина, равная отношению объема вещества к количеству вещества. Он может быть записан в следующих типах форматов
Vm =
V — объем газа, а n — количество вещества.
Из этого уравнения также можно найти V.
V = n-Vm
Единицей измерения молекулярной опухоли является л/моль, и эта величина постоянна при нормальных условиях, поэтому молекулярная опухоль составляет 22,4 л/моль.
Объем 1 кмоль называется объемным объемом и измеряется в м 3 / кмоль. То есть 22,4 м 3 / кмоль, а объем 1 ммоль называется объемным объемом и измеряется в мл / моль. Другими словами, объем составляет 22, 4 мл/моль.
Используйте новую формулу для решения задачи.
1. найдите объем азота (N2 ) объемом 2 моль.
Найдите объем азота (N2) в объеме 2 моль. По условию, дано 2 моль азота. Найдите объем азота. Чтобы решить эту задачу, используйте уравнение, чтобы найти объем газа относительно объема вещества. Другими словами, умножьте объем молекулы на объем вещества. Подставьте значение в формулу. То есть 22,4 литра на моль, умноженные на 2 моля, дают 44,8 литра. Таким образом, 2 моль азота занимают объем 44,8 л.
2. найти объем озона (O3 ) имеет объем 67,2 литра.
Согласно этой задаче, учитывая объем озона — 67,2 литра, необходимо найти количество вещества озона. Чтобы решить проблему, используйте тип. Объем делится на молекулярный вес, и значения в формуле обмениваются. Итак, разделив 67,2 литра на 22,4 литра на молекулу, получаем 3 молекулы. Таким образом, 3 моль озона занимают объем 67,2 л.
Таким образом, молекулярный объем — это объем одного моля газа. Как и другие объемы, он обозначается как молекулярный объем, но с символом V.m .
Закон объемных отношений
Если в результате реакции также образуется газ, напишите уравнение реакции между газами.
Соотношение объемов реактора и вещества: 2:1:2. Получим соотношение этих газовых опухолей при нормальных условиях.
Как видите, коэффициент газовой опухоли соответствует отношению предыдущего коэффициента типа вещества в уравнении.
В этой же ситуации объемы реакционных газов и газообразных продуктов реакции относятся друг к другу как небольшие целые числа. Это закон Гей-Лоссака о пропорциональности объемов.
Из изученных примеров можно сделать вывод, что при решении задачи удобно использовать коэффициенты, так как они указывают на количество вещества в уравнении химической реакции.
Согласно уравнению, определите количество кислорода, необходимое для окисления 60 л серы (IV) оксидом серы (VI).
- 1. Моль — мера количества вещества. В 1 моль любого вещества содержится число Авогадро структурных единиц (6,02-1023).
- 2. Молярная масса вещества (М) численно равна относительной молекулярной массе (Мг).
- 3. Расчеты по химическим уравнениям производятся на основе закона сохранения масс веществ.
- 4. В равных объемах газов, взятых при одинаковых условиях, содержится одинаковое число молекул. (Закон Авогадро.)
- 5. Относительной плотностью одного газа по отношению к другому газу (Dy(X)) называется отношение масс газов, взятых в равных объемах при одинаковых условиях.
- 6. Объемы реагирующих газообразных веществ относятся между собой и к объемам образующихся газообразных продуктов, как небольшие целые числа, равные коэффициентам в уравнении химической реакции. (Закон объемных отношений Гей-Люссака.)
- 7. При нормальных условиях (н. у.) любой газ занимает 22,4 л. Эта величина называется молярным объемом (У = 22,4 л/моль).
Услуги в области химии:.
Лекции по химии:.
Лекции по неорганической химии:.
Лекции по органической химии:.
Отправляйте задания в любое время дня и ночи
Официальный сайт Брилёновой Натальи Валерьевны, профессора факультета информатики Екатеринбургского государственного института.
Все права интеллектуальной собственности на загруженный материал сохраняются за бенефициарами этого материала. Коммерческое и/или иное использование запрещено за пределами материалов предварительного изучения NataliblileNova.ru. Публикация и распространение опубликованных материалов не предназначены для получения коммерческой и/или иной выгоды.
Этот сайт предназначен для облегчения образовательного пути студентов. Наталья Брилёнова не предлагает и не оказывает товары и услуги.
Обязательно ссылайтесь на сайт Natalibrilenova.ru в случае создания копий материалов.
РАСЧЕТЫ ПО ХИМИЧЕСКИМ УРАВНЕНИЯМ, или Как вычислить массу вещества (или объем газа) по известному количеству вещества одного из вступающих в реакцию или образующихся в результате нее веществ
Расчеты по химическим уравнениям являются одними из самых широко используемых в химии.
Это самый простой тип расчетных задач, в основе которых лежит химическое уравнение.
Содержание
Особенности задач с расчетами по химическим уравнениям
Основной алгоритм расчетов с использованием химических уравнений
Расчеты по химическим уравнениям: примеры
Особенности задач с расчетами по химическим уравнениям
В задачах с расчетами по химическим уравнениям речь идет о каком-либо химическом превращении (например, разложении) одного какого-то вещества или химическом взаимодействии двух или нескольких веществ. Причем:
- Масса или объем одного из них известны. Требуется найти массу или объем продукта реакции – вещества (или одного из веществ), образующегося в результате взаимодействия.
- Либо, наоборот, известны масса или объем образовавшегося вещества, требуется найти массу или объем исходного вещества.
- Либо известны масса или объем одного из реагентов, необходимо вычислить массу или объем второго реагента.
Прежде, чем приступить к вычислениям, важно составить уравнение реакции взаимодействия и правильно расставить коэффициенты.
Необходимо помнить, что коэффициенты, стоящие перед формулами веществ в уравнении реакции, показывают, в каких эквивалентных (достаточных, необходимых, пропорциональных) количествах реагируют вещества. Эти количества называют «количествами вещества по уравнению реакции» и записывают под формулами соответствующих веществ в уравнении.
Те количества вещества, которые находят, используя данные задачи, называют «количествами вещества по условию задачи» и в уравнение не записывают.
В ходе решения сравнивают «количества вещества по уравнению реакции» для того, чтобы узнать, в каком соотношении находятся вещества, о которых идет речь в задаче. Используя данные об этом соотношении, определяют «количества вещества по условию задачи». А затем, применяя основную расчетную формулу, вычисляют искомые массу или объем вещества.
Основной алгоритм расчетов с использованием химических уравнений
Основные шаги, которые необходимо сделать при решении задач с использованием химических уравнений, можно отобразить в виде схемы:
Расчеты по химическим уравнениям: примеры
Приведем несколько примеров с расчетами по химическим уравнениям.
Пример 1. В избытке воды растворили 11,5 г металлического натрия. Какой объем водорода выделился при этом?
- Так как в задаче говорится о химическом процессе: натрий реагирует с водой, — то запишем уравнение реакции.
- Над формулами веществ в уравнении реакции расставим данные условия задачи.
- Под формулами веществ в уравнении реакции расставим количества вещества (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярную массу натрия (смотрим по таблице Менделеева) и молярный объем для водорода (так как требуется найти объем этого газа, а не массу).
- В условии говорится, что натрий реагирует с избытком воды. Это означает только то, что её будет достаточно для взаимодействия с металлом.
Пример 2. Кальций массой 2 г прореагировал с кислородом. Какая масса кислорода вступила в реакцию?
- Так как в задаче говорится о химическом процессе: кальций реагирует с кислородом, — то запишем уравнение реакции.
- Над формулами веществ в уравнении реакции расставим данные условия задачи.
- Под формулами веществ в уравнении реакции расставим количества вещества (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярные массы (смотрим и считаем по таблице Менделеева).
Пример 3. Смесь, состоящую из 3 г магния и 3,9 г цинка, сплавили с серой, которая находилась в избытке. Рассчитайте массу полученной смеси сульфидов металлов.
- В составе смеси два металла: магний и цинк. Однако каждый из них прореагирует с серой самостоятельно. Поэтому запишем два уравнения реакции и решим фактически две задачи в одной.
- Над формулами веществ в уравнениях реакций расставим данные условия задачи.
- Под формулами веществ в уравнениях реакций расставим количества веществ (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярные массы (смотрим и считаем по таблице Менделеева).
- Поскольку требуется найти массу смеси образовавшихся сульфидов, то рассчитаем массу каждого из них из соответствующего уравнения. Укажем это в уравнениях над формулами сульфидов.
- Избыток серы говорит только о том, что ее будет достаточно для полного реагирования как магния, так и цинка.
Итак, при расчетах по химическим уравнениям важно правильно записать уравнение реакции и расставить коэффициенты.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Основные формулы для решения задач по химии
05-Авг-2012 | комментариев 450 | Лолита Окольнова
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов). Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Несколько миллионов. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества. Обозначается как M
Есть еще молекулярная масса — Mr
Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 гмоль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=mM
n=V22.4 (лмоль)
Масса вещества m (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (лмоль)
или вот еще удобная табличка:
Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
В ОГЭ и ЕГЭ по химии задач , в которых нужно было бы найти только объем массу кол-во моль нет — это обычно ЧАСТЬ решения задачи. Однако, чтобы легко решать более сложные задачи, нужно тренироваться на таких вот небольших упражнениях.
Находим количество вещества по массе
1 Какое количество вещества алюминия содержится в образце металла массой 10.8 г?2 Какое количество вещества содержится в оксиде серы (VI) массой 12 г?
3 Определите количество моль брома, содержащееся в массе 12.8 г.
Находим массу по количеству вещества:
4. Определите массу карбоната натрия количеством вещества 0.25 моль.Объем по количеству вещества:
5. Какой объем будет иметь азот при н.у., если его количество вещества 1.34 моль?6. Какой объем занимают при н.у. 2 моль любого газа?
Ответы:/p>
- 0.4 моль
- 0.15 моль
- 0.08 моль
- 26.5 г
- 30 л
- 44.8 л
Категории:
|
Обсуждение: “Основные формулы для решения задач по химии”
(Правила комментирования)