-
Молярная масса и молярный объем эквивалента.
Эквивалент,
как частица, может быть охарактеризован
молярной массой Мэ(В),
молярным объемом Vэ(В)
и определенным количеством вещества
nэ(В).
Количество
вещества эквивалента (nэ)
– это величина, пропорциональная
отношению числа эквивалентов вещества
(Nэ)
к числу Авогадро (NА),
равному 6,02∙1023
формульных единиц:
nэ
= Nэ/
NА
, [моль]
по
аналогии с количеством вещества:
n
= N/
NА,
[моль]
Так
как в одной формульной единице (атоме,
молекуле, радикале и т.д.) содержится
Z(В)
эквивалентов вещества, то число химических
эквивалентов вещества Nэ
равно произведению Z(В)
на Nф.е.,
Nэ
= Z(В)
∙ Nф.е
а,
соответственно,
nэ
= Z(В)
∙ n,
[моль]
Таким
образом, моль эквивалентов вещества –
это количество вещества, содержащего
6,02∙1023
эквивалентов.
Молярной
массой химического эквивалента вещества
(Мэ(В))
называется масса одного моль эквивалента
вещества В, равная отношению массы
вещества (m(В))
к количеству вещества химического
эквивалента (nэкв(В)),
выражаенная в г/моль или кг/моль:
Мэ(В)
= m(В)/
nэ(В)
Взаимосвязь
между
молярной
массой вещества М(В)
и молярной массой его эквивалента Мэ(В)
выражается соотношением:
Мэ(В)
= М(В) /
Z(В),
т.е.
молярная масса эквивалента вещества
всегда в Z
раз меньше молярной массы этого вещества.
Например,
Мэ(КОН)
= М(КОН) /
Z(КОН),
где Z(КОН)=ν(ОН–)=1,
следовательно, Мэ(КОН)
=56/1=56 г/моль.
Молярную
массу эквивалента сложного вещества
можно представить, как сумму молярных
масс эквивалентов образующих его
составных частей. Например, Мэ(оксида)
= Мэ(элемента)
+ Мэ(кислорода);
Мэ(кислоты)
= Мэ(Н+)
+ Мэ(кислотного
остатка);
Мэ(основания)
= Мэ(металла)
+ Мэ(ОН–);
Мэ(соли)
= Мэ(металла)
+ Мэ(кислотного
остатка).
Так,
молярная масса эквивалента основной
соли сульфата кальция равна: Мэ((CaOH)2SO4)
= Мэ((CaOH)+)
+ Мэ(SO42-)=
=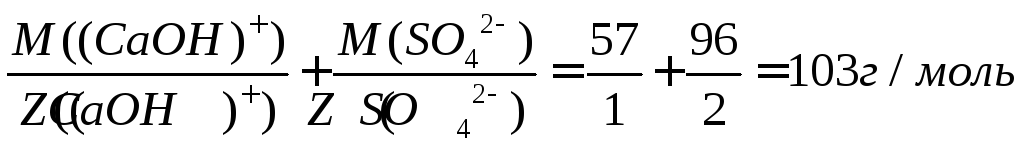
Молярным
объемом эквивалента газообразного
вещества
Vэ(В)
называется
объем одного
моль эквивалента газообразного вещества,
равный отношению
объема
данного газообразного вещества (Vгаз)
к количеству
вещества химического эквивалента
газообразного вещества:
Vэ(газа)
= Vгаз
/ nэ
, л/моль
Учитывая,
что для газов, принимаемых условно за
идеальные
n
= V
/ VМ,
где
VМ
= 22,414 л/моль
– объем одного моль любого газа при
нормальных условиях (н.у.)*, тогда
Vэ(газа)
= VМ/
Z(В)
= 22,414 / Z(В)
, л/моль.
Таким
образом, объем эквивалента
*
Нормальные условия (н.у.)
–
термодинамическая
температура
Т=273,15К, атмосферное давление р=1,01325∙105
Па (1 атм, 760 мм рт.ст.). Не
путать со
стандартными
условиями!
1.3. Закон эквивалентов.
Закон
эквивалентов, открытый в 1792 г. И.Рихтером
гласит: элементы
всегда взаимодействуют между собой в
определенных массовых количествах,
соответствующих их эквивалентам, или:
в реакциях всегда участвуют равные
количества вещества эквивалентов.
Например,
для реакции аА + вВ → сС + dD
будут справедливы равенства:
nэ(А)
= nэ(В)
= nэ(С)
= nэ(D)
или
![]()
Если
вещества А и В газообразные, то закон
эквивалентов принимает вид:
![]()
Закон
эквивалентов для реагирующих веществ,
находящихся в растворе:
сэ(А)∙Vр-ра(А)
= сэ(В)∙Vр-ра(В),
где
сэ(i)
=
![]() –
–
молярная концентрация эквивалентаi
вещества, равная отношению количества
вещества эквивалента nэ(i)
к объему раствора вещества Vp–pa(i).
Соседние файлы в предмете Химия
- #
- #
- #
- #
- #
- #
Эквивалент. Закон зквивалентов. Определение эквивалентной массы вещества
Определение объема водорода
Задача № 11.
Некоторое количество металла, эквивалентная масса которого равна 27,9 г/моль, вытесняет из кислоты 700 мл водорода, измеренного при нормальных условиях. Определить массу металла.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
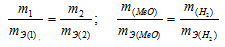
Та как водород находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м3). Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 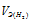 , молекула которого состоит из двух атомов, т. е. содержит два моля атомов водорода, равен 22,4/2 = 11,2 л/моль или 12000 мл/моль.
, молекула которого состоит из двух атомов, т. е. содержит два моля атомов водорода, равен 22,4/2 = 11,2 л/моль или 12000 мл/моль.
Тогда можно записать:
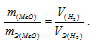
Отсюда:
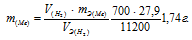
Ответ: 1,74г.
Определение эквивалентной массы вещества
Задача № 12.
1,60г кальция и 2,61г цинка вытесняют из кислоты одинаковые количества водорода. Вычислить эквивалентную массу цинка, зная, что эквивалентная масса кальция равна 20,0 г/моль.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
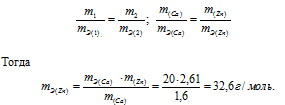
Ответ: 32,6г/моль.
Определение отношения масс реагирующих веществ
Задача № 13.
Серная и ортофосфорная кислоты имеют одинаковую молекулярную массу. Каково отношение масс этих кислот, пошедших на нейтрализацию одного и того же количества щелочи, если образовались соответственно сульфат и дигидроортофосфат?
Решение:
Формула сульфата имеет вид MeSO4, а дигидроортофосфата – MeH2PO4. Таким образом, на образование сульфата затрачивается две эквивалентные массы щёлочи, а на образование дигидроортофосфата – одна эквивалентная масса щёлочи. Так как H2SO4 с двумя эквивалентными массами щёлочи, то её эквивалентная масса в реакции нейтрализации равна М/2 г/моль, а фосфорная кислота реагирует с одной эквивалентной массой щёлочи, то её эквивалентная масса равна М/1г/моль. Отсюда, отношение мас этих кислот, с учётом, что их молекулярные массы равны будет иметь вид:
mH2SO4 : mH3PO4 = ½M : 1M = 1 : 2
Это можно подтвердить уравнениями реакций нейтрализации этих кислот с гидроксидом натрия:
H2SO4 +2NaOH = Na2SO4 + 2H2O;
H3PO4 + NaOH = NaH2PO4 +H2O.
Ответ: mH2SO4 : mH3PO4 = 1 : 2.
Задача № 14.
Медь образует два оксида. На определенное количество меди при образовании первого оксида пошло вдвое больше кислорода, чем при образовании второго. Каково отношение валентности меди в первом оксиде к ее валентности во втором?
Решение:
Согласно закону эквивалентов 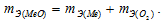 По условию задачи при образовании первого оксида ушло в два раза больше кислорода, чем при образовании второго, следовательно, эквивалентная масса меди в первом оксиде будет в два раза меньше, чем во втором. Валентность металла определяется из соотношения mэ =A/B, где mэ – эквивалентная масса металла; А – мольная масс металла; В – стехиометрическая валентность металла. Тогда B = A/mэ. Приняв, что А и mэ – постоянные величины, запишем соотношения валентностей для первого и второго оксидов:
По условию задачи при образовании первого оксида ушло в два раза больше кислорода, чем при образовании второго, следовательно, эквивалентная масса меди в первом оксиде будет в два раза меньше, чем во втором. Валентность металла определяется из соотношения mэ =A/B, где mэ – эквивалентная масса металла; А – мольная масс металла; В – стехиометрическая валентность металла. Тогда B = A/mэ. Приняв, что А и mэ – постоянные величины, запишем соотношения валентностей для первого и второго оксидов:
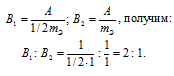
Таким образом, валентность меди в первом оксиде равна II, а во втором – I.
Ответ: 2 : 1.
Определение значения эквивалентной массы вещества
Задача № 15
При взаимодействии ортофосфорной кислоты со щелочью образовалась соль Na2HPO4. Найти для этого случая значение эквивалентной массы ортофосфорной кислоты.
Решение:
Уравнение реакции имеет вид:
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
Эквивалент (эквивалентная масса) кислоты равна мольной массе (М) делённой на число атомов водорода, замещённых в данной реакции на металл (на число вступающих в реакцию атомов водорода). Так как при взаимодействии ортофосфорной кислоты со щёлочью образовалась соль Na2HPO4, т.е. на натрий заместилось два атома водорода в кислоте H3PO4. Следовательно, эквивалентная масса ортофосфорной кислоты в реакции со щёлочью при образовании гидрофосфата натрия равна М/2 = М(H3PO4)/2 = 98/ 2 = 49г/моль.
Ответ: 49г/моль.
Задача № 16
На нейтрализацию 2,45г кислоты идет 2,00г гидроксида натрия. Определить эквивалентную массу кислоты.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
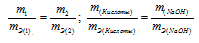
Эквивалентная масса гидроксида натрия равна М(NaOH)0/1 = 40г/моль.
Тогда
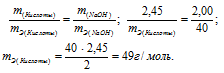
Ответ: 49г/моль.
Задача № 17
При взаимодействии 5,95г некоторого вещества с 2,75г хлороводорода получилось 4,40г соли. Вычислить эквивалентные массы вещества и образовавшейся соли.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
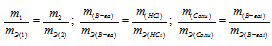
Эквивалентная масса хлороводорода равна М(HCl) = 36,5/1 = 36,5г/моль.
Тогда
а) Находим эквивалентную массу вещества:
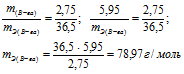
б) Находим эквивалентную массу соли:
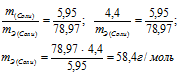
Ответ: а) 58,4г/моль; б) 78,97 г/моль.
Определение эквивалентного объема водорода
Задача № 18.
0,376г алюминия при взаимодействии с кислотой вытеснили 0,468л водорода, измеренного при нормальных условиях. Определить эквивалентный объем водорода, зная, что эквивалентная масса алюминия равна 8,99 г/моль.
Решение:
Если одно из веществ находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м3). Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
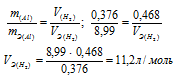
Ответ: 11,2л/моль.
Эквивалент – это реальная или условная
частица, которая в кислотно-основных реакциях присоединяет
(или отдает) один ион Н+ или ОН–, в
окислительно-восстановительных реакциях принимает (или отдает) один
электрон, реагирует с одним атомом водорода или с одним эквивалентом
другого вещества. Например, рассмотрим следующую
реакцию:
H3PO4 + 2KOH
®
K2HPO4 + 2H2O.
В
ходе этой реакции только два атома водорода замещаются на атомы
калия, иначе, в реакцию вступают два иона Н+ (кислота
проявляет основность 2). Тогда по определению эквивалентом
H3PO4
будет являться условная частица 1/2H3PO4,
т.к. если одна молекула H3PO4
предоставляет два иона Н+, то один ион Н+ дает
половина молекулы H3PO4.
С
другой стороны, на реакцию с одной молекулой ортофосфорной кислотой
щелочь отдает два иона ОН–, следовательно, один ион ОН–
потребуется на взаимодействие с 1/2 молекулы кислоты. Эквивалентом
кислоты является условная частица 1/2Н3РО4, а
эквивалентом щелочи частица КОН.
Число, показывающее, какая часть молекулы
или другой частицы вещества соответствует эквиваленту, называется
фактором эквивалентности (fЭ).
Фактор эквивалентности – это безразмерная величина, которая меньше,
либо равна 1. Формулы расчета фактора эквивалентности приведены в
таблице 1.1.
Таким образом, сочетая фактор эквивалентности и формульную единицу
вещества, можно составить формулу эквивалента какой-либо частицы,
где фактор эквивалентности записывается как химический коэффициент
перед формулой частицы:
fЭ
(формульная единица вещества)
º
эквивалент
В примере, рассмотренном выше, фактор эквивалентности для кислоты,
соответственно, равен 1/2, а для щелочи КОН равен 1.
Между H3PO4
и КОН также могут происходить и другие реакции. При этом кислота
будет иметь разные значения фактора эквивалентности:
H3PO4 + 3KOH
®
K3PO4 + 3H2O
fЭ(H3PO4)
= 1/3
H3PO4 + KOH
®
KН2PO4
+ H2O fЭ(H3PO4)
= 1.
Следует учитывать, что эквивалент одного
и того же вещества может меняться в зависимости от того, в какую
реакцию оно вступает. Эквивалент элемента также может быть
различным в зависимости от вида соединения, в состав которого он
входит. Эквивалентом может являться как сама молекула или
какая-либо другая формульная единица вещества, так и ее часть.
Таблица 1.1 –
Расчет фактора эквивалентности
|
Частица |
Фактор |
Примеры |
|
Элемент |
где В(Э) – |
|
|
Простое вещество |
где |
fЭ(H2)
fЭ(O2)
fЭ(Cl2)
fЭ(O3) |
|
Оксид |
где |
|
|
Кислота |
где |
fЭ(H2SO4) или
fЭ(H2SO4) (основность равна 2) |
|
Основание |
где |
fЭ(Cu(OH)2)
fЭ(Cu(OH)2)
|
|
Соль |
где |
|
|
Частица в |
где |
Fe2+
fЭ(Fe2+)
MnO4–
fЭ(MnO4–) |
|
Ион |
где |
fЭ(SO42–) |
Пример.
Определите фактор эквивалентности и эквивалент у солей: а)
ZnCl2, б) КНСО3, в)
(MgOH)2SO4.
Решение: Для расчетов воспользуемся формулами, приведенными в
таблице 1.1.
а)
ZnCl2 (средняя соль):
![]() .
.
fЭ(ZnCl2)
= 1/2, поэтому эквивалентом ZnCl2
является частица 1/2ZnCl2.
б) КНСО3
(кислая соль):
![]() .
.
fЭ(КНСО3) = 1,
поэтому эквивалентом КНСО3 является частица КНСО3.
в) (MgOH)2SO4
(основная соль):
![]() .
.
fЭ(
(MgOH)2SO4
) = 1/2, поэтому эквивалентом
(MgOH)2SO4
является частица 1/2(MgOH)2SO4.
Эквивалент, как частица, может быть охарактеризован молярной массой
(молярным объемом) и определенным
количеством вещества
nэ.
Молярная масса эквивалента (МЭ)
– это масса одного моль эквивалента. Она равна
произведению молярной массы вещества на фактор эквивалентности:
Молярная масса
эквивалента имеет размерность «г/моль».
Молярная масса эквивалента сложного
вещества равна сумме молярных масс эквивалентов образующих его
составных частей, например:
МЭ(оксида) = МЭ(элемента)
+ МЭ(О) = МЭ(элемента)
+ 8
МЭ(кислоты) = МЭ(Н)
+ МЭ(кислотного остатка) = 1 + МЭ(кислотного
остатка)
МЭ(основания) = МЭ(Ме)
+ МЭ(ОН) = МЭ(Ме) +
17
МЭ(соли) = МЭ(Ме)
+ МЭ(кислотного остатка).
Газообразные вещества помимо молярной массы эквивалента имеют
молярный объем эквивалента (![]()
или VЭ)
– объем, занимаемый молярной массой эквивалента или объем одного
моль эквивалента. Размерность «л/моль».
При н.у. получаем:
![]()
Закон
эквивалентов был открыт в 1792 г. И. Рихтером.
Современная формулировка закона:
вещества реагируют и образуются согласно их эквивалентам.
Все вещества в уравнении реакции связаны законом эквивалентов,
поэтому:
nэ(реагента1)
= … = nэ(реагентаn)
=
nэ(продукта1)
= … =
nэ(продуктаn)
Из закона эквивалентов следует, что массы (или объемы)
реагирующих и образующихся веществ пропорциональны молярным массам
(молярным объемам) их эквивалентов. Для любых двух веществ,
связанных законом эквивалентов, можно записать:
где m1 и
m2 – массы реагентов и
(или) продуктов реакции, г;
![]() ,
, ![]() –
–
молярные массы эквивалентов реагентов и (или) продуктов реакции,
г/моль;
V1, V2
– объемы реагентов и (или) продуктов реакции, л;
![]() ,
,![]() –
–
молярные объемы эквивалентов реагентов и (или) продуктов реакции,
л/моль.
Л.А. Яковишин
