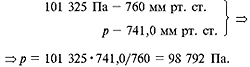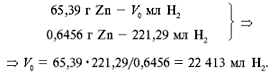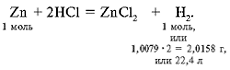Как вычислить объем газа
Газ, как и вещества, находящиеся в других агрегатных состояниях, имеет ряд параметров, в число которых входит и объем. Объем газа находится на основании других его характеристик, которые приведены в условии задачи. Любой газ, независимо от вида и состава, имеет объем, который и требуется найти во многих задачах.
Инструкция
Газ, независимо от его состава, имеет три основных параметра: массу, объем и плотность. В большинстве задач оперируют так называемым идеальным газом, поэтому опираться в них необходимо лишь на приведенные в условии значения массы, давления, температуры. Например, в условии задачи может быть указан газ азот N2 с температурой в 60 градусов, давлением в 30 кПа и массой в 0,05 г. Зная эти три параметра и состав газа, по уравнению Менделеева-Клапейрона можно найти его объем. Для этого необходимо переделать данное уравнение следующим образом:
pV=mRT/M.
Осуществив дальнейшее преобразование формулы, найдите объем азота:
V =mRT/pM.
При этом молярную массу M можно найти по таблице Д.И. Менделеева. У азота она равна 12 г/моль. Тогда:
V=0,05*12*8,31*333/30*12≈4,61.
Если известны объем при нормальных условиях, а объем при других условиях является искомым, примените законы Бойля-Мариотта и Гей-Люссака:
pV/T=pнVн/Tн.
В таком случае преобразуйте формулу следующим образом:
pV*Tн=pнVн*T.
Отсюда объем V равен:
V=pнVн*T/p*Tн.
Индекс н означает величину того или иного параметра при нормальных условиях.
Если рассматривать объем газа с точки зрения термодинамики, можно заметить, что на газы могут действовать силы, за счет которых меняется объем. При этом давление газа постоянно, что характерно для изобарных процессов. В ходе таких процессов объем изменяется с одной величины на другую. Их можно обозначить как V1 и V2. В условиях ряда задач описывается некоторый газ, находящийся под поршнем в сосуде. При расширении этого газа поршень передвигается на некоторое расстояние dl, в результате чего осуществляется работа:
A=pdV=p(V2 -V1).
Эта формула связывает изменение объема газа и работу. Как известно, если дан конечный объем V2, то можно найти начальный объем V1:
V1=pV2-A/p.
Наконец, наиболее просто найти объем газа, исходя из двух других физических параметров – массы и плотности. Если в условиях задан газ с некоторой плотностью и массой, то его объем следует вычислять по формуле:
V=m/ρ.
У каждого газа имеется определенная плотность, как и у любого твердого или жидкого вещества. Поэтому, находя объем газа, в первую очередь необходимо учитывать именно этот параметр.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,660 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,971 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Уравнение состояния идеального газа – основные понятия, формулы и определение с примерами
Содержание:
Уравнение состояния идеального газа:
Уравнения Клапейрона и Менделеева — клапейрона; законы Шарля, Гей-Люссака, Бойля — Мариотта, Авогадро, Дальтона, — пожалуй, такого количества «именных» законов нет ни в одном разделе физики. за каждым из них — кропотливая работа в лабораториях, тщательные измерения, длительные аналитические размышления и точные расчеты. нам намного проще. Мы уже знаем основные положения теории, и «открыть» все вышеупомянутые законы нам не составит труда.
Уравнение состояния идеального газа
Давление газа полностью определяется его температурой и концентрацией молекул: p=nkT. Запишем данное уравнение в виде: pV = NkT. Если состав и масса газа известны, число молекул газа можно найти из соотношения
Произведение числа Авогадро 


Обратите внимание! Состояние данного газа некоторой массы однозначно определяется двумя его макроскопическими параметрами; третий параметр можно найти из уравнения Менделеева — Клапейрона.
Уравнение Клапейрона
С помощью уравнения Менделеева — Клапейрона можно установить связь между макроскопическими параметрами газа при его переходе из одного состояния в другое. Пусть газ, имеющий массу m и молярную массу М, переходит из состояния (

Для каждого состояния запишем уравнение Менделеева — Клапейрона: 



Для данного газа некоторой массы отношение произведения давления на объем к температуре газа является неизменным.
Изопроцессы
Процесс, при котором один из макроскопических параметров данного газа некоторой массы остается неизменным, называют изопроцессом. Поскольку состояние газа характеризуется тремя макроскопическими параметрами, возможных изопроцессов тоже три: происходящий при неизменной температуре; происходящий при неизменном давлении; происходящий при неизменном объеме. Рассмотрим их.
Какой процесс называют изотермическим. Закон Бойля — Мариотта
Пузырек воздуха, поднимаясь со дна глубокого водоема, может увеличиться в объеме в несколько раз, при этом давление внутри пузырька падает, поскольку вследствие дополнительного гидростатического давления воды (
Рис. 30.2. Изотермическое сжатие газа. Если медленно опускать поршень, температура газа под поршнем будет оставаться неизменной и равной температуре окружающей среды. Давление газа при этом будет увеличиваться
Изотермический процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменной температуре.
Пусть некий газ переходит из состояния (



Закон Бойля — Мариотта:
Для данного газа некоторой массы произведение давления газа на его объем остается постоянным, если температура газа не изменяется:
Графики изотермических процессов называют изотермами. Как следует из закона Бойля — Мариотта, при неизменной температуре давление газа данной массы обратно пропорционально его объему: 
Какой процесс называют изобарным. Закон Гей-Люссака
Изобарный процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменном давлении.
Пусть некий газ переходит из состояния (


Рис. 30.4. Изобарное расширение газа. Если газ находится под тяжелым поршнем массой M и площадью S, который может перемещаться практически без трения, то при увеличении температуры объем газа будет увеличиваться, а давление газа будет оставаться неизменным и равным p
Закон Гей-Люссака
Для данного газа некоторой массы отношение объема газа к температуре остается постоянным, если давление газа не изменяется:
Графики изобарных процессов называют изобарами. Как следует из закона Гей-Люссака, при неизменном давлении объем газа данной массы прямо пропорционален его температуре: V = const⋅T. График данной зависимости — прямая, проходящая через начало координат (рис. 30.5, а). По графику видно, что с приближением к абсолютному нулю объем идеального газа должен уменьшиться до нуля. Понятно, что это невозможно, поскольку реальные газы при низких температурах превращаются в жидкости. В координатах p, V и p, T изобары перпендикулярны оси давления (рис. 30.5, б, в).
Изохорный процесс. Закон Шарля
Если газовый баллон сильно нагреется на солнце, давление в нем повысится настолько, что баллон может взорваться. В данном случае имеем дело с изохорным нагреванием.
Изохорный процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменном объеме.
Пусть некий газ переходит из состояния () в состояние (), то есть объем газа не изменяется (рис. 30.6). В этом случае имеет место равенство . После сокращения на V получим:
Рис. 30.6. Изохорное нагревание газа. Если газ находится в цилиндре под закрепленным поршнем, то с увеличением температуры давление газа тоже будет увеличиваться. Опыт показывает, что в любой момент времени отношение давления газа к его температуре неизменно:
Закон Шарля
Для данного газа некоторой массы отношение давления газа к его температуре остается постоянным, если объем газа не изменяется:
Графики изохорных процессов называют изохорами. Из закона Шарля следует, что при неизменном объеме давление газа данной массы прямо пропорционально его температуре: p T = ⋅ const . График этой зависимости — прямая, проходящая через начало координат (рис. 30.7, а). В координатах p, V и V, T изохоры перпендикулярны оси объема (рис. 30.7, б, в).
Пример №1
В вертикальной цилиндрической емкости под легкоподвижным поршнем находится 2 моль гелия и 1 моль молекулярного водорода. Температуру смеси увеличили в 2 раза, и весь водород распался на атомы. Во сколько раз увеличился объем смеси газов?
Анализ физической проблемы. Смесь газов находится под легкоподвижным поршнем, поэтому давление смеси не изменяется:, но использовать закон Бойля — Мариотта нельзя, так как вследствие диссоциации (распада) молярная масса и число молей водорода увеличились в 2 раза:
Решение:
Воспользуемся уравнением состояния идеального газа: pV = νRT. Запишем это уравнение для состояний смеси газов до и после распада: Разделив уравнение (2) на уравнение (1) и учитывая, что получим: где Найдем значение искомой величины:
Ответ: примерно в 2,7 раза.
Пример №2
На рис. 1 представлен график изменения состояния идеального газа неизменной массы в координатах V, T. Представьте график данного процесса в координатах p, V и p, T.
Решение:
1. Выясним, какой изопроцесс соответствует каждому участку графика (рис. 1).
Зная законы, которым подчиняются эти изопроцессы, определим, как изменяются макроскопические параметры газа. Участок 1–2: изотермическое расширение; T = const, V ↑, следовательно, по закону Бойля — Мариотта p ↓. Участок 2–3: изохорное нагревание; V = const, T ↑, следовательно, по закону Шарля p ↑ . Участок 3–1: изобарное охлаждение; p = const , T ↓, следовательно, по закону Гей-Люссака V ↓ .
2. Учитывая, что точки 1 и 2 лежат на одной изотерме, точки 1 и 3 — на одной изобаре, а точки 2 и 3 на одной изохоре, и используя результаты анализа, построим график процесса в координатах p, V и p, T (рис. 2)
- Из соотношения p=nkT можно получить ряд важных законов, большинство из которых установлены экспериментально.
- Уравнение состояния идеального газа (уравнение Менделеева — Клапейрона): — универсальная газовая постоянная.
- Уравнение Клапейрона:
- Законы, которым подчиняются изопроцессы, то есть процессы, при которых один из макроскопических параметров данного газа некоторой массы остается неизменным:
| Рекомендую подробно изучить предметы: |
|
| Ещё лекции с примерами решения и объяснением: |
- Температура в физике
- Парообразование и конденсация
- Тепловое равновесие в физике
- Изопроцессы в физике
- Абсолютно упругие и неупругие столкновения тел
- Механизмы, работающие на основе правила моментов
- Идеальный газ в физике
- Уравнение МКТ идеального газа
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Уравнение состояния идеального газа
теория по физике 🧲 молекулярная физика, МКТ, газовые законы
Уравнение состояния идеального газа было открыто экспериментально. Оно носит название уравнения Клапейрона — Менделеева. Это уравнение устанавливает математическую зависимость между параметрами идеального газа, находящегося в одном состоянии. Математически его можно записать следующими способами:
Уравнение состояния идеального газа
Внимание! При решении задач важно все единицы измерения переводить в СИ.
Пример №1. Кислород находится в сосуде вместимостью 0,4 м 3 под давлением 8,3∙10 5 Па и при температуре 320 К. Чему равна масса кислорода? Молярная масса кислорода равна 0,032 кг/моль.
Из основного уравнения состояния идеального газа выразим массу:
Уравнение состояния идеального газа следует использовать, если газ переходит из одного состояния в другое и при этом изменяется его масса (количество вещества, число молекул) или молярная масса. В этом случае необходимо составить уравнение Клапейрона — Менделеева отдельно для каждого состояния. Решая систему уравнений, легко найти недостающий параметр.
Подсказки к задачам
Важна только та масса, что осталась в сосуде. Поэтому:
| Давление возросло на 15% | p2 = 1,15p1 |
| Объем увеличился на 2% | V2 = 1,02V1 |
| Масса увеличилась в 3 раза | m2 = 3m1 |
| Газ нагрелся до 25 о С | T2 = 25 + 273 = 298 (К) |
| Температура уменьшилась на 15 К (15 о С) | T2 = T1 – 15 |
| Температура уменьшилась в 2 раза | |
| Масса уменьшилась на 20% | m2 = 0,8m1 |
| Выпущено 0,7 начальной массы | |
| Какую массу следует удалить из баллона? | Нужно найти разность начальной и конечной массы: |
| Газ потерял половину молекул | |
| Молекулы двухатомного газа (например, водорода), диссоциируют на атомы | |
| Озон (трехатомный кислород) при нагревании превращается в кислород (двухатомный газ) | M (O3) = 3Ar (O)∙10 –3 кг/моль M (O2) = 2Ar (O)∙10 –3 кг/моль |
| Открытый сосуд | Объем V и атмосферное давление pатм остаются постоянными |
| Закрытый сосуд | Масса m, молярная масса M, количество вещества ν, объем V, число N и концентрация n частиц, плотность ρ— постоянные величины |
| Нормальные условия | Температура T0 = 273 К Давление p0 = 10 5 Па |
| Единицы измерения давления | 1 атм = 10 5 Па |
Пример №2. В баллоне содержится газ под давлением 2,8 МПа при температуре 280 К. Удалив половину молекул, баллон перенесли в помещение с другой температурой. Определите конечную температуру газа, если давление уменьшилось до 1,5 МПа.
2,8 МПа = 2,8∙10 6 Па
1,5 МПа = 1,5∙10 6 Па
Так как половина молекул была выпущена, m2 = 0,5m1. Объем остается постоянным, как и молярная масса. Учитывая это, запишем уравнение состояния идеального газа для начального и конечного случая:
Преобразим уравнения и получим:
Приравняем правые части и выразим искомую величину:
На графике представлена зависимость объёма постоянного количества молей одноатомного идеального газа от средней кинетической энергии теплового движения молекул газа. Опишите, как изменяются температура и давление газа в процессах 1−2 и 2−3. Укажите, какие закономерности Вы использовали для объяснения.
Алгоритм решения
Решение
График построен в координатах (V;Ek). Процесс 1–2 представляет собой прямую линию, исходящую из начала координат. Это значит, что при увеличении объема растет средняя кинетическая энергия молекул. Но из основного уравнения МКТ идеального газа следует, что мерой кинетической энергии молекул является температура:
Следовательно, когда кинетическая энергия молекул растет, температура тоже растет.
Запишем уравнение Менделеева — Клапейрона:
Так как количество вещества одинаковое для обоих состояния 1 и 2, запишем:
ν R = p 1 V 1 T 1 . . = p 2 V 2 T 2 . .
Мы уже выяснили, что объем и температура увеличиваются пропорционально. Следовательно, давление в состояниях 1 и 2 равны. Поэтому процесс 1–2 является изобарным, давление во время него не меняется.
Процесс 2–3 имеет график в виде прямой линии, перпендикулярной кинетической энергии. Так как температуры прямо пропорциональна кинетической энергии, она остается постоянной вместе с этой энергией. Следовательно, процесс 2–3 является изотермическим, температура во время него не меняется. Мы видим, что объем при этом процессе уменьшается. Но так как объем и давление — обратно пропорциональные величины, то давление на участке 2–3 увеличивается.
pазбирался: Алиса Никитина | обсудить разбор | оценить
На высоте 200 км давление воздуха составляет примерно 10 –9 от нормального атмосферного давления, а температура воздуха Т – примерно 1200 К. Оцените плотность воздуха на этой высоте.
Уравнение состояния идеального газа
Содержание:
Уравнение состояния идеального газа получило название «уравнение Менделеева-Клапейрона». Давление смеси химически невзаимодействующих газов равно сумме их парциальных давлений: закон Дальтона.
На странице -> решение задач по физике собраны решения задач и заданий с решёнными примерами по всем темам физики.
Уравнение состояния идеального газа
Уравнение состояния идеального газа – это p = nkT называется уравнением Менделеева Клапейрона и оно даёт взаимосвязь трёх важнейших макроскопических параметров, описывающих состояние идеального газа давления, объёма и температуры. Поэтому уравнение Менделеева Клапейрона называется ещё уравнением состояния идеального газа.
Термодинамические параметры газа
В предыдущих главах было показано, что при описании свойств газа можно пользоваться величинами, характеризующими молекулярный мир (микромир), например энергией молекулы, скоростью ее движения, массой и т. п. Числовые значения таких величин мы можем определять только с помощью расчета. Все такие величины принято называть микроскопическими (от греческого «микрос» — малый).
Однако для описания свойств газов можно пользоваться и такими величинами, числовые значения которых находят простым измерением с помощью приборов, например давлением, температурой и объемом газа. Значения таких величин определяются совместным действием огромного числа молекул, поэтому они называются макроскопическими (от греческого «макрос» — большой).
Соотношение (4.1): устанавливает связь между микроскопическими и макроскопическими величинами для газов. Поэтому формулу (4.1) называют основным уравнением молекулярно-кинетической теории газов. Макроскопические величины, однозначно характеризующие состояние газа, называют термодинамическими параметрами газа. Важнейшими термодинамическими параметрами газа являются его объем V, давление р и температура Т.
Если взять определенную массу газа т, то при постоянных р, V и Т газ будет находиться в равновесном состоянии. Когда происходят изменения этих параметров, то в газе протекает тот или иной процесс. Если этот процесс состоит из ряда непрерывно следующих друг за другом равновесных состояний газа, то он называется равновесным процессом. Равновесный процесс должен протекать достаточно медленно, так как при быстром изменении параметров давление и температура не могут иметь соответственно одинаковые значения во всем объеме газа. В этой главе рассматриваются только равновесные процессы в газах, при которых масса газа остается постоянной.
Когда процесс в газе заканчивается, то газ переходит в новое состояние, а его параметры приобретают новые постоянные числовые значения, вообще говоря, отличные от их значений в начале процесса. Если же при постоянной массе газа значения всех его параметров в начале и в конце процесса окажутся одинаковыми, то процесс называется круговым или замкнутым.
Соотношение между значениями тех или иных параметров в начале и конце процесса называется газовым законом. Газовый закон, выражающий связь между всеми тремя параметрами газа, называется объединенным газовым законом.
Отметим еще, что такого процесса в газе, при котором изменялся бы только один параметр газа, не существует, так как значения этих параметров взаимосвязаны. Примером сказанного является закон Шарля, выражающий связь между р и Т.
Объединенный газовый закон. Приведение объема газа к нормальным условиям
Связь между давлением, объемом и температурой определенной массы газа устанавливается с помощью соотношения (4.9):
Поскольку обозначает число молекул в единице объема газа, то , где N — общее число молекул, V — объем газа. Тогда получим
Так как при постоянной массе газа N остается неизменным, — постоянное число, т. е.
Поскольку значения р, V и Т в (5.2) относятся к одному и тому же состоянию газа, можно следующим образом сформулировать объединенный газовый закон: при постоянной массе газа произведение объема на давление, деленное на абсолютную температуру газа, есть величина одинаковая для всех состояний этой массы газа.
Следовательно, если числовые значения параметров в начале процесса, происходящего с какой-либо определенной массой газа, обозначить через р1 , V1 и Т1, а их значения в конце процесса соответственно через р2 , V2 и Т2, то
Формулы (5.2) и (5.3) представляют собой математическое выражение объединенного газового закона.
На практике иногда нужно установить, какой объем V0 займет имеющаяся масса газа при нормальных условиях, т. е. при Т0=273 К и при р0=1,013 . 10 5 Па. Если значения параметров для этой массы газа в каком-либо произвольном состоянии, отличном от нормального, обозначить через р, V и Т, то на основании (5.3) получаем , или
Формула (5.4) позволяет приводить объем заданной массы газа к нормальным условиям.
Молярная газовая постоянная. Определение числового значения постоянной Больцмана
Формула (5.1) справедлива для любой массы газа, в которой содержится N молекул. Если применить эту формулу к одному молю какого-либо газа, то N нужно заменить постоянной Авогадро NA, а V — объемом одного моля Vмоль
Так как в одном моле любого газа содержится одно и то же число молекул NA, то произведение имеет одинаковое значение для всех газов, т. е. не зависит от природы газа. Произведение обозначается R и называется молярной газовой постоянной. Таким образом,
Числовое значение R можно найти, если применить (5.5) к состоянию одного моля газа при нормальных условиях, так как при этом м 3 /моль (§ 3.6). Действительно,
Это числовое значение R в СИ необходимо запомнить, так как им часто пользуются при расчетах и при решении задач.
Теперь легко найти числовое значение постоянной Больнмана . Из (5.6) получаем . Подставляя сюда числовые значения R и , вычисляем :
Уравнение Клапейрона — Менделеева. Плотность газа
Выясним, как будет выглядеть соотношение (5.1), если в него ввести молярную газовую постоянную R. Так как N — полное число молекул в массе газа т, а — число молекул в одном моле, то
где — число молей в массе газа /т. Поэтому
Поскольку , а равно массе газа т, деленной на массу одного моля газа , то получаем
Соотношение (5.7) называется уравнением Клапейрона — Менделеева или уравнением состояния для произвольной массы идеального газа. Для одного моля идеального газа уравнение Клапейрона — Менделеева принимает вид
С помощью формулы (5.7) легко выяснить, какими величинами определяется плотность газа. Так как , то из (5.7) имеем
Зависимость средней квадратичной скорости молекул газа от температуры
Выясним теперь, как можно с помощью вычислений находить среднюю квадратичную скорость движения молекул газа . Поскольку средняя кинетическая энергия поступательного движения молекул газа равна (3/2) , то можно написать , откуда
Отметим, что под т в формуле (5.10) подразумевается масса одной молекулы в кг. Так как , получим . Поскольку а есть масса одного моля газа (§ 3.6), имеем
Наконец, из (5.9) следует, что , поэтому
Среднюю квадратичную скорость можно находить по любой из формул (5.10)—(5.12). Из функции Максвелла можно получить формулы для средней арифметической скорости и наивероятнейшей скорости. Средняя арифметическая скорость
Наконец, наивероятнейшую скорость вычисляют так:
(Используя график функции Максвелла (рис. 3.3), поясните, почему меньше , а меньше
Изохорический процесс
Процессы, при которых масса газа и один из его параметров остаются постоянными, называются изопроцессами (от греческого «изос» — равный, одинаковый). Поскольку имеется три параметра газа, существует три различных изопроцесса. Первый из них (изохорический) рассмотрен выше (§ 4.3). Процесс в газе, который происходит при постоянной массе и неизменном объеме, называется изохорическим (от греческого «хора» — пространство). Графики для этого процесса называются изохорами (рис. 4.3).
Отметим, что к любому изопроцессу применим объединенный газовый закон и формулы (5.3), (5.7) и (5.8) с учетом того, что один из параметров остается постоянным. При изохорическом процессе постоянным остается объем V, поэтому формула (5.3) после сокращения на V принимает вид
Итак, изохорический процесс подчиняется закону Шарля: при постоянной-массе газа и неизменном объеме давление газа прямо пропорционально его абсолютной температуре. Это видно и из уравнения Клапейрона — Менделеева (5.7):
Так как V, т, и R остаются постоянными, то из (5.7) следует, что р пропорционально Т. Отметим, что закон Шарля можно формулировать и так, как это было сделано в § 4.3.
Изобарический- процесс
Процесс в газе, который происходит при постоянной массе и неизменном давлении, называется изобарическим (от греческого «барос» — тяжесть). Этот процесс был изучен французским физиком Л. Гей-Люссаком в 1802 г.
Поскольку при изобарическом процессе р постоянно, то после сокращения на р формула (5.3) принимает вид
Формула (5.16) является математическим выражением закона Гей-Люссака: при постоянной массе газа и неизменном давлении объем газа прямо пропорционален его абсолютной температуре. (Это видно и из уравнения Клапейрона — Менделеева (5.7): так как р, т, и R постоянны, то объем V пропорционален Т.)
На рис. 5.1 схематически изображен опыт Гей-Люссака. Колба с газом помещается в сосуд с водой и льдом.
В пробку вставлена трубка, изогнутая таким образом, что свободный конец ее горизонтален. Газ в колбе отделен от окружающего воздуха небольшим столбиком ртути в трубке. Температуру газа определяют по термометру, а объем — по положению столбика ртути. Для этого на трубке нанесены деления, соответствующие определенному внутреннему объему трубки (при градуировке трубки можно учесть и расширение сосуда при нагревании, но оно сравнительно мало’).
Сначала по положению столбика ртути 1 определяют — объем газа при 0°С. Затем газ нагревают (столбик ртути перемещается в положение 2), в процессе нагревания записывают значения объема и температуры и строят график, который называется изобарой.
Оказывается, что изобара представляет собой прямую линию (рис. 5.2, а), которая пересекается с осью абсцисс в точке А.
Из подобия треугольников на рис. 5.2, а следует
Обозначив через , получим
Здесь — коэффициент объемного расширения газа (гл. 13).
Если повторять этот опыт для разных газов или для разных масс газа, то все графики будут пересекаться в точке А, соответствующей t=—273°С (рис. 5.2, б), т. е. коэффициент одинаков для всех газов. Это означает, что расширение газа при изобарическом процессе не зависит от его природы.
Отметим, что для газов коэффициенты и в формулах (4.2а) и (5.17) численно одинаковы, поэтому обычно пользуются одним .
Изотермический процесс
Процесс в газе, который происходит при постоянной температуре, называется изотермическим.
Изотермический процесс в газе был изучен английским ученым Р. Бойлем и французским ученым Э. Мариоттом. Установленная ими опытным путем связь получается непосредственно из формулы (5.3) после сокращения на Т:
Формула (5.18) является математическим выражением закона Бойля — Мариотта: при постоянной массе газа и неизменной температуре давление газа обратно пропорционально его объему. Иначе говоря, в этих условиях произведение объема газа на соответствующее давление есть величина постоянная:
Соотношение (5.19) можно получить и из (5.7) или (5.8), так как при постоянном Г справа в формулах (5.7) и (5.8) стоит постоянная величина. График зависимости р от V при изотермическом процессе в газе представляет собой гиперболу и называется изотермой. На рис. 5.3 изображены три изотермы для одной и той же массы газа, но при разных температурах Т.
Отметим еще, что из формулы (5.9) непосредственно вытекает, что при изотермическом процессе плотность газа изменяется прямо пропорционально давлению:
(Подумайте, как проверить закон Бойля — Мариотта на опыте.)
Внутренняя энергия идеального газа
Как отмечалось, силы взаимодействия молекул в идеальном газе отсутствуют. Это означает, что молекулярно-потенциальной энергии у идеального газа нет. Кроме того, атомы идеального газа представляют собой материальные точки, т. е. не имеют внутренней структуры, а значит, не имеют и энергии, связанной с движением и взаимодействием частиц внутри атома. Таким образом, внутренняя энергия идеального газа представляет собой только сумму знамений кинетической энергии хаотического движения всех его молекул:
Поскольку у материальной точки вращательного движения быть не может, то у одноатомных газов (молекула состоит из одного атома) молекулы обладают только поступательным движением. Так как среднее значение энергии поступательного движения молекул определяется соотношением(4.8): , то внутренняя энергия одного моля одноатомного идеального газа выразится формулой , где — постоянная Авогадро. Если учесть, что , то получим:
Для произвольной массы одноатомного идеального газа имеем
Если молекула газа состоит из двух жестко связанных атомов (двухатомный газ), то молекулы при хаотическом движении приобретают еще и вращательное движение, которое происходит вокруг двух взаимно перпендикулярных осей. Поэтому при одинаковой температуре внутренняя энергия двухатомного газа больше, чем одноатомного, и выражается формулой
Наконец, внутренняя энергия многоатомного газа (молекула содержит три или больше атомов) в два раза больше, чем у одно-атомного при той же температуре:
поскольку вращение молекулы вокруг трех взаимно перпендикулярных осей вносит в энергию теплового движения такой же вклад, как поступательное движение молекулы по трем взаимно перпендикулярным направлениям.
Отметим, что формулы (5.23) и (5.24) теряют силу для реальных газов при высоких температурах, так как при этом в молекулах возникают еще колебания атомов, что ведет к увеличению внутренней энергии газа. (Почему это не относится к формуле (5.22)?)
Работа газа при изменении его объема
Физический смысл молярной газовой постоянной. Опыт показывает, что сжатый газ в процессе своего расширения может выполнять работу. Приборы и агрегаты, действия которых основаны на этом свойстве газа, называют пневматическими. На этом принципе действуют пневматические молотки, механизмы для закрывания и открывания дверей на транспорте и т. д.
Представим себе цилиндр с подвижным поршнем, заполненный газом (рис. 5.4).
Пока давление газа внутри цилиндра и окружающего наружного воздуха одинаковы, поршень неподвижен. Пусть при этом температура газа и окружающей среды равна а давление равно р.
Будем теперь медленно нагревать газ в цилиндре до температуры . Газ при этом начинает изобарически расширяться (внешнее давление р остается постоянным), и поршень переместится из положения 1 в положение 2 на расстояние . При этом газ совершит работу против внешней силы. Сила F, совершающая эту работу, будет равна рS, где S — площадь сечения цилиндра. Из механики известно, что работа выражается формулой , или . Так как есть приращение объема газа в процессе его изобарического нагревания от до , имеем
Нетрудно сообразить, что при изохорическом процессе работа газа равна нулю, так как никакого изменения объема, занятого газом, в этом случае не происходит. Вообще следует помнить, что газ выполняет работу только в процессе изменения своего объема, т. е. при . Отметим, что при расширении газа работа газа положительна; при сжатии газа положительную работу выполняют внешние силы, а работа газа в этом случае отрицательна.
Выясним, как можно определить работу газа по графику зависимости р от V в том или ином газовом процессе. При изобарическом процессе график зависимости р от V представляет собой прямую линию, параллельную оси абсцисс, так как р постоянно. Из рис. 5.5 видно, что работа газа в этом случае численно равна заштрихованной площади.
Выясним, как найти работу газа при изотермическом процессе. На рис. 5.6 изображена изотерма идеального газа. При таком процессе газ выполняет работу, так как в этом случае отлично от нуля. Формулу (5.25) здесь применять нельзя, так как она верна при постоянном давлении р, а в изотермической процессе р изменяется. Однако можно взять такое малое приращение объема , при котором изменением давления можно пренебречь. Тогда приближенно можно считать, что при увеличении объема газа на давление остается постоянным. Работу при этом можно вычислять по формуле . На рис. 5.6 она выражается заштрихованной площадью.
Разбивая интервал на множество интервалов , настолько малых, что работу на каждом из них можно вычислять по формуле , полную работу газа найдем как сумму элементарных работ . Это означает, что работа газа будет равна сумме площадей, подобных заштрихованной площади на рис. 5.6. Следовательно, работа газа при изотермическом процессе выражается площадью, ограниченной двумя ординатами и , отрезком оси абсцисс и графиком зависимости р от V.
Можно строго доказать, что работа газа при любом процессе выражается площадью, ограниченной двумя ординатами, отрезком оси абсцисс и графиком того процесса в координатах V и р.
Выясним теперь физический смысл молярной газовой постоянной R. Применяя формулу (5.25) к одному молю идеального газа, получим
Но из уравнения Клапейрона — Менделеева (5.8) для одного моля можно записать для двух состояний газа:
Подставляя это выражение в (5.26), будем иметь , или
Из (5.27) следует, что молярная газовая постоянная численно равна работе, совершаемой одним молем идеального газа при его изобарическом нагревании на один кельвин.
Из соотношения видно, что постоянная Больцмана показывает, сколько работы в среднем приходится на одну молекулу идеального газа при изобарическом нагревании на один кельвин.
Услуги по физике:
Лекции по физике:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
[spoiler title=”источники:”]
http://natalibrilenova.ru/uravnenie-sostoyaniya-idealnogo-gaza/
[/spoiler]
Лабораторная работа № 5. Измерение объемов твердых тел, жидкостей и газов
Гипермаркет знаний>>Физика>>Физика 7 класс>> Лабораторная работа № 5. Измерение объемов твердых тел, жидкостей и газов
Тема. Измерение объемов твердых тел, жидкостей и газов.
Цель: научиться определять объемы жидкостей, твердых тел (правильной и неправильной формы) и газов.
Оборудование: мерный цилиндр или мензурка, линейка, сосуд с водой, тело неправильной формы, тело, имеющее форму прямоугольного параллелепипеда, небольшая колба, стакан.

Теоретические сведения
1. Объем — это физическая величина, которая характеризует свойство тел занимать ту или иную часть пространства. Единицей объема в международной системе единиц (СИ) является кубический метр (м3).
Напоминаем: кубический метр равен объему куба с ребром 1 м.
2. Объем жидкости и газа измеряют с помощью мерного цилиндра (рис. I, а), или мензурки.

Для измерения объема жидкости с помощью мерного цилиндра (мензурки) необходимо:
а) перелить жидкость в мерный сосуд (она приобретет форму сосуда, а ее верхняя граница будет находиться на определенной высоте в зависимости от объема);
б) определить пометку шкалы, напротив которой расположена верхняя граница столба жидкости (рис. I, б);
в) зная цену деления шкалы, вычислить объем жидкости.
Измерение объема газа с помощью мерного цилиндра (мензурки) основано на свойстве газа занимать весь имеющийся объем. Поэтому, чтобы определить объем воздуха, который содержится в сосуде, необходимо выяснить, чему равен объем его внутренней части, то есть вместимость сосуда.
Для измерения вместимости сосуда необходимо:
а) заполнить сосуд водой и перелить ее в мерный цилиндр (мензурку);
б) определить объем перелитой воды.
Измеренное значение объема воды будет равно объему воздуха, который содержится в сосуде.
Для определения объема твердого тела с помощью мерного сосуда необходимо:
а) налить в мерный цилиндр (мензурку) воду объемом V1 так, чтобы в нее можно было погрузить тело и вода не переливалась через край;
б) погрузить в воду тело и измерить общий объем воды вместе с телом V2.
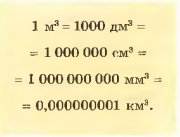
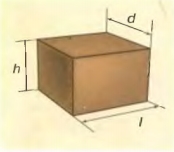
Рис. 2
в) вычислить объем вытесненной телом воды как разность измерений до и после погружения: V =V2 – V1.
Полученное значение будет равно объему твердого тела, так как тело вытесняет ровно столько жидкости, сколько оно занимает места в пространстве.
3. Если тело имеет правильную геометрическую форму, то, измерив линейные размеры, можно определить его объем с помощью соответствующих математических формул.
Например, объем тела, которое имеет форму прямоугольного параллелепипеда (рис. 2), вычисляется по формуле:
V = Idh, где I — длина тела; d — ширина тела; h — высота тела.
Указания к работе
Подготовка к эксперименту
1. Прежде чем начать измерения, вспомните:
а) как определяется цена деления шкалы средства измерения;
б) как правильно снимать показания мерного цилиндра;
в) какие меры безопасности надо соблюдать при работе с мензуркой.
2. Определите и запишите цену деления шкал линейки и мерного цилиндра.
Эксперимент
Результаты всех измерений сразу же заносите в таблицу.
1. Измерьте объем тела неправильной геометрической формы с помощью мерного цилиндра.
2 . Определите объем тела правильной геометрической формы.
| Наименование тела | Начальный объем воды Vy см3 | Объем воды и тела V2, см3 | Объем тела V | |
| см3 | м3 | |||
| Тело правильной геометрической формы | ||||
| Тело неправильной геометрической формы |
3. Определите объем тела правильной геометрической формы с помощью линейки.
| Длина тела I, см | Ширина тела d, см | Высота тела h, см | Объем тела V1 см3 |
4. Измерьте объем воздуха, который содержится в колбе и других сосудах, находящихся на вашем столе.
| Номер опыта | Название сосуда | Объем жидкости, см3 | Объем воздуха, см3 |
| 1. | |||
| 2. | |||
| 3. |
Анализ результатов эксперимента
1. Проанализировав различные способы измерения объема, укажите:
а) какой из способов определения объема твердого тела является более универсальным и почему;
б) какие факторы повлияли на точность полученных вами результатов.
2. Сделайте вывод, в котором укажите, что именно вы научились измерять и для чего могут пригодиться навыки, полученные при выполнении работы.
Дополнительное задание
Предложите способы измерения объема тела неправильной формы, если:
а) его объем меньше, чем цена деления мерного сосуда, который у вас имеется;
б) тело не помещается в сосуд, который у вас имеется.
Физика. 7 класс: Учебник / Ф. Я. Божинова, Н. М. Кирюхин, Е. А. Кирюхина. — X.: Издательство «Ранок», 2007. — 192 с.: ил.
Содержание урокаконспект урока и опорный каркас
презентация урока
интерактивные технологии
акселеративные методы обучения Практика
тесты, тестирование онлайн
задачи и упражнения
домашние задания
практикумы и тренинги
вопросы для дискуссий в классе Иллюстрации
видео- и аудиоматериалы
фотографии, картинки
графики, таблицы, схемы
комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты Дополнения
рефераты
шпаргалки
фишки для любознательных
статьи (МАН)
литература основная и дополнительная
словарь терминов Совершенствование учебников и уроков
исправление ошибок в учебнике
замена устаревших знаний новыми Только для учителей
календарные планы
учебные программы
методические рекомендации
обсуждения
Идеальные уроки-кейсы
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь – Образовательный форум.
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний – Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов –
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других “взрослых” тем.
Разработка – Гипермаркет знаний 2008-
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: 
УЧЕБНАЯ КНИГА ПО ХИМИИ
ДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
СТУДЕНТОВ ПЕДАГОГИЧЕСКИХ ВУЗОВ И ШКОЛЬНИКОВ 9–10
КЛАССОВ,
РЕШИВШИХ ПОСВЯТИТЬ СЕБЯ ХИМИИ И ЕСТЕСТВОЗНАНИЮ
УЧЕБНИКЗАДАЧНИК
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
НАУЧНЫЕ РАССКАЗЫ ДЛЯ ЧТЕНИЯ
Продолжение. См. № 4–14, 16–28, 30–34, 37–44, 47,
48/2002;
1, 2, 3,
4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19/2003
§ 5.2. Вещество в газовом состоянии
(окончание)
Последний этап любой экспериментальной или
теоретической работы заключается в установлении
границ применимости выведенной формулы,
высказанного утверждения или установленного
закона.
Изучение газов показывает, что уравнение
Клапейрона–Менделеева наиболее точно описывает
поведение газа при низком давлении и высокой
температуре.
Повторяем еще раз: газ, свойства и поведение
которого описывает это уравнение, называют
идеальным газом, а само уравнение – уравнением
состояния идеального газа.
Молекулы воображаемого идеального газа
принято представлять точками, не обладающими
объемом и взаимодействующими друг с другом при
столкновениях, как абсолютно упругие шары. Ни
один реальный газ не соответствует в полной мере
этим требованиям. Поведение реальных газов тем
значительнее отличается от поведения идеальных,
чем выше давление и ниже температура.
Чем выше давление, тем сильнее сказывается
наличие у молекул газа собственного объема, не
позволяющего считать молекулы точками. При
низких температурах на поведении газов
сказывается взаимное притяжение молекул, не
позволяющее им вести себя как абсолютно упругие
шары.
Ближе всего к воображаемым идеальным газам по
своему поведению приближаются газы, состоящие из
наиболее простых молекул и имеющие низкие
температуры конденсации (кипения) (°С): гелий
(–269), неон (–246,1), аргон (–185,9), молекулы которых
одноатомны, а также водород (–252,9), кислород (–183),
азот (–195,8), монооксид углерода СО (–192). Мольные
объемы этих газов при н. у. почти равны 22,4 л.
Газы, имеющие более высокие температуры
конденсации, заметно отличаются от идеальных
газов, и их мольные объемы (при н. у.) меньше 22,4 л,
например, диоксид углерода СО2 (–79 °С)
имеет мольный объем 22,26 л, аммиак NН3
(–33 °С) – 22,08 л. Однако в наших расчетах мы
будем полагать, что при н. у. все газы имеют
мольный объем, равный 22,4 л/моль.
Попытайтесь объяснить в письменном виде,
почему мера идеальности газа связана с его
температурой конденсации. Почему чем тяжелее и
сложнее молекула, тем выше температура кипения
соответствующего вещества и тем больше газ этого
вещества отличается от идеального?
Следовательно, идеальный газ – это такой газ,
поведение которого описывается уравнением
газового состояния
p•V = n•R•T, один моль которого содержит 6,02•1023
молекул (число Авогадро) и занимает объем 22,4 л
при нормальных условиях.
Пользуясь уравнением Клапейрона–Менделеева,
можно по экспериментальным значениям массы,
объема, давления и температуры некоторой порции
газа рассчитать его мольную массу.
Действительно, n – число молей газа – может
быть выражено как частное от деления массы
вещества (в г) на его мольную (молярную) массу (в
г/моль):
n = m/M.
Тогда уравнение Клапейрона–Менделеева можно
записать:
p•V = (m/M)•R•T.
Откуда
M = m•R•T/(p•V).
Но значительно проще, особенно если вы забыли
значение газовой постоянной, пользоваться
следующим простым приемом при вычислении
мольной массы газа.
Приведите объем известной массы газа к
нормальным условиям и рассчитайте ту массу
вещества, которая будет приходиться на 22,4 л газа.
Можно записать условия задачи в виде
пропорции:
Откуда
M = m•22,4/V0.
Иногда эксперимент и расчеты по формуле
Клапейрона–Менделеева не приводят к желаемым
результатам. Если молекулы газа соединяются
между собой, то при постоянном объеме давление
понижается, а при постоянном давлении объем
уменьшается, вследствие чего получается более
высокое численное значение мольной массы.
Наоборот, если молекула неустойчива и
распадается, то численное значение мольной массы
окажется заниженным.
По отклонению полученного значения мольной
массы от теоретического делают заключение о
характере проходящей в газовой фазе реакции.
Список новых и забытых понятий и слов
Методы планирования
эксперимента и выведения формулы;
многофакторный и однофакторный эксперименты;
закон Авогадро;
температурные шкалы Цельсия и Кельвина;
закон Бойля–Мариотта;
p•V = n•R•T;
идеальные и реальные газы;
p1•V1/T1 = p2•V2/T2;
нормальные условия (н. у.);
101 325 Па = 1 атм = 760 мм рт. ст.;
мольный (молярный) объем газа;
VМ = 22,4 л/моль;
парниковый эффект;
плотность газа;
мольная масса воздуха М(возд.) = 29 г/моль;
универсальная газовая постоянная R;
постоянная Больцмана k;
уравнение состояния идеального газа.
ЗАДАЧИ И ВОПРОСЫ
1. Представьте себе такую часто встречающуюся в
научных исследованиях ситуацию. Вы провели два
опыта и измерили при некоторых температуре t
и давлении p объем V газа,
образовавшегося в каждом опыте:
В каком из опытов образовался большой объем
газа?
Помните, что объемы газов нужно привести к
нормальным условиям, воспользовавшись
соотношением:
р0•V0/T0
= p•V/T.
2. Это задача об одном из важнейших понятий
химии и физики – объеме 1 моль газа. Представьте
себе, что вы желаете получить ровно 2,0158 г
водорода. Сколько нужно взять цинка для реакции
его с хлороводородной (соляной) кислотой?
Ответ. 65,39 г цинка.
3. Рассчитайте, сколько следует взять
хлороводорода, содержащегося в хлороводородной
(соляной) кислоте, для полного «растворения» 65,39 г
цинка и получения 2,0158 г водорода. Объясните,
почему слово «растворение» заключено в кавычки.
4. Сколько пероксида водорода (в г) следует взять
для получения 1 л кислорода согласно реакции:
2Н2О2 = 2Н2О + О2?
5. Азот можно получить разложением при
нагревании нитрита аммония:
NH4NO2 = 2H2O + N2.
Сколько азота (в л) при нормальных и обычных
условиях (температуру и давление задайте сами)
можно получить из 1 г нитрита аммония?
6. Рассчитайте плотность кислорода (в г/л) при
нормальных условиях (мольный объем кислорода и
массу его моля вы знаете).
7. Рассчитайте плотность кислорода при обычных
условиях (температуру и давление задайте сами).
Не забудьте, что для этого следует знать мольный
объем при заданных вами условиях.
При повышении температуры и понижении давления
мольный объем газа становится больше, а
плотность газа – меньше!
8. Выведите формулу пересчета плотности газа
при переходе от нормальных условий к любым
заданным. Чем проще формула, тем выше оценка
работы! Плотность при нормальных условиях
обозначьте 0.
9. При температуре 20,35 °С и давлении 98 600 Па
0,0502 г некоторого газа занимают объем 28,24 мл.
Рассчитайте мольную массу этого газа.
Воспользуйтесь формулой:
M = m•R•T/(p•V).
Вспомните, что R = 8314 Па•л/(К•моль).
Ответ. М = 43,99 г/моль.
Это значение почти совпадает с теоретическим
для СО2, равным 12,011 + 15,999•2 = 44,01 г/моль,
поэтому можно предположить, что в эксперименте
использовался углекислый газ.
Задачу можно решить и другим способом:
рассчитаем объем при нормальных условиях (V0
= 0,02558 л). Далее составляем пропорциональную
зависимость:
Откуда М = 43,96 г/моль. Получено почти то же
самое значение мольной массы.
10. Докажите, что при 0 К давление газа равно нулю.
Это чрезвычайно интересный для мироздания
вопрос. Если вы найдете такое доказательство, то
в будущем можете стать естествоиспытателем и
философом.
11. Чем отличается пожар на Земле от пожара в
космическом корабле?
12. Как узнать, какой состав земной атмосферы
(кислород, углекислый газ, ядовитые примеси) был
столетие, тысячелетие назад или в какой-либо
геологический период?
13. Переведите на русский язык.
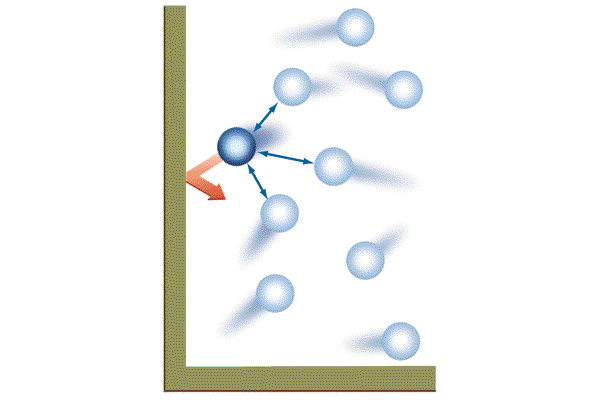
It is now well known that gases consist of molecules which move in the volume confining
them at high speeds, and along straight lines from collision to collision. Molecules can
collide either with other molecules of gas or with the walls of the containing vessel. The
collisions of molecules with the walls give rise to a constant force acting on the walls.
This force per unit area is the pressure exerted by the gas.
In comparison with the volume occupied by the gas, the actual volume of the molecules
themselves is very small under ordinary conditions. This is evident, for example, from the
fact that the volume of a liquid is thousands of times less than that of its vapour; this,
of course, is due, not to any change in the volume of the molecules themselves, but to a
decrease in the free space between them.
The study of the gaseous state led to the introduction of the concept of an ideal gas. By
this term we denote a gas whose properties are described exactly by certain laws known
collectively as the ideal gas laws. In contradistinction to an ideal gas, these laws are
applicable to real gases only when the pressure is sufficiently low. The properties of
real gases deviate from those of an ideal gas mainly due to the mutual attraction of the
molecules and their intrinsic volume.
As the distance between the molecules decreases their mutual attraction becomes stronger.
As the volume of a real gas decreases (due to increase in pressure or lowering of the
temperature) the properties of the gas will deviate ever more strongly from those of an
ideal gas.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
1. Получение водорода.
На рис. 5.1 показана схема прибора для получения
водорода и измерения его объема. В колбу 1
помещают навеску цинка и закрывают ее пробкой 2,
сквозь которую проходит сливная трубка
делительной воронки 3. При закрытом
кране 4 в воронку 3 наливают
избыток соляной (хлороводородной) кислоты.
Делительную воронку закрывают пробкой 5,
сквозь которую пропущена стеклянная трубка 6 с
надетым на нее резиновым шлангом 7.
Колба 1 имеет боковой отросток 8,
который куском резинового шланга соединен с
тройником 9 (Т-образная стеклянная
трубка с тремя концами). Другой конец тройника
соединен с резиновой трубкой 7, идущей
от трубки 6, пропущенной сквозь пробку 5,
закрывающую делительную воронку. С помощью еще
одного конца тройника водород через резиновую
трубку 10 попадает в устройство для
измерения объема газа.
Наиболее простой способ измерить объем
выделяющегося газа – это воспользоваться
заполненным водой мерным цилиндром 11,
перевернутым верхней частью вниз и опущенным в
сосуд с водой 12. Воду заливают в цилиндр
так, чтобы ее поверхность почти выступала над его
отверстием 13. Затем это отверстие
закрывают большим пальцем правой руки, цилиндр
переворачивают вверх дном и, не отпуская пальца
от отверстия, помещают вместе с рукой в сосуд 12,
заполненный водой. Когда отверстие цилиндра
окажется под водой, палец убирают, и вода из
цилиндра теперь не вытекает. В отверстие
цилиндра помещают конец Г-образной стеклянной
трубки 14, соединенной шлангом 10
с тройником 9.
Теперь, открыв кран 4, можно перелить
кислоту в колбу. Начинается реакция, и водород
(вместе с содержащимся в колбе воздухом)
переходит в цилиндр 11, вытесняя из него
воду в сосуд 12. После окончания реакции
объем образовавшегося водорода определяют по
высоте столба воды h в цилиндре. Атмосферное
давление р и температуру t во время
опыта определяют соответственно по барометру 15
и термометру 16.
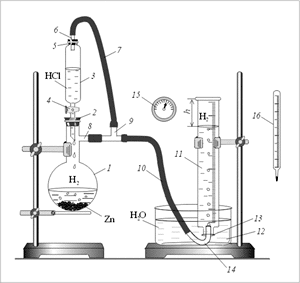 |
Рис. 5.1.
|
Перечислите недостатки этого
способа измерения объема газа. (Оценку
выставляют за число приведенных существенных
недостатков.)
Зачем прибор оснащен пробкой 5, трубкой 7
и тройником 9? Как следует поступить при
измерении объема водорода, если прибор собран
без этих частей?
Может случиться, что в лаборатории не найдется
колбы с боковым отростком 8 или тройника
9. Нарисуйте схему прибора без этих частей и
проводите опыт, используя конструкцию прибора,
предложенную вами.
Проведем эксперимент по получению требуемого
количества водорода. Вы, конечно, понимаете, что
ни один химик не возьмет ровно 65,39 г цинка, и вы
этого не будете делать при выполнении
лабораторной работы. Отвесим около 0,01 моль цинка
с точностью до четвертого знака после запятой.
Пусть это будет 0,6456 г. При действии на это
количество цинка избытком соляной кислоты
выделилось 242,92 мл водорода при температуре
19,20 °С и давлении 741,0 мм рт. ст. Переведем мм рт.
ст. в Па:
Абсолютная температура опыта:
19,20 + 273,15 = 292,35 К.
Запомните последовательность дальнейших
расчетов.
Переведем объем газа в условиях эксперимента к
нормальным условиям:101 325•V0/273,15 =
98 792•242,92/292,35,V0 = 221,29 мл (см3).
Таким образом, 0,6456 г цинка при взаимодействии с
избытком соляной кислоты выделили бы из раствора
221,29 мл водорода при нормальных условиях.
Сколько водорода (в мл) выделит 1 моль цинка, т. е.
65,39 г? Записываем условия, составляем соотношение
для пропорции и находим ответ:
Таким образом, в реакции взаимодействия 1 моль
цинка с кислотой образовался 1 моль водорода,
занимающего при нормальных условиях 22 413 мл,
или округленно 22,4 л:
2. Определение плотности газа.
Плотность газа легко определить
экспериментально. Для этого можно
воспользоваться газовым пикнометром, стеклянным
сосудом известной вместимости (рис. 5.2).
Лабораторный газовый пикнометр представляет
собой колбочку 1 с двумя трубками 2 и
3 и двумя кранами 4. Трубка 2
доходит почти до дна колбочки, трубка 3
выходит из верхней части колбочки.
В зависимости от того, легче или тяжелее воздуха
изучаемый газ, его подают в одну из трубок и при
открытых кранах 4 пропускают через
колбочку до полного вытеснения воздуха. После
окончания пропускания газа сначала закрывают
выпускной кран, затем впускной и взвешивают
пикнометр при закрытых кранах. Пропускание газа
и взвешивание проводят несколько раз до
получения постоянной массы пикнометра с газом.
При определении плотности газов следует помнить,
что «пустой» пикнометр – это в действительности
пикнометр, наполненный воздухом. При вычислениях
следует учитывать массу воздуха, когда
определяется масса «пустого» пикнометра, или
определять массу «пустого» пикнометра, из
которого откачан воздух вакуумным насосом.
Этот пикнометр можно использовать для
определения плотности жидкости.
Простейший газовый пикнометр легко собрать из
колбочки и резиновой пробки с двумя пропущенными
через нее стеклянными трубками с кранами или
вместо кранов с резиновыми трубками и зажимами.
Если вместимость пикнометра неизвестна,
наполним его водой (до кранов или зажимов) и
выльем ее в измерительный цилиндр. Мы узнали
вместимость пикнометра. Тщательно его высушим,
откачаем из него воздух и взвесим. Откроем краны
и наполним пикнометр воздухом, взвесим, запишем
температуру и атмосферное давление. Теперь, зная
массу воздуха и его объем, приведенный к
нормальным условиям, вычисляем плотность
воздуха.
Посмотрите на рис. 5.2. Для определения плотности
водорода Н2, кислорода О2, азота N2,
хлора Сl2, аммиака NH3, метана СН4
или углекислого газа СО2 через какую трубку
– 2 или 3 – вы будете подавать изучаемый газ для
заполнения пикнометра?
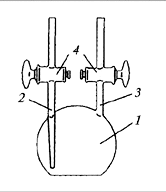 |
Рис. 5.2. Пикнометр:
|
Собирать выделяющийся в реакции газ
проще всего над жидкостью, если газ с этой
жидкостью не реагирует и достаточно мало в ней
растворим. Такой прием был использован при
измерении объема водорода.
Газы тяжелее или легче воздуха можно собирать в
пробирки, располагая их вниз или вверх дном.
Как вы будете собирать газы: водород Н2,
кислород О2, аммиак NH3, метан СН4,
азот N2, ацетилен С2Н2, хлор Сl2,
диоксид серы (сернистый газ) SO2, гелий Не
(его можно получить не химической реакцией, а
нагреванием одного очень редкого минерала) и
сероводород H2S?
О.С.ЗАЙЦЕВ