Молярный объем газа

4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
Для того, чтобы узнать состав любых газообразных веществ необходимо уметь оперировать такими понятиями, как молярный объем, молярная масса и плотность вещества. В данной статье рассмотрим, что такое молярный объем, и как его вычислить?
Количество вещества
Количественные расчеты проводят с целью, чтобы в реальности осуществить тот или иной процесс или узнать состав и строение определенного вещества. Эти расчеты неудобно производить с абсолютными значениями массы атомов или молекул из-за того, что они очень малы. Относительные атомные массы также в большинстве случаев невозможно использовать, так как они не связаны с общепринятыми мерами массы или объема вещества. Поэтому введено понятие количество вещества, которое обозначается греческой буквой v (ню) или n. Количество вещества пропорционально числу содержащихся в веществе структурных единиц (молекул, атомных частиц).
Единицей количества вещества является моль.
моль – это такое количество вещества, которое содержит столько же структурных единиц, сколько атомов содержится в 12 г изотопа углерода.
Масса 1 атома равна 12 а. е. м., поэтому число атомов в 12 г изотопа углерода равно:
Na= 12г/12*1,66057*10в степени-24г=6,0221*10 в степени 23
Физическая величина Na называется постоянной Авогадро. Один моль любого вещества содержит 6,02*10 в степени 23 частиц.
Молярный объем газа
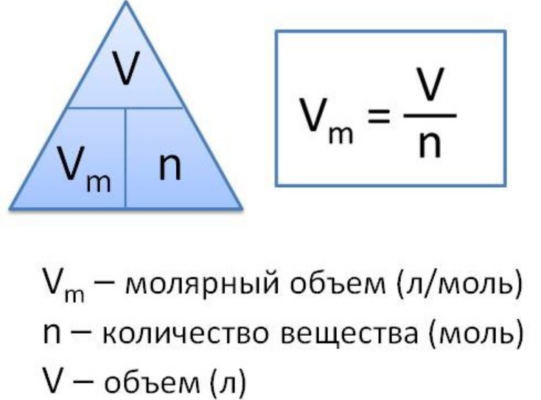
Молярный объем газа – это отношение объема вещества к количеству этого вещества. Эту величину вычисляют при делении молярной массы вещества на его плотность по следующей формуле:
Vm=M/p,
где Vm – молярный объем, М – молярная масса, а p – плотность вещества.
В международной системе Си измерение молярного объема газообразных веществ осуществляется в кубических метрах на моль (м3 /моль)
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа. Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм3 /м.
Таблица «молярный объем газов»
В следующей таблице представлен объем некоторых газов:
| Газ | Молярный объем, л |
| H2 | 22,432 |
| O2 | 22,391 |
| Cl2 | 22,022 |
| CO2 | 22,263 |
| NH3 | 22,065 |
| SO2 | 21,888 |
| Идеальный | 22,41383 |
Что мы узнали?
Молярный объем газа, изучаемый по химии (8 класс) наряду с молярной массой и плотностью являются необходимыми величинами для определения состава того или иного химического вещества. Особенностью молярного газа является то, что в одном моле газа всегда содержится одинаковый объем. Этот объем называется молярным объемом газа.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Аэлита Коробка
5/5
-
Александр Котков
5/5
-
Настя Бабич
5/5
-
Александр Котков
5/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
А какая ваша оценка?
Молярный объём
Vm
— это отношение объёма данной порции вещества к его количеству.
Численно молярный объём равен объёму (1) моль вещества.
Обрати внимание!
Молярный объём любого газа при нормальных условиях (давлении (101,3) кПа и температуре (0) °С) равен (22,4) дм³/моль.
Вычисление объёма газа по его количеству
Преобразуем формулу молярного объёма — выразим из неё
V
:
— объём газа равен произведению его количества на молярный объём.
Пример:
вычисли объём (н. у.) метана количеством (1,5) моль.
дм³.
Вычисление количества газа по его объёму
Выразим из формулы молярного объёма
n
:
— количество газа можно вычислить, если его объём разделить на молярный объём.
Пример:
вычисли количество водорода, соответствующее при н. у. его объёму (11,2) дм³.
моль.
Как вычислить объем газа
Газ, как и вещества, находящиеся в других агрегатных состояниях, имеет ряд параметров, в число которых входит и объем. Объем газа находится на основании других его характеристик, которые приведены в условии задачи. Любой газ, независимо от вида и состава, имеет объем, который и требуется найти во многих задачах.
Инструкция
Газ, независимо от его состава, имеет три основных параметра: массу, объем и плотность. В большинстве задач оперируют так называемым идеальным газом, поэтому опираться в них необходимо лишь на приведенные в условии значения массы, давления, температуры. Например, в условии задачи может быть указан газ азот N2 с температурой в 60 градусов, давлением в 30 кПа и массой в 0,05 г. Зная эти три параметра и состав газа, по уравнению Менделеева-Клапейрона можно найти его объем. Для этого необходимо переделать данное уравнение следующим образом:
pV=mRT/M.
Осуществив дальнейшее преобразование формулы, найдите объем азота:
V =mRT/pM.
При этом молярную массу M можно найти по таблице Д.И. Менделеева. У азота она равна 12 г/моль. Тогда:
V=0,05*12*8,31*333/30*12≈4,61.
Если известны объем при нормальных условиях, а объем при других условиях является искомым, примените законы Бойля-Мариотта и Гей-Люссака:
pV/T=pнVн/Tн.
В таком случае преобразуйте формулу следующим образом:
pV*Tн=pнVн*T.
Отсюда объем V равен:
V=pнVн*T/p*Tн.
Индекс н означает величину того или иного параметра при нормальных условиях.
Если рассматривать объем газа с точки зрения термодинамики, можно заметить, что на газы могут действовать силы, за счет которых меняется объем. При этом давление газа постоянно, что характерно для изобарных процессов. В ходе таких процессов объем изменяется с одной величины на другую. Их можно обозначить как V1 и V2. В условиях ряда задач описывается некоторый газ, находящийся под поршнем в сосуде. При расширении этого газа поршень передвигается на некоторое расстояние dl, в результате чего осуществляется работа:
A=pdV=p(V2 -V1).
Эта формула связывает изменение объема газа и работу. Как известно, если дан конечный объем V2, то можно найти начальный объем V1:
V1=pV2-A/p.
Наконец, наиболее просто найти объем газа, исходя из двух других физических параметров – массы и плотности. Если в условиях задан газ с некоторой плотностью и массой, то его объем следует вычислять по формуле:
V=m/ρ.
У каждого газа имеется определенная плотность, как и у любого твердого или жидкого вещества. Поэтому, находя объем газа, в первую очередь необходимо учитывать именно этот параметр.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Молярная масса
Вы знаете, что одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но у каждого вещества его структурная единица имеет собственную массу. Поэтому и массы одинаковых химических количеств различных веществ тоже будут различны.
Молярная масса — это масса порции вещества химическим количеством 1 моль.
Молярная масса вещества Х обозначается символом M(Х). Она равна отношению массы данной порции вещества m(Х) (в г или кг) к его химическому количеству n(Х) (в моль):
В Международной системе единиц молярная масса выражается в кг/моль. В химии чаще используется дольная единица — г/моль.
Определим молярную массу углерода. Масса углерода химическим количеством 1 моль равна 0,012 кг, или 12 г. Отсюда:
Молярная масса любого вещества, если она выражена в г/моль, численно равна его относительной молекулярной (формульной) массе.
Например:
На рисунке 47 показаны образцы веществ (H2O, CaCO3, Zn), химическое количество которых одно и то же — 1 моль. Как видите, массы разных веществ химическим количеством 1 моль различны.
Молярная масса является важной характеристикой каждого отдельного вещества. Она отражает зависимость между массой и химическим количеством вещества. Зная одну из этих величин, можно определить вторую — массу по химическому количеству:
и, наоборот, химическое количество по массе:
а также число структурных единиц:
Взаимосвязь между этими тремя характеристиками вещества в любом его агрегатном состоянии можно выразить простой схемой:
Формула и алгоритм нахождения объёма
Сегодня мы научимся одному немаловажному умению в химии – находить объём различных растворов и прочих веществ. Это знание необходимо потому, что оно поможет нам в решении многих задач как в тетради, так и в жизни. Нужно лишь знать устоявшуюся формулу.
Важно понимать, что формула нахождения объёма может быть разной в зависимости от того вещества, объём которого нам предстоит найти, а точнее, от агрегатного состояния этого вещества. Для нахождения объёма газа и жидкости используются разные, непохожие друг на друга формулы.
Чёткая и правильная формула для расчёта объёма жидкости выглядит следующим образом: С=n/V.
В этом случае:
- C – молярная масса раствора (моль на литр).
- n – количество вещества (моль).
- V – объём вещества-жидкости (литры).
Из этого следует что V=n/c.
Cуществует и вторая формула для нахождения объёма жидкости при другой задаче и других данных: V=m/p.
Здесь, соответственно:
- V – объём и измеряется он в миллилитрах.
- m – масса, измеряется в граммах.
- p – плотность, измеряется в граммах, делённых на миллилитры.
В случае если, кроме объёма, требуется также найти массу, это можно сделать, зная формулу и количество нужного вещества. При помощи формулы вещества находим его молярную массу путём сложения атомной массы всех элементов, которые входят в его состав.
Для примера возьмём M (AuSo2) и при расчётах у нас должно выйти 197+32+16 * 2 = 261 г/моль. После проведённых расчётов находим массу по формуле m=n*M, где, следовательно:
- m – масса.
- n – количество вещества, которое измеряется в молях (моль).
- M – молярная масса вещества: граммы, делённые на моль.
Количество вещества, как правило, даётся в задаче. Если же нет, то, скорее всего, допущена опечатка или ошибка в условии, и вам стоит обратиться за помощью и объяснениями к учителю, а не пытаться самим вывести несуществующую величину. Основные формулы и алгоритмы решения приведены в данной статье.
Также существует формула для нахождения объёма газа, и выглядит она так – V=n*Vm:
- V – объём газа (литры).
- n – количество вещества (моль).
- Vm – молярный объём газа (литры/моль).
Но есть своего рода исключение. Оно состоит в том, что при нормальных условиях, то есть при определённом давлении и температуре, объём газа является постоянной величиной, равной 22,3 л/моль.
Есть и третий вариант. Если в самом задании будет присутствовать уравнение реакции, тогда ход решения должен проходить иначе. Из уравнения, которое у вас имеется, можно найти количество каждого вещества, оно будет равняться коэффициенту. К примеру, Ch4 + 2O2 = CO2 + H2O. Из этого уравнения следует, что 1 моль метана и 2 моль кислорода при взаимодействии дают 1 моль углерода и 1 моль воды. Даже если учесть тот факт, что в условии имеется количество вещества лишь одного-единственного компонента, не составит труда найти количество всех остальных веществ. Если количество метана составит 0,3 моль, значит, n(Сh4) будет равняться 0,6 моль, n(CO2) = 0,3 моль, n(H2O) = 0.3 моль.
б) Газовые законы объем газа
Кроме вышеуказанной формулы для решения расчетных химических задач, нередко приходится использовать газовые законы, известные из курса физики.
— Закон Бойля-Мариотта
При постоянной температуре объем данного количества газа обратно пропорционален давлению, под которым он находится:
pV = const
— Закон Гей-Люссака
При постоянном давлении изменение объема газа прямо пропорционально температуре:
V/T = const
— Объединенный газовый закон Бойля-Мариотта и Гей-Люссака
pV/T = const
Помимо этого, если известна масса или количество газа, его объем можно вычислить, используя уравнение Менделеева-Клапейрона:
pV = nRT;
pV = n/M ×RT,
где n–число молей вещества, m–масса (г), Ь – молярная масса газа (г/моль), R – универсальная газовая постоянная равная 8,31 Дж/(моль×К).
Молярный объем кристаллов
Объем Vя элементарной ячейки кристалла вычисляют с помощью характеристик кристаллической структуры, которые определяют на основании результатов рентгеноструктурного анализа.
Зависимость между объемом ячейки и молярным объемом:
Vm=VяNA/Z
где Z — определяет, сколько формульных единиц в элементарной ячейке.
Молярный объем
В отличие от твердых и жидких веществ все газообразные вещества химическим количеством 1 моль занимают одинаковый объем (при одинаковых условиях). Эта величина называется молярным объемом и обозначается Vm.
Подобно молярной массе, молярный объем газа равен отношению объема данного газообразного вещества V(Х) к его химическому количеству n(Х):
Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С и давление 101,325 кПа.
Установлено, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 дм3/моль. Другими словами, молярный объем любого газа при нормальных условиях:
Молярный объем — это объем, равный 22,4 дм3, который занимает 1 моль любого газа при нормальных условиях.
Пример 1. Вычислите химическое количество SiO2, масса которого равна 240 г.
Спойлер
[свернуть]
Пример 2. Определите массу серной кислоты H2SO4, химическое количество которой 2,5 моль.
Спойлер
[свернуть]
Пример 3. Сколько молекул CO2 и сколько атомов кислорода содержится в углекислом газе массой 110 г?
Спойлер
[свернуть]
Пример 4. Какой объем занимает кислород химическим количеством 5 моль при нормальных условиях?
Спойлер
[свернуть]
Краткие выводы урока:
- Масса вещества химическим количеством 1 моль называется его молярной массой. Она равна отношению массы данной порции вещества к его химическому количеству.
- Объем газообразных веществ химическим количеством 1 моль при нормальных условиях одинаков и равен 22,4 дм3.
- Величина, равная 22,4 дм3/моль, называется молярным объемом газов.
Надеюсь урок 9 «» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «».
Теги
Или с учетом химической формулы газа: p = M/V М = M/22,4, где M — молекулярная масса, V М — молярный объем.
Как считать объем газа?
Молярный объём V m — это отношение объёма данной порции вещества к его количеству. Численно молярный объём равен объёму (1) моль вещества. Обрати внимание! Молярный объём любого газа при нормальных условиях (давлении (101,3) кПа и температуре (0) °С) равен (22,4) дм³/моль.
Вычисление объёма газа по его количеству Преобразуем формулу молярного объёма — выразим из неё V : V ( X ) = n ( X ) ⋅ V m — объём газа равен произведению его количества на молярный объём. Пример: вычисли объём (н.у.) метана количеством (1,5) моль. V ( CH 4 ) = n ( CH 4 ) ⋅ V m = 1,5 ⋅ 22,4 = 33,6 дм³.
Вычисление количества газа по его объёму Выразим из формулы молярного объёма n : n ( X ) = V ( X ) V m — количество газа можно вычислить, если его объём разделить на молярный объём. Пример: вычисли количество водорода, соответствующее при н.у. его объёму (11,2) дм³.
Сколько литров в 1 м3 газа?
Кубометр газа — это сколько? — 1 кубометр сжиженного углеводородного газа — это 1000 литров. Не стоит путать кубометр и тонну газа, т.к. они неравнозначны: количество литров зависит от плотности газа, которая может колебаться от 0,51 до 0,56 (соответственно 1000 литров сжиженного газа — это 510-560 кг).
Как измеряют объем природного газа?
Для учета потребления природного газа и передачи показаний счетчика все еще используются кубометры (м 3 ), однако, согласно правилам Кабинета министров № 78 «Правила торговли и использования природного газа », в расчетах за природный газ необходимо использовать киловатт-часы (кВт·ч).
Сколько кубометров газа в 1 кг?
1 кг жидкого пропана объемом около 1,9 л образует около 500 литров газа. Соответственно 1 кг зимней смеси будет иметь объем 0,25х1,7 + 0,75х1,9 = 1,85 л и образует в нормальных условиях газ объемом 0,25х370 + 0,75х500 = 467,5 л (0,4675 м3).
Что такое объем газа?
V — объем газа — пространство, заполняемое газом. Ввиду отсутствия заметного притяжения между молекулами газа, он занимает весь предоставленный ему объем. Формулы, где встречается объем газа: Уравнение Менделеева — Клайперона Давление газа. Уравнение Клайперона. Объединенный газовый закон (при m = const; ν = const) Концентрация молекул газа. Плотность вещества. Работа газа при изобарном процессе,
Как измерить куб газа?
Приведение к нормальным и стандартным условиям — Единицей измерения объема газа является кубический метр (м³). Измеренный объем приводится к нормальным физическим условиям. Нормальные физические условия: давление 101 325 Па, температура 273,16 К (0 °С).
Стандартные условия: давление 101 325 Па, температура 293,16 К (+20 °С). В настоящее время эти обозначения выходят из употребления. Поэтому в дальнейшем следует указывать те условия, к которым относятся объемы и другие параметры газа. Если эти условия не указываются, то это значит, что параметры газа даны при 0 °С (273,16 °К) и 760 мм рт.
ст. (1,033 кгс/см²). Иногда объем газа (особенно в иностранной литературе и нормах) при пользовании системой СИ приводится к 288,16 °К (+15 °С) и давлению 1 бар (105 Па). Если известен объем газа при одних условиях, то пересчитать его в объемы при других условиях можно с помощью коэффициентов, приведенных следующей таблице.
Как перевести объем газа в литры?
Как перевести пропан-бутан из килограммов в литры ? ❓ Для того, чтобы посчитать количество литров в одном килограмме газа нужно воспользоваться формулой: Литр =Килограмм/Плотность Пример: Известно, что в баллоне 50 литров залито 21 килограмм газа, у которого испытательная плотность равна 0,567.
Чтобы посчитать литры нужно 21 разделить на 0,567. Получится 37,04 литра газа. Как перевести пропан-бутан из литров в килограммы? Для того, чтобы посчитать сколько килограммов содержится в одном литре газа нужно воспользоваться формулой: Килограмм= Литр*Плотность Пример: Известно, что в автомобиль заправлено 100 литров газа плотностью 0,567.
Чтобы посчитать какое количество килограммов газа, нужно 100 умножить на 0,567. Получится 56,7 кг газа. Уважаемые клиенты! Рекомендуем Вам 👓 наиболее популярные сезонные товары по низким ценам: Газовые баллоны 🛠️ Газовые комплекты ☘️ Газовая плита Гефест ПГТ-1+ баллон 5л Турист Полный комплект(баллон, редуктор, плита) для выездов на природу, на дачу. Рекомендован автотуристам.3 490 Комплект газовый Кемпинг ПГТ 1Б-В ( газ.горелка + баллон 8 литров), Крым Высота: 365 мм, Диаметр: 265 мм, Рабочее давление: 1,6 Мпа Товар распродан Таганок НЗГА Дачник Н-1 Объем, л 5. Тепловая мощность горелки, кВт: 1,8 Товар распродан Посмотреть все Газовые плиты здесь Посмотреть Газовые баллоны и все для подключения здесь
Какой объем газа в баллоне 50 литров?
Сколько м3 пропана в 1 баллоне на 5, 12, 27, 50 литров? — Мы произвели специальные расчеты, условно переводящие пропан-бутан в газообразное состояние. При стандартных условиях (100 кПа, 288 К) из 1кг сжиженного газа образуется 0,526 м³ пропана или 0,392 м³ бутана.
| Ёмкость баллона (л) | 5 | 12 | 27 | 50 |
|---|---|---|---|---|
| Вместимость (кубометров горючего газа) | 0,95 | 2,59 | 5,38 | 10,01 |
| Объём жидкого пропана (литров) | 4,3 | 10,2 | 22,9 | 42,5 |
Следует иметь в виду, что теплотворная способность пропан-бутановой смеси в три раза выше, чем у природного газа (метана).
В чем измеряется количество газа?
Соответственно, количество газа, как правило, измеряют в кубических метрах (м³), редко — в единицах массы, килограммах или тоннах (в основном — технологических газов).
Сколько тонн в кубометре газа?
Перевод 1 тонны СПГ в кубометры (м 3 ). — 1 тонна СПГ — это примерно 1,38 тыс м 3 природного газа после регазификации. Примерно — потому что плотность газа и компонентный на разных месторождения разная. Формулу Менделеева — Клайперона никто не отменял. Кроме метана в состав природного газа могут входить: этан, пропан, бутан и некоторые другие вещества.
- Плотность газа изменяется в интервале 0,68 — 0,85 кг/м³, но зависит не только от состава, но и от давления и температуры в месте расчета плотности газа.
- Стандартные условия для температуры и давления – это установленные стандартом физические условия, с которыми соотносят свойства веществ, зависящие от этих условий.
Национальный институт стандартов и технологий (NIST) устанавливает температуру 20 °C (293,15 K) и абсолютное давление 1 атм (101.325 кПа), и этот стандарт называют нормальной температурой и давлением (NTP). Плотность компонентов газа сильно различается:
Метан — 0,668 кг/м³, Этан — 1,263 кг/м³, Пропан — 1,872 кг/м³.
Поэтому, в зависимости от компонентного состава изменяется и количество м 3 газа при переводе из тонн. Перевод 1 м³ СПГ в 1 м³ регазифицированного природного газа Пропорции тоже зависят от компонентного состава. В среднем принимается соотношение 1: 600.1 м³ СПГ — это примерно 600 м 3 природного газа после регазификации.
Процесс сжижения идет ступенями, на каждой из которых газ сжимается в 5-12 раз, затем охлаждается и передается на следующую ступень. Собственно сжижение происходит при охлаждении после последней стадии сжатия. Процесс сжижения таким образом требует значительного расхода энергии — до 25 % от ее количества, содержащегося в сжиженном газе.
Ныне применяются 2 техпроцесса:
конденсация при постоянном давлении (компримирование), что довольно неэффективно из-за энергоемкости, теплообменные процессы: рефрижераторный — с использованием охладителя и турбодетандерный/дросселирование с получением необходимой температуры при резком расширении газа.
В процессах сжижения газа важна эффективность теплообменного оборудования и теплоизоляционных материалов. При теплообмене в криогенной области увеличение разности температурного перепада между потоками всего на 0,5ºС может привести к дополнительному расходу мощности в интервале 2 — 5 кВт на сжатие каждых 100 тыс м 3 газа.
каскадный цикл с последовательным использованием в качестве хладагентов пропана, этилена и метана путем последовательного снижения их температуры кипения, цикл с двойным хладагентом — смесью этана и метана, расширительные циклы сжижения.
Известно 7 различных технологий и методы сжижения природного газа:
- для производства больших объемов СПГ лидируют техпроцессы AP-SMR™, AP-C3MR™ и AP-X™ с долей рынка 82% компании Air Products, технология Optimized Cascade, разработанная ConocoPhillips, использование компактных GTL-установок, предназначенных для внутреннего использования на промышленных предприятиях, локальные установки производства СПГ могут найти широкое применение для производства газомоторного топлива ( ГМТ ), использование морских судов с установкой сжижения природного газа ( FLNG ), которые открывают доступ к газовым месторождениям, недоступным для объектов газопроводной инфраструктуры, использование морских плавающих платформ СПГ, к примеру, которая строится компанией Shell в 25 км от западного берега Австралии.
- Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях.
- Нормальными условиями считается температура 0 градусов и давление 101,325 кПа.
- Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм 3 /моль.
- Этот объем называется молярным объемом идеального газа.
В чем измеряется газ при продаже?
Цены на природный газ — Основное использование единицы — при котировке оптовых цен на топливо (как правило, на англо-американских рынках), в основном, газа. Одна тысяча кубических метров природного газа содержит около 360 термов, Газовые счётчики измеряют объём газа; поэтому газовые компании используют коэффициент пересчёта объёма в теплотворную способность ; размерность такого коэффициента в англоязычных странах обычно терм/Ccf (100 кубических футов).
- кубометр в России; 100 кубических футов (Ccf) в США; киловатт-час в Великобритании.
Как правильно измерять расход газа?
Ультразвуковые расходомеры к содержанию — Принцип действия ультразвуковых расходомеров основан на измерении величины ультразвуковых колебаний, которые распространяются в потоке измеряемого вещества. Приборы для измерения количества вещества называются расходометрическими счётчиками.
1.скоростные счётчики, принцип действия которых основан на суммировании числа оборотов помещённого в поток жидкости вращающегося элемента.2.объёмные счетчики, принцип действия которых основан на суммировании объёмов вещества, вытесненного из измерительной камеры прибора.
Наибольшее распространение получили скоростные счётчики.
Сколько кг газа в 50 литровом баллоне?
При покупке бытовых пропановых баллонов часто возникает вопрос: какой будет расход пропана? При ответе на данный вопрос необходимо знать объем газа в баллоне. Сколько газа в баллонах? Баллон объемом 50 литров, В баллоне находится 21,5 кг*. Баллон объемом 27 литров, Чтобы определить сколько газа потребляет ваша газовая плита, необходимо обратиться к технической документации плиты. Например, у газовой плиты гефест ПГ 900 с 4 конфорками максимальный расход газа 486 г/ч (или 0,486 кг/час). Следовательно, если включены все 4 конфорки на максимум, то баллона 50 литров хватит на 44 часа (количество газа в баллоне 21,5 кг делим на расход 0,486 кг/час). Расход газа котлом рассчитывается аналогично расходу газа в газовых плитах. Из нюансов следует отметить, что расход сильно зависит от степени утепления вашего дома, а также от температуры окружающей среды. Чем меньше утеплен дом и чем ниже температура на улице, тем больше необходимо котлу затратить энергии (сжечь газ), чтобы нагреть помещения до необходимой температуры.
Сколько это 1000 кубометров газа?
Энергетический эквивалент природного газа
| тысяча кубометров природного газа → миллион кубометров природного газа | 0.001 |
|---|---|
| тысяча кубометров природного газа → тысяча кубических футов природного газа | 35.96 |
| тысяча кубометров природного газа → кубометр природного газа | 1,000 |
Сколько кг газа в 40 литровом баллоне?
Объем и вес технических газов в стандартных баллонах
| Газ | Объем баллона | Вес газа |
|---|---|---|
| Аргон технический | 40 л | 7,5 кг |
| Углекислота | 40 л | 20-24 кг |
| Пропан | 50 л | 21,5 кг |
| Ацетилен | 40 л | 5 кг |
Как найти объем газа по массе?
Молярный объем газа — Молярный объем газа – это отношение объема вещества к количеству этого вещества. Эту величину вычисляют при делении молярной массы вещества на его плотность по следующей формуле: Vm=M/p, где Vm – молярный объем, М – молярная масса, а p – плотность вещества. Рис.2. Молярный объем формула. В международной системе Си измерение молярного объема газообразных веществ осуществляется в кубических метрах на моль (м 3 /моль) Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм 3 /м. Рис.3. Молярный объем газа при нормальных условиях.
Как рассчитать расход газа через трубу?
Уравнение состояния: P =ρг·Rг·T·z, (6) где Rг = R/M. Для расчета массового расхода газа по трубопроводу основной яв- ляется формула. ρ = ρг/ρв – относительная плотность газа по воздуху.
Как определить первоначальный объем газа?
Данные задачи: P2 (конечное давление) = 1,5Р1 (начальное давление); ΔV (уменьшение объема) = 30 мл; процесс считаем изотермическим. Для нахождения первоначального объема взятого газа будем использовать пропорцию: P1 * V1 = P2 * V2. Подставим значение переменных: P1 * V1 = 1,5P1 * (V1 — 30). V1 = 1,5V1 — 45.0,5V1 = 45 и V1 = 45 / 0,5 = 90 мл. Ответ: Первоначально заданный газ занимал объем 90 мл.