Как найти объем газа при нормальных условиях
Любой идеальный газ можно охарактеризовать несколькими параметрами: температурой, объемом, давлением. Соотношение, устанавливающее связь между этими величинами, называется уравнением состояния газа.

Инструкция
Экспериментально было установлено, что при постоянной температуре P1V1=P2V2, или, что то же самое, PV=const (закон Бойля-Мариотта). При постоянном давлении постоянным остается отношение объема к температуре: V/T=const (закон Гей-Люссака). Если же зафиксировать объем, то P/T=const (закон Шарля). Объединение этих трех законов дает универсальный газовый закон, который гласит, что PV/T=const. Данное уравнение было установлено французским физиком Б. Клапейроном в 1834 году.
Значение постоянной определяется лишь количеством вещества газа. Д.И. Менделеев в 1874 году вывел уравнение для одного моля. Так он получил значение универсальной газовой постоянной: R=8,314 Дж/(моль∙К). Итак, PV=RT. В случае произвольного количества газа ν PV=νRT. Само количество вещества можно найти из отношения массы к молярной массе: ν=m/M.
Молярная масса численно равна относительной молекулярной. Последнюю можно найти из таблицы Менделеева, она указывается в ячейке элемента, как правило, внизу. Молекулярная масса соединения равна сумме молекулярных масс входящих в него элементов. В случае разновалентных атомов требуется умножение на индекс. Например, M(N2O)=14∙2+16=28+16=44 г/моль.
Нормальными условиями для газов принято считать давление P0 =1 атм = 101, 325 кПа, температуру T0=273,15 К = 0°C. Теперь можно найти объем одного моля газа при нормальных условиях: Vm=RT/P0=8,314∙273,15/101,325=22,413 л/моль. Эта табличная величина является молярным объемом.
При нормальных условиях количество вещества равно отношению объема газа к молярному объему: ν=V/Vm. При произвольных условиях надо использовать непосредственно уравнение Менделеева-Клапейрона: ν=PV/RT.
Таким образом, чтобы найти объем газа при нормальных условиях, надо количество вещества (число молей) этого газа умножить на молярный объем, равный 22,4 л/моль. Обратной операцией можно найти количество вещества из заданного объема.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Молярный объем газа

4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
Для того, чтобы узнать состав любых газообразных веществ необходимо уметь оперировать такими понятиями, как молярный объем, молярная масса и плотность вещества. В данной статье рассмотрим, что такое молярный объем, и как его вычислить?
Количество вещества
Количественные расчеты проводят с целью, чтобы в реальности осуществить тот или иной процесс или узнать состав и строение определенного вещества. Эти расчеты неудобно производить с абсолютными значениями массы атомов или молекул из-за того, что они очень малы. Относительные атомные массы также в большинстве случаев невозможно использовать, так как они не связаны с общепринятыми мерами массы или объема вещества. Поэтому введено понятие количество вещества, которое обозначается греческой буквой v (ню) или n. Количество вещества пропорционально числу содержащихся в веществе структурных единиц (молекул, атомных частиц).
Единицей количества вещества является моль.
моль – это такое количество вещества, которое содержит столько же структурных единиц, сколько атомов содержится в 12 г изотопа углерода.
Масса 1 атома равна 12 а. е. м., поэтому число атомов в 12 г изотопа углерода равно:
Na= 12г/12*1,66057*10в степени-24г=6,0221*10 в степени 23
Физическая величина Na называется постоянной Авогадро. Один моль любого вещества содержит 6,02*10 в степени 23 частиц.
Молярный объем газа
Молярный объем газа – это отношение объема вещества к количеству этого вещества. Эту величину вычисляют при делении молярной массы вещества на его плотность по следующей формуле:
Vm=M/p,
где Vm – молярный объем, М – молярная масса, а p – плотность вещества.
В международной системе Си измерение молярного объема газообразных веществ осуществляется в кубических метрах на моль (м3 /моль)
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа. Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм3 /м.
Таблица «молярный объем газов»
В следующей таблице представлен объем некоторых газов:
| Газ | Молярный объем, л |
| H2 | 22,432 |
| O2 | 22,391 |
| Cl2 | 22,022 |
| CO2 | 22,263 |
| NH3 | 22,065 |
| SO2 | 21,888 |
| Идеальный | 22,41383 |
Что мы узнали?
Молярный объем газа, изучаемый по химии (8 класс) наряду с молярной массой и плотностью являются необходимыми величинами для определения состава того или иного химического вещества. Особенностью молярного газа является то, что в одном моле газа всегда содержится одинаковый объем. Этот объем называется молярным объемом газа.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Аэлита Коробка
5/5
-
Александр Котков
5/5
-
Настя Бабич
5/5
-
Александр Котков
5/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
А какая ваша оценка?
Молярный объём
Vm
— это отношение объёма данной порции вещества к его количеству.
Численно молярный объём равен объёму (1) моль вещества.
Обрати внимание!
Молярный объём любого газа при нормальных условиях (давлении (101,3) кПа и температуре (0) °С) равен (22,4) дм³/моль.
Вычисление объёма газа по его количеству
Преобразуем формулу молярного объёма — выразим из неё
V
:
— объём газа равен произведению его количества на молярный объём.
Пример:
вычисли объём (н. у.) метана количеством (1,5) моль.
дм³.
Вычисление количества газа по его объёму
Выразим из формулы молярного объёма
n
:
— количество газа можно вычислить, если его объём разделить на молярный объём.
Пример:
вычисли количество водорода, соответствующее при н. у. его объёму (11,2) дм³.
моль.
Или с учетом химической формулы газа: p = M/V М = M/22,4, где M — молекулярная масса, V М — молярный объем.
Как считать объем газа?
Молярный объём V m — это отношение объёма данной порции вещества к его количеству. Численно молярный объём равен объёму (1) моль вещества. Обрати внимание! Молярный объём любого газа при нормальных условиях (давлении (101,3) кПа и температуре (0) °С) равен (22,4) дм³/моль.
Вычисление объёма газа по его количеству Преобразуем формулу молярного объёма — выразим из неё V : V ( X ) = n ( X ) ⋅ V m — объём газа равен произведению его количества на молярный объём. Пример: вычисли объём (н.у.) метана количеством (1,5) моль. V ( CH 4 ) = n ( CH 4 ) ⋅ V m = 1,5 ⋅ 22,4 = 33,6 дм³.
Вычисление количества газа по его объёму Выразим из формулы молярного объёма n : n ( X ) = V ( X ) V m — количество газа можно вычислить, если его объём разделить на молярный объём. Пример: вычисли количество водорода, соответствующее при н.у. его объёму (11,2) дм³.
Сколько литров в 1 м3 газа?
Кубометр газа — это сколько? — 1 кубометр сжиженного углеводородного газа — это 1000 литров. Не стоит путать кубометр и тонну газа, т.к. они неравнозначны: количество литров зависит от плотности газа, которая может колебаться от 0,51 до 0,56 (соответственно 1000 литров сжиженного газа — это 510-560 кг).
Как измеряют объем природного газа?
Для учета потребления природного газа и передачи показаний счетчика все еще используются кубометры (м 3 ), однако, согласно правилам Кабинета министров № 78 «Правила торговли и использования природного газа », в расчетах за природный газ необходимо использовать киловатт-часы (кВт·ч).
Сколько кубометров газа в 1 кг?
1 кг жидкого пропана объемом около 1,9 л образует около 500 литров газа. Соответственно 1 кг зимней смеси будет иметь объем 0,25х1,7 + 0,75х1,9 = 1,85 л и образует в нормальных условиях газ объемом 0,25х370 + 0,75х500 = 467,5 л (0,4675 м3).
Что такое объем газа?
V — объем газа — пространство, заполняемое газом. Ввиду отсутствия заметного притяжения между молекулами газа, он занимает весь предоставленный ему объем. Формулы, где встречается объем газа: Уравнение Менделеева — Клайперона Давление газа. Уравнение Клайперона. Объединенный газовый закон (при m = const; ν = const) Концентрация молекул газа. Плотность вещества. Работа газа при изобарном процессе,
Как измерить куб газа?
Приведение к нормальным и стандартным условиям — Единицей измерения объема газа является кубический метр (м³). Измеренный объем приводится к нормальным физическим условиям. Нормальные физические условия: давление 101 325 Па, температура 273,16 К (0 °С).
Стандартные условия: давление 101 325 Па, температура 293,16 К (+20 °С). В настоящее время эти обозначения выходят из употребления. Поэтому в дальнейшем следует указывать те условия, к которым относятся объемы и другие параметры газа. Если эти условия не указываются, то это значит, что параметры газа даны при 0 °С (273,16 °К) и 760 мм рт.
ст. (1,033 кгс/см²). Иногда объем газа (особенно в иностранной литературе и нормах) при пользовании системой СИ приводится к 288,16 °К (+15 °С) и давлению 1 бар (105 Па). Если известен объем газа при одних условиях, то пересчитать его в объемы при других условиях можно с помощью коэффициентов, приведенных следующей таблице.
Как перевести объем газа в литры?
Как перевести пропан-бутан из килограммов в литры ? ❓ Для того, чтобы посчитать количество литров в одном килограмме газа нужно воспользоваться формулой: Литр =Килограмм/Плотность Пример: Известно, что в баллоне 50 литров залито 21 килограмм газа, у которого испытательная плотность равна 0,567.
Чтобы посчитать литры нужно 21 разделить на 0,567. Получится 37,04 литра газа. Как перевести пропан-бутан из литров в килограммы? Для того, чтобы посчитать сколько килограммов содержится в одном литре газа нужно воспользоваться формулой: Килограмм= Литр*Плотность Пример: Известно, что в автомобиль заправлено 100 литров газа плотностью 0,567.
Чтобы посчитать какое количество килограммов газа, нужно 100 умножить на 0,567. Получится 56,7 кг газа. Уважаемые клиенты! Рекомендуем Вам 👓 наиболее популярные сезонные товары по низким ценам: Газовые баллоны 🛠️ Газовые комплекты ☘️ Газовая плита Гефест ПГТ-1+ баллон 5л Турист Полный комплект(баллон, редуктор, плита) для выездов на природу, на дачу. Рекомендован автотуристам.3 490 Комплект газовый Кемпинг ПГТ 1Б-В ( газ.горелка + баллон 8 литров), Крым Высота: 365 мм, Диаметр: 265 мм, Рабочее давление: 1,6 Мпа Товар распродан Таганок НЗГА Дачник Н-1 Объем, л 5. Тепловая мощность горелки, кВт: 1,8 Товар распродан Посмотреть все Газовые плиты здесь Посмотреть Газовые баллоны и все для подключения здесь
Какой объем газа в баллоне 50 литров?
Сколько м3 пропана в 1 баллоне на 5, 12, 27, 50 литров? — Мы произвели специальные расчеты, условно переводящие пропан-бутан в газообразное состояние. При стандартных условиях (100 кПа, 288 К) из 1кг сжиженного газа образуется 0,526 м³ пропана или 0,392 м³ бутана.
| Ёмкость баллона (л) | 5 | 12 | 27 | 50 |
|---|---|---|---|---|
| Вместимость (кубометров горючего газа) | 0,95 | 2,59 | 5,38 | 10,01 |
| Объём жидкого пропана (литров) | 4,3 | 10,2 | 22,9 | 42,5 |
Следует иметь в виду, что теплотворная способность пропан-бутановой смеси в три раза выше, чем у природного газа (метана).
В чем измеряется количество газа?
Соответственно, количество газа, как правило, измеряют в кубических метрах (м³), редко — в единицах массы, килограммах или тоннах (в основном — технологических газов).
Сколько тонн в кубометре газа?
Перевод 1 тонны СПГ в кубометры (м 3 ). — 1 тонна СПГ — это примерно 1,38 тыс м 3 природного газа после регазификации. Примерно — потому что плотность газа и компонентный на разных месторождения разная. Формулу Менделеева — Клайперона никто не отменял. Кроме метана в состав природного газа могут входить: этан, пропан, бутан и некоторые другие вещества.
- Плотность газа изменяется в интервале 0,68 — 0,85 кг/м³, но зависит не только от состава, но и от давления и температуры в месте расчета плотности газа.
- Стандартные условия для температуры и давления – это установленные стандартом физические условия, с которыми соотносят свойства веществ, зависящие от этих условий.
Национальный институт стандартов и технологий (NIST) устанавливает температуру 20 °C (293,15 K) и абсолютное давление 1 атм (101.325 кПа), и этот стандарт называют нормальной температурой и давлением (NTP). Плотность компонентов газа сильно различается:
Метан — 0,668 кг/м³, Этан — 1,263 кг/м³, Пропан — 1,872 кг/м³.
Поэтому, в зависимости от компонентного состава изменяется и количество м 3 газа при переводе из тонн. Перевод 1 м³ СПГ в 1 м³ регазифицированного природного газа Пропорции тоже зависят от компонентного состава. В среднем принимается соотношение 1: 600.1 м³ СПГ — это примерно 600 м 3 природного газа после регазификации.
Процесс сжижения идет ступенями, на каждой из которых газ сжимается в 5-12 раз, затем охлаждается и передается на следующую ступень. Собственно сжижение происходит при охлаждении после последней стадии сжатия. Процесс сжижения таким образом требует значительного расхода энергии — до 25 % от ее количества, содержащегося в сжиженном газе.
Ныне применяются 2 техпроцесса:
конденсация при постоянном давлении (компримирование), что довольно неэффективно из-за энергоемкости, теплообменные процессы: рефрижераторный — с использованием охладителя и турбодетандерный/дросселирование с получением необходимой температуры при резком расширении газа.
В процессах сжижения газа важна эффективность теплообменного оборудования и теплоизоляционных материалов. При теплообмене в криогенной области увеличение разности температурного перепада между потоками всего на 0,5ºС может привести к дополнительному расходу мощности в интервале 2 — 5 кВт на сжатие каждых 100 тыс м 3 газа.
каскадный цикл с последовательным использованием в качестве хладагентов пропана, этилена и метана путем последовательного снижения их температуры кипения, цикл с двойным хладагентом — смесью этана и метана, расширительные циклы сжижения.
Известно 7 различных технологий и методы сжижения природного газа:
- для производства больших объемов СПГ лидируют техпроцессы AP-SMR™, AP-C3MR™ и AP-X™ с долей рынка 82% компании Air Products, технология Optimized Cascade, разработанная ConocoPhillips, использование компактных GTL-установок, предназначенных для внутреннего использования на промышленных предприятиях, локальные установки производства СПГ могут найти широкое применение для производства газомоторного топлива ( ГМТ ), использование морских судов с установкой сжижения природного газа ( FLNG ), которые открывают доступ к газовым месторождениям, недоступным для объектов газопроводной инфраструктуры, использование морских плавающих платформ СПГ, к примеру, которая строится компанией Shell в 25 км от западного берега Австралии.
- Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях.
- Нормальными условиями считается температура 0 градусов и давление 101,325 кПа.
- Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм 3 /моль.
- Этот объем называется молярным объемом идеального газа.
В чем измеряется газ при продаже?
Цены на природный газ — Основное использование единицы — при котировке оптовых цен на топливо (как правило, на англо-американских рынках), в основном, газа. Одна тысяча кубических метров природного газа содержит около 360 термов, Газовые счётчики измеряют объём газа; поэтому газовые компании используют коэффициент пересчёта объёма в теплотворную способность ; размерность такого коэффициента в англоязычных странах обычно терм/Ccf (100 кубических футов).
- кубометр в России; 100 кубических футов (Ccf) в США; киловатт-час в Великобритании.
Как правильно измерять расход газа?
Ультразвуковые расходомеры к содержанию — Принцип действия ультразвуковых расходомеров основан на измерении величины ультразвуковых колебаний, которые распространяются в потоке измеряемого вещества. Приборы для измерения количества вещества называются расходометрическими счётчиками.
1.скоростные счётчики, принцип действия которых основан на суммировании числа оборотов помещённого в поток жидкости вращающегося элемента.2.объёмные счетчики, принцип действия которых основан на суммировании объёмов вещества, вытесненного из измерительной камеры прибора.
Наибольшее распространение получили скоростные счётчики.
Сколько кг газа в 50 литровом баллоне?
При покупке бытовых пропановых баллонов часто возникает вопрос: какой будет расход пропана? При ответе на данный вопрос необходимо знать объем газа в баллоне. Сколько газа в баллонах? Баллон объемом 50 литров, В баллоне находится 21,5 кг*. Баллон объемом 27 литров, Чтобы определить сколько газа потребляет ваша газовая плита, необходимо обратиться к технической документации плиты. Например, у газовой плиты гефест ПГ 900 с 4 конфорками максимальный расход газа 486 г/ч (или 0,486 кг/час). Следовательно, если включены все 4 конфорки на максимум, то баллона 50 литров хватит на 44 часа (количество газа в баллоне 21,5 кг делим на расход 0,486 кг/час). Расход газа котлом рассчитывается аналогично расходу газа в газовых плитах. Из нюансов следует отметить, что расход сильно зависит от степени утепления вашего дома, а также от температуры окружающей среды. Чем меньше утеплен дом и чем ниже температура на улице, тем больше необходимо котлу затратить энергии (сжечь газ), чтобы нагреть помещения до необходимой температуры.
Сколько это 1000 кубометров газа?
Энергетический эквивалент природного газа
| тысяча кубометров природного газа → миллион кубометров природного газа | 0.001 |
|---|---|
| тысяча кубометров природного газа → тысяча кубических футов природного газа | 35.96 |
| тысяча кубометров природного газа → кубометр природного газа | 1,000 |
Сколько кг газа в 40 литровом баллоне?
Объем и вес технических газов в стандартных баллонах
| Газ | Объем баллона | Вес газа |
|---|---|---|
| Аргон технический | 40 л | 7,5 кг |
| Углекислота | 40 л | 20-24 кг |
| Пропан | 50 л | 21,5 кг |
| Ацетилен | 40 л | 5 кг |
Как найти объем газа по массе?
Молярный объем газа — Молярный объем газа – это отношение объема вещества к количеству этого вещества. Эту величину вычисляют при делении молярной массы вещества на его плотность по следующей формуле: Vm=M/p, где Vm – молярный объем, М – молярная масса, а p – плотность вещества. Рис.2. Молярный объем формула. В международной системе Си измерение молярного объема газообразных веществ осуществляется в кубических метрах на моль (м 3 /моль) Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм 3 /м. Рис.3. Молярный объем газа при нормальных условиях.
Как рассчитать расход газа через трубу?
Уравнение состояния: P =ρг·Rг·T·z, (6) где Rг = R/M. Для расчета массового расхода газа по трубопроводу основной яв- ляется формула. ρ = ρг/ρв – относительная плотность газа по воздуху.
Как определить первоначальный объем газа?
Данные задачи: P2 (конечное давление) = 1,5Р1 (начальное давление); ΔV (уменьшение объема) = 30 мл; процесс считаем изотермическим. Для нахождения первоначального объема взятого газа будем использовать пропорцию: P1 * V1 = P2 * V2. Подставим значение переменных: P1 * V1 = 1,5P1 * (V1 — 30). V1 = 1,5V1 — 45.0,5V1 = 45 и V1 = 45 / 0,5 = 90 мл. Ответ: Первоначально заданный газ занимал объем 90 мл.
- Молярный объем газа
- Объем газа при нормальных условиях
- Газовые законы. Закон Авогадро. Молярный объем газа
- § 17. Молярный объём газов
- Объем газа при нормальных условиях
Молярный объем газа
Из положений о том, что один моль любого вещества включает число частиц этого вещества, равное числу Авогадро, и что равные числа частиц различных газов при одинаковых физических условиях содержатся в равных объемах этих газов, вытекает следствие:
равные количества любых газообразных веществ при одинаковых физических условиях занимают равные объемы
Например, объем одного моль любого газа имеет (при p, T = const) одно и то же значение. Следовательно, уравнение реакции, протекающей с участием газов, задает не только соотношение их количеств и масс, но и объемов.
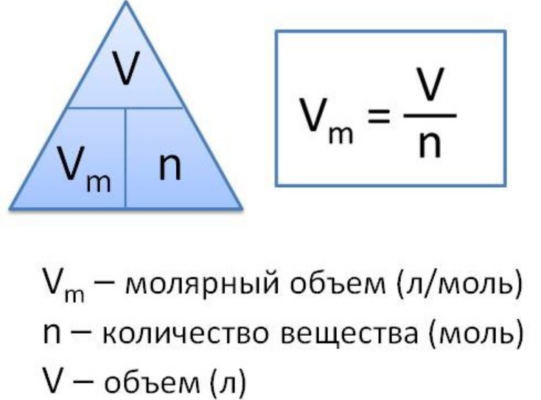
молярный объем газа (VM) — это объем газа в котором содержится 1 моль частиц этого газа
VM = V / n
Единица молярного объема газа в СИ — кубический метр на моль (м 3 /моль), но чаще используют дольные единицы — литр (кубический дециметр) на моль (л/моль, дм 3 /моль) и мллилитр (кубический сантиметр) на моль (см 3 /моль).
В соответствии с определением молярного объема дял любого газа отношение его объема V к количеству n будет одинаковым при условии, что это идеальный газ.
При нормальных условиях (н.у.) — 101,3 кПа, 0°С — молярный объем идеального газа равен
VM = 2,241381·10 -2 м 3 /моль ≈ 22.4 л/моль
В химических расчетах используется округленное значение 22,4 л/моль, поскольку точное значение относится к идеальному газу, а большинство реальных газов по свойствам отличаются от него. Реальные газы с очень низкой температурой равновесной конденсации (H2, O2, N2) при нормальных условиях имеют объем, почти равный 22,4 л/моль, а газы, конденсирующиеся при высоких температурах, имеют несколько меньшее значение молярного объема при н.у.: для CO2 — 22.26 л/моль, для NH3 — 22,08 л/моль.
Зная объем некоторого газа при заданных условиях, можно определить количество веществ в этом объеме, и наоборот, по количеству вещества в данной порции газа можно найти объем этой порции:
n = V / VM; V = VM * n
Молярный объем газа при н.у. — фундаментальная физическая постоянная, которая широко используется в химических расчетах. Она позволяет применять объем газа вместо его массы, что очень удобно в аналитической химии (газоанализаторы основанные на измерении объема), поскольку легче измерить объем газа, чем его массу.
Значение молярного объема газа при н.у. является коэффициентом пропорциональности между постоянными Авогадро и Лошмидта:
VM = NA / NL = 6.022·10 23 (моль -1 ) / 2,24·10 4 (см 3 /моль) = 2.69·10 19 (см -3 )
Используя значения молярного объема и молярную массу газа можно определить плотность газа:
ρ = M / VM
В расчетах, основанных на законе эквивалентов для газообразных веществ (реагентов, продуктов) вместо эквивалентной массы удобнее применятьэквивалентный объем, который предстваляет собой отношение объема порции данного газа к эквивалентному количеству вещества в этой порции:
Veq = V / neq = V / zn = VM / z; (p, T = const)
Единица эквивалентного объема совпадает с единицей молярного объема. Значение эквивалентного объема газа является константой данного газа только в конкретной реакции, так как зависит от фактора эквивалентности feq.
Молярный объем газа
Молярный объем газа Из положений о том, что один моль любого вещества включает число частиц этого вещества, равное числу Авогадро, и что равные числа частиц различных газов при одинаковых
Источник: techemy.com
Объем газа при нормальных условиях
Тема 1
УРОК 7
Тема. Молярный объем газов. Вычисление объема газа при нормальных условиях
Цели урока: ознакомить учащихся с понятием «молярный объем»; раскрыть особенности использования понятия «молярный объем» для газообразных веществ; научить учащихся использовать полученные знания для расчетов объемов газов при нормальных условиях.
Тип урока: комбинированный.
Формы работы: рассказ учителя, управляемая практика.
Оборудование: Периодическая система химических элементов Д. И. Менделеева, карточки с заданиями, куб объемом 22,4 л (со стороной 28,2 см).
II. Проверка домашнего задания, актуализация опорных знаний
Ученики сдают на проверку выполненное на листах домашнее задание.
1) Что такое «количество вещества»?
2) Единица измерения количества вещества.
3) Сколько частиц содержится в 1 моль вещества?
4) Какая существует зависимость между количеством вещества и агрегатного состояния, в котором находится это вещество?
5) Сколько молекул воды содержится в 1 моль льда?
6) А в 1 моль жидкой воды?
7) В 1 моль водяного пара?
8) Какую массу будут иметь:
III . Изучение нового материала
Создание и решение проблемной ситуации Проблемный вопрос. Какой объем будет занимать:
Ответить на эти вопросы сразу мы не можем, потому что объем вещества зависит от плотности вещества. И согласно формуле V = m / ρ , объем будет разным. 1 моль пара занимает больший объем, чем 1 моль воды или льда.
Потому, что в жидких и газообразных веществах расстояние между молекулами воды разная.
Изучением газообразных веществ занималось множество ученых. Значительный вклад в изучение этого вопроса внесли французский химик Жозеф Луи Гей-Люссак и английский физик Роберт Бойль, которые сформулировали ряд физических закономерностей, описывающих состояние газов.
Из этих закономерностей вы знаете?
Все газы одинаково сжимаются, имеют одинаковый термический коэффициент расширения. Объемы газов зависят не от размеров отдельных молекул, а от расстояния между молекулами. Расстояния между молекулами зависят от скорости их движения, энергии и, соответственно, температуры.
На основании этих законов и своих исследований итальянский ученый Амедео Авогадро сформулировал закон:
В равных объемах различных газов содержится одинаковое количество молекул.
При обычных условиях газообразные вещества имеют молекулярное строение. Молекулы газов очень мелкие по сравнению с расстоянием между ними. Поэтому объем газа определяется не размером частиц (молекул), а расстоянием между ними, что для любого газа примерно одинакова.
А. Авогадро сделал вывод, что, если взять 1 моль, т. е. 6,02 · 1023 молекул любых газов, то они будут занимать одинаковый объем. Но при этом измеряться этот объем при одинаковых условиях, то есть при одинаковых температуре и давлении.
Условия, при которых проводятся подобные расчеты, назвали нормальными условиями.
Нормальные условия (н. в.):
Т= 273 К или t = 0 °С
Р = 101,3 кПа или Р = 1 атм. = 760 мм рт. ст.
Объем 1 моль вещества называют молярным объемом ( Vm ). Для газов при нормальных условиях равен 22,4 л/моль.
Демонстрируется куб объемом 22,4 л.
В таком кубе содержится 6,02-1023 молекул любых газов, например, кислорода, водорода, аммиака ( NH 3 ), метана (СН4).
При каких условиях?
При температуре 0 °С и давлении 760 мм рт. ст.
Из закона Авогадро следует, что
где Vm = 22,4 л/моль любого газа при н. в.
Итак, зная объем газа, можно вычислить количество вещества, и наоборот.
IV. Формирование навыков и умений
Практика на примерах
Вычислите, какой объем будут занимать 3 моль кислорода при н. в.
Вычислите количество молекул карбон( IV ) оксида в объеме 44,8 л (н. в).
2) Вычислим количество молекул С O 2 по формулам:
N ( CO 2) = 2 моль · 6,02 · 1023 молекул/моль = 12,04 · 1023 молекул.
Ответ: 12,04 · 1023 молекул.
Вычислите, какой объем занимает азот массой 112 г (по н. в.).
V ( N 2 ) = 4 моль · 22,4 л/моль = 89,6 л.
V. Домашнее задание
Проработать соответствующий параграф учебника, ответить на вопросы.
Творческое задание (домашняя практика). Самостоятельно решить задачи 2, 4, 6 с карты.
Карточка-задание к уроку 7
Вычислите, какой объем займет 7 моль азота N 2 (по н. в.).
Вычислите количество молекул водорода объемом 112 л.
(Ответ: 30,1 · 1023 молекул)
Вычислите, какой объем занимает сероводород массой 340 г.
Объем газа при нормальных условиях
Молярный объем газов. Вычисление объема газа при нормальных условиях – КОЛИЧЕСТВО ВЕЩЕСТВА. РАСЧЕТЫ ПО ХИМИЧЕСКИМ ФОРМУЛАМ – ВСЕ УРОКИ ХИМИИ – 8 класс – конспекты уроков – уроки химии – План урока – Конспект урока – Планы уроков – разработки уроков по химии – ХИМИЯ – Стандарт и академический уровень школьная программа – всех уроков химии для восьмого класса 12-летней школы
Источник: schooled.ru
Газовые законы. Закон Авогадро. Молярный объем газа
Французский ученый Ж.Л. Гей-Люссак установил законобъемный отношений:
Например, 1 л хлора соединяется с 1 л водорода, образуя 2 л хлороводорода; 2 л оксида серы (IV) соединяются с 1 л кислорода, образуя 1 л оксида серы (VI).
Этот закон позволил итальянскому ученому А. Авогадро предположить, что молекулы простых газов (водорода, кислорода, азота, хлора и др.) состоят из двух одинаковых атомов. При соединении водорода с хлором их молекулы распадаются на атомы, а последние образуют молекулы хлороводорода. Но поскольку из одной молекулы водорода и одной молекулы хлора образуются две молекулы хлороводорода, объем последнего должен быть равен сумме объемов исходных газов.
Таким образом, объемные отношения легко объясняются, если исходить из представления о двухатомности молекул простых газов (Н2, Сl2, O2, N2 и др.)- Это служит, в свою очередь, доказательством двухатомности молекул этих веществ.
Изучение свойств газов позволило А. Авогадро высказать гипотезу, которая впоследствии была подтверждена опытными данными, а потому стала называться законом Авогадро:
Из закона Авогадро вытекает важное следствие: при одинаковых условиях 1 моль любого газа занимает одинаковый объем.
Этот объем можно вычислить, если известна масса 1 л газа. При нормальных условиях, (н.у.) т. е. температуре 273К (О°С) и давлении 101 325 Па (760 мм рт. ст.) , масса 1 л водорода равна 0,09 г, молярная масса его равна 1,008 • 2 = 2,016 г/моль . Тогда объем, занимаемый 1 моль водорода при нормальных условиях, равен 22,4 л
При тех же условиях масса 1л кислорода 1,492г ; молярная 32г/моль. Тогда объем кислорода при (н.у.), тоже равен 22,4 моль.
Молярным объем газа — это отношение объема вещества к количеству этого вещества:
где Vm — молярный объем газа (размерность л/моль ); V — объем вещества системы; n — количество вещества системы. Пример записи: Vm газа (н.у.) =22,4 л/моль.
На основании закона Авогадро определяют молярные массы газообразных веществ. Чем больше масса молекул газа, тем больше масса одного и того же объема газа. В равных объемах газов при одинаковых условиях содержится одинаковое число молекул, а следовательно, и молей газов. Отношение масс равных объемов газов равно отношению их молярных масс:
где m1 — масса определенного объема первого газа; m2 — масса такого же объема второго газа; M1 и M2 — молярные массы первого и второго газов.
Обычно плотность газа определяют по отношению к самому легкому газу — водороду (обозначают DH2). Молярная масса водорода равна 2г/моль. Поэтому получаем.
Молекулярная масса вещества в газообразном состоянии равна его удвоенной плотности по водороду.
Часто плотность газа определяют по отношению к воздуху (DB). Хотя воздух является смесью газов, все же говорят о его средней молярной массе. Она равна 29г/моль. В этом случае молярная масс определяется выражением М = 29DB.
Определение молекулярных масс показало, что молекулы простых газов состоят из двух атомов (Н2, F2,Cl2, O2 N2), а молекулы инертных газов — из одного атома(He, Ne, Ar, Kr, Xe, Rn). Для благородных газов «молекула» и «атом» равнозначны.
Закон Бойля — Мариотта: при постоянной температуре объем данного количества газа обратно пропорционален давлению, под которым он находится.Отсюда pV = const,
где р — давление, V — объем газа.
Закон Гей-Люссака: при постоянном давлении и изменение объема газа прямо пропорционально температуре, т.е.
V/T = const,
где Т — температура по шкале К (кельвина)
Объединенный газовый закон Бойля — Мариотта и Гей-Люссака:
pV/T = const.
Эта формула обычно употребляется для вычисления объема газа при данных условиях, если известен его объем при других условиях. Если осуществляется переход от нормальных условий (или к нормальным условиям), то эту формулу записывают следующим образом:
pV/T = pV/T,
где р,V,T -давление, объем газа и температура при нормальных условиях (р = 101 325 Па [760 мм рт. ст.], Т = 273 К V=22,4л/моль).
Если известны масса и количество газа, а надо вычислить его объем, или наоборот, используют уравнение Менделеева-Клайперона:
где n — количество вещества газа, моль; m — масса, г; М — молярная масса газа, г/иоль; R — универсальная газовая постоянная. R = 8,31 Дж/(моль*К)
Газовые законы
Газовые законы. Закон Авогадро. Молярный объем газа Французский ученый Ж.Л. Гей-Люссак установил закон объемный отношений: Например, 1 л хлора соединяется с 1 л водорода , образуя 2
Источник: es.himbiorep.ru
§ 17. Молярный объём газов
Массу 1 моль вещества называют молярной. А как называют объём 1 моль вещества? Очевидно, что и его называют молярным объёмом.
Чему равен молярный объём воды? Когда мы отмеривали 1 моль воды, мы не взвешивали на весах 18 г воды — это неудобно. Мы пользовались мерной посудой: цилиндром или мензуркой, так как знали, что плотность воды равна 1 г/мл. Поэтому молярный объём воды равен 18 мл/моль. У жидкостей и твёрдых веществ молярный объём зависит от их плотности (рис. 52, а). Другое дело у газов (рис. 52, б).
Рис. 52.
Молярные объёмы (н. у.):
а — жидкостей и твёрдых веществ; б — газообразных веществ
Если взять 1 моль водорода Н2 (2 г), 1 моль кислорода O2 (32 г), 1 моль озона O3 (48 г), 1 моль углекислого газа СO2 (44 г) и даже 1 моль водяных паров Н2O (18 г) при одинаковых условиях, например нормальных (в химии принято называть нормальными условиями (н. у.) температуру 0 °С и давление 760 мм рт. ст., или 101,3 кПа), то окажется, что 1 моль любого из газов займёт один и тот же объём, равный 22,4 л, и содержит одинаковое число молекул — 6 × 10 23 .
А если взять 44,8 л газа, то какое количество вещества его будет взято? Конечно же 2 моль, так как заданный объём вдвое больше молярного. Следовательно:
где V — объём газа. Отсюда
Молярный объём — это физическая величина, равная отношению объёма вещества к количеству вещества.
Молярный объём газообразных веществ выражается в л/моль. Vm — 22,4 л/моль. Объём одного киломоля называют киломолярным и измеряют в м 3 /кмоль (Vm = 22,4 м 3 /кмоль). Соответственно миллимолярныи объём равен 22,4 мл/ммоль.
Задача 1. Найдите массу 33,6 м 3 аммиака NH3 (н. у.).
Задача 2. Найдите массу и объём (н. у.), который имеют 18 × 10 20 молекул сероводорода H2S.
При решении задачи обратим внимание на число молекул 18 × 10 20 . Так как 10 20 в 1000 раз меньше 10 23 , очевидно, расчёты следует вести с использованием ммоль, мл/ммоль и мг/ммоль.
Ключевые слова и словосочетания
- Молярный, миллимолярный и киломолярный объёмы газов.
- Молярный объём газов (при нормальных условиях) равен 22,4 л/моль.
- Нормальные условия.
Работа с компьютером
- Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
- Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Вопросы и задания
- Найдите массу и число молекул при н. у. для: а) 11,2 л кислорода; б) 5,6 м 3 азота; в) 22,4 мл хлора.
- Найдите объём, который при н. у. займут: а) 3 г водорода; б) 96 кг озона; в) 12 × 10 20 молекул азота.
- Найдите плотности (массу 1 л) аргона, хлора, кислорода и озона при н. у. Сколько молекул каждого вещества будет содержаться в 1 л при тех же условиях?
- Рассчитайте массу 5 л (н. у.): а) кислорода; б) озона; в) углекислого газа СO2.
- Укажите, что тяжелее: а) 5 л сернистого газа (SO2) или 5 л углекислого газа (СO2); б) 2 л углекислого газа (СO2) или 3 л угарного газа (СО).
Объем газа при нормальных условиях
Химия 8 класс. Молярный объём газов
Источник: tepka.ru
Объем газа при нормальных условиях
2.6. Закон Авогадро (А. Авогадро, 1811)
В равных объемах газов (V) при одинаковых условиях (температуре Т и давлении Р) содержится одинаковое число молекул.
Следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объем.
В частности, при нормальных условиях, т.е. при 0 ° С (273К) и 101,3 кПа, объем 1 моля газа, равен 22,4 л. Этот объем называют молярным объемом газа Vm.
Таким образом, при нормальных условиях (н.у.) молярный объем любого газа Vm = 22,4 л/моль.
Закон Авогадро используется в расчетах для газообразных веществ. При пересчете объема газа от нормальных условий к любым иным используется объединенный газовый закон Бойля-Мариотта и Гей-Люссака:
где Рo, Vo, Тo – давление, объем газа и температура при нормальных условиях (Рo = 101,3 кПа, Тo = 273К).
Если известна масса (m) или количество ( n ) газа и требуется вычислить его объем, или наоборот, используют уравнение Менделеева – Клапейрона:
где n = m/M – отношение массы вещества к его молярной массе,
R – универсальная газовая постоянная, равная 8,31 Дж/(моль × К).
Из закона Авогадро вытекает еще одно важное следствие: отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов. Эта постоянная величина называется относительной плотностью газа и обозначается D. Так как молярные объемы всех газов одинаковы (1-е следствие закона Авогадро), то отношение молярных масс любой пары газов также равна этой постоянной:
где М1 и М2 – молярные массы двух газообразных веществ.
Величина D определяется экспериментально как отношение масс одинаковых объемов исследуемого газа (М1) и эталонного газа с известной молекулярной массой (М2). По величинам D и М2 можно найти молярную массу исследуемого газа:
Объем газа при нормальных условиях
Объем газа при нормальных условиях 2.6. Закон Авогадро (А. Авогадро, 1811) В равных объемах газов (V) при одинаковых условиях (температуре Т и давлении Р) содержится одинаковое число
Источник: pipec8.narod.ru