Молярный объем газа

4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
Для того, чтобы узнать состав любых газообразных веществ необходимо уметь оперировать такими понятиями, как молярный объем, молярная масса и плотность вещества. В данной статье рассмотрим, что такое молярный объем, и как его вычислить?
Количество вещества
Количественные расчеты проводят с целью, чтобы в реальности осуществить тот или иной процесс или узнать состав и строение определенного вещества. Эти расчеты неудобно производить с абсолютными значениями массы атомов или молекул из-за того, что они очень малы. Относительные атомные массы также в большинстве случаев невозможно использовать, так как они не связаны с общепринятыми мерами массы или объема вещества. Поэтому введено понятие количество вещества, которое обозначается греческой буквой v (ню) или n. Количество вещества пропорционально числу содержащихся в веществе структурных единиц (молекул, атомных частиц).
Единицей количества вещества является моль.
моль – это такое количество вещества, которое содержит столько же структурных единиц, сколько атомов содержится в 12 г изотопа углерода.
Масса 1 атома равна 12 а. е. м., поэтому число атомов в 12 г изотопа углерода равно:
Na= 12г/12*1,66057*10в степени-24г=6,0221*10 в степени 23
Физическая величина Na называется постоянной Авогадро. Один моль любого вещества содержит 6,02*10 в степени 23 частиц.
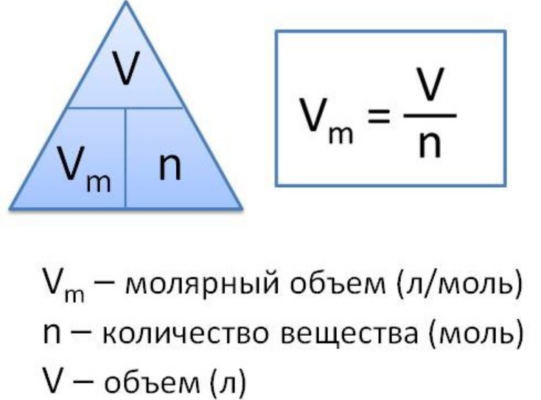
Молярный объем газа
Молярный объем газа – это отношение объема вещества к количеству этого вещества. Эту величину вычисляют при делении молярной массы вещества на его плотность по следующей формуле:
Vm=M/p,
где Vm – молярный объем, М – молярная масса, а p – плотность вещества.
В международной системе Си измерение молярного объема газообразных веществ осуществляется в кубических метрах на моль (м3 /моль)
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа. Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм3 /м.
Таблица «молярный объем газов»
В следующей таблице представлен объем некоторых газов:
| Газ | Молярный объем, л |
| H2 | 22,432 |
| O2 | 22,391 |
| Cl2 | 22,022 |
| CO2 | 22,263 |
| NH3 | 22,065 |
| SO2 | 21,888 |
| Идеальный | 22,41383 |
Что мы узнали?
Молярный объем газа, изучаемый по химии (8 класс) наряду с молярной массой и плотностью являются необходимыми величинами для определения состава того или иного химического вещества. Особенностью молярного газа является то, что в одном моле газа всегда содержится одинаковый объем. Этот объем называется молярным объемом газа.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Аэлита Коробка
5/5
-
Александр Котков
5/5
-
Настя Бабич
5/5
-
Александр Котков
5/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
А какая ваша оценка?
Как вычислить объем газа
Газ, как и вещества, находящиеся в других агрегатных состояниях, имеет ряд параметров, в число которых входит и объем. Объем газа находится на основании других его характеристик, которые приведены в условии задачи. Любой газ, независимо от вида и состава, имеет объем, который и требуется найти во многих задачах.
Инструкция
Газ, независимо от его состава, имеет три основных параметра: массу, объем и плотность. В большинстве задач оперируют так называемым идеальным газом, поэтому опираться в них необходимо лишь на приведенные в условии значения массы, давления, температуры. Например, в условии задачи может быть указан газ азот N2 с температурой в 60 градусов, давлением в 30 кПа и массой в 0,05 г. Зная эти три параметра и состав газа, по уравнению Менделеева-Клапейрона можно найти его объем. Для этого необходимо переделать данное уравнение следующим образом:
pV=mRT/M.
Осуществив дальнейшее преобразование формулы, найдите объем азота:
V =mRT/pM.
При этом молярную массу M можно найти по таблице Д.И. Менделеева. У азота она равна 12 г/моль. Тогда:
V=0,05*12*8,31*333/30*12≈4,61.
Если известны объем при нормальных условиях, а объем при других условиях является искомым, примените законы Бойля-Мариотта и Гей-Люссака:
pV/T=pнVн/Tн.
В таком случае преобразуйте формулу следующим образом:
pV*Tн=pнVн*T.
Отсюда объем V равен:
V=pнVн*T/p*Tн.
Индекс н означает величину того или иного параметра при нормальных условиях.
Если рассматривать объем газа с точки зрения термодинамики, можно заметить, что на газы могут действовать силы, за счет которых меняется объем. При этом давление газа постоянно, что характерно для изобарных процессов. В ходе таких процессов объем изменяется с одной величины на другую. Их можно обозначить как V1 и V2. В условиях ряда задач описывается некоторый газ, находящийся под поршнем в сосуде. При расширении этого газа поршень передвигается на некоторое расстояние dl, в результате чего осуществляется работа:
A=pdV=p(V2 -V1).
Эта формула связывает изменение объема газа и работу. Как известно, если дан конечный объем V2, то можно найти начальный объем V1:
V1=pV2-A/p.
Наконец, наиболее просто найти объем газа, исходя из двух других физических параметров – массы и плотности. Если в условиях задан газ с некоторой плотностью и массой, то его объем следует вычислять по формуле:
V=m/ρ.
У каждого газа имеется определенная плотность, как и у любого твердого или жидкого вещества. Поэтому, находя объем газа, в первую очередь необходимо учитывать именно этот параметр.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Рассчитать объем воздуха:
Рассчитать объем воздуха (газа) при нормальных условиях, если известна его масса, можно по формуле: V = m · Vm / M = ν · Vm. Рассчитать объем воздуха (газа), если известна его масса, температура и давление, можно по формуле: V = m · R · T / (p · M) = ν · R · T / p.
Расчет объема воздуха (газа)
Теория расчета объема газа
Пример: Рассчитайте объем для 1 кг воздуха
Рассчитать объем газа: азота, водорода, воздуха, гелия, озона, кислорода, углекислого газа, хлора
Рассчитать объем воздуха (газа) при нормальных условиях:
Рассчитать объем воздуха (газа):
Теория:
Рассчитать объем воздуха (газа) при нормальных условиях, если известна его масса, можно по формуле:
V = m · Vm / M = ν · Vm,
где
V – объем газа, л,
ν – количество вещества, моль,
Vm – молярный объем газа, л/моль, Vm = 22,4 л/моль,
ν = m / M,
m – масса газа, г,
М – молярная масса газа, г/моль,
M(воздух) = 28,966 г/моль,
Нормальные условия: 0 оС (или 273,15 К), 101,325 кПа или 1 атм.
Рассчитать объем воздуха (газа), если известна его масса, температура и давление, можно по формуле:
V = m · R · T / (p · M) = ν · R · T / p,
где
V – объем газа, л,
ν – количество вещества, моль,
ν = m / M,
m – масса газа, г,
М – молярная масса газа, г/моль,
M(воздух) = 28,966 г/моль,
R – универсальная газовая постоянная, R ≈ 8,314 Дж/(моль⋅К),
T – термодинамическая температура, К.
P – давление, кПа.
Пример: Рассчитайте объем для 1 кг воздуха:
Рассчитайте объем для 1 кг воздуха при нормальных условиях.
V = m · Vm / M = 1 000 грамм · 22,4 л/моль / 28,966 г/моль = 773,32 литра.
Рассчитайте объем для 1 кг воздуха при 30 градусах Цельсия (303,15 К), давлении 30 кПа.
V = m · R · T / p · M = 1 000 грамм · 8,314 Дж/(моль⋅К) · 303,15 К / (30 кПа · 28,966 г/моль) = 2 900,399 литров или 2,900399 м3.
Рассчитать объем газа: азота, водорода, воздуха, гелия, озона, кислорода, углекислого газа, хлора
Коэффициент востребованности
2 249
Объем воздуха,
объем и масса продуктов сгорания
определяются на 1 кг твердого, жидкого
или на 1 м3
сухого газообразного топлива при
нормальных условиях.
Объем воздуха,
необходимый для сгорания топлива.
Теоретический (при коэффициенте
избытка воздуха в топке αт=1)
объем сухого воздуха (м3/кг),
необходимый для полного сгорания 1 кг
твердого или жидкого топлива, определяется
по формуле
V0=0,089Cp+0,226Hp+0,033(S-Op). (1.27)
Теоретический
объем воздуха (м3/м3),
необходимый для полного сгорания 1
м3
сухого газообразного топлива, определяется
по формуле
V0=0,0478[0,5(CO+H2)+1,5H2S+2CH4+Σ(m+n/4)CmHn-O2]. (1.28)
В формуле (1.27)
содержание элементов топлива выражается
в процентах на 1 кг массы топлива, а в
(1.28) содержание горючих газов СО, Н2,
H2S,
СН4
и т. д. — в процентах по объему.
Для сгорания смеси
двух твердых, жидких или газообразных
топлив теоретический объем сухого
воздуха определяется по формуле
V=b1V
+(1-b1)
V, (1.29)
где b1
— массовая
доля одного из топлив в смеси.
Действительный
объем воздуха (м3/кг,
м3/м3),
поступивший в топку, определяется по
формуле
Vд=αтV0,
(1.30)
где αт—
коэффициент избытка воздуха в топке.
Состав и
объем
продуктов сгорания
топлива. При
полном сгорании топлива продукты
сгорания содержат газы: СО2,
SO;
N2,
О2
и пары воды Н2О,
т. е.
CO2+SO2+N2+O2+H2O=100%.
Полный объем
продуктов сгорания Vг(м3/кг)
представляет собой сумму объемов сухих
газов Vcг
и водяных
паров VHгO:
Vг=Vсг+VHгO, (0.31)
при этом
Vсг=VROг+VNг+VOг
где VROг=VCOг+VSOг
— объем
трехатомных газов, м3/кг;
VNг+VOг
— объем двухатомных газов, м3/кг.
Для твердых (кроме
сланцев) и жидких топлив теоретические
объемы (м3/кг)
продуктов полного сгорания при
αт=1
определяются по формулам:
объем двухатомных
газов
; (1.32)
объем трехатомных
газов
VROг=0,0187(CP+0,375S); (1.33)
объем сухих газов
V=VROг+
=0,0187(CP+0,375S
)
(1.34)
объем водяных
паров
V=0,0124(9Hp+Wp)+0,0161V0; (1.35)
полный объем
продуктов сгорания
V=V
+V
=0,0187(CP+0,375S
)
+0,0124(9Hp+Wp)+0,0161V0.
(1.36)
Для сланцев объем
трехатомных газов определяется по
формуле
V=V
+[0,509(СО2)
/100]
K=0,0187
(Cp+0,375S)+[0,509(CO2)
/l00]К, (1.37)
где K
— коэффициент разложения карбонатов:
при слоевом сжигании К=0,7,
при камерном
— 1,0.
Для газообразного
топлива теоретические объемы продуктов
сгорания (м3/м3)
при αт=1
определяются по формулам:
объем двухатомных
газов
; (1.38)
объем трехатомных
газов
V=
0,01[CO2+CO+H2S+ΣmCmHn]; (1.39)
объем сухих газов
V=V
+V
; (1.40)
объем водяных
паров
V=0,01[H2S+H2+Σ(n/2)СmНn+0,124dг]+0,0161V0, (1.41)
где dг
— влагосодержание
газообразного топлива, отнесенное к 1
м3
сухого газа, г/м3;
полный объем
продуктов сгорания
V=V
+V
. (1.42)
Для твердых (кроме
сланцев), жидких и газообразных топлив
объемы продуктов полного сгорания
(м3/кг)
при αт
>1 определяются по формулам:
объем сухих газов
Vсг=V+(αт-1)V0=V
+V
+(αт-1)V0; (1.43)
объем водяных
паров
V=V
+0,0161(αт-1)V0; (1.44)
полный объем
продуктов сгорания определяется по
формуле (1.31).
Для сланцев полный
объем продуктов сгорания (м3/кг)
при αт
>1:
Vгк=V+V
+V
=V
+V
+0,0124(9Hp+Wp)+0,0161αтV0. (1.45)
Содержание (%) СО2,
SO2
и RO2
в сухих газах при полном сгорании топлива
определяется по формулам:
CO2=(V/Vcг)100; (1.46)
SО2=(
V/Vcг)100; (1.47)
RО2=(V/Vcг)100. (1.48)
Максимальное
содержание (%) трехатомных газов ROв сухих газах при полном сгорании топлива
RO=21/(l+β), (1.49)
где β
— характеристика
топлива:
для твердого и
жидкого
β
=2,35(Hp-0,126Op+0,04Np)/(Cp+0,375S); (1.50)
для газообразного

Содержание (%) азота
N2
и кислорода О2
в сухих газах при
полном
сгорании топлива
N2=100-RO2-O2; (1.52)
O2=21-βRO2-RO2. (1.53)
Масса продуктов
сгорания:
для твердого (кроме
сланцев) и жидкого топлива (кг/кг)
Мг=1-0,01Ар+1,306αтV0; (l.54)
для газообразного
топлива (кг/м3)
Мг=+0,001dгт+1,306αтV0, (1.55)
где
— плотность сухого газа, кг/м3;
dгт
— содержание влаги в топливе, кг/м3;
для сланцев (кг/кг)
Mгк=1-0,01А+1,306αтV0+0,01(СО2)
К, (1.56)
где А
— расчетное
содержание золы в топливе с учетом
неразложившихся карбонатов, %; К
— коэффициент
разложения карбонатов: при слоевом
сжигании К=0,7,
при камерном
— 1,0.
Расчетное содержание
(%) золы в топливе с учетом неразложившихся
карбонатов
А=Ар+(1-К)(СО2)
. (1.57)
Для твердых топлив
концентрация золы в продуктах сгорания
определяется по формуле
μзл=Араун/(100Мг), (1.58)
где аун
— доля золы топлива, уносимой продуктами
сгорания.
Коэффициент
избытка воздуха в топке.
При полном сгорании топлива коэффициент
избытка воздуха в топке определяется
по формуле
, (1.59)
где О2
и N2
— содержание кислорода и азота в газах,
%.
Задача 1.27.
Определить
объем продуктов полного сгорания на
выходе из топки, а также теоретический
и действительный объемы воздуха,
необходимые для сгорания 1 м3
природного
газа Ставропольского месторождения
состава: СО2=0,2%;
СН4=98,2%;
С2Н6=0,4%;
С3Н8=0,1%;
С4Н10=0,1%;
N2=l,0%.
Коэффициент избытка воздуха в топке
αт=1,2.
Решение:
Теоретический объем воздуха, необходимый
для полного сгорания 1 м3
топлива, определяем по формуле (1.28)
V0=0,0478[0,5CO+0,5H2+1,5H2S+2CH4+Σ(m+n/4)CmHn-O2]=
=0,0478(2·98,2+3,5·0,4+5·0,1+6,5·0,1)=9,51
м3/м3.
Действительный
объем воздуха по формуле (1.30)
Vд=αтV0=1,2·9,51=11,41м3/м3.
Объем сухих газов
при αт=1,2,
по формуле (1.43),
Vсг=V+(αт-1)V0=V
+V
+(αт-1)V0=
=0,01(0,2+98,2+2·0,4+3·0,1+4·0,1)+0,79·9,51+1,0/100+(1,2-1)9,51=10,42
м3/м3.
Объем водяных
паров при αт=1,2,
по формуле (1.44),
V=0,01(H2S+H2+2CH4+3C2H6+4C3H8+5С4Н10+0,124dг)+0,0161αтV0=
=0,01(2·98,2+3·0,4+4·0,1+5·0,1)+0,0161·1,2·9,51=2,17
м3/м3.
Объем продуктов
полного сгорания, по формуле (1.31),
Vг=Vсг+V=10,42+2,17=12,59
м3/м3.
Задача 1.28.
Определить
на выходе из топки объем продуктов
полного сгорания
1 кг карагандинского
угля марки К ее става: Ср=54,7%;
Нр=3,3%;
S=0,8%;
Np=0,8%;
Op=4,8%,
Ар=27,6%;
Wp=8,0%.
Коэффициент избытка воздуха в топке
αт=1,3.
Решение:
Теоретический объем воздуха, необходимый
дл полного сгорания 1 кг топлива,
определяем по формуле (1.27):
V0=0,089Cp+0,266Нр+0,033(S–Ор)=0,089·54,7+0,266·3,3+0,033(0,8-4,8)=5,61
м3/кг.
Объем сухих газов
при αт=1,3,
по формуле (1.43),
Vсг=V+V
+(αт-1)V0=0,0187(Cp+0,375S
)+0,79V0+0,8Np/100+(αт-l)V0=
=0,0187(54,7+0,375·0,8)+0,79·5,61+0,8·0,8/100+(1,3-1)·5,61=7,15
м3/кг.
Объем водяных
паров при αт=1,3,
по формуле (1.44),
V=V
+0,0161(αт-1)V0=0,0124(9Hp+Wр)+0,0161αтV0=
=0,0124(9·3,3+8)+0,0161·1,3·5,61=0,58
м3/кг.
Объем продуктов
полного сгорания, по формуле (1.31),
Vг=Vcг+V=7,15+0,58=7,73
м3/кг.
Задача 1.29.
Определить
теоретический и действительный объемы
воздуха, необходимые для слоевого
сжигания 1000 кг донецкого угля марки Г
состава: Ср=55,2%;
Нр=3,8%;
S=3,2%;
Nр=1,0%;
Ор=5,8%;
Ар=23,0%;
Wp=8,0%.
Коэффициент избытка воздуха в топке
αт=1,3.
Ответ: V0
= 5830 м3;
Vд=7579
м3.
Задача 1.30.
Определить объем воздуха, необходимый
для сжигания 800 кг/ч ленгерского угля
марки БЗ состава: Ср=45,0%;
Нр=2,6%;
S=l,7%;
Np=0,4%;
Ор=9,9%;
Aр=11,4%;
Wp=29,0%,
и 500 кг/ч экибастузского угля марки СС
состава: Ср=43,4%;
Нр=2,9%;
S=0,8%;
Np=0,8%;
Op=7,0%;
Aр=38,1%;
Wp=7,0%,
при коэффициентах избытка воздуха в
топочной камере соответственно
αт=1,4
и 1,3.
Ответ: Vд=7823
м3/ч.
Задача 1.31.
Определить теоретический и действительный
объемы воздуха, необходимые для сжигания
2000 м3/ч
природного газа Ставропольского
месторождения состава: СО2=0,5%;
СН4=92,8%;
С2Н6=2,8%;
С3Н8=0,9%;
С4Н10=0,4%;
С5Н12=0,1%;
N2=2,5%;
и 1000 м3/ч
природного газа Ленинградского
месторождения состава: CO2=0,1%;
СН4=89,7%;
С2Н6=5,2%;
С3Н8=1,7%;
С4Н10=0,5%;
С5Н12=0,1%;
N2=2,7%,
при коэффициентах избытка воздуха в
топочной камере соответственно
αт=1,15
и 1,1.
Ответ: V0=29360
м3/ч;
Vд=33264
м3/ч.
Задача 1.32.
Определить теоретический и действительный
объемы воздуха, необходимые для слоевого
сжигания 2000 кг кузнецкого угля марки
Д, если известен состав его горючей
массы: Cг=78,5%;
Нг=5,6%;
S=
0,4%; Nг=2,5%;
Oг=13,0%,
зольность сухой массы Ас=15,0%
и влажность
рабочая Wp=12,0%.
Коэффициент избытка воздуха в топочной
камере αт=1,3.
Ответ:
V0=
12 040 м3;
Vд
=15 652 м3.
Задача 1.33.
Определить теоретический объем воздуха,
необходимый для слоевого сжигания
1500 кг ленинградских сланцев, если
известен состав их горючей массы:
Сг=74,0%;
Нг=9,5%;
S=6,l%;
Nг=0,4%;
Ог=10,0%;
Ар=46,0%;
Wp=11,5%
и(СО2)=16,4%.
Ответ: V0=3765
м3.
Задача 1.34.
В топке котла
сжигается смесь, состоящая из 2·103
кг кузнецкого угля марки Д состава:
C=58,7%;
Н=4,2%;
(S)1=0,3%;
N=l,9%;
O=9,7%;
A=13;2%;
W=12,0%,
и 3·103
кг кузнецкого угля марки Г состава:
С=66Д%;
Н=4,7%;
(S)2=0,5%;
N=1,8%;
O=7,5%;
А=11,0%;
W=8,5%.
Определить
теоретический объем сухого воздуха,
необходимый для сгорания смеси.
Ответ: V=32700
м3.
Задача 1.35. В
топке котла сжигается воркутинский
уголь марки Ж состава: Сp=59,6%;
Нр=3,8%;
S=0,8%;
Np=l,3%;
Ор=5,4%;
Aр=23,6%;
Wp=5,5%.
Определить объем сухих газов при полном
сгорании топлива. Коэффициент избытка
воздуха в топке αт=1,3.
Ответ: Vсг=7,84
м3/кг.
Задача 1.36.
Определить
объем водяных паров при полном сгорании
в слое 10 кг/ч фрезерного торфа состава:
Ср=24,7%
Нр=2,б%;
S=0,l%;
Np=l,l%;
Ор=15,2%;
Ар=6,3%;
Wр=50,0%
при коэффициентах избытка воздуха в
топке αт=1,3
и 1,4.
Ответ: V=963
м3/ч;
V=965
м3/ч.
Задача 1.37.
В топке котла
сжигается 600 м3
природного газа Угерского месторождения
состава: СО2=0,2%;
СН4=98,5%;
С2Н6=0,2%;
С3Н8=0,1%;
N2=l,0%.
Определить объем продуктов сгорания
при коэффициенте избытка воздуха в
топке αт=1,3.
Ответ: Vг=7210
м3.
Задача 1.38.
Определить
объем сухих газов, получаемых при полном
сгорании в слое 800 кг кузнецкого угля
марки Д, если известен состав его горючей
массы: Cг=78,5%;
Нг=5,6%;
S=0,4%;
Nг=2,5%;
Ог=13,0%;
зольность сухой массы Аг=15,0%
и влажность рабочая Wp=12,0%.
Коэффициент избытка воздуха в топке
αт=1,3.
Ответ: Vcг=6141
м3.
Задача 1.39.
Определить
объем двух- и трехатомных газов и
содержание СО2
и SO2
в сухих газах, получаемых при полном
сгорании 1 кг донецкого угля марки Т
состава: Ср=62,7%;
Нр=3,1%;
S=2,8%;
Np=0,9%;
Ор=1,7%;
Ар=23,8%;
Wp=5,0%
если известно, что дымовые газы при
полном сгорании содержат RO=18,8%.
Решение:
Объем трехатомных газов определяем по
форму (1.33):
V=V
+V
=0,0187(Сp+0,375S
)=0,0187(62,7+
0,375·2,8)=1,19 м3/кг.
Объем сухих газов
находим по формуле (1.48):
=
6,33 м3/кг.
Объем двухатомных
газов V=Vcг–V
=
6,33-1,19=5,14
м3/кг.
Содержание СО2 в
сухих газах определяем по формуле
(1.46):
CO2=(V/Vcг)100=(0,0187Ср/Vcг)100=(0,0187·62,7/6,33)100=18,5%.
Содержание SO2
в сухих газах находим по формуле (1.47):
SO2==(V/Vcг)100=(0,0187·0.375S
/Vcг)100=(0,0187·0.375·2,8/6,33)100=0,31%.
Задача
1.40. Определить
объем трехатомных газов и содержание
в них СО2
и SO2,
получаемых при полном сгорании 1 кг
ткибульского угля марки Г состава:
Ср=45,4%;
Нр=3,5%;
S=1,3%;
Np=0,9%;
Оp=8,9%;
Aр=27,0%;
Wp=13,0%,
если известно, что дымовые газы
содержат RO=18,7%.
Ответ:
V=0,86
м3/кг;
СО2=18,5%;
SO2=0,2%.
Задача 1.41.
Определить объем сухих дымовых газов,
получаемых при сжигании 1000 кг
фрезерного торфа состава: Ср=24,7%;
Нр=2,6%;
S=0,1%;
Np=l,l%;
Op=15,2%;
Aр=6,3%;
Wp=50,0%,
если известно, что дымовые газы при
полном сгорании топлива содержат
RO2=15,0%.
Коэффициент избытка воздуха в топке
αт=
1,3.
Ответ: Vcг=3066
м3.
Задача 1.42. В
топке котла сжигается 5·103
кг/ч донецкого угля марки Г состава:
Ср=0,2%;
Нр=3,8%;
S=3,2%;
Np=l,0%;
Ор=5,8%;
Ар=23,0%;
Wp=8,0%.
Определить, на сколько был увеличен
объем подаваемого в топку воздуха, если
известно, что при полном сгорании топлива
содержание RO2
в дымовых газах снизилось с 16 до 14%.
Ответ: Vв=5949
м3/ч.
Задача 1.43. В
топке котла сжигается 2·103
кг/ч малосернистого мазута состава:
Ср=84,65%;
Нр=11,7%;
S=0,3%;
Ор=0,3%;
Ар=0,05%;
Wp=3,0%.
Определить, на сколько был увеличен
объем подаваемого в топку воздуха, если
известно, что при полном сгорании топлива
содержание RO2
в дымовых газах снизилось с 15 до 12%.
Ответ:
Vв=
6666 м3/ч.
Задача 1.44.
В топке котла
во время испытаний сожжено 3·103
кг/ч кузнецкого угля марки Д состава:
Сp=58,7%;
Нр=4,2%;
S=0,3%;
Np=l,9%;
Ор=9,7%;
Aр=13,2%;
Wp=12,0%.
В течение первой половины испытаний в
продуктах полного сгорания топлива
получено RO2=18%,
а в течение второй половины испытаний
RO2
уменьшилось до 15%. Определить, какой
объем воздуха добавлен в топку между
первой и второй половинами испытаний.
Ответ:
Vв=
4650 м3/ч.
Задача
1.45. Определить
объем продуктов сгорания, получаемых
при полном сгорании 1 кг ленинградских
сланцев состава Ср=20,6%;
Нр=2;7%;
S=l,7%;
Np=0,l%;
Op=2,8%;
Ар=46,0%;
Wp=11,5%;
(СО2)=16,4%.
Коэффициент избытка воздуха в топке
αт=1,3.
Ответ: Vг
=2,96 м3/кг.
Задача
1.46. Определить
объем продуктов сгорания, получаемых
при полном сгорании 2·103
кг/ч карагандинского угля марки К
состава: Ср=54,7%;
Нр=3,3%;
S=0,8%;
Np=0,8%;
Ор=4,8%;
Ар=27,6%;
Wp=8,0%,
если известно, что дымовые газы содержат
RO2=18%.
Ответ: Vг=12560
м3/ч.
Задача 1.47.
Определить
максимальное содержание трехатомных
газов в продуктах полного сгорания 1 кг
донецкого угля марки А состава: Ср=63,8%;
Нр=1,2%;
S=l,7%;
Np=0,6%;
Ор=1,3%;
Ар=22,9%;
Wp=
8,5%.
Ответ: RO=20,2%.
Задача
1.48. В
топке котла сжигается смесь из 2·103
кг, донецкого угля марки Д состава:
С=49,3%;
H=3,б%;
(S)1=3,0%;
N=l,0%;
О=8,3%;
A=21,8%;
W=13,0%
и 3·103
кг/ч донецкого угля марки Г состава:
С=55,2%;
Н=3,8%;
(S)2=3,2%;
N=1,0%;
O=5,8%;
A=23%;
W=8%.
Определить
объем газов, получаемых при полно
сгорании смеси, если коэффициент избытка
воздуха в топке αт=1,3.
Ответ: Vг=37
480 м3/ч.
Задача 1.49.
Определить
объем газов, получаемых при полном
сгорании 1000 м3/ч
природного газа Радченковского мест
рождения состава: СО2=0,1%;
СН4=85,8%;
С2H6=0,2%;
С3Н8=0,1%;
С4Н10=0,1%;
N2=13,7%.
Коэффициент избытка воздуха в топочной
камере αт=1,1.
Ответ: Vг=10
230 м3/ч.
Задача 1.50. В топке
котла сжигается 1 кг артемовско угля
марки БЗ состава: Ср=35,7%;
Нр=2,9%;
S=0,3%;
Nр=0,7%;
Ор=12,1%;
Ар=24,3%;
Wp=24,0%.
Определить объем продуктов сгорания и
содержание в них кислорода О2,
если RO2=18%.
Ответ: Vг=4,16
м3/кг;
О2=1,3%.
Задача
1.51. В
топке котла сжигается 1 кг анадырского
угля марки БЗ состава: Ср=50,1%;
Нр=4,0%;
S=0,1
Np=0,7%;
Ор=12,2%;
Ар=11,9%;
Wp=21,0%.
Определить коэффициент избытка воздуха
при полном сгорании топлива, если RO2
= 16%.
Ответ: αт=1,2.
Задача 1.52.
В топке котла сжигается донецкий уголь
марки Т состава: Ср=62,7%;
Нр=3,1%;
S=2,8%;
Np=0,9%;
Op=
l,7%;
Ар=23,8%;
Wp=5,0%.
Определить
содержание азота N2
в продуктах сгорания и коэффициент
избытка воздуха при полном сгорании
топлива, если RO2=15,0%.
Ответ: V=5,09
м3/кг;
αт=1,26.
Задача 1.53.
Определить объем сухих газов и коэффициент
избытка воздуха при полном сгорании
природного газа Саратовского
месторождения состава: СО2=1,2%;
СН4=91,9%;
С2Н6=2,1%;
С3Н8=1,3%;
С4Н10=0,4%;
С5Н12=0,1%;
N2=3,0%,
если известно, что продукты сгорания
содержат RO2=16,0%
и О2=4,0%.
Ответ: Vсг=6,44
м3/м3;
αт=1,23.
Задача 1.54. В
топке котла сжигается 1 кг райчихинского
угля марки Б1 состава: Ср=30,4%;
Нр=1,7%;
S=0,3%;
Np=0,5%;
Ор=12,2%;
Aр=7,9%;
Wp=47,0%.
Определить содержание кислорода О2
в продуктах сгорания и коэффициент
избытка воздуха при полном сгорании
топлива, если RO2=16,0%.
Ответ: О2=4,8
%; αт=1,3.
Задача 1.55.
Определить
массу продуктов сгорания и концентрацию
золы в продуктах сгорания, получаемых
при полном сгорании 1 кг ленинградских
сланцев состава: Ср=20,6%;
Hp=2,7%;
S=1,7%;
Np=0,l%;
Ор=2,8%;
Aр=46,0%;
Wp=11,5%;
(СО2)=16,4%,
если, известно, что доля золы топлива,
уносимой продуктами сгорания, аун=0,95.
Коэффициент избытка воздуха в топке
αт=1,3.
Решение:
Расчетное содержание золы в топливе с
учетом неразложившихся карбонатов
определяем по формуле (1.57):
А=Ар+(1-К)(СО2)
=46,0+(1-0,1)16,4=50,9%.
Теоретический
объем воздуха, необходимый для полного
сгорания 1 кг топлива, находим по
формуле (1.27):
V0=0,089Ср+0,266Нр+0,033(S-Ор)=0,089·20,6+0,266·2,7+0,033(1,7-2,8)=2,52
м3/кг.
Масса продуктов
сгорания, по формуле (1.56),
Mгк=1-0,01A+1,306αтV0+0,01(СО2)
K=1-0,01·50,9+1,306·1,3·2,52+0,01·16,4·0,7=
=4,9
кг/кг.
Концентрация золы
в продуктах сгорания, по формуле (1.58),
μзл=Араун/(Мгк)=(46·0,95)/(4,9·100)=0,0892.
Задача 1.56.
Определить
массу продуктов сгорания и концентрацию
золы в продуктах сгорания, получаемых
при полном сгорании 1 кг карагандинского
угля марки К состава: Ср=54,7%;
Нр=3,3%;
S=0,8%;
Np=0,8%;
Ор=4,8%;
Ар=27,6%;
Wp=8,0%,
если известно, что доля золы топлива,
уносимой продуктами сгорания, аун=0,85.
Коэффициент избытка воздуха в топке
αт=1,3.
Ответ: Мг=9,25
кг/кг; μзл=0,0253.
Задача 1.57.
Определить
массу продуктов сгорания, получаемых
при полном сгорании 1 м3
природного газа Ставропольского
месторождения состава: СО2=0,2%;
СН4=98,2%;
С2Н6=0,4%;
С3Н8=0,1%;
С4Н10=0,1%;
N2=l,0%,
если известно, что плотность сухого
газа ρ=0,728
кг/м3.
Коэффициент избытка воздуха в топке
αт=1,15.
Ответ: Мг=15
кг/м3.
В
воздухе содержатся различные газы: азот, кислород, углекислый газ, благородные
газы, водяные пары и другие.
Для
того, чтобы количественно выразить состав смеси газов, используют величину,
которую называют «объёмной долей газов в смеси».
Объёмная
доля газа – это отношение объёма данного газа к общему объёму
смеси.
Объёмная
доля обозначается буквой φ (фи). Объёмная доля газа показывает, какую
часть общего объёма смеси занимает данный газ.
Доказано,
в 100 л воздуха 78 л азота, 21 л кислорода, 0,03 л углекислого газа и 0,97 л
благородных газов. Если нужно найти объёмные доли этих газов в воздухе, то
следует объём каждого газа разделить на объём воздуха. Получается, что в
воздухе содержится 78 % азота, 21 % кислорода, 0,03 % углекислого газа и 0,97 %
благородных газов. Сумма всех объёмных долей газов в смеси равна 1, или 100 %.
В
воздухе, который мы выдыхаем, содержится только 16 % кислорода, а содержание
углекислого газа увеличивается до 4 %. Поэтому помещения,
в которых много людей, нужно постоянно проветривать.
В
задачах чаще необходимо искать объём газа по известной объёмной доле этого
газа. Например, найдём объём кислорода в 300 л воздуха. Зная, что объёмная доля
кислорода в воздухе равна 21 %, нужно 300 умножить на 0,21, и мы получим 63 л.
Таким образом, в 300 л воздуха содержится 63 л кислорода.
Учитывая
то, что объёмная доля аргона в воздухе равна 0,9 %, найдём объём воздуха,
который необходим для получения 7 л аргона. В условии задачи даны объём аргона
и его объёмная доля в водухе. Найти нужно объём
воздуха. Для этого 7 л разделим на 0,009.
Найдём
объёмную долю каждого газа, если смешали 4 л кислорода и 5 л углекислого газа.
Объём смеси равен сумме объёмов двух газов – кислорода и углекислого газа.
Чтобы
найти объёмную долю кислорода в смеси, нужно 4 л разделить на 9 л. Получаем
0,44, или 44 %. Для того, чтобы определить процентное содержание углекислого
газа в смеси, необходимо от 100 % вычесть 44 %. Получим 56 %.