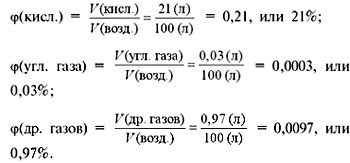амитаф
Просветленный
(20393)
7 лет назад
Mсм=(m1+m2+…)/((m1/M1)+(m2/M2)+…)
смотря сколько газов в смеси
Аня СергеевнаУченик (66)
7 лет назад
а удельный объем?
амитаф
Просветленный
(20393)
не заметила, что объем, написала молярную массу смеси
а молярный объем
Vмол=Vсм/Mсм
Аня СергеевнаУченик (66)
7 лет назад
Вот я немного запуталась в Мсм- т. е это молярная масса и нужно найти количество вещества смеси? вот количество вещества смеси какая там формула не подскажите?
амитаф
Просветленный
(20393)
Vсм=v1+v2+…=(m1/M1)+(m2/M2)+…
Вячек
Высший разум
(391245)
7 лет назад
Молярный объём, или объём 1 моль любого газа рассчитал Амедео Авогадро больше 200 лет назад! Он составляет 22,4 л/моль. При нормальных условиях эта величина справедлива не только для одиночного газа, но и для любых смесей газов!
toten kopf
Мыслитель
(7809)
7 лет назад
Найдем молярный объем воздуха при 0 градусах Цельсия.
Известно, что плотность сухого воздуха при 0 градусов 1,2929 г/л
Примем следующий газовый состав воздуха , % масс.:
Азот 75,5 %
Кислород 23,15 %
Аргон 1,292 %
Углекислый газ 0,058 %
Рассчитаем массу 1 моля воздуха:
28 * 0,755 + 32 * 0,2315 + 40 * 0,01292 + 44 * 0,00058 = 29,09 г/моль
Рассчитаем объем 1 моля воздуха при 0 градусах Цельсия:
Vm = 29,09 г/моль / 1,2929 г/л = 22,499 л/моль.
В
воздухе содержатся различные газы: азот, кислород, углекислый газ, благородные
газы, водяные пары и другие.
Для
того, чтобы количественно выразить состав смеси газов, используют величину,
которую называют «объёмной долей газов в смеси».
Объёмная
доля газа – это отношение объёма данного газа к общему объёму
смеси.
Объёмная
доля обозначается буквой φ (фи). Объёмная доля газа показывает, какую
часть общего объёма смеси занимает данный газ.
Доказано,
в 100 л воздуха 78 л азота, 21 л кислорода, 0,03 л углекислого газа и 0,97 л
благородных газов. Если нужно найти объёмные доли этих газов в воздухе, то
следует объём каждого газа разделить на объём воздуха. Получается, что в
воздухе содержится 78 % азота, 21 % кислорода, 0,03 % углекислого газа и 0,97 %
благородных газов. Сумма всех объёмных долей газов в смеси равна 1, или 100 %.
В
воздухе, который мы выдыхаем, содержится только 16 % кислорода, а содержание
углекислого газа увеличивается до 4 %. Поэтому помещения,
в которых много людей, нужно постоянно проветривать.
В
задачах чаще необходимо искать объём газа по известной объёмной доле этого
газа. Например, найдём объём кислорода в 300 л воздуха. Зная, что объёмная доля
кислорода в воздухе равна 21 %, нужно 300 умножить на 0,21, и мы получим 63 л.
Таким образом, в 300 л воздуха содержится 63 л кислорода.
Учитывая
то, что объёмная доля аргона в воздухе равна 0,9 %, найдём объём воздуха,
который необходим для получения 7 л аргона. В условии задачи даны объём аргона
и его объёмная доля в водухе. Найти нужно объём
воздуха. Для этого 7 л разделим на 0,009.
Найдём
объёмную долю каждого газа, если смешали 4 л кислорода и 5 л углекислого газа.
Объём смеси равен сумме объёмов двух газов – кислорода и углекислого газа.
Чтобы
найти объёмную долю кислорода в смеси, нужно 4 л разделить на 9 л. Получаем
0,44, или 44 %. Для того, чтобы определить процентное содержание углекислого
газа в смеси, необходимо от 100 % вычесть 44 %. Получим 56 %.
Вот и подходит к концу изучение газов. Кто-то скажет: “Слава Богу!”, а мне жаль. Согласна, задачи на газы – одни из самых сложных. Логически сложных. Они заставляют наш мозг смотреть на химию совсем другими глазами – системно, учат абстрагироваться. Если вы серьезно пройдете через “газовую атаку”, вы станете другим. Это сложно, психологически больно (многие ученики, реально, плачут), но это очень эффективно! Сегодня мои ребята – совсем другие. Это уже не те желторотики, которые пришли ко мне два месяца назад. И хотя до Ломоносова им еще далеко, но, благодаря газам, они уже мыслят и рассуждают по-взрослому.
Такие серьезные изменения в понимании химии, анализе заданий, решении задач, не могут остаться незамеченными. Первыми их начинают чувствовать школьные учителя химии. И что? В лучшем случае они стараются ничего не замечать, в худшем – ревностное отношение к ребенку и гнобление по поводу и без повода. И пошел-поехал цирк с конями. “Репетитор – аферист, он только деньги берет и ничему не учит! Приходите ко мне – я вас научу всему и даже больше! Не хотите? Скоро контрольная – он (она) не напишет! Я трупом лягу, но до ЕГЭ его (ее) не допущу! Позор на мою голову и на всю школу!”
Ровно десять лет назад привели ко мне десятиклассницу Настю Х. Мы учили газы и решали задачи на изменение объема. Мама Насти рассказала о том, что ее дочь весь 9-й класс работала с репетитором, роль которого исполняла школьная учительница. Занимались два раза в неделю по 2 часа. Я ожидала увидеть вполне подготовленное дитя (год с хорошим репетитором – это очень круто!). Объясняю решение задачи. Настя пыхтит-пыхтит, потом не выдержала. “Это – что?! Химия?!” – робко спросила она. “Конечно, химия! – сказала я и задала вполне естественный вопрос: “А что ты делала с репетитором целый год?!” “Химию учила”. “Какую химию? Что учила?” Прежде, чем продолжить, сядьте, чтобы не упасть, и держитесь за ручки кресла. “Мы с учителем лепили модели молекул из пластилина”. Еще раз, для тех, кто не понял.
ЛЕПИЛИ!
МОДЕЛИ МОЛЕКУЛ!
ИЗ ПЛАСТИЛИНА!
ДВА ЧАСА!
ДВА РАЗА В НЕДЕЛЮ!
ГОД!
ЗА ДЕНЬГИ!!!
500 РУБЛЕЙ ЧАС!!!
Конечно, это, скорее, исключение, чем норма (я надеюсь), но перлы о школьных учителях я слышу каждый год из уст моих учеников. О тех учителях, кому вы доверили своих детей, и от которых уйти невозможно. Как быть? Мой добрый совет – не рассказывайте школьным преподавателям о том, что вы работаете с репетитором. На вопрос: “Откуда ты это знаешь?”, отвечайте: “Это вы меня научили!” И химичкам хорошо, и вы не попадете под горячую руку амбициозного “педагога”. Я не учу обманывать – это маленькая хитрость. С волками жить – по волчьи выть. Либо по волчьи выть, либо съедену быть. Поэтому, никогда не делитесь с химичками авторскими алгоритмами, а занятия с репетитором пусть будут вашим маленьким секретом.
Кстати, кем стала девочка Настя, вы узнаете в конце статьи, когда решите все задачи и разберетесь с особенностями авторской фишки.
Однако, вернемся к основной теме. В статье “Секретная шпаргалка по химии. 4.3. Горение смеси газов” я рассказала о гипотетических (предполагаемых) алгоритмических приемах для 28 задания ЕГЭ и подробно описала первую фишку:
1) Расчеты по уравнениям реакции горения смеси газов, состав которой нужно определить предварительно
2) Определение объемного состав смеси по участникам процесса горения (задачи на систему уравнений с двумя неизвестными)
3) Определение состава смеси газообразных продуктов, если в условии избыток-недостаток, степень превращения или выход реакции
4) Задачи на изменение объема газовой смеси в процессе реакции
В статье “Секретная шпаргалка по химии. 4.4. Смеси газов и уравнения с двумя неизвестными” я рассказала о второй предполагаемой фишке “Определение объемного состав смеси по участникам процесса горения (задачи на систему уравнений с двумя неизвестными)”.
В статье “Секретная шпаргалка по химии. 4.5. Избыток-недостаток, степень превращения, выход реакции в смеси газов” я рассказала о третьей предполагаемой фишке: “Определение состава смеси газообразных продуктов, если в условии избыток-недостаток, степень превращения или выход реакции”.
Сегодня мы поговорим о последней, четвертой, фишке “Задачи на изменение объема газовой смеси в процессе реакции”. Это очень интересные задачи! Я их обожаю, поскольку считаю своими “крестными”. Стандартный алгоритм решения такого типа задач – очень громоздкий, тяжелый и сложный. Лет двадцать назад я разработала авторский алгоритм, простой и понятный. Его рабочее название – “Задачи на изменение объема”. Алгоритм решения строится по схеме ΔV (по условию) = ΔV (по уравнению). В результате, решение задач упростилось на порядок. Настоятельно советую разобрать эти задачи, элементы которых уже встречались в 34-х и 35-х заданиях ЕГЭ и могут встретиться в усложненных вариантах 28-го задания. Итак, поехали!
Решим задачи на изменение объема газовой смеси в процессе реакции, используя Четыре Заповеди. Каждое действие обводится зеленым овалом. Читайте внимательно и обязательно записывайте решение каждого задания. После проработки статьи попробуйте самостоятельно решить все разобранные задачи.
Задание 28*(1)
В закрытом сосуде взорвали 60 мл смеси О2 и Н2. Объем паро-газовой смеси, в котором вспыхивает тлеющая лучина, составил 48 мл. Определить состав исходной газовой смеси.
1. Первая Заповедь. Выписать данные задачи в разделе “Дано”.
2. Вторая заповедь. Написать уравнение реакции.
3. Третья заповедь. Сделать предварительные расчеты
Это очень важная часть, поэтому разберем ее подробно. Именно здесь спрятан авторский алгоритм решения (авторская фишка). Пойдем по-порядку. Первое, что необходимо сделать – провести анализ газов-реагентов для определения избытка-недостатка. Обратимся к условию. “Объем паро-газовой смеси, в котором вспыхивает тлеющая лучина…” – дает нам информацию: во-первых, вода после реакции находилась в парообразном состоянии и занимала определенную часть объема продуктов, во-вторых, кислород был в избытке (лучина вспыхивает только при наличии кислорода), в-третьих, водород был в недостатке и сгорел полностью (столько, сколько его было в исходной смеси)
Далее строим алгоритм расчетов по схеме ΔV (по условию) = ΔV (по уравнению). ΔV (по условию) определяем по разнице объемов реагентов и продуктов. ΔV (по уравнению) рассчитываем по уравнению реакции, принимая за неизвестное Х объем газа, который в недостатке. Затем приравниваем ΔV (по условию) = ΔV (по уравнению) и находим Х. Таким образом, авторский алгоритм помог сделать легкие предварительные расчеты по определению объемов каждого газа в исходной смеси.
4. Четвертая заповедь. Составить алгоритм решения задачи.
Вопрос задачи “Определить состав исходной газовой смеси” подразумевает, что требуется рассчитать объемные доли по стандартной формуле. Это удобно сделать в таблице
Задание 28*(2)
К 20 мл смеси ацетилена и азота прибавили 60 мл кислорода. После реакции объем смеси стал равен 56 мл. Определить состав исходной смеси и ее плотность по воздуху.
Задание 28*(3)
14 л смеси бутана с избытком кислорода (н.у.) подожгли. После приведения к н.у. объем газовой смеси стал 8,75 л. Определите объемный состав конечной газовой смеси.
Можете попробовать самостоятельно решить одну из самых несложных задач И.Ю. Белавина. Если вы хорошо разобрались с авторским алгоритмом, у вас все получится.
И.Ю. Белавин, 2005, задача 215
“К 100 мл смеси метана, метиламина и азота добавили 250 мл кислорода и полученную смесь газов взорвали. После охлаждения и конденсации воды объем смеси составил 240 мл, а после пропускания ее через избыток раствора гидроксида натрия он уменьшился до 180 мл. Определите объемный состав исходной газовой смеси. (Ответ: V(СН4) = 20 мл, V(СН3NН2) = 40 мл и V(N2) = 40 мл)”
Задачи решили? Понравилось работать с авторским алгоритмом? Выполняю обещание. Знакомьтесь! Умница и красавица Анастасия Храмченкова! Занималась со мной два года – 10-й и 11-й классы. В 2009 г. поступила в Первый МГМУ им. И.М. Сеченова, сдав блестяще и ЕГЭ, и ДВИ. В 2015 г. закончила обучение с красным дипломом! В настоящее время – клинический ординатор в Медицинском Центре Москвы.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии http://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7(903) 186-74-55. Приходите ко мне на курс, на Мастер-классы “Решение задач по химии” – и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте, или на Facebook. Я обязательно отвечу вам.
Репетитор по химии и биологии кбн В.Богунова
Моля́рный объём Vm — отношение объёма вещества к его количеству, численно равен объёму одного моля вещества. Термин «молярный объём» может быть применён к простым веществам, химическим соединениям и смесям. В общем случае он зависит от температуры, давления и агрегатного состояния вещества. Молярный объём также можно получить делением молярной массы M вещества на его плотность ρ: таким образом, Vm = V/n = M/ρ. Молярный объём характеризует плотность упаковки молекул в данном веществе. Для простых веществ иногда используется термин атомный объём[1].
В Международной системе единиц (СИ) единицей измерения молярного объёма является кубический метр на моль (русское обозначение: м3/моль; международное: m3/mol).
Молярный объём смеси[править | править код]
Для смеси веществ, при расчёте молярного объёма, количеством вещества считают сумму количеств всех веществ, составляющих смесь. Если известна плотность смеси ρc, мольные доли компонентов xi и их молярные массы Mi, молярный объём смеси можно найти как отношение средней молярной массы смеси (суммы молярных масс её компонентов, умноженных на их мольные доли) к плотности смеси.
Молярный объём газов[править | править код]
Согласно закону Авогадро, одинаковые количества газов при одинаковых условиях занимают одинаковый объём. Молярный объём идеального газа рассчитывается по формуле, выводящейся из уравнения состояния идеального газа
,
где T — термодинамическая температура, P — давление, R = 8,314 462 618 153 24 (точно) м3⋅Па⋅К−1⋅моль−1 — универсальная газовая постоянная.
При стандартных условиях (T = 273,15 K (0 °C), P = 101 325 Па) молярный объём идеального газа Vm = 22,413 969 545… л/моль[2][3]. Молярные объёмы идеального газа при других давлениях и температурах, часто принимаемых в качестве стандартных:
- Vm = 24,465 403 697… л/моль (T = 298,15 K (25 °C), P = 101 325 Па),
- Vm = 22,710 954 641… л/моль (T = 273,15 K (0 °C), P = 100 000 Па)[4],
- Vm = 24,789 570 296… л/моль (T = 298,15 K (25 °C), P = 100 000 Па).
| Газ | Vm, л/моль | Газ | Vm, л/моль |
|---|---|---|---|
| He | 22,426 | CO | 22,408 |
| Ne | 22,428 | CO2 | 22,262 |
| Ar | 22,394 | N2O | 22,260 |
| Kr | 22,388 | SO2 | 21,889 |
| Xe | 22,266 | CH4 | 22,376 |
| H2 | 22,430 | C2H6 | 22,176 |
| O2 | 22,393 | C2H4 | 22,255 |
| N2 | 22,404 | C2H2 | 22,157 |
Молярные объёмы реальных газов в той или иной степени отличаются от молярного объёма идеального газа, однако во многих случаях для практических вычислений отклонениями от идеальности можно пренебречь. Различие молярных объёмов идеального и реального газа связано в первую очередь с силами притяжения между молекулами и с конечным объёмом молекулы реального газа; в связи с этим, уравнение состояния реального газа с большей точностью описывается не формулой Менделеева — Клапейрона (уравнением состояния идеального газа), а формулой Ван-дер-Ваальса:
В таблице справа приведены молярные объёмы некоторых реальных газов (T = 273,15 K (0 °C), P = 101 325 Па)[5]. Видно, что для газов с относительно большими молекулами (двуокись серы, углеводороды) молярный объём несколько меньше молярного объёма идеального газа (22,414 л/моль в указанных условиях); для газов с маленькими молекулами (гелий, неон, водород) молярный объём несколько больше «идеального».
С молярным объёмом идеального газа связана постоянная Лошмидта NL — количество молекул идеального газа в единице объёма при стандартных условиях:
Молярный объём кристаллов[править | править код]
Объём Vя элементарной ячейки кристалла можно вычислить из параметров кристаллической структуры, которые определяются с помощью рентгеноструктурного анализа. Объём ячейки связан с молярным объёмом следующим образом:
- Vm = VяNA/Z,
где Z — количество формульных единиц в элементарной ячейке.
Значения молярного объёма химических элементов[править | править код]
Ниже приведены значения молярного (атомного) объёма простых веществ в см3/моль (10−6 м3/моль, 10−3 л/моль) при нормальных условиях либо (для элементов, газообразных при н.у.) при температуре конденсации и нормальном давлении.
| Группа | I A (1) | II A (2) | III B (3) | IV B (4) | V B (5) | VI B (6) | VII B (7) | VIII B (8) | VIII B (9) | VIII B (10) | I B (11) | II B (12) | III A (13) | IV A (14) | V A (15) | VI A (16) | VII A (17) | VIII A (18) |
| Период | ||||||||||||||||||
| 1 | H 14,0 |
He 31,8 |
||||||||||||||||
| 2 | Li 13,1 |
Be 5 |
B 4,6 |
C 5,3 |
N 17,3 |
O 14 |
F 17,1 |
Ne 16,8 |
||||||||||
| 3 | Na 23,7 |
Mg 14 |
Al 10 |
Si 12,1 |
P 17 |
S 15,5 |
Cl 18,7 |
Ar 24,2 |
||||||||||
| 4 | K 45,3 |
Ca 29,9 |
Sc 15 |
Ti 10,6 |
V 8,35 |
Cr 7,23 |
Mn 7,39 |
Fe 7,1 |
Co 6,7 |
Ni 6,6 |
Cu 7,1 |
Zn 9,2 |
Ga 11,8 |
Ge 13,6 |
As 13,1 |
Se 16,5 |
Br 23,5 |
Kr 32,2 |
| 5 | Rb 55,9 |
Sr 33,7 |
Y 19,8 |
Zr 14,1 |
Nb 10,8 |
Mo 9,4 |
Tc 8,5 |
Ru 8,3 |
Rh 8,3 |
Pd 8,9 |
Ag 10,3 |
Cd 13,1 |
In 15,7 |
Sn 16,3 |
Sb 18,4 |
Te 20,5 |
I 25,7 |
Xe 42,9 |
| 6 | Cs 70 |
Ba 39 |
* | Hf 13,6 |
Ta 10,9 |
W 9,53 |
Re 8,85 |
Os 8,43 |
Ir 8,54 |
Pt 9,1 |
Au 10,2 |
Hg 14,8 |
Tl 17,2 |
Pb 18,3 |
Bi 21,3 |
Po 22,7 |
At н/д |
Rn н/д |
| 7 | Fr н/д |
Ra 45 |
** | Rf н/д |
Db н/д |
Sg н/д |
Bh н/д |
Hs н/д |
Mt н/д |
Ds н/д |
Rg н/д |
Cn н/д |
Nh н/д |
Fl н/д |
Mc н/д |
Lv н/д |
Ts н/д |
Og н/д |
| Лантаноиды | * | La 22,5 |
Ce 21 |
Pr 20,8 |
Nd 20,6 |
Pm 19,96 |
Sm 19,9 |
Eu 28,9 |
Gd 19,9 |
Tb 19,2 |
Dy 19 |
Ho 18,7 |
Er 18,4 |
Tm 18,1 |
Yb 24,8 |
Lu 17,8 |
||
| Актиноиды | ** | Ac 22,54 |
Th 19,8 |
Pa 15 |
U 12,5 |
Np 21,1 |
Pu 12,12 |
Am 20,8 |
Cm 18,28 |
Bk 16,8 |
Cf 16,5 |
Es н/д |
Fm н/д |
Md н/д |
No н/д |
Lr н/д |
||
См. также[править | править код]
- Число Авогадро
- Удельный объём
- Молярная масса
- Молярная теплоёмкость
Примечания[править | править код]
- ↑ Для молекулярных кристаллов простых веществ молярный объём, определяемый через 1 моль молекул, не равен атомному объёму, поскольку количество атомов не равно количеству молекул. В этих случаях необходимо уточнять, относится ли указанная величина к молекулярному или к атомному молярному объёму. Так, атомный молярный объём иода (кристаллы, состоящие из двухатомных молекул I2) вдвое меньше молекулярного молярного объёма.
- ↑ CODATA Value: molar volume of ideal gas (273.15 K, 101.325 kPa). Дата обращения: 17 ноября 2022.
- ↑ После изменения определений основных единиц СИ в 2019 году универсальная газовая константа стала не измеряемой, а определяемой (точно фиксированной) величиной, будучи произведением точно фиксированных величин — постоянной Больцмана и постоянной Авогадро. Это же относится и к стандартному молярному объёму.
- ↑ CODATA Value: molar volume of ideal gas (273.15 K, 100 kPa). Дата обращения: 17 ноября 2022.
- ↑ 1 2 Battino R. The Ostwald coefficient of gas solubility (англ.) // Fluid Phase Equilibria. — 1984. — Vol. 15, no. 3. — P. 231—240. — ISSN 0378-3812. — doi:10.1016/0378-3812(84)87009-0. [исправить]; Table 2.
УЧЕБНИКИ. ПОСОБИЯ
О.С.ГАБРИЕЛЯН,
И.Г.ОСТРОУМОВ,
А.К.АХЛЕБИНИН
СТАРТ В ХИМИЮ
7 класс
Продолжение. Начало см. в № 1, 2, 3, 4, 5, 6, 7/2006
Глава 2. Математика в химии
(окончание)
§ 13. Объемная доля газов в смеси
В состав воздуха входит несколько различных
газов: кислород, азот, углекислый газ,
благородные газы, водяные пары и некоторые
другие вещества. Содержание каждого из этих
газов в чистом воздухе строго определенно.
Для того чтобы выразить состав смеси газов в
цифрах, т.е. количественно, используют особую
величину, которую называют объемной долей газов
в смеси.
Объемную долю газа в смеси обозначают
греческой буквой
– «фи».
Объемной долей газа в смеси называют
отношение объема данного газа к общему объему
смеси:
Что же показывает объемная доля газа в смеси
или, как говорят, какой физический смысл этой
величины? Объемная доля газа показывает, какую
часть общего объема смеси занимает данный газ.
Если бы нам удалось разделить 100 л воздуха на
отдельные газообразные компоненты, мы получили
бы около 78 л азота, 21 л кислорода, 30 мл углекислого
газа, в оставшемся объеме содержались бы так
называемые благородные газы (главным образом
аргон) и некоторые другие (рис. 62).
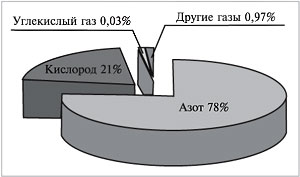 |
Рис. 62.
|
Рассчитаем объемные доли этих газов в
воздухе:
Нетрудно заметить, что сумма объемных долей
всех газов в смеси всегда равна 1, или 100%:
(азота) +
(кисл.) +
(угл. газа) +
(др. газов) = 78% + 21% + 0,03% + 0,97% = 100%.
Тот воздух, который мы выдыхаем, гораздо беднее
кислородом (его объемная доля снижается до 16%),
зато содержание углекислого газа возрастает до
4%. Такой воздух для дыхания уже непригоден. Вот
почему помещение, в котором находится много
людей, надо регулярно проветривать.
В химии на производстве чаще приходится
сталкиваться с обратной задачей: определять
объем газа в смеси по известной объемной доле.
Пример. Вычислите объем кислорода,
содержащегося в 500 л воздуха.
Из определения объемной доли газа в смеси
выразим объем кислорода:
V(кисл.) = V(возд.)•(кисл.).
Подставим в уравнение числа и рассчитаем объем
кислорода:
V(кисл.) = 500 (л)•0,21 = 105 л.
Кстати, для приближенных расчетов объемную
долю кислорода в воздухе можно принять равной 0,2,
или 20%.
При расчете объемных долей газов в смеси можно
воспользоваться маленькой хитростью. Зная, что
сумма объемных долей равна 100%, для «последнего»
газа в смеси эту величину можно рассчитать
по-другому.
Задача. Анализ атмосферы Венеры
показал, что в 50 мл венерианского «воздуха»
содержится 48,5 мл углекислого газа и 1,5 мл азота.
Рассчитайте объемные доли газов в атмосфере
планеты.
Дано:
V(смеси) = 50 мл,
V(угл. газа) = 48,5 мл,
V(азота) = 1,5 мл.
Найти:
(угл. газа),
(азота).
Решение
Рассчитаем объемную долю углекислого газа в
смеси. По определению:
Вычислим объемную долю азота в смеси, зная, что
сумма объемных долей газов в смеси равна 100%:
(угл.
газа) + (азота) = 100%,
(азота) =
100% – (угл. газа) =
100% – 97% = 3%.
Ответ. (угл.
газа) = 97%, (азота) =
3%.
С помощью какой величины измеряют содержание
компонентов в смесях другого типа, например в
растворах? Понятно, что в этом случае
пользоваться объемной долей неудобно. На помощь
приходит новая величина, о которой вы узнаете на
следующем уроке.
1.
Что такое объемная доля компонента в газовой
смеси?2. Объемная доля аргона в воздухе 0,9%. Какой
объем воздуха необходим для получения 5 л аргона?3. При разделении воздуха было получено 224 л
азота. Какие объемы кислорода и углекислого газа
были получены при этом?
4.
Объемная доля метана в природном газе составляет
92%. Какой объем этой газовой смеси будет
содержать 4,6 мл метана?5. Смешали 6 л кислорода и 2 л углекислого
газа. Найдите объемную долю каждого газа в
полученной смеси.
§ 14. Массовая доля вещества в растворе
– Сколько ложечек сахара ты кладешь в чай?
– Дома – две, в гостях – восемь.
Шутка известная, но давайте посмотрим на нее
глазами химика. Вряд ли вам понравится такой «чай
в гостях». Уж очень сладкий он будет из-за
неумеренного содержания сахара! Содержание
растворенного вещества в растворе химики
называют концентрацией.
Концентрацию вещества можно выражать
различными способами. Кстати, число ложечек на
чашку воды – способ вполне приемлемый, но только
для кухни. Трудно представить себе химика,
приготавливающего раствор таким образом.
Один из самых распространенных способов
выражения концентрации раствора – через
массовую долю растворенного вещества.
Массовой долей вещества в растворе называют
отношение массы растворенного вещества к массе
раствора:
Не правда ли, очень похоже на объемную долю? Так
оно и есть, ведь любая доля, как вы уже знаете, –
это отношение какой-то части к целому. Как и
массовая доля элемента в сложном веществе,
массовая доля вещества в растворе обозначается
греческой буквой
(«омега») и может принимать значения от 0 до 1 (или
от 0 до 100%). Она показывает, какая часть массы
раствора приходится на растворенное вещество. И
еще: массовая доля вещества в процентах численно
равна массе растворенного вещества в 100 г
раствора. К примеру, в 100 г 3%-го раствора уксуса
содержится 3 г чистой уксусной кислоты.
Самые простые растворы состоят из двух
компонентов. Один из компонентов раствора –
растворитель. Для нас более привычны жидкие
растворы, значит, растворитель в них – жидкое
вещество. Чаще всего – вода.
Другой компонент раствора – растворенное
вещество. Им может быть и газ, и жидкое, и твердое
вещество.
Масса раствора складывается из массы
растворителя и массы растворенного вещества, т.
е. верно выражение:
m(раствора) = m(растворителя) + m(растворенного
вещества).
Предположим, массовая доля растворенного
вещества равна 0,1, или 10%. Значит, оставшиеся 0,9,
или 90%, – это массовая доля растворителя.
Массовая доля растворенного вещества широко
используется не только в химии, но и в медицине,
биологии, физике, да и в повседневной жизни. В
качестве иллюстрации к сказанному рассмотрим
решение некоторых задач прикладного характера.
Задача 1. Перед посадкой семена
томатов дезинфицируют (протравливают) 1%-м
раствором марганцовки. Какую массу такого
раствора можно приготовить из 0,25 г марганцовки?
Дано:
(марганцовки) =
0,01 г,
m(марганцовки) = 0,25 г.
Найти:
m(раствора).
Решение
Зная массу растворенного вещества и его
массовую долю в растворе, можно вычислить массу
раствора:
Ответ. m(раствора) = 25 г.
Задача 2. В медицине широко применяют
так называемые физиологические растворы, в
частности раствор поваренной соли с массовой
долей соли 0,9%. Рассчитайте массы соли и воды,
необходимые для приготовления 1500 г
физиологического раствора.
Дано:
(соли) = 0,009,
m(раствора) = 1500 г.
Найти:
m(соли),
m(воды).
Решение
Вычислим массу соли, необходимой для
приготовления 1500 г физиологического раствора:
m(соли) = m(раствора)•(соли) = 1500 (г)•0,009 = 13,5 г.
Определим массу воды, необходимой для
приготовления раствора:
m(воды) = m(раствора) – m(соли) =
1500 – 13,5 = 1486,5 г.
Ответ. m(соли) = 13,5 г, m(воды) = 1486,5 г.
Отличаются ли свойства растворов от свойств
компонентов, образующих эти гомогенные смеси?
С помощью домашнего эксперимента (задание 9 к
этому параграфу) вам будет нетрудно убедиться в
том, что раствор замерзает при более низкой
температуре, чем чистый растворитель. Например,
морская вода начинает замерзать при температуре
–1,9 °С, в то время как чистая вода
кристаллизуется при 0 °С.
1.
Что такое массовая доля растворенного вещества?
Сравните понятия «объемная доля» и «массовая
доля» компонентов смеси.2. Массовая доля йода в аптечной йодной
настойке составляет 5%. Какую массу йода и спирта
нужно взять, чтобы приготовить 200 г настойки?3. В 150 г воды растворили 25 г поваренной соли.
Определите массовую долю соли в полученном
растворе.4. В 200 г столового уксуса содержится 6 г
уксусной кислоты. Определите массовую долю
кислоты в столовом уксусе.
5.
Найдите массу воды и лимонной кислоты,
необходимую для приготовления 50 г 5%-го раствора.6. Из 240 г 3%-го раствора питьевой соды
выпарили 80 г воды. Найдите массовую долю соды в
полученном растворе.7. К 150 г 20%-го раствора сахара добавили 30 г
сахара. Найдите массовую долю вещества в
полученном растворе.8. Смешали два раствора серной кислоты: 80 г
40%-го и 160 г 10%-го. Найдите массовую долю кислоты в
полученном растворе.
9.
Пять чайных ложек поваренной соли (с горкой)
растворите в 450 г (450 мл) воды. Учитывая, что масса
соли в каждой ложке примерно 10 г, рассчитайте
массовую долю соли в растворе. В две одинаковые
пластиковые бутылки объемом 0,5 л налейте
полученный раствор и водопроводную воду.
Поместите бутылки в морозильную камеру
холодильника. Загляните в холодильник примерно
через час. Какая жидкость начнет замерзать
раньше? В какой бутылке содержимое раньше
превратится в лед? Сделайте вывод.
ПРАКТИЧЕСКАЯ РАБОТА № 3.
Приготовление раствора с заданной массовой
долей
растворенного вещества
Цель данной работы состоит в приготовлении
раствора с заданной массовой долей путем
растворения рассчитанной массы твердого
вещества в определенном объеме воды.
Рассчитайте массу твердого вещества,
необходимого для приготовления раствора в
соответствии с вашим вариантом задания (табл. 3).
На весах отмерьте рассчитанную массу твердого
вещества и перенесите его в химический стакан.
Таблица 3
Варианты задания к практической
работе № 3
| Вариант | Растворенное вещество |
Масса раствора, г |
Массовая доля растворенного вещества, % |
|---|---|---|---|
| 1 | Поваренная соль | 80 | 10 |
| 2 | Сахар | 150 | 5 |
| 3 | Лимонная кислота | 50 | 2 |
| 4 | Натриевая селитра | 70 | 10 |
Рассчитайте массу воды, необходимой
для приготовления раствора. Поскольку плотность
воды равна 1 г/мл, рассчитанная вами масса
численно равна ее объему. С помощью мерного
цилиндра отмерьте вычисленный объем воды и
прилейте его к веществу в стакане. Перемешивая
содержимое стакана стеклянной палочкой,
добейтесь полного растворения вещества в воде.
Требуемый раствор готов.
§ 15. Массовая доля примесей
На примере замерзания раствора соли вы
убедились, что присутствие посторонних
соединений изменяет свойства вещества. В
некоторых областях техники использование
недостаточно «чистых» материалов недопустимо.
Микросхему компьютера не сделать без особо
чистого кристалла кремния, в атомной энергетике
предъявляются повышенные требования к очистке
ядерного топлива, световой сигнал «погаснет» в
стекловолоконном кабеле, наткнувшись на
посторонние вкрапления.
Если главное (основное) вещество содержит
посторонние загрязнения – это тоже смесь, только
в этом случае все ненужные, а порой и вредные ее
компоненты называют одним словом – примеси. Чем
меньше примесей, тем чище вещество.
Иногда вещество, содержащее примеси, называют
техническим образцом или просто образцом.
Следовательно, любой такой образец включает
основное вещество и примеси.
Степень чистоты вещества принято выражать
массовой долей основного компонента или
массовой долей примесей.
С массовыми долями разного типа вы уже знакомы.
Попробуйте теперь сами сформулировать
определение, что такое массовая доля примесей в
веществе. Получилось? Сравните.
Массовой долей примесей называется отношение
массы примесей к массе образца:
Предположим, вам нужно вычислить массовую долю
основного вещества в образце. Тогда можно
воспользоваться формулой:
Следует не забывать, что сумма массовых долей
основного вещества и примесей всегда равна 1, или
100%:
(осн.
в-ва) + (примесей) =
1, или 100%.
Также справедливо утверждение, что масса
образца складывается из массы основного
вещества и массы примесей:
m(образца) = m(осн. в-ва) + m(примесей).
Разберем несколько задач с использованием
понятия «массовая доля примесей».
Задача 1. Природная самородная
сера содержит 8% примесей. Какая масса чистой серы
содержится в 2 т природного образца?
Дано:
(примесей) = 0,08,
m(образца) = 2 т.
Найти:
m(серы).
Решение
Вычислим массу примесей в 2 т самородной серы:
m(примесей) = m(образца)•(примесей) = 2 (т) •0,08
= 0,16 т.
Рассчитаем массу чистой серы, содержащейся в
природном образце:
m(серы) = m(образца) – m(примесей)
= 2 (т) – 0,16 (т) = 1,84 т.
Ответ. m(серы) = 1,84 т.
Задача 2. В пищевой отрасли
промышленности можно использовать лимонную
кислоту, содержащую не более 1% посторонних
примесей. В аналитической лаборатории
установлено, что в 2,345 г продукта содержится 2,312 г
кислоты. Можно ли использовать продукт в пищевых
целях?
Дано:
m(образца) = 2,345 г,
m(кислоты) = 2,312 г.
Найти:
(примесей).
Решение
Вычислим массовую долю лимонной кислоты в
образце:
Рассчитаем массовую долю примесей в образце:
(примесей)
= 1 – (кислоты) = 1
– 0,986 = 0,014, или 1,4%.
Ответ. Данный образец лимонной кислоты не
может быть использован в пищевой отрасли
промышленности.
1.
Что называется массовой долей примесей? Что
показывает эта величина?2. В промышленности используются вещества с
маркировкой «ч», что означает «чистое вещество».
Содержание примесей в них может составлять,
например, 0,01%. Найдите максимально допустимую
массу примесей в 120 г образца сажи с маркировкой
«ч».3. Массовая доля примесей в известняке
составляет 5%. Рассчитайте массу основного
вещества (карбоната кальция), содержащегося в 300
кг природного известняка.
4.
При очистке медного купороса получилось 150 мг
примесей, что составило 2% от массы образца.
Определите массу технического медного купороса,
который подвергли очистке.
5. Для изготовления полупроводниковых
батарей используется сверхчистый кремний.
Массовая доля примесей в нем не должна превышать
0,000 000 0001%. Годится ли для данных целей
кремний, в 30 кг которого содержится 0,03 мг
примесей?