5 Найдите массу глюкозы и объем кислорода (н.у.), образующихся в процессе фотосинтеза, если в реакцию вступило 448 м3 углекислого газа (н.у.). Вычислите количество вещества воды, которое для этого потребовалось.

Решение:
Реакцию синтеза кислорода при фотосинтезе можно схематично представить так:
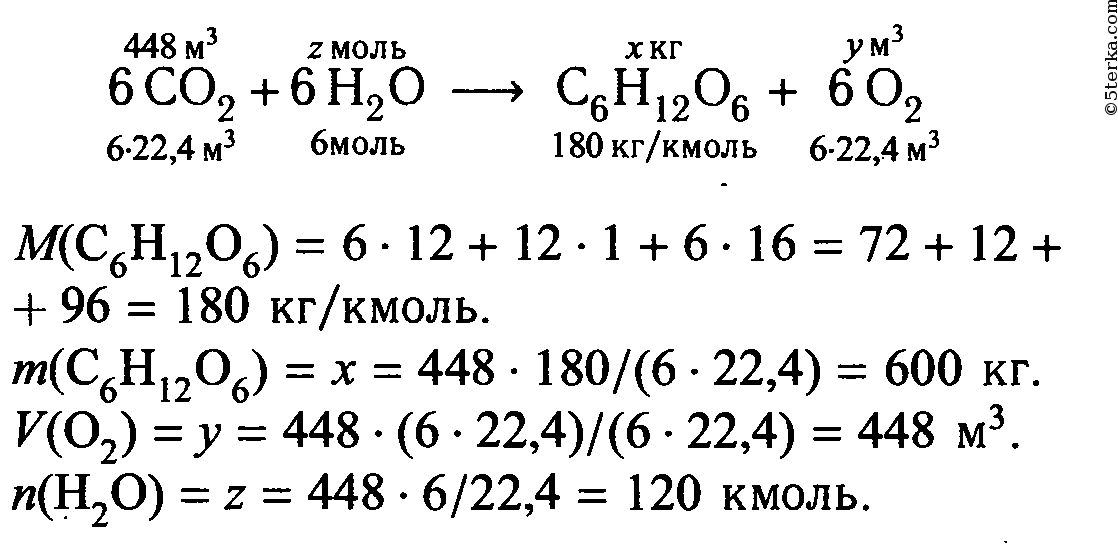
Ответ:

| Глюкоза[1] | |
|---|---|
 |
|
| Общие | |
| Систематическое наименование |
(2R,3S,4R,5R)-2,3,4,5,6-пентагидроксигексаналь (D-глюкоза), (2S,3R,4S,5S)-2,3,4,5,6-пентагидроксигексаналь (L-глюкоза) |
| Традиционные названия | Глюкоза, декстроза |
| Хим. формула | C6H12O6 |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 180,16 г/моль |
| Плотность | 1,5620 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления |
α-D-глюкоза: 146 °C (моногидрат: 83 °C) β-D-глюкоза: 148–150 °C |
| Химические свойства | |
| Растворимость | |
| • в воде |
32,3 г/100 мл (0 °C) 562 г/100 мл (90,8 °C) |
| • в 80 % этаноле | 2 г/100 мл |
Вращение ![{displaystyle [alpha ]_{D}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/429fc012b121ba581ec80c25ca5c4e5635452410) |
α-D-глюкоза: +112,2° β-D-глюкоза: +18,7° |
| Структура | |
| Дипольный момент | 14,1 Д |
| Классификация | |
| Рег. номер CAS |
50-99-7 (D-глюкоза) 921-60-8 (L-глюкоза) |
| PubChem | 5793 |
| Рег. номер EINECS | 200-075-1 |
| RTECS | LZ6600000 |
| ChEBI | 17234 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Глюко́за, или виноградный сахар, или декстроза (D-глюкоза), C6H12O6 — органическое соединение, моносахарид (шестиатомный гидроксиальдегид, гексоза), один из самых распространённых источников энергии в живых организмах[2]. Встречается в соке многих фруктов и ягод, в том числе и винограда, от чего и произошло название этого вида сахара. Глюкозное звено входит в состав полисахаридов (целлюлоза, крахмал, гликоген) и ряда дисахаридов (мальтозы, лактозы и сахарозы), которые в пищеварительном тракте быстро расщепляются на мономеры: например, сахароза — на глюкозу и фруктозу, лактоза — на глюкозу и галактозу, и т. д.
Этимология[править | править код]
Название «глюкоза» было дано в 1838 году Жаном-Батистом Дюма, в основу легло греческое слово «gleukos», что означает «сладкий»[]. Фридрих Август Кекуле предложил термин «декстроза», поскольку в водном растворе глюкозы плоскость линейно-поляризованного света повернута вправо, а «dexter» на латыни означает «правый»[3].
История[править | править код]
Вероятно, глюкоза известна человеку с древних времён, поскольку она кристаллизуется из мёда. Однако в чистом виде её выделили гораздо позже: немецкий химик Андреас Маргграф получил её в 1747 году из виноградного сока. Жозеф Луи Пруст в 1801 году осадил кристаллы α-D-глюкозы из того же виноградного сока. Благодаря этим экспериментам за глюкозой закрепилось название виноградного сахара[4].
Использование глюкозы в качестве подсластителя связано с тем, что во время Наполеоновских войн были заблокированы поставки тростникового сахара из Вест-Индии. Ещё в 1000 году до н. э. в Китае из крахмала (ферментацией риса) получали искусственный подсластитель — дисахарид мальтозу. К концу XVIII в. в Европе было известно, что крахмал можно обработать кислотой и получить сладкое вещество. Именно это позволило К. С. Кирхгофу нагреванием картофельного крахмала с серной кислотой получить сладкое сиропообразное вещество. В результате оптимизации процесса он получил сироп, который кристаллизовался при стоянии. Кроме того, была предпринята попытка прессовать получаемую массу в твёрдый продукт и в таком виде продавать. Однако организовать производство не удалось, поскольку Наполеон потерпел поражение и поставки сахара были восстановлены[4].
Процесс получения глюкозы исследовал французский химик Соссюр. Он выяснил, что крахмал подвергается гидролизу, при котором разрушаются связи между углеводными фрагментами, причём на каждый разрыв расходуется по одной молекуле воды. Также было обнаружено, что конфеты, производимые из сиропов глюкозы, не такие сладкие, как те, что получают из сахарозы. Поэтому в Германии и других странах Европы было организовано производство глюкозы[4].
В то время промышленная глюкоза была недостаточно чистой и получалась в виде сиропов. Её приходилось многократно кристаллизовать из воды или использовать органические растворители. Единственной твёрдой формой, которую выпускали в большом количестве, была литая глюкоза: сироп заливали в формы, где он затвердевал[4].
В 1923 году в США Уильям Б. Ньюкирк (англ. William B. Newkirk) запатентовал промышленный способ получения глюкозы. Этот способ отличался тщательным контролем условий кристаллизации, благодаря чему глюкоза выпадала из раствора в виде чистых, крупных кристаллов[4].
Строение молекулы[править | править код]
Глюкоза принадлежит к классу альдогексоз, то есть является полигидроксиальдегидом, содержащим шесть атомов углерода, альдегидную группу и пять гидроксильных групп. Четыре атома углерода в её структуре являются хиральными, поэтому существует 16 стереоизомерных альдогексоз: некоторые встречаются в природе, некоторые получены синтетически. Конкретную конфигурацию хиральных центров глюкозы в конце XIX в. установил немецкий химик Эмиль Фишер. Он сделал это при помощи реакций наращивания и деградации углеродной цепи сахаров. Наряду с наиболее распространённым в природе моносахаридом D-глюкозой существует также её энантиомер L-глюкоза, который в природе практически не встречается[5][6].

D-глюкоза (слева) и L-глюкоза (справа)
Часто D-глюкозу изображают в линейной форме, однако в действительности D-глюкоза существует в циклической форме, образованной в результате присоединения ОН-группы при углероде С-5 к альдегидной группе. Образующийся при этом циклический полуацеталь устойчив: в растворах и кристаллической форме D-глюкоза более чем на 99 % находится в форме полуацеталя. В общем такую форму называют пиранозной (от названия пирана — шестичленного гетероцикла с одним атомом кислорода), а циклическую D-глюкозу называют D-глюкопиранозой[7].
При описанной циклизации возникает новый стереоцентр при полуацетальном атоме углерода, поэтому D-глюкопираноза может существовать в виде двух диастереомеров, называемых аномерами: α-D-глюкопиранозы и β-D-глюкопиранозы (или кратко: α-D-глюкозы и β-D-глюкозы; α-аномера и β-аномера). Изображать циклические формы углеводов удобно при помощи проекций Хеуорса — идеализированных шестичленных циклов с заместителями над и под плоскостью цикла[7][6].
|
|
|
Наиболее близко к истине структуру молекулы глюкозы можно изобразить, используя конформацию «кресло». В таком представлении все гидроксильные группы D-глюкопиранозы находятся в экваториальных положениях (кроме аномерной, которая может находиться в экваториальном либо аксиальном положении в зависимости от аномера). Экваториальные положения более выгодны по сравнению с аксиальными: это объясняет, почему глюкоза является наиболее распространённым моносахаридом[7].
|
|
|
В растворах α-D-глюкопираноза и β-D-глюкопираноза существуют в равновесии и взаимопревращаются через образование открытоцепной формы. Равновесная доля α-аномера при 31 °C составляет 38 %, а более устойчивого β-аномера — 62 %[8]. Чистые аномеры можно получить в кристаллическом виде: α-аномер кристаллизуется из воды в виде моногидрата, а β-аномер кристаллизуется из пиридина[9].

Физические свойства[править | править код]
Глюкоза — бесцветное кристаллическое вещество без запаха. Обладает сладким вкусом. D-глюкоза представлена в виде трёх кристаллических форм: безводной α-D-глюкопиранозы, моногидрата α-D-глюкопиранозы и безводной β-D-глюкопиранозы (хотя описан также моногидрат β-D-глюкопиранозы). Безводные формы имеют орторомбические кристаллы, а гидрат — моноклинные[8]. Все три формы отличаются температурой плавления: α-аномер плавится при 146 °C, его моногидрат — при 83 °C, β-аномер — при 148—150 °C[9].
Аномеры D-глюкопиранозы оптически активны: удельное вращение α-аномера составляет +112,2°, β-аномера — +18,9°[9]. Оба аномера при растворении претерпевают мутаротацию, то есть превращаются в равновесную смесь, состоящую из 62 % β-аномера и 38 % α-аномера[8]. Удельное вращение этой смеси составляет +52,7°[9].
Получение[править | править код]
Производство глюкозных сиропов[править | править код]
Кислотный гидролиз крахмала[править | править код]

Единственным сырьём для производства глюкозы является крахмал, хотя делаются попытки использовать другой природный полимер глюкозы — целлюлозу. Основным источником крахмала является кукуруза: 100 % глюкозных подсластителей в США и 84 % в Японии производят из кукурузного крахмала. Также 70 % производимой в мире кукурузы идёт на производство глюкозы. В Европе постепенно возрастает использование пшеничного крахмала, хотя в основном используется также кукурузный крахмал. В Австралии глюкозу получают только из пшеничного крахмала. В Азии используют крахмал из саго, тапиоки и кукурузы[10].
Для получения глюкозы крахмал гидролизуют в присутствии кислот или ферментов. При этом происходит разрыв связей между глюкозными звеньями полимерных амилозы и амилопектина — компонентов крахмала — и образуется мономер (D-глюкоза) с некоторым содержанием димеров: мальтозы и изомальтозы. Для кислотного гидролиза готовят суспензию крахмала в воде (30-40 мас. %) и доводят pH до 2 или ниже. При атмосферном давлении кислотный гидролиз протекает 6 ч, однако современные установки позволяют проводить процесс при повышенном давлении и, соответственно, более высокой температуре. При давлении 415—620 кПа и температуре до 160 °C крахмал гидролизуется в течение нескольких минут. Останавливают реакцию добавлением нейтрализующего реагента (обычно карбоната натрия), и pH повышается до 4-5,5[11].
После гидролиза нерастворимые примеси, которые изначально присутствовали в крахмале, отделяют центрифугированием или фильтрованием, а растворимые примеси удаляют активированным углём и ионообменными смолами. Смолы также позволяют обесцветить полученную глюкозу. Конечный раствор упаривают. Большинство глюкозных сиропов продают в виде 70-85 % растворов, хотя их можно упарить и до твёрдого состояния[11].
Глюкозные сиропы отличаются по степени гидролиза крахмала: её оценивают по количеству присутствующих в конечном продукте восстанавливающих сахаров и выражают в декстрозных эквивалентах (DE). Интересно, что кислотный гидролиз является в целом случайным процессом, однако в данном случае при одинаковой степени конверсии получается очень воспроизводимый углеводный состав конечного продукта. В некоторых случаях этот факт является нежелательным ограничением, потому что производителю может понадобиться более гибко регулировать углеводный состав. Из-за этого в промышленности стали использовать ферментативный гидролиз крахмала[11].
Ферментативный гидролиз крахмала[править | править код]
Ферментативный гидролиз используют как дополнение к кислотному. Изначально таким способом пытались повысить степень конверсии и получить более сладкий и менее вязкий сироп с большим содержанием глюкозы. Однако ферментативный гидролиз позволяет также регулировать соотношение глюкозы и мальтозы в продукте. Для проведения ферментативного гидролиза pH повышают до 4-6, а температуру снижают до 60-70 °C, затем вносят необходимые ферменты, которые подбирают исходя из потребностей по составу. Бактериальные α-амилазы случайным образом расщепляют α-1,4-гликозидные связи в крахмале. β-Амилазы и грибковые α-амилазы расщепляют те же связи, но дают преимущественно мальтозу. Глюкоамилаза отщепляет по одной молекуле глюкозы с невосстанавливающего конца, но может расщеплять также α-1,6-связи. Пуллуланаза расщепляет α-1,6-связи. По окончании процесса ферменты дезактивируют нагреванием или изменением pH[11].
Открытие термоустойчивых α-амилаз позволило разработать полностью ферментативные процессы и ещё более точно контролировать степень конверсии и углеводный состав продукта. Ферменты вносят в суспензию крахмала при pH 6-6,5, после чего суспензию нагревают паром до 103—107 °C и выдерживают в течение 5-10 мин, а затем 1-2 ч при 95 °C. После этого проводят вторичный ферментативный гидролиз, как и в случае кислотного гидролиза[11].
Производство общего сахара[править | править код]
Большая часть глюкозы продаётся в виде сиропов, но существует небольшая потребность также в твёрдой глюкозе. Её производят как в чистом виде, так и в виде общего сахара (англ. total sugars) — отверждённого гидролизата крахмала. Общий сахар может содержать значительное количество мальтозы (DE<20), быть практически чистой глюкозой (95-99 %), а также содержать определённый процент фруктозы[12].
Производство кристаллической глюкозы[править | править код]
Изначально чистую кристаллическую глюкозу производили из крахмала, гидролизованного в кислой среде. В таких условиях удавалось добиться только 88 % содержания глюкозы, поскольку в условиях гидролиза образовывались побочные продукты, связанные с мутаротацией и изомеризацией. С 1938 года начали использовать ферментативный гидролиз, который позволил получать более чистую глюкозу[13].
Моногидрат α-D-глюкозы получают кристаллизацией из перенасыщенных сиропов с содержанием твёрдого вещества в 74-79 %, из которого глюкоза составляет 95-96 %. Такие сиропы производят ферментативным гидролизом, нацеленным на максимальную конверсию. Сироп охлаждают до 46-50 °C и смешивают с затравочными кристаллами из предыдущей партии. Сироп медленно охлаждают до 20-40 °C в течение 2-5 дней: при этом около 60 % кристаллизуется в виде моногидрата α-D-глюкозы. Маточный раствор отделяют на центрифугах, кристаллы глюкозы промывают водой и там же сушат до максимально сухого состояния (14 % влаги). Затем их досушивают потоком горячего воздуха до 8,5-9 % влаги (теоретическое содержание воды в моногидрате — 9,08 %). Кристаллизации не мешает наличие примесей, поэтому маточный раствор концентрируют и получают вторую порцию кристаллов либо объединяют его со следующей партией сиропа. Извлечение моногидрата глюкозы из сиропа достигает 87,5 %. При повторных кристаллизациях из маточного раствора степень выделения повышается до 100 %[13].
Безводную α-D-глюкозу кристаллизуют при 60-65 °C в условиях вакуума и испарения растворителя. Исходные сиропы должны быть достаточно чистые. Цикл кристаллизации значительно короче, чем для моногидрата, и составляет 6-8 ч. Выделяют и сушат кристаллы примерно так же, как описано выше. Содержание воды в конечном продукте не превышает 0,1 %[13].
Безводную β-D-глюкозу получают кристаллизацией выше 100 °C. Дополнительные сложности связаны с тем, что β-D-глюкоза значительно лучше растворима в воде, чем α-D-глюкоза (72 % против 30 % при 25 °C)[13].
Химические свойства[править | править код]
Глюкоза может восстанавливаться в шестиатомный спирт (сорбит). Окисление глюкозы в зависимости от метода окисления может приводить к трём продуктам: глюконовой кислоте (окисление альдегидной группы), глюкаровой кислоте (дополнительно окисляется первичная OH-группа) либо глюкуроновой кислоте (окисление только первичной OH-группы)[9].
Как восстанавливающий сахар, глюкоза проявляет восстановительные свойства. Это проявляется в реакциях с реактивом Толленса (аммиачным раствором оксида серебра), реактивом Бенедикта и реактивом Фелинга (реагенты на основе меди)[источник не указан 584 дня].
Глюкоза обладает также некоторыми специфическими свойствами, такими как брожение — деструктивное разложение под действием ферментов. Возможны несколько типов брожения: спиртовое (образуется этанол и углекислый газ), молочно-кислое (образуется молочная кислота), масляное (образуется бутановая кислота, водород, углекислый газ). ацетоновое (образуется бутанол, ацетон, водород, углекислый газ), лимоннокислое-кислое (образуется лимонная кислота)[источник не указан 584 дня].
Биологическая роль[править | править код]
Глюкоза — основной продукт фотосинтеза, образуется в цикле Кальвина.
В организме человека и животных глюкоза является основным и наиболее универсальным источником энергии для обеспечения метаболических процессов. Глюкоза является субстратом гликолиза, в ходе которого она может окислиться либо до пирувата в аэробных условиях, либо до лактата в случае анаэробных условий. Пируват, полученный таким образом в гликолизе, далее декарбоксилируется, превращаясь в ацетил-КоА (ацетилкоэнзим А). Также в ходе окислительного декарбоксилирования пирувата восстанавливается кофермент НАД+. Ацетил-КоА далее используется в цикле Кребса, а восстановленный кофермент используется в дыхательной цепи.
Глюкоза депонируется у животных в виде гликогена, у растений — в виде крахмала, полимер глюкозы — целлюлоза является основной составляющей клеточных оболочек всех высших растений.
У животных глюкоза помогает пережить заморозки. Так, у некоторых видов лягушек перед зимой повышается уровень глюкозы в крови, за счёт чего их тела способны выдержать заморозку во льду.
Применение[править | править код]
В медицине[править | править код]

Глюкозу используют при интоксикации (например, при пищевом отравлении и инфекциях), вводят внутривенно струйно и капельно, так как она является универсальным антитоксическим средством.
Глюкозу используют для целей регидратации организма, как источник углеводов, в том числе при парентеральном питании.
Также препараты на основе глюкозы и сама глюкоза используются эндокринологами при определении наличия и типа сахарного диабета у человека (в виде стресс-теста на ввод повышенного количества глюкозы в организм).
Глюкозу применяют в медицине как питательное вещество и компонент кровозаменяющих противошоковых жидкостей. Кроме того, в медицине широко применяется кальциевая соль глюконовой кислоты (глюконат кальция).
Для медицинских целей глюкоза обычно используется в виде раствора для инъекций или инфузий, а также в виде таблеток.
В пищевой промышленности[править | править код]
В пищевой промышленности глюкоза применяется при выпечке хлеба, в кондитерском деле, а также при производстве сгущённого молока, мороженого, простокваша, кефир. Также для производства спирта, вин, пива.
В сельском хозяйстве[править | править код]
В сельском хозяйстве глюкоза зачастую применяется для подкормки пчёл.
В химической промышленности[править | править код]
Глюкоза используется для получения витамина C (аскорбиновая кислота), сорбита и биополимеров.
Примечания[править | править код]
- ↑ Рабинович В. А., Хавин З. Я. Краткий химический справочник. — 2-е издание. — Химия, 1978.
- ↑ Степаненко Б. Н., Городецкий В. К.; Ковалев Г. В. (фарм.). Глюкоза // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3-е изд. — М. : Советская энциклопедия, 1977. — Т. 6 : Гипотиреоз — Дегенерация. — С. 197—199. — 632 с. : ил.
- ↑ Sami Dridi. Nutritional Biochemistry: From the Classroom to the Research Bench. — Bentham Science Publishers, 2022. — С. 208-209. — 287 с. — ISBN 978-981-5051-58-2. Архивная копия от 15 мая 2022 на Wayback Machine
- ↑ 1 2 3 4 5 Ullmann, 2006, p. 45–48.
- ↑ Терней, 1981, с. 444–447.
- ↑ 1 2 Робертс Дж., Касерио М. Основы органической химии / Пер. с англ. Ю. Г. Бунделя, под ред. А. Н. Несмеянова. — М. : Мир, 1978. — С. 10–27.
- ↑ 1 2 3 Терней, 1981, с. 424–429.
- ↑ 1 2 3 Ullmann, 2006, p. 48.
- ↑ 1 2 3 4 5 Химическая энциклопедия, 1988.
- ↑ Ullmann, 2006, p. 49–51.
- ↑ 1 2 3 4 5 Ullmann, 2006, p. 51–56.
- ↑ Ullmann, 2006, p. 56.
- ↑ 1 2 3 4 Ullmann, 2006, p. 56–58.
Литература[править | править код]
- Линевич Л. И. Глюкоза // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1: А — Дарзана. — С. 589–590. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
- Терней А. Современная органическая химия : в 2 т.. — М. : Мир, 1981. — Т. 2.
- Schenck F. W. Glucose and Glucose-Containing Syrups (англ.) // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2006. — doi:10.1002/14356007.a12_457.pub2.
- Ельницкий А. П. Химия : учеб. для 11-го кл. учреждений общ. средн. образования с рус.яз. обучения / А. П. Ельницкий, Е. И. Шарапа. — 3-е изд., пересмотр. и доп. — Минск : Нар. асвета, 2013. — 318 с. : ил. ISBN 978-985-03-1960-9
Ссылки[править | править код]
- 1Н и 13С ЯМР-спектры α-D-глюкозы. Sigma-Aldrich. Дата обращения: 9 апреля 2019.
- ИК-спектр α-D-глюкозы. Sigma-Aldrich. Дата обращения: 9 апреля 2019.
- КР-спектр α-D-глюкозы. Sigma-Aldrich. Дата обращения: 9 апреля 2019.
Уравнения реакций этапов энергетического обмена. 1 этап – подготовительный
1 этап – подготовительный
2 этап – гликолиз (бескислородный)
Этап – кислородный
ЗАДАЧИ
1)В процессе гидролиза образовалось 972 молекулы АТФ. Определите, какое количество молекул глюкозы подверглось расщеплению и сколько молекул АТФ образовалось в результате гликолиза и полного окисления. Ответ поясните.
Ответ: 1) при гидролизе (кислородный этап) из одной молекулы глюкозы образуется 36 молекул АТФ, следовательно, гидролизу подверглось: 972 : 36 = 27 молекул глюкозы;
2) при гликолизе одна молекула глюкозы расщепляется до 2-х молекул ПВК с образованием 2-х молекул АТФ, поэтому количество молекул АТФ равно: 27 х 2 = 54;
3) при полном окислении одной молекулы глюкозы образуется 38 молекул АТФ, следовательно, при полном окислении 27 молекул глюкозы образуется : 27 х 38 = 1026 молекул АТФ (или 972 + 54 = 1026).
2)Какое из двух типов брожения – спиртовое или молочнокислое является энергетически более эффективным? Эффективность рассчитать по формуле:
где Езап. – запасённая энергия; Еобщ. – общая энергия.
Энергия, запасённая в 1 моль АТФ, составляет 30,6 кДж/моль.
Энергия общая – 150 кДж/моль (спиртовое брожение);
Энергия общая – 210 кДж/моль (молочнокислое брожение).
Ответ: 1) и спиртовое и молочнокислое брожение протекает в анаэробных условиях (без кислорода), и в результате синтезируется 2 моль АТФ, т.е. 2 х 30,6 кДж/моль = 61,2 кДж/моль;
2) эффективность спиртового брожения:
| Эфсп. бр. = | 61,2 | Х 100% = 40,8% |
| 150 |
3) эффективность молочнокислого брожения:
| Эфмол. бр. = | 61,2 | Х 100% = 29,1% |
| 210 |
4) энергетически более эффективным является спиртовое брожение.
3) Гликолизу подверглось две молекулы глюкозы, окислению только одна. Определите количество образованных молекул АТФ и выделившихся молекул углекислого газа при этом.
Для решения используем уравнения 2 этапа (гликолиза)и 3 этапа (кислородного)энергетического обмена.
При гликолизе одной молекулы глюкозы образуется 2 молекулы АТФ, а при окислении 36 АТФ.
По условию задачи гликолизу подверглось 2 молекулы глюкозы: 2∙× 2=4 ,а окислению только одна
Углекислый газ образуется только на 3 этапе, при полном окислении одной молекулы глюкозы образуется 6 СО2
4)В процессе гликолиза образовалось 68 молекул пировиноградной кислоты (ПВК). Определите, какое количество молекул глюкозы подверглось расщеплению и сколько молекул АТФ образовалось при полном окислении. Ответ поясните.
1) при гликолизе (бескислородный этап катаболизма) одна молекула глюкозы расщепляется с образованием 2-х молекул ПВК, следовательно, гликолизу подверглось: 68 : 2 = 34 молекулы глюкозы;
2) при полном окислении одной молекулы глюкозы образуется 38 молекул АТФ (2 молекулы при гликолизе и 38 молекул при гидролизе);
3) при полном окислении 34-х молекул глюкозы образуется: 34 х 38 = 1292 молекулы АТФ.
5)В процессе гликолиза образовались 112 молекул пировиноградной кислоты (ПВК). Какое количество молекул глюкозы подверглось расщеплению и сколько молекул АТФ образуется при полном окислении глюкозы в клетках эукариот? Ответ поясните.
Пояснение.1) В процессе гликолиза при расщеплении 1 молекулы глюкозы образуется 2 молекулы пировиноградной кислоты и выделяется энергия, которой хватает на синтез 2 молекул АТФ.
2) Если образовалось 112 молекулы пировиноградной кислоты, то, следовательно расщеплению подверглось 112 : 2 = 56 молекул глюкозы.
3) При полном окислении в расчете на одну молекулу глюкозы образуется 38 молекул АТФ.
Следовательно, при полном окислении 56 молекулы глюкозы образуется 38 х 56 = 2128 молекул АТФ
6)В процессе кислородного этапа катаболизма образовалось 1368 молекулы АТФ. Определите, какое количество молекул глюкозы подверглось расщеплению и сколько молекул АТФ образовалось в результате гликолиза и полного окисления? Ответ поясните.
Пояснение.1) В процессе энергетического обмена из одной молекулы глюкозы образуется 36 молекул АТФ, следовательно, гликолизу, а затем полному окислению подверглось 1368 : 36 = 38 молекул глюкозы.
2) При гликолизе одна молекула глюкозы расщепляется до 2-ух молекул ПВК с образованием 2 молекул АТФ. Поэтому количество молекул АТФ, образовавшихся при гликолизе, равно 38 × 2 = 76.
3) При полном окислении одной молекулы глюкозы образуется 38 молекул АТФ, следовательно, при полном окислении 38 молекул глюкозы образуется 38 × 38 = 1444 молекул АТФ.
7)В процессе кислородного этапа катаболизма образовалось 1368 молекулы АТФ. Определите, какое количество молекул глюкозы подверглось расщеплению и сколько молекул АТФ образовалось в результате гликолиза и полного окисления? Ответ поясните.
Пояснение.1) В процессе энергетического обмена из одной молекулы глюкозы образуется 36 молекул АТФ, следовательно, гликолизу, а затем полному окислению подверглось 1368 : 36 = 38 молекул глюкозы.
2) При гликолизе одна молекула глюкозы расщепляется до 2-ух молекул ПВК с образованием 2 молекул АТФ. Поэтому количество молекул АТФ, образовавшихся при гликолизе, равно 38 × 2 = 76.
3) При полном окислении одной молекулы глюкозы образуется 38 молекул АТФ, следовательно, при полном окислении 38 молекул глюкозы образуется 38 × 38 = 1444 молекул АТФ.
8) В процессе диссимиляции произошло расщепление 7 моль глюкозы, из которых полному (кислородному) расщеплению подверглось только 2 моль. Определите:
а) сколько молей молочной кислоты и углекислого газа при этом образовано;
б) сколько молей АТФ при этом синтезировано;
в) сколько энергии и в какой форме аккумулировано в этих молекулах АТФ;
г) Сколько молей кислорода израсходовано на окисление образовавшейся при этом молочной кислоты.
1) Из 7 моль глюкозы 2 подверглись полному расщеплению, 5 – не полому (7-2=5):
2) составляем уравнение неполного расщепления 5 моль глюкозы; 5C6H12O6 + 5•2H3PO4 + 5•2АДФ = 5•2C3H6O3 + 5•2АТФ + 5•2H2O;
3) составляет суммарное уравнение полного расщепления 2 моль глюкозы:
4) суммируем количество АТФ: (2•38) + (5•2) = 86 моль АТФ; 5) определяем количество энергии в молекулах АТФ: 86•40кДж = 3440 кДж.
а) 10 моль молочной кислоты, 12 моль CO2;
в) 3440 кДж, в форме энергии химической связи макроэргических связей в молекуле АТФ;
9) В результате диссимиляции в клетках образовалось 5 моль молочной кислоты и 27 моль углекислого газа. Определите:
а) сколько всего молей глюкозы израсходовано;
б) сколько из них подверглось только неполному и сколько полному расщеплению;
в) сколько АТФ при этом синтезировано и сколько энергии аккумулировано;
г) сколько молей кислорода израсходовано на окисление образовавшейся молочной кислоты.
Энергетический обмен
Обмен веществ
Обмен веществ (метаболизм) складывается из процессов расщепления и синтеза – диссимиляции и ассимиляции, постоянно протекающих в организме. Чтобы жизнь продолжалась, количество поступающей энергии должно превышать (или как минимум равняться) количеству расходуемой энергии, поэтому диссимиляция и ассимиляция поддерживают определенный баланс друг с другом.

Энергетический обмен
Энергетический обмен (диссимиляция – от лат. dissimilis ‒ несходный) – обратная ассимиляции сторона обмена веществ, совокупность реакций, которые приводят к высвобождению энергии химических связей. Это реакции расщепления жиров, белков, углеводов, нуклеиновых кислот до простых веществ.
Возможно три этапа диссимиляции: подготовительный, анаэробный и аэробный. Среда обитания определяет количество этапов диссимиляции. Их может быть три, если организм обитает в кислородной среде, и два, если речь идет об организме, обитающем в бескислородной среде (к примеру, в кишечнике).
Обсудим этапы энергетического обмена более подробно:
-
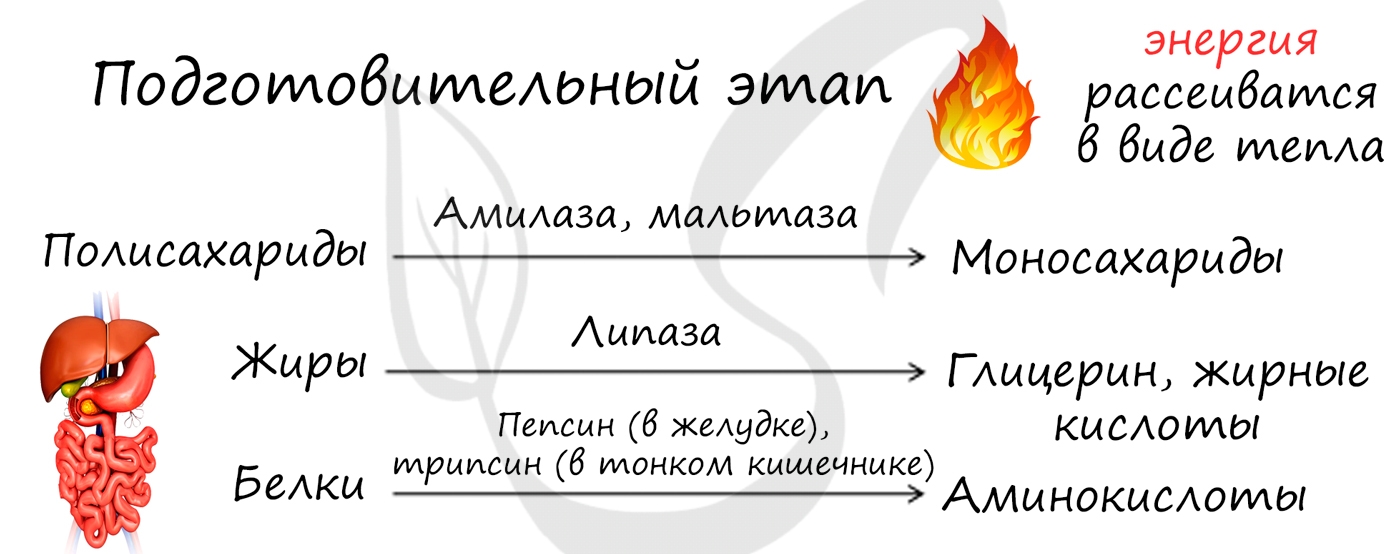
Подготовительный этап
Подготовительный этап осуществляется ферментами в ЖКТ. В результате действия ферментов сложные вещества превращаются в более простые: полимеры распадаются на мономеры. Это сопровождается разрывом химических связей и выделением энергии, большая часть которой рассеивается в виде тепла.
Под действием ферментов белки расщепляются на аминокислоты, жиры – на глицерин и жирные кислоты, сложные углеводы – до простых сахаров.
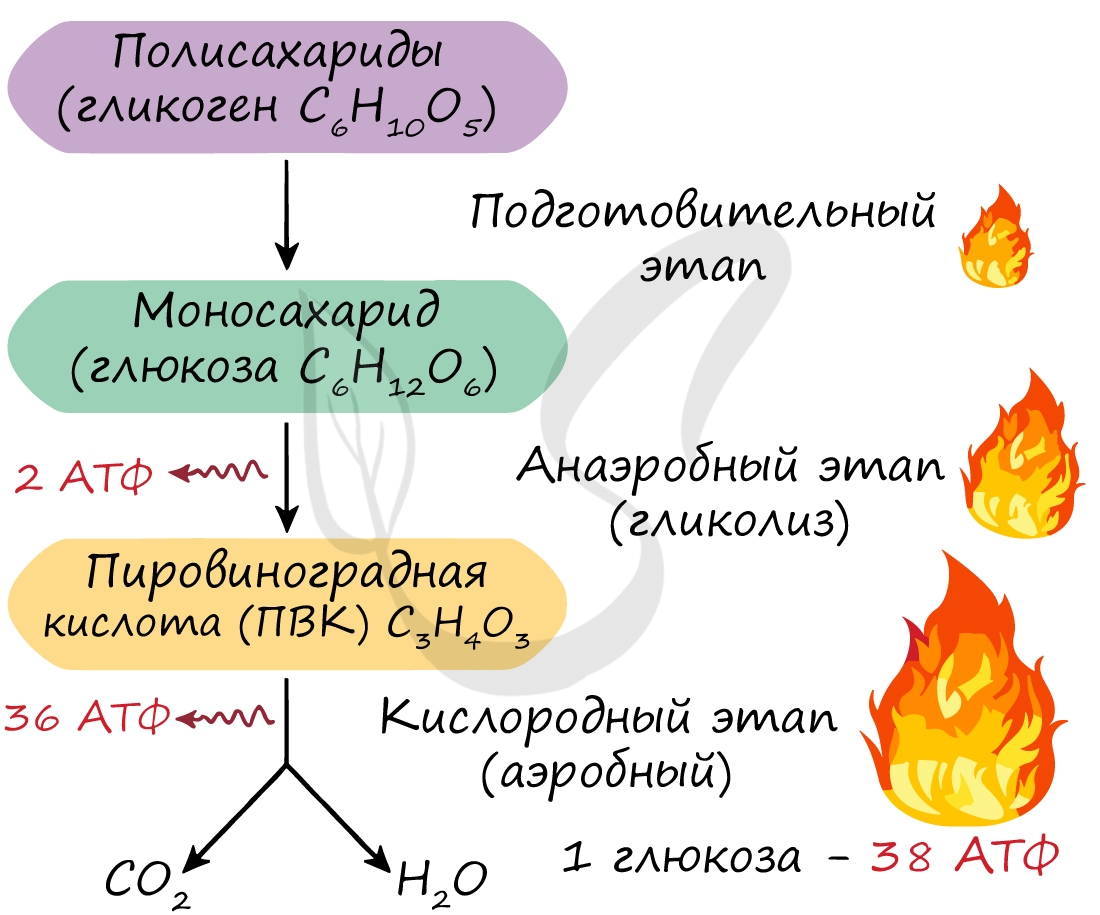
Этот этап является последним для организмов-анаэробов, обитающих в условиях, где кислород отсутствует. На этапе гликолиза происходит расщепление молекулы глюкозы: образуется 2 молекулы АТФ и 2 молекулы пировиноградной кислоты (ПВК). Происходит данный этап в цитоплазме клеток.
Кислородный этап (аэробный)
Этот этап доступен только для аэробов – организмов, живущих в кислородной среде. Из каждой молекулы ПВК, образовавшейся на этапе гликолиза, синтезируется 18 молекул АТФ – в сумме с двух ПВК выход составляет 36 молекул АТФ.
Таким образом, суммарно с одной молекулы глюкозы можно получить 38 АТФ (гликолиз + кислородный этап).
Кислородный этап протекает на кристах митохондрий (складках, выпячиваниях внутренней мембраны), где наибольшая концентрация окислительных ферментов. Главную роль в этом процессе играет так называемый цикл Кребса, который подробно изучает биохимия.
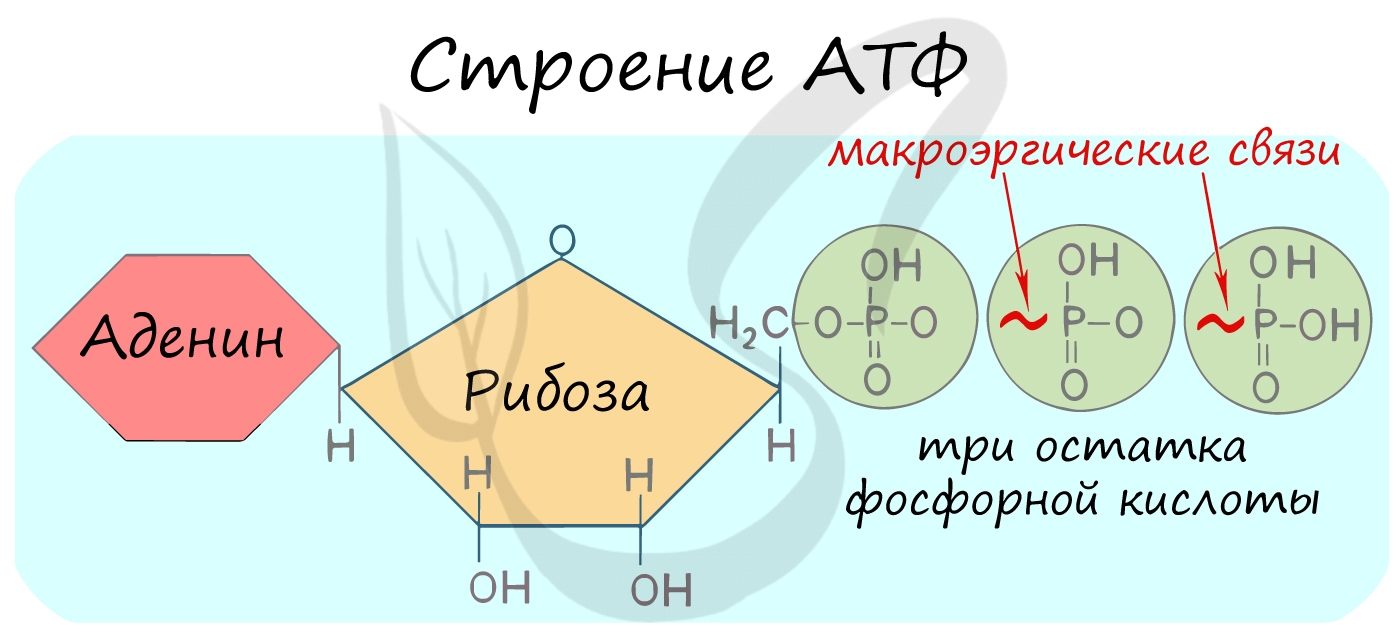
АТФ – аденозинтрифосфорная кислота
Трудно переоценить роль в клетке АТФ – универсального источника энергии. Молекула АТФ состоит из азотистого основания – аденина, углевода – рибозы и трех остатков фосфорной кислоты.
Между остатками фосфорной кислоты находятся макроэргические связи – ковалентные связи, которые гидролизуются с выделением большого количества энергии. Их принято обозначать типографическим знаком тильда “∽”.
АТФ гидролизуется до АДФ (аденозиндифосфорная кислота), а затем и до АМФ (аденозинмонофосфорная кислота). Гидролиз АТФ сопровождается выделением энергии (E) на каждом этапе и может быть представлен такой схемой:
- АТФ + H2O = АДФ + H3PO4 + E
- АДФ + H2O = АМФ + H3PO4 + E
- АМФ + H2O = аденин + рибоза + H3PO4 + E
Пластический обмен
АТФ является универсальным источником энергии в клетке: энергия макроэргических связей АТФ используется для реакций пластического обмена (ассимиляции), протекающих с затратой энергии: синтеза белка на рибосоме (трансляции), удвоению ДНК (репликации) и т.д.
В результате пластического обмена в нашем организме происходит синтез белков, жиров и углеводов.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Метаболизм клетки. Энергетический обмен и фотосинтез. Реакции матричного синтеза.
Понятие метаболизма
Метаболизм — совокупность всех химических реакций, протекающих в живом организме. Значение метаболизма состоит в создании необходимых организму веществ и обеспечении его энергией.
Выделяют две составные части метаболизма — катаболизм и анаболизм.
Составные части метаболизма
Часть
Характеристика
Примеры
Затраты энергии
Катаболизм (энергетический обмен, диссимиляция)
Совокупность химических реакций, приводящих к образованию простых веществ из более сложных
Гидролиз полимеров до мономеров и расщепление последних до низкомолекулярных соединений углекислого газа, воды, аммиака и других веществ
Энергия выделяется
Анаболизм (пластический обмен, ассимиляция)
Совокупность химических реакций синтеза сложных веществ из более простых
Образование углеводов из углекислого газа и воды в процессе фотосинтеза, реакции матричного синтеза
Энергия поглощается
Процессы пластического и энергетического обмена неразрывно связаны между собой. Все синтетические (анаболические) процессы нуждаются в энергии, поставляемой в ходе реакций диссимиляции. Сами же реакции расщепления (катаболизма) протекают лишь при участии ферментов, синтезируемых в процессе ассимиляции.
Роль ФТФ в метаболизме
Энергия, высвобождающаяся при распаде органических веществ, не сразу используется клеткой, а запасается в форме высокоэнергетических соединений, как правило, в форме аденозинтрифосфата (АТФ). По своей химической природе АТФ относится к мононуклеотидам.
АТФ (аденозинтрифосфорная кислота) — мононуклеотид, состоящий из аденина, рибозы и трёх остатков фосфорной кислоты, соединяющихся между собой макроэргическими связями.
В этих связях запасена энергия, которая высвобождается при их разрыве:
АТФ + H2O → АДФ + H3PO4 + Q1
АДФ + H2O → АМФ + H3PO4 + Q2
АМФ + H2O → аденин + рибоза + H3PO4 + Q3,
где АТФ — аденозинтрифосфорная кислота; АДФ — аденозиндифосфорная кислота; АМФ — аденозинмонофосфорная кислота; Q1 = Q2 = 30,6 кДж; Q3 = 13,8 кДж.
Запас АТФ в клетке ограничен и пополняется благодаря процессу фосфорилирования. Фосфорилирование — присоединение остатка фосфорной кислоты к АДФ (АДФ + Ф → АТФ). Он происходит с разной интенсивностью при дыхании, брожении и фотосинтезе. АТФ обновляется чрезвычайно быстро (у человека продолжительность жизни одной молекулы АТФ менее 1 мин).
Энергия, накопленная в молекулах АТФ, используется организмом в анаболических реакциях (реакциях биосинтеза). Молекула АТФ является универсальным хранителем и переносчиком энергии для всех живых существ.
Энергетический обмен
Энергию, необходимую для жизнедеятельности, большинство организмов получают в результате процессов окисления органических веществ, то есть в результате катаболических реакций. Важнейшим соединением, выступающим в роли топлива, является глюкоза.
По отношению к свободному кислороду организмы делятся на три группы.
Классификация организмов по отношению к свободному кислороду
| Группа | Характеристика | Организмы |
| Аэробы (облигатные аэробы) | Организмы, способные жить только в кислородной среде | Животные, растения, некоторые бактерии и грибы |
| Анаэробы (облигатные анаэробы) | Организмы, неспособные жить в кислородной среде | Некоторые бактерии |
| Факультативные формы (факультативные анаэробы) | Организмы, способные жить как в присутствии кислорода, так и без него | Некоторые бактерии и грибы |
У облигатных аэробов и факультативных анаэробов в присутствии кислорода катаболизм протекает в три этапа: подготовительный, бес- кислородный и кислородный. В результате органические вещества распадаются до неорганических соединений. У облигатных анаэробов и факультативных анаэробов при недостатке кислорода катаболизм протекает в два первых этапа: подготовительный и бескислородный. В результате образуются промежуточные органические соединения, еще богатые энергией.
Этапы катаболизма
1. Первый этап — подготовительный — заключается в ферментативном расщеплении сложных органических соединений на более простые. Белки расщепляются до аминокислот, жиры — до глицерина и жирных кислот, полисахариды — до моносахаридов, нуклеиновые кислоты — до нуклеотидов. У многоклеточных организмов это происходит в желудочно-кишечном тракте, у одноклеточных — в лизосомах под действием гидролитических ферментов. Высвобождающаяся при этом энергия рассеивается в виде теплоты. Образовавшиеся органические соединения либо подвергаются дальнейшему окислению, либо используются клеткой для синтеза собственных органических соединений.
2. Второй этап — неполное окисление (бескислородный) — заключается в дальнейшем расщеплении органических веществ, осуществляется в цитоплазме клетки без участия кислорода. Главным источником энергии в клетке является глюкоза. Бескислородное, неполное окисление глюкозы называется гликолизом. В результате гликолиза одной молекулы глюкозы образуется по две молекулы пировиноградной кислоты (ПВК, пируват) CH3COCOOH, АТФ и воды, а также атомы водорода, которые связываются молекулой-переносчиком НАД + и запасаются в виде НАД·Н.
Суммарная формула гликолиза имеет следующий вид:
C6H12O6 + 2H3PO4 + 2АДФ + 2НАД+ → 2C3Н4O3 + 2H2O + 2АТФ + 2НАД·Н.
Далее при отсутствии в среде кислорода продукты гликолиза (ПВК и НАД·Н) перерабатываются либо в этиловый спирт — спиртовое брожение (в клетках дрожжей и растений при недостатке кислорода)
CH3COCOOH → СО2 + СН3СОН
СН3СОН + 2НАД·Н → С2Н5ОН + 2НАД + ,
либо в молочную кислоту — молочнокислое брожение (в клетках животных при недостатке кислорода)
CH3COCOOH + 2НАД·Н → C3Н6O3 + 2НАД + .
При наличии в среде кислорода продукты гликолиза претерпевают дальнейшее расщепление до конечных продуктов.
3. Третий этап — полное окисление (дыхание) — заключается в окислении ПВК до углекислого газа и воды, осуществляется в митохондриях при обязательном участии кислорода.
Он состоит из трёх стадий:
А) образование ацетилкоэнзима А;
Б) окисление ацетилкоэнзима А в цикле Кребса;
В) окислительное фосфорилирование в электронотранспортной цепи.
А. На первой стадии ПВК переносится из цитоплазмы в митохондрии, где взаимодействует с ферментами матрикса и образует 1) диоксид углерода, который выводится из клетки; 2) атомы водорода, которые молекулами-переносчиками доставляются к внутренней мембране митохондрии; 3) ацетилкофермент А (ацетил-КоА).
Б. На второй стадии происходит окисление ацетилкоэнзима А в цикле Кребса. Цикл Кребса (цикл трикарбоновых кислот, цикл лимонной кислоты) — это цепь последовательных реакций, в ходе которых из одной молекулы ацетил-КоА образуются 1) две молекулы диоксида углерода, 2) молекула АТФ и 3) четыре пары атомов водорода, передаваемые на молекулы-переносчики — НАД и ФАД. Таким образом, в результате гликолиза и цикла Кребса молекула глюкозы расщепляется до СО2, а высвободившаяся при этом энергия расходуется на синтез 4 АТФ и накапливается в 10 НАД·Н и 4 ФАД·Н2.
В. На третьей стадии атомы водорода с НАД·Н и ФАД·Н2 окисляются молекулярным кислородом О2 с образованием воды. Один НАД·Н способен образовывать 3 АТФ, а один ФАД·Н2–2 АТФ. Таким образом, выделяющаяся при этом энергия запасается в виде ещё 34 АТФ.
Этот процесс протекает следующим образом. Атомы водорода концентрируются около наружной стороны внутренней мембраны митохондрии. Они теряют электроны, которые по цепи молекул-переносчиков (цитохромов) электронотранспортной цепи (ЭТЦ) переносятся на внутреннюю сторону внутренней мембраны, где соединяются с молекулами кислорода:
О2 + е – → О2 – .
В результате деятельности ферментов цепи переноса электронов внутренняя мембрана митохондрий изнутри заряжается отрицательно (за счёт О2 – ), а снаружи — положительно (за счёт Н + ), так что между её поверхностями создаётся разность потенциалов. Во внутреннюю мембрану митохондрий встроены молекулы фермента АТФ- синтетазы, обладающие ионным каналом. Когда разность потенциалов на мембране достигает критического уровня, положительно заряженные частицы H + силой электрического поля начинают проталкиваться через канал АТФазы и, оказавшись на внутренней поверхности мембраны, взаимодействуют с кислородом, образуя воду:
1/2О2 – +2H + → Н2О.
Энергия ионов водорода H + , транспортирующихся через ионный канал внутренней мембраны митохондрии, используется для фосфорилирования АДФ в АТФ:
АДФ + Ф → АТФ.
Такое образование АТФ в митохондриях при участии кислорода называется окислительным фосфорилированием.
Суммарное уравнение расщепления глюкозы в процессе клеточного дыхания:
C6H12O6 + 6O2 + 38H3PO4 + 38АДФ → 6CO2 + 44H2O + 38АТФ.
Таким образом, в ходе гликолиза образуются 2 молекулы АТФ, в ходе клеточного дыхания — ещё 36 молекул АТФ, в целом при пол- ном окислении глюкозы — 38 молекул АТФ.
Пластический обмен
Пластический обмен, или ассимиляция, представляет собой совокупность реакций, обеспечивающих синтез сложных органических соединений из более простых (фотосинтез, хемосинтез, биосинтез белка и др.).
Гетеротрофные организмы строят собственные органические вещества из органических компонентов пищи. Гетеротрофная ассимиляция сводится, по существу, к перестройке молекул:
органические вещества пищи (белки, жиры, углеводы) → простые органические молекулы (аминокислоты, жирные кислоты, моносахариды) → макромолекулы тела (белки, жиры, углеводы).
Автотрофные организмы способны полностью самостоятельно синтезировать органические вещества из неорганических молекул, потребляемых из внешней среды. В процессе фото- и хемосинтеза происходит образование простых органических соединений, из которых в дальнейшем синтезируются макромолекулы:
неорганические вещества (СО2, Н2О) → простые органические молекулы (аминокислоты, жирные кислоты, моносахариды) → макромолекулы тела (белки, жиры, углеводы).
Фотосинтез
Фотосинтез — синтез органических соединений из неорганических за счёт энергии света. Суммарное уравнение фотосинтеза:
Фотосинтез протекает при участии фотосинтезирующих пигментов, обладающих уникальным свойством преобразования энергии солнечного света в энергию химической связи в виде АТФ. Фотосинтезирующие пигменты представляют собой белковоподобные вещества. Наиболее важным является пигмент хлорофилл. У эукариот фотосинтезирующие пигменты встроены во внутреннюю мембрану пластид, у прокариот — во впячивания цитоплазматической мембраны.
Строение хлоропласта очень похоже на строение митохондрии. Во внутренней мембране тилакоидов гран содержатся фотосинтетические пигменты, а также белки цепи переноса электронов и молекулы фермента АТФ-синтетазы.
Процесс фотосинтеза состоит из двух фаз: световой и темновой.
1. Световая фаза фотосинтеза протекает только на свету в мембране тилакоидов граны.
К ней относятся поглощение хлорофиллом квантов света, образование молекулы АТФ и фотолиз воды.
Под действием кванта света (hv) хлорофилл теряет электроны, переходя в возбуждённое состояние:
Эти электроны передаются переносчиками на наружную, то есть обращенную к матриксу поверхность мембраны тилакоидов, где накапливаются.
Одновременно внутри тилакоидов происходит фотолиз воды, то есть её разложение под действием света:
Образующиеся электроны передаются переносчиками к молекулам хлорофилла и восстанавливают их. Молекулы хлорофилла возвращаются в стабильное состояние.
Протоны водорода, образовавшиеся при фотолизе воды, накапливаются внутри тилакоида, создавая Н + -резервуар. В результате внутренняя поверхность мембраны тилакоида заряжается положительно (за счёт Н + ), а наружная — отрицательно (за счёт е – ). По мере накопления по обе стороны мембраны противоположно заряженных частиц нарастает разность потенциалов. При достижении критической величины разности потенциалов сила электрического поля начинает проталкивать протоны через канал АТФ-синтетазы. Выделяющаяся при этом энергия используется для фосфорилирования молекул АДФ:
АДФ + Ф → АТФ.
Образование АТФ в процессе фотосинтеза под действием энергии света называется фотофосфорилированием.
Ионы водорода, оказавшись на наружной поверхности мембраны тилакоида, встречаются там с электронами и образуют атомарный водород, который связывается с молекулой-переносчиком водорода НАДФ (никотинамидадениндинуклеотидфосфат):
2Н + + 4е – + НАДФ + → НАДФ·Н2.
Таким образом, во время световой фазы фотосинтеза происходят три процесса: образование кислорода вследствие разложения воды, синтез АТФ и образование атомов водорода в форме НАДФ·Н2. Кислород диффундирует в атмосферу, а АТФ и НАДФ·Н2 участвуют в процессах темновой фазы.
2. Темновая фаза фотосинтеза протекает в матриксе хлоропласта как на свету, так и в темноте и представляет собой ряд последовательных преобразований СО2, поступающего из воздуха, в цикле Кальвина. Осуществляются реакции темновой фазы за счёт энергии АТФ. В цикле Кальвина СО2 связывается с водородом из НАДФ·Н2 с образованием глюкозы.
В процессе фотосинтеза кроме моносахаридов (глюкоза и др.) синтезируются мономеры других органических соединений — аминокислоты, глицерин и жирные кислоты. Таким образом, благодаря фотосинтезу растения обеспечивают себя и всё живое на Земле необходимыми органическими веществами и кислородом.
Сравнительная характеристика фотосинтеза и дыхания эукариот представлена в таблице.
Сравнительная характеристика фотосинтеза и дыхания эукариот
Признак
Фотосинтез
Дыхание
Уравнение реакции
6СО2 + 6Н2О + энергия света → C6H12O6 + 6O2
C6H12O6 + 6O2 → 6СО2 + 6Н2О + энергия (АТФ)
Исходные вещества
Углекислый газ, вода
Органические вещества, кислород
Продукты реакции
Органические вещества, кислород
Углекислый газ, вода
Значение в круговороте веществ
Синтез органических веществ из неорганических
Разложение органических веществ до неорганических
Превращение энергии
Превращение энергии света в энергию химических связей органических веществ
Превращение энергии химических связей органических веществ в энергию макроэргических связей АТФ
Важнейшие этапы
Световая и темновая фаза (включая цикл Кальвина)
Неполное окисление (гликолиз) и полное окисление (включая цикл Кребса)
Место протекания процесса
Хлоропласты
Гиалоплазма (неполное окисление) и митохондрии (полное окисление)
Генетическая информация у всех организмов хранится в виде определённой последовательности нуклеотидов ДНК (или РНК у РНК-содержащих вирусов). Прокариоты содержат генетическую информацию в виде одной молекулы ДНК. В эукариотических клетках генетический материал распределён в нескольких молекулах ДНК, организованных в хромосомы.
ДНК состоит из кодирующих и некодирующих участков. Кодирующие участки кодируют РНК. Некодирующие области ДНК выполняют структурную функцию, позволяя участкам генетического материала упаковываться определённым образом, или регуляторную функцию, участвуя во включении генов, направляющих синтез белка.
Кодирующими участками ДНК являются гены. Ген — участок молекулы ДНК, кодирующей синтез одной мРНК (и соответственно полипептида), рРНК или тРНК.
Участок хромосомы, где расположен ген называется локусом. Совокупность генов клеточного ядра представляет собой генотип, совокупность генов гаплоидного набора хромосом — гено́м, совокупность генов внеядерных ДНК (митохондрий, пластид, цитоплазмы) — плазмон.
Реализация информации, записанной в генах, через синтез белков называется экспрессией (проявлением) генов. Генетическая информация хранится в виде определённой последовательности нуклеотидов ДНК, а реализуется в виде последовательности аминокислот в белке. Посредниками, переносчиками информации выступают РНК. То есть реализация генетической информации происходит следующим образом:
ДНК → РНК → белок.
Этот процесс осуществляется в два этапа:
1) транскрипция;
2) трансляция.
Транскрипция (от лат. transcriptio — переписывание) — синтез РНК с использованием ДНК в качестве матрицы. В результате образуются мРНК, тРНК и рРНК. Процесс транскрипции требует больших затрат энергии в виде АТФ и осуществляется ферментом РНК-полимеразой.
Одновременно транскрибируется не вся молекула ДНК, а лишь отдельные её отрезки. Такой отрезок (транскриптон) начинается промотором — участком ДНК, куда присоединяется РНК-полимераза и откуда начинается транскрипция, а заканчивается терминатором — участком ДНК, содержащим сигнал окончания транскрипции. Транскриптон — это ген с точки зрения молекулярной биологии.
Транскрипция, как и репликация, основана на способности азотистых оснований нуклеотидов к комплементарному связыванию. На время транскрипции двойная цепь ДНК разрывается, и синтез РНК осуществляется по одной цепи ДНК.
В процессе транскрипции последовательность нуклеотидов ДНК переписывается на синтезирующуюся молекулу мРНК, которая выступает в качестве матрицы в процессе биосинтеза белка.
Гены прокариот состоят только из кодирующих нуклеотидных последовательностей.
Гены эукариот состоят из чередующихся кодирующих (экзонов) и некодирующих (интронов) участков.
После транскрипции участки мРНК, соответствующие интронам, удаляются в ходе сплайсинга, являющегося составной частью процессинга.
Процессинг — процесс формирования зрелой мРНК из её предшественника пре-мРНК. Он включает два основных события. 1.Присоединение к концам мРНК коротких последовательностей нуклеотидов, обозначающих место начала и место конца трансляции. Сплайсинг — удаление неинформативных последовательностей мРНК, соответствующих интронам ДНК. В результате сплайсинга молекулярная масса мРНК уменьшается в 10 раз. Трансляция (от лат. translatio — перевод) — синтез полипептидной цепи с использованием мРНК в роли матрицы.
В трансляции участвуют все три типа РНК: мРНК является информационной матрицей; тРНК доставляют аминокислоты и узнают кодоны; рРНК вместе с белками образуют рибосомы, которые удерживают мРНК, тРНК и белок и осуществляют синтез полипептидной цепи.
Этапы трансляции
Этап
Характеристика
Инициация
Сборка комплекса, участвующего в синтезе полипептидной цепи. Малая субчастица рибосомы соединяется с инициаторной мет-трнк, а затем с мрнк, после чего происходит образование целой рибосомы, состоящей из малой и большой субчастиц.
Элонгация
Удлинение полипептидной цепи. Рибосома перемещается вдоль мрнк, что сопровождается многократным повторением цикла присоединения очередной аминокислоты к растущей полипептидной цепи.
Терминация
Завершение синтеза полипептидной молекулы. Рибосома достигает одного из трёх стоп-кодонов мрнк, а так как не существует трнк с антикодонами, комплементарными стоп-кодонам, синтез полипептидной цепи прекращается. Она высвобождается и отделяется от рибосомы. Рибосомные субчастицы диссоциируют, отделяются от мрнк и могут принять участие в синтезе следующей полипептидной цепи.
Реакции матричного синтеза. К реакциям матричного синтеза относятся
- самоудвоение ДНК (репликация);
- образование мРНК, тРНК и рРНК на молекуле ДНК (транскрипция);
- биосинтез белка на мРНК (трансляция).
Все эти реакции объединяет то, что молекула ДНК в одном случае или молекула мРНК в другом выступают в роли матрицы, на которой происходит образование одинаковых молекул. Реакции матричного синтеза являются основой способности живых организмов к воспроизведению себе подобных.
Регуляция экспрессии генов. Тело многоклеточного организма построено из разнообразных клеточных типов. Они отличаются структурой и функциями, то есть дифференцированы. Различия проявляются в том, что помимо белков, необходимых любой клетке организма, клетки каждого типа синтезируют ещё и специализированные белки: в эпидермисе образуется кератин, в эритроцитах — гемоглобин и т. д. Клеточная дифференцировка обусловлена изменением набора экспрессируемых генов и не сопровождается какими-либо необратимыми изменениями в структуре самих последовательностей ДНК.
[spoiler title=”источники:”]
http://studarium.ru/article/123
http://examer.ru/ege_po_biologii/teoriya/metabolizm_kletki
[/spoiler]
Факторы, влияющие на результаты анализов
Влияние различных факторов на результаты лабораторных исследований
Лабораторные исследования зачастую служат более чувствительными показателями состояния человека, чем его самочувствие. Результаты анализов отражают физико-химические свойства исследуемой пробы и дают объективную диагностическую информацию в цифровом выражении. Важные решения о стратегии ведения пациента часто основаны на небольших изменениях лабораторных данных. Именно поэтому роль лабораторных тестов, а также спектр и количество проводимых исследований, необходимых в процессе диагностики и лечения заболеваний, постоянно возрастает. Однако из практики работы любой диагностической лаборатории известно, что получаемые ими результаты далеко не всегда являются правильными. Это связано с наличием большого количества непатологических факторов, способных оказывать влияние на конечные результаты лабораторных данных.
Как показывает наш опыт работы, основное количество получаемых неудовлетворительных результатов связано с ошибками, допущенными в ходе проведения анализа. Появление случайных и систематических ошибок на любой стадии анализа будет снижать достоверность лабораторных результатов и, как следствие, затруднит постановку правильного диагноза и проведение адекватного лечения.
ПРЕАНАЛИТИЧЕСКИЙ (ДОЛАБОРАТОРНЫЙ) ЭТАП включает в себя все стадии от назначения анализа клиницистом до поступления пробы в лабораторию на рабочее место, а именно: назначение анализа, взятие биологического материала, его обработку и доставку в лабораторию. Ошибки, возникающие на внелабораторном этапе анализа, составляют от 70% до 95% от общего их числа. Именно они могут оказаться непоправимыми и полностью обесценить весь ход проводимых исследований.
Поэтому правильная организация преаналитического этапа должна стать составной частью любой системы обеспечения качества лабораторного анализа.
При получении, обработке и доставке образцов в лабораторию следует иметь в виду следующие факторы, которые могут быть как устранимыми, так и неустранимыми. Результаты лабораторных исследований подвержены влиянию биологической и аналитической вариации. Если аналитическая вариация зависит от условий выполнения теста, то величина биологической вариации — от целого комплекса факторов. Общая биологическая вариация исследуемых показателей обусловлена внутрииндивидуальной вариацией, наблюдаемой у одного и того же человека в результате влияния биологических ритмов (разное время дня, года), и межиндивидуальной вариацией, вызванной как эндогенными, так и экзогенными факторами.
Факторы биологической вариации (физиологические факторы, факторы среды, условия взятия пробы, токсичные и терапевтические факторы) могут оказать влияние на результаты лабораторных исследований. Часть из них способна вызывать реальные отклонения лабораторных результатов от референтных значений вне связи с патологическим процессом. К таким факторам относят:
- Физиологические закономерности (влияние расы, пола, возраста, типа сложения, характера и объёма привычной активности, питания);
- Влияние окружающей среды (климат, геомагнитные факторы, время года и суток, состав воды и почвы в зоне обитания, социально-бытовая среда);
- Воздействие профессиональных и бытовых токсичных средств (алкоголь, никотин, наркотики) и ятрогенные влияния (диагностические и лечебные процедуры, лекарственные средства);
- Условия взятия пробы (приём пищи, физическая нагрузка, положение тела, стресс во время взятия пробы и др.);
- Методика взятия крови (способ взятия, средства и посуда, консерванты и т.д.);
- Неправильный (по времени) забор материала;
- Условия (температура, встряхивание, влияние света) и время транспортировки биоматериала на исследования в лабораторию.
Рассмотрим влияние наиболее важных факторов на результаты лабораторных анализов.
ПРИЕМ ПИЩИ
Режим питания, состав принимаемой пищи, перерывы в её приёме оказывают существенное влияние на ряд показателей лабораторных исследований. После приема пищи содержание отдельных продуктов обмена в крови может повышаться или подвергаться изменениям в результате постабсорбционных гормональных эффектов. Определение других аналитов может затрудняться вследствие мутности, вызванной хиломикронемией в послеобеденных пробах крови.
После 48 часов голодания может увеличиваться концентрация билирубина в крови. Голодание в течение 72 часов снижает концентрацию глюкозы в крови у здоровых людей до 2,5 ммоль/л, увеличивает концентрацию триглицеридов, свободных жирных кислот без значительных изменений концентрации холестерина. Длительное голодание (2 – 4 недели) также способно влиять на ряд лабораторных показателей. Концентрация общего белка, холестерина, триглицеридов, мочевины, липопротеинов в крови снижается; выведение креатинина и мочевой кислоты почками с мочой повышается. Длительное голодание тесно связано со снижением расхода энергии. Вследствие этого в крови снижается концентрация гормонов щитовидной железы – общего тироксина и еще в большей степени трийодтиронина. Голодание также приводит к увеличению содержания в пробах сыворотки крови кортизола и сульфата дегидроэпиандростерона.
Употребление жирной пищи может повысить концентрацию калия, триглицеридов и щелочной фосфатазы. Активность щелочной фосфатазы в таких случаях может особенно увеличиваться у людей с О- или В-группой крови.
Физиологические изменения после употребления жирной пище в виде гиперхиломикронемии могут увеличивать мутность сыворотки (плазмы) крови и тем самым влиять на результаты измерения оптической плотности. Повышение концентрации липидов в сыворотке крови может быть после употребления пациентом масла, крема или сыра, что приведёт к ложным результатам и потребует повторного анализа.
Определенные виды пищи и режимы питания могут влиять на ряд показателей сыворотки крови и мочи. Потребление большого количества мяса, то есть пищи с высоким содержанием белка, может увеличить концентрации мочевины и аммиака в сыворотке крови, количества уратов (солей кальция) в моче. Пища с высоким отношением ненасыщенных жирных кислот к насыщенным может вызвать снижение концентрации холестерина в сыворотке крови, а мясная пища вызывает увеличение концентрации уратов. Бананы, ананасы, томаты, авокадо богаты серотонином. При их употреблении за 3 дня до исследования мочи на 5-оксииндолуксусную кислоту даже у здорового человека её концентрация может быть повышенной. Напитки, богатые кофеином, увеличивают концентрацию свободных жирных кислот и вызывают выход катехоламинов из надпочечников и мозга (концентрация катехоламинов в сыворотке крови повышается). Кофеин способен повышать активность плазматического ренина. Приём алкоголя увеличивает в крови концентрацию лактата, мочевой кислоты и триглицеридов. Повышенное содержание общего холестерина, мочевой кислоты, гамма-глутамилтранспептидазы и увеличение среднего объема эритроцитов может быть связано с хроническим алкоголизмом.
Бессолевая диета может приводить к повышению уровня альдостерона в 3-5 раз. Концентрация билирубина после 48-часового голодания может повыситься в 2 раза, после еды – снижается на 20–25%; изменения уровня билирубина в течение суток могут достигать 15–30%.
ФИЗИЧЕСКИЕ УПРАЖНЕНИЯ
Состояние физической активности обследуемого оказывает большое влияние на результаты.
Физическая нагрузка может оказывать как преходящее, так и длительное влияние на различные параметры гомеостаза. Преходящие изменения включают в себя вначале снижение, а затем увеличение концентрации свободных жирных кислот в крови, повышение на 180% концентрации аммиака и на 300% — лактата, увеличение активности креатинкиназы, ACT, ЛДГ. Физические упражнения влияют на показатели гемостаза: активируют свертывание крови и функциональную активность тромбоцитов. Изменения указанных показателей связаны с активацией метаболизма и они обычно возвращаются к исходным (до физической нагрузки) значениям вскоре после прекращения физической деятельности. Тем не менее, активность некоторых ферментов (альдолаза, КК, ACT, ЛДГ) может оставаться повышенной в течение 24 ч после 1одночасовой интенсивной физической нагрузки. Длительная физическая нагрузка увеличивает концентрацию в крови половых гормонов, включая тестостерон, андростендион и лютеинизирующий гормон (ЛГ).
При длительном строгом постельном режиме и ограничении физической активности повышается экскреция с мочой норадреналина, кальция, хлора, фосфатов, аммиака, активность щелочной фосфатазы в сыворотке крови.
ЭМОЦИОНАЛЬНЫЙ СТРЕСС
Влияние психического стресса (страх перед взятием крови, перед операцией и т.д.) на результаты лабораторных тестов часто недооценивается. Между тем под его влиянием возможны преходящий лейкоцитоз; снижение концентрации железа; увеличение уровня катехоламинов, альдостерона, кортизола, пролактина, ангиотензина, ренина, соматотропного гормона, ТТГ и повышение концентрации альбумина, глюкозы, фибриногена, инсулина и холестерина. Сильное беспокойство, сопровождаемое гипервентиляцией, вызывает дисбаланс кислотно-основного состояния (КОС) с увеличением концентрации лактата и жирных кислот в крови.
ПОЛ ПАЦИЕНТА
Для целого ряда клинико-химических и гематологических показателей имеются статистически значимые различия между полами. В частности, это относится к уровням стероидных и гликопротеидных гормонов (прогестерон, эстрадиол, тестостерон, 17-ОН прогестерон, ЛГ, ФСГ, пролактин), транспортных белков (ССГ, ТСГ) и других биологически активных соединений (ТГ). В методической литературе имеется обширная информация по этому вопросу, кроме того, ее можно найти в большинстве инструкций по использованию диагностических наборов. Однако следует отметить, что приведенные в литературе референсные интервалы следует рассматривать лишь как ориентировочные. Это связано с наличием конструктивных особенностей наборов от различных фирм-производителей, а также с региональными и расовыми различиями в составе населения. Поэтому в каждой лаборатории рекомендуется установить собственные значения нормальных уровней исследуемых показателей с использованием тех видов наборов, которые регулярно применяются в рутинной практике.
ВОЗРАСТ ПАЦИЕНТА
Концентрация целого спектра аналитов зависит от возраста пациента и может значительно изменяться от момента рождения до старости. Наиболее ярко возрастные изменения выражены для некоторых биохимических показателей (гемоглобин, билирубин, активность щелочной фосфатазы, содержание липопротеинов низкой плотности и др.) а также для ряда аналитов, определяемых иммунохимическими методами. К ним относятся половые стероидные и гликопротеидные гормоны, тиреоиды, АКТГ, альдостерон, ренин, гормон роста (соматотропный), паратгормон, 17-оксипрогестерон, дегидроэпиандростерон, ПСА и др. Желательно, чтобы в каждой лаборатории имелись возрастные нормы для каждого из исследуемых показателей, что позволит более точно интерпретировать полученные результаты.
БЕРЕМЕННОСТЬ
Трактуя результаты лабораторных исследований у беременных, необходимо учитывать срок беременности в момент взятия пробы. При физиологической беременности средний объем плазмы возрастает примерно от 2600 до 3900 мл, причем в первые 10 недель прирост может быть незначительным, а затем происходит нарастающее увеличение объема к 35-й неделе, когда достигается указанный уровень. Объем мочи также может физиологически увеличиваться до 25% в 3-м триместре. В последнем триместре наблюдается 50% физиологическое повышение скорости клубочковой фильтрации.
Беременность является нормальным физиологическим процессом, который сопровождаются значительными изменениями в выработке стероидных, гликопротеидных и тиреоидных гормонов, транспортных белков (ССГ, ТСГ), АКТГ, ренина, а также в целом ряде биохимических и гематологических показателей. Поэтому для правильной интерпретации результатов важно точно указать срок беременности, когда была взята исследуемая проба крови.
При проведении скрининга врожденных пороков развития плода по лабораторным показателям следует иметь в виду, что диагностическая чувствительность и специфичность данного вида исследования в значительной степени будет определяться комбинацией выбранных иммунохимических маркеров. Она должна быть различной на разных стадиях развития плода. Например, для первого триместра беременности наиболее предпочтительным является определение АФП, свободной 6-субъединицы ХГЧ и ассоциированного с беременностью белка А (РАРРА), а для второго триместра – АФП, общего ХГЧ и свободного эстриола. Все указанные виды анализа должны проводиться в строго рекомендуемые сроки беременности, а каждая лаборатория, занимающаяся скрининговыми исследованиями, должна располагать собственной постоянно обновляемой и пополняемой базой медиан уровней исследуемых маркеров для каждой недели беременности.
МЕНСТРУАЛЬНЫЙ ЦИКЛ
Статистически значимые изменения концентрации могут быть вызваны колебаниями гормонального фона при менструации. Так, концентрация альдостерона в плазме определяется в два раза выше перед овуляцией, чем в фолликулярной фазе. Подобным образом ренин может проявить предовуляторное повышение.
Менструальный цикл является нормальным физиологическим процессом, который сопровождается значительными изменениями в выработке половых, тиреоидных гормонов, транспортных белков, АКТГ, ренина, а также в целом ряде биохимических и гематологических показателей. Для правильной интерпретации результатов важно точно указать день менструального цикла, когда была взята исследуемая проба крови.
БИОЛОГИЧЕСКИЕ РИТМЫ
Существуют линейные хронобиологические ритмы – например, возраст пациента, циклические ритмы – такие, как циркадные и сезонные, а также другие биологические циклы – например, менструальный цикл.
Циркадные ритмы аналита, т.е. изменения его концентрации в течение суток, наиболее ярко выражены у кортизола, АКТГ, альдостерона, пролактина, ренина, ТТГ, паратгормона, тестостерона и др. Отклонения концентраций от среднесуточных значений могут достигать 50%-400%, и этот фактор обязательно должен приниматься во внимание.
Суточные колебания содержания некоторых аналитов в сыворотке крови
|
Аналиты |
Максимальная концентрация (время суток) |
Минимальная концентрация (время суток) |
Амплитуда (% от средней за сутки) |
|
АКТГ |
6-10 |
0-4 |
150-200 |
|
Кортизол |
5-8 |
21-3 |
180-200 |
|
Тестостерон |
2-4 |
20-24 |
30-50 |
|
ТСГ |
20-2 |
7-13 |
5-15 |
|
Та |
8-12 |
23-3 |
10-20 |
|
ТТГ |
21-23 |
1-21 |
300-400 |
|
Пролактин |
5-7 |
10-12 |
80-100 |
|
Альдостерон |
2-4 |
12-14 |
60-80 |
|
Ренин |
0-6 |
10-12 |
120-140 |
|
Адреналин |
9-12 |
2-5 |
30-50 |
Например, циркадный ритм кортизола может являться причиной недостоверных результатов теста на толерантность к глюкозе, если он проводится во второй половине дня.
Для того чтобы не затруднять процесс интерпретации результатов, отбор проб для анализа нужно проводить строго в определенное время суток, обычно между 7:00 и 9:00 часами утра. Следует иметь в виду, что референсные интервалы большинства тестов, приведенных в справочной литературе, установлены именно для этого промежутка времени.
При проведении специальных исследований, например, при установлении индивидуального циркадного ритма секреции гормона, в течение суток берется несколько проб анализируемого материала. В документах, сопровождающих такие образцы, необходимо указать точное время взятия каждого из них.
На циркадный ритм могут накладываться индивидуальные ритмы сна, еды, физической активности, которые не следует путать с действительно суточными колебаниями. Для того, чтобы исключить индивидуальные ритмы при определении уровня аналитов, секретируемых порциями (ренин, вазопрессин, тестостерон, пролактин и др.), можно использовать смешанную пробу, полученную из трех образцов крови, взятых с интервалом в 2-3 часа. В некоторых случаях следует учитывать сезонные влияния. Например, содержание трийодтиронина на 20% ниже летом, чем зимой.
ПРИЕМ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
Прием может отражаться на количественном содержании в организме целого ряда анализируемых показателей. Например, уровень ТТГ снижается при лечении допамином, концентрация общих и свободных фракций тиреоидных гормонов будет изменяться при введении фуросемида, даназола, амиодарона и салицилатов, а применение некоторых противоязвенных препаратов может повышать уровень пролактина у мужчин.
Присутствие лекарственных препаратов в биологическом материале – например, контрацептивов, салицилатов, андрогенов и др. – может специфическим (перекрестная реакция) или неспецифическим образом (интерференция) влиять на результаты лабораторных исследований при определении концентрации стероидных и тиреоидных гормонов, а также специфических связывающих белков крови. Прием аспиринсодержащих препаратов при определении длительности кровотечения по Дуке должен быть отменен за 7 – 10 дней до исследования. Если этого не сделать, можно получить патологический результат исследования. Поэтому проведение медикаментозной терапии, могущей искажать результаты анализа, следует назначать после взятия проб крови.
При проведении лекарственного мониторинга точное время взятия крови является очень важным параметром для правильной интерпретации результатов исследования.
Широкий спектр лекарственной интерференции в ходе лабораторных исследований рассмотрен во многих обзорах и книгах. Чтобы исключить возможность получения ложных результатов, обусловленных применением лекарственных препаратов, рекомендуется консультироваться с клиницистами, а также использовать соответствующие справочники.
При подготовке обследуемых к проведению биохимических исследований приняты следующие подходы: лекарства, мешающие определению компонентов, исключаются до взятия биоматериала, если они даются не по жизненным показаниям; утренний прием лекарств проводится только после взятия биоматериала; взятие крови с диагностической целью проводится перед инфузией лекарств и растворов. Загрязнение лабораторных проб инфузионными растворами является самой обычной и часто встречаемой формой преаналитической интерференции в больницах. Рекомендуется информировать лабораторию о том, когда и какое вливание было проведено пациенту, и когда была взята проба крови.
Пробу крови никогда не следует брать из сосуда, расположенного проксимально месту инфузии. Пробы следует брать из другой руки, из вены, в которую не проводится вливание.
Влияние ЛС на результаты лабораторных исследований может быть двух типов:
- Физиологическое влияние in vivo (в организме пациента) ЛС и их метаболитов;
- Влияние in vitro (на химическую реакцию, используемую для определения показатели) благодаря химическим и физическим свойствам ЛС (интерференция).
Физиологическое влияние ЛС и их метаболитов во многом известны практическим врачам. Рассмотрим значение интерференции, то есть вмешательства постороннего фактора в результаты анализа.
Интерференция может быть вызвана наличием в пробе биоматериала как эндогенного, так и экзогенного вещества. К основным эндогенным интерферирующим факторам относят следующие:
- Гемолиз, т.е. разрушение эритроцитов с выходом в жидкую часть крови ряда внутриклеточных компонентов (гемоглобин, ЛДГ, калия, магния и др.), что изменяет истинные результаты определения концентрации/активности таких компонентов крови, как билирубин, липаза, КК,ЛДГ, калий, магний и др;
- Липемия, извращающая результаты ряда колориметрических и нефелометрических методов исследования (особенно при исследовании фосфора, общего билирубина, мочевой кислоты, общего белка, электролитов);
- Парапротеинемия, вызывающая изменения результатов определения некоторыми методами фосфатов, мочевины, КК, ЛДГ, амилазы.
Наиболее частые экзогенные интерферирующие факторы — ЛС или их метаболиты. Так, при определении катехоламинов флуориметрическим методом в моче интенсивную флюоресценцию может вызывать принимаемый пациентом тетрациклин; метаболит пропранолола 4-гидррксипропранолол интерферирует при определении билирубина методами Йендрассика-Грофа и Эвелина-Меллоя.
Выявить интерференцию ЛС — одна из задач врача клинической лабораторной диагностики. Важный шаг для решения этой проблемы — контакт с клиницистом для выяснения характера принимаемых пациентом препаратов.
КУРЕНИЕ
У курильщиков может быть повышена концентрация карбоксигемоглобина, катехоламинов в плазме крови и кортизола в сыворотке крови. Изменения концентрации этих гормонов часто приводят к снижению количества эозинофилов, в то время как содержание нейтрофилов, моноцитов и свободных жирных кислот увеличивается. Курение приводит к увеличению концентрации гемоглобина, количества эритроцитов, среднего объёма эритроцита (MCV) и снижению количества лейкоцитов. Обнаружено повышение активности гаммаглутамилтрансферазы на 10% при потреблении 1 пачки сигарет в день; возможно удвоение активности по сравнению с референтными значениями при потреблении большего количества сигарет.
ДИАГНОСТИЧЕСКИЕ И ЛЕЧЕБНЫЕ МЕРОПРИЯТИЯ
На результаты лабораторных исследований могут оказывать влияние следующие диагностические и лечебные мероприятия:
- Оперативные вмешательства;
- Вливания и переливания;
- Пункции, инъекции, биопсии, пальпация, общий массаж;
- Эндоскопия;
- Диализ;
- Физическое напряжение (например, эргометрия, физические упражнения, ЭКГ);
- Функциональные тесты (например, пероральный тест на толерантность к глюкозе);
- Прием рентгеноконтрастных и лекарственных веществ;
- Ионизирующее излучение.
Например, уровень ПСА в течение нескольких дней может быть повышен после массажа простаты или катетеризации мочевого пузыря. Любые манипуляции с молочной железой или тепловые процедуры (например, сауна) приводят к значительному возрастанию уровня пролактина. Чтобы предотвратить такое влияние, взятие проб необходимо проводить до выполнения диагностических процедур, способных искажать результаты теста. Влагалищное кровотечение, произошедшее перед взятием пробы крови, может влиять на результат скрининга: кровотечение может увеличивать уровень АФП в крови матери. В этих условиях рекомендуется отложить анализ ~ на одну неделю после остановки кровотечения.
ПЕРИОДИЧНОСТЬ ВЗЯТИЯ ПРОБ
Повторные взятия проб крови широко используются в динамических исследованиях – при проведении стимуляционных тестов, для оценки эффективности проводимого лечения, при прогнозировании исхода заболевания, при лекарственном мониторинге, а также в целом ряде других случаев. Интервалы между взятием образцов, помимо конкретных задач исследования, должны определяться с учетом следующих факторов:
- Периода биологической полужизни определяемого аналита. Например, для оценки уровня ПСА в постоперационном периоде отбор крови для исследования должен проводиться не ранее, чем через 10-14 дней после хирургического вмешательства;
- Факмакокинетических свойств препаратов при проведении терапевтического лекарственного мониторинга. Например, забор крови для определения циклоспорина А должен производиться непосредственно перед приемом следующей его дозы, а для сердечных гликозидов – через 4 часа после введения препарата.
- Динамики изменения концентрации аналита в ходе нормальных или патологических процессов (мониторинг беременности, диагностика и мониторинг опухолевых и инфекционных заболеваний и др.). Обычно при этом индивидуальные колебания уровней исследуемых аналитов могут быть очень значительными (свободный эстриол, ХГЧ, АФП и др.). В этих случаях средние значения нормы или ее диапазоны не являются достаточно информативными для постановки диагноза. Вместо них используют значения медиан нормальных концентраций.
При мониторинге опухолевых заболеваний, а также для оценки эффективности проводимого лечения в качестве точки отсчета используются индивидуальные базовые уровни онкомаркеров до начала терапии. Последующие заборы крови проводятся через строго определенные клиницистами промежутки времени. Этот же принцип используется при диагностике и лечении инфекционных заболеваний – выявление специфических антител к возбудителю и динамика их уровней в ходе лечения.
При хранении образцов мочи при комнатной температуре может теряться до 40% глюкозы после 24-часового хранения.
ПОЛОЖЕНИЕ ТЕЛА ПАЦИЕНТА ПРИ ЗАБОРЕ КРОВИ
Положение тела пациента также влияет на ряд показателей. Переход из положения лёжа в положение сидя или стоя приводит к гидростатическому проникновению воды и фильтрующихся веществ из внутрисосудистого пространства в интерстициальное. Вещества, имеющие большую молекулярную массу (белки), и клетки крови со связанными с ними веществами не проходят в ткани, поэтому их концентрация в крови повышается (ферменты, общий белок, альбумин, железо, билирубин, ХС, ТГ, ЛС; связанные с белками, кальций). Могут увеличиваться концентрация гемоглобина, гематокрит, количество лейкоцитов. Отбор крови для определения ряда аналитов – таких, как альдостерон, эпинефрин, норэпинефрин, предсердный натрийуретический пептид, а также для оценки активности плазматического ренина – следует проводить в положении лежа и/или стоя при спокойном состоянии пациента. В направлении должна быть сделана специальная отметка о времени и условиях получения пробы.
МЕСТО И ТЕХНИКА ЗАБОРА КРОВИ
Место и техника забора крови также могут оказать существенное влияние на результаты лабораторных тестов (например, наложение жгута на период времени более 2 мин при заборе крови из вены может привести к гемоконцентрации и увеличению концентрации в крови белков, факторов коагуляции, содержания клеточных элементов). Лучшее место забора крови на анализы — локтевая вена. Следует также отметить, что венозная кровь — лучший материал не только для определения биохимических, гормональных, серологических, иммунологических показателей, но и для общеклинического исследования. Это обусловлено тем, что применяемые в настоящее время гематологические анализаторы, с помощью которых проводят общеклинические исследования крови (подсчёт клеток, определение гемоглобина, гематокрита и др.), предназначены для работы с венозной кровью, и в большинстве своём в странах, где их производят, они сертифицированы и стандартизированы для работы только с венозной кровью. Выпускаемые фирмами калибровочные и контрольные материалы также предназначены для калибровки гематологических анализаторов по венозной крови.
Помимо этого, при заборе крови из пальца возможен ряд методических особенностей, которые стандартизировать очень трудно (холодные, цианотичные, отёчные пальцы, необходимость в разведении исследуемой крови и др.), что приводит к значительным разбросам в получаемых результатах и как следствие — к необходимости повторных исследований для уточнения результата.
Для общеклинического исследования кровь из пальца рекомендуют забирать в следующих случаях:
- При ожогах, занимающих большую площадь поверхности тела пациента;
- При наличии у пациента очень мелких вен или их малой доступности;
- При выраженном ожирении пациента;
- При установленной склонности к венозному тромбозу;
- У новорождённых.
Пункцию артерии для забора крови используют редко (преимущественно для исследования газового состава артериальной крови).
ДРУГИЕ ФАКТОРЫ
Среди других факторов, влияющих на результаты исследований, имеют значение расовая принадлежность, географическое положение местности, высота над уровнем моря, температура окружающей среды.
Например; уровни АФП выше у женщин негроидной расы по сравнению с европеоидной расой. Активность ГГТ приблизительно в два раза выше у афро-американцев по сравнению с белым населением.
Как правильно подготовиться к исследованиям в клинико-диагностической лаборатории
АНАЛИЗ КРОВИ (КЛИНИЧЕСКИЙ, БИОХИМИЧЕСКИЙ, ИММУНОФЕРМЕНТНЫЙ)
- Исследование производится утром натощак – между последним приемом пищи и взятием крови должно пройти не менее 8 – 12 часов. Вечером предшествующего дня рекомендуется необильный ужин. Желательно за 1 – 2 дня до обследования исключить из рациона жирное, жареное и алкоголь. Если накануне состоялось застолье или было посещение бани или сауны – необходимо перенести лабораторное исследование на 1 – 2 дня;
- Накануне исследования лечь спать в обычное время и встать не позднее чем за 1 час до взятия крови;
- По возможности пробы следует брать между 7 и 9 часами утра;
- Период воздержания от приема алкоголя должен быть не менее 24 ч до сдачи анализа;
- За 1 час до взятия крови необходимо воздержаться от курения;
- Не следует сдавать кровь после рентгенологических исследований, физиотерапевтических и лечебных процедур, способных оказать влияние на результаты теста;
- Необходимо исключить факторы, влияющие на результаты исследований: физическое напряжение (бег, подъем по лестнице), эмоциональное возбуждение. Перед процедурой следует отдохнуть 10 – 15 минут и успокоиться. Для исключения влияния изменения положения тела обследуемый должен находиться в покое, сидеть или лежать не менее 5 мин. При динамическом наблюдении за пациентом взятие материала нужно проводить в идентичном положении тела;
- Необходимо помнить, что результат исследования может быть искажен действием принимаемых лекарственных препаратов. Поэтому перед сдачей анализа следует проконсультироваться у врача о возможности ограничения приема лекарственных препаратов для подготовки к исследованию. Рекомендуется отказаться от приема лекарственных препаратов перед сдачей крови на исследование, то есть забор крови производится до приема лекарственных препаратов;
- Учитывая суточные ритмы изменения показателей крови повторные исследования целесообразно проводить в одно и то же время;
- В разных лабораториях могут применяться разные методы исследования и единицы измерения. Чтобы оценка результатов обследования была корректной и была приемлемость результатов, желательно проводить исследования в одной и той же лаборатории, в одно и то же время.
ТЕСТ ТОЛЕРАНТНОСТИ К ГЛЮКОЗЕ (САХАРНАЯ КРИВАЯ)
Пероральный тест толерантности к глюкозе проводится, если клинические симптомы сахарного диабета отсутствуют, а содержание глюкозы в крови натощак ниже патологического уровня и находится в пределах физиологической нормы (предварительно необходимо провести исследование глюкозы в крови натощак).
Цель теста – определить эффективность работы инсулиновыделительного механизма поджелудочной железы и глюкозораспределительной системы организма. Необходимо подготовиться к этому тесту изменением диеты и приема лекарственных препаратов, по меньшей мере, за 3 дня до проведения теста. Очень важно точно следовать приведенной ниже инструкции, так как только в этом случае будут получены ценные результаты теста:
- Количество углеводов в пище должно быть не менее 125 граммов в день в течение 3 дней перед проведением теста;
- Нельзя ничего есть в течение 12 часов, предшествующих началу теста, но ни в коем случае голодание не должно быть более 16 часов;
- Не позволять себе физические нагрузки в течение 12 часов перед началом теста и во время проведения теста.
Методика проведения теста. Исследование производится дважды с интервалом в 2 часа. Утром, натощак, производится забор крови на глюкозу. Затем пациенту дают определенное количество глюкозы (в зависимости от массы тела), растворенной в теплой воде. Нагрузку следует принять медленно, не залпом, но не дольше, чем за 5 минут. За это время формируется адекватная физиологическая реакция на прием большого количества углеводов. После приема нагрузки производят повторный забор крови на глюкозу через 2 часа. Вместо глюкозы можно использовать пробный завтрак, содержащий не менее 120 граммов углеводов, 30 грамм из которых должны составлять легкоусвояемые (сахар, варенье, джем).
ОСОБЕННОСТИ ПОДГОТОВКИ К ОТДЕЛЬНЫМ ЛАБОРАТОРНЫМ ТЕСТАМ
Исследование холестерина и липидного спектра
Для определения холестерина и липидного спектра забор крови производится строго после 12 – 14 часового голодания. За 2 недели необходимо отменить препараты, понижающие уровень липидов в крови, если не ставиться цель определить гиполипидемический эффект терапии этими препаратами. Накануне взятия крови должен быть исключен прием алкоголя: присутствие алкоголя в крои является распространенной причиной выявления гипертриглицеридемии, даже у голодавших пациентов. Если исследование липидов проводится у больного, перенесшего инфаркт миокарда, то кровь следует брать либо в течение 24 часов после инфаркта, либо по истечении 3 месяцев, поскольку в период выздоровления метаболизм липидов нарушен.
Мочевая кислота
Необходимо в предшествующие исследованию дни соблюдать диету – отказаться от употребления богатой пуринами пищи: печени, почек, максимально ограничить в рационе мясо, рыбу, кофе, чай, алкоголь. Противопоказаны интенсивные физические нагрузки. Обязательна отмена таких лекарственных препаратов, как кофеин, теобромин, теофилин, салицилаты, аскорбиновая кислота, антибиотики, сульфаниламиды, производные тиазола.
Билирубин
Не рекомендуется накануне принимать аскорбиновую кислоту, лекарства или продукты, вызывающие искусственную окраску сыворотки.
Кортизол
Накануне исследования исключить прием таких препаратов как: глюкокортикоиды, эстрогены, пероральные контрацептивы. Также необходимо исключить прием алкоголя, физические упражнения, курение, стрессовые ситуации. Забор крови осуществляется не позднее 2-х часов после сна и до 10 часов утра.
Простатспецифический антиген (ПСА)
Забор крови должен быть произведен до пальпаторного исследования и массажа предстательной железы (ПЖ), лазерной терапии, рентгенографии, цистоскопии, колоноскопии. Эти лечебно – диагностические мероприятия могут вызвать более или менее выраженный и длительный подъем уровня ПСА в крови. Так как степень таких изменений непредсказуема, забор крови необходимо проводить или до или спустя неделю после проведенных манипуляций.
Диагностики инфекционных заболеваний (в том числе урогенитальные инфекции)
Забор крови для диагностики производится до начала приема антибактериальных и химиотерапевтических препаратов или не ранее чем через 10 – 14 дней после их отмены. При выполнении исследований на наличие инфекций следует учитывать, что в зависимости от периода инфицирования и состояния иммунной системы у любого пациента может быть ложноотрицательный результат. Но, тем не менее, отрицательный результат не исключает полностью наличие инфекции и в сомнительных случаях необходимо провести повторный анализ.
Иммунограмма
Анализ крови сдается строго натощак, после 12-часового голодания и обязательно до начала приема антибактериальных, противовоспалительных и гормональных препаратов или не ранее чем через 2 недели после их отмены. Если накануне исследования было повышение температуры, какое либо острое или обострение хронического заболевания, то лучше перенести срок сдачи анализа.
Аллергены
Для исключения ложноотрицательных результатов необходимо воздержаться от приема противоаллергенных препаратов за 3 – 5 дней до сдачи анализа крови.
Пролактин
Забор крови производится утром, не ранее, чем через 3 часа после пробуждения. Учитывая, что уровень пролактина может повышаться в результате физического или эмоционального стресса, после половых актов, после пребывания в сауне, приема алкоголя, необходимо перед исследованием исключить указанные факторы.
Исследование на тиреоидные гормоны
За 2 – 3 дня до проведения исследования исключается прием йодсодержащих препаратов, за 1 месяц – тиреоидных гормонов (чтобы получить истинные базальные уровни), если нет специальных указаний врача- эндокринолога. Однако, если целью исследования является контроль за дозой препаратов тиреоидных гормонов, забор крови производится на фоне приема обычной дозы.
Тиреоглобулин
Исследование целесообразно проводить спустя как минимум 6 недель после тиреоэктомии, либо проведенного лечения. Если назначены такие диагностические процедуры, как биопсия или сканирование ЩЖ, то исследование уровня ТГ в крови нужно строго проводить до процедур.
Соматотропный гормон
За 3 дня до взятия крови необходимо исключить спортивные тренировки, стрессовые ситуации. За 1 час до взятия крови – курение. Исследование проводится натощак (через 12 часов после последнего приема пищи). Пациент должен находиться в полном покое в течение 30 минут перед взятием крови. Не допускать стресса в процессе взятия крови.
ОБЩИЙ АНАЛИЗ МОЧИ
Для общего анализа мочи предпочтительно использовать «утреннюю» мочу, которая в течение ночи собирается в мочевом пузыре. Моча должна быть собрана после тщательного туалета наружных половых органов (несоблюдение этого правила может повлечь за собой выявление повышенного количества эритроцитов и лейкоцитов в моче, что затруднит постановку правильного диагноза) в сухую, чистую, хорошо отмытую от чистящих и дезинфицирующих средств посуду (для сбора мочи лучше использовать одноразовые пластиковые контейнеры). Для анализа можно собирать всю мочу, однако, в нее могут попасть элементы воспаления мочеиспускательного канала, наружных половых органов. Поэтому, как правило, первую порцию мочи не используют. Вторую, среднюю, порцию мочи собирают в чистую посуду, не касаясь склянкой тела. Посуда с мочой плотно закрывается крышкой. Моча, собранная для общего анализа, может храниться не более 1,5 – 2 часов (обязательно на холоду!). Длительное хранение мочи при комнатной температуре приводит к изменению физических свойств, разрушению клеток и размножению бактерий.
Накануне сдачи анализа следует исключить алкоголь, маринады, копчености, сахар, мед.
СБОР СУТОЧНОЙ МОЧИ ДЛЯ БИОХИМИЧЕСКОГО АНАЛИЗА
Суточная моча собирается в течение 24 часов на обычном питьевом режиме. Утром в 6 – 8 часов освобождается мочевой пузырь (эта порция мочи выливается), а затем в течение суток собирается вся моча в чистый широкогорлый сосуд с плотно закрывающейся крышкой, емкостью не менее 2 литров. При этом емкость с мочой необходимо сохранять в течение всего времени в прохладном месте (оптимально – в холодильнике на нижней полке – при 4 – 8 С), не допуская ее замерзания. Последняя порция берется точно в то же время, когда накануне был начат сбор (время начала и конца сбора отмечают). Если не вся моча доставляется в лабораторию, то количество суточной мочи измеряется мерным цилиндром, часть отливается в чистый сосуд, в котором ее доставляют в лабораторию, и обязательно указывается объем суточной мочи. Перед сдачей мочи на анализ нежелательно применение лекарственных веществ, так как некоторые из них (в частности, аскорбиновая кислота, входящая в состав комплексных витаминных препаратов) оказывают влияние на результаты биохимических исследований мочи.
Несоблюдение правил сбора, сроков и режима хранения проб, полученных для исследований, приводит к отрицательному результату!
Сдавайте анализы постоянно в одной и той же лаборатории – и вашему врачу будут примерно известны Ваши личные показатели нормы и любое отклонение от нормы будет сразу им замечено.

Благодарим за
обращение!
Спасибо, что помогаете нам стать лучше.
В ближайшее время наши менеджеры с Вами свяжутся.
Глюкоза в крови
Энциклопедия / Анализы / Глюкоза в крови
Синонимы: Глюкоза (в крови), глюкоза в плазме, blood Glucose, сахар в крови.
Научный редактор: М. Меркушева, ПСПбГМУ им. акад. Павлова, лечебное дело.
Сентябрь, 2018.
Глюкоза (простой углевод, моносахарид) поступает в организм с пищей. В процессе расщепления сахарида выделяется определенное количество энергии, которая необходима всем клетками, тканям и органам человека для поддержания нормальной их жизнедеятельности.
Концентрация глюкозы в крови – один из главных критериев оценки состояния здоровья человека. Изменение баланса сахара крови в ту или иную сторону (гипер- или гипогликемия) самым негативным образом сказывается как на общем самочувствии, так и на функциональности всех внутренних органов и систем.
В процессе пищеварения сахар из продуктов питания распадается на отдельные химические компоненты, среди которых основным является глюкоза. Ее уровень в крови регулируется инсулином (гормон поджелудочной железы). Чем выше содержание глюкозы, тем больше инсулина вырабатывается. Однако объем секретируемого поджелудочной железой инсулина ограничен. Тогда излишки сахара откладываются в печени и мышцах в виде своеобразного «сахарного запаса» (гликогена), либо в форме триглицеридов в жировых клетках.
Сразу же после приема пищи уровень глюкозы в крови повышается (в норме), но быстро стабилизируется благодаря действию инсулина. Понизиться показатель может после длительного голодания, интенсивных физических и умственных нагрузок. В этом случае поджелудочная железа вырабатывает другой гормон – антагонист инсулина (глюкагон), который повышает содержание глюкозы, заставляя клетки печени трансформировать гликоген обратно в глюкозу. Так в организме происходит процесс саморегуляции концентрации сахара крови. Нарушить его могут следующие факторы:
- генетическая предрасположенность к сахарному диабету (нарушение метаболизма глюкозы);
- нарушение секреторной функции поджелудочной железы;
- аутоиммунное повреждение поджелудочной железы;
- избыточная масса тела, ожирение;
- возрастные изменения;
- неправильное питание (преобладание в пище простых углеводов);
- хронический алкоголизм;
- стресс.
Наиболее опасным считается состояние, когда концентрация глюкозы в крови резко повышается (гипергликемия) или снижается (гипогликемия). В этом случае развиваются необратимые повреждения тканей внутренних органов и систем: сердца, почек, кровеносных сосудов, нервных волокон, головного мозга, которые могут привести к летальному исходу.
Гипергликемия может развиться и при беременности (гестационный диабет). Если своевременно не выявить проблему и не принять меры по ее устранению, то у женщины беременность может протекать с осложнениями.
Биохимический анализ крови на сахар рекомендуется делать 1 раз в 3 года пациентам старше 40 лет и 1 раз в год тем, кто находится в группе риска (наследственность по сахарному диабету, ожирение и т.д.). Это поможет предотвратить развитие опасных для жизни заболеваний и их осложнений.
- Профилактический осмотр пациентов из группы риска по сахарному диабету;
- Заболевания гипофиза, щитовидной железы, печени, надпочечников;
- Мониторинг состояния больных сахарным диабетом 1-го и 2-го типа, получающих лечение, совместно с анализом на гликированный гемоглобин и С-пептид;
- Подозрение на развитие гестационного диабета (24-28 неделя беременности);
- Ожирение;
- Предиабет (нарушение толерантности к глюкозе).
Также показанием к проведению анализа является сочетание симптомов:
- сильная жажда;
- частые позывы к мочеиспусканию;
- стремительный набор/потеря веса;
- повышенный аппетит;
- повышенная потливость (гипергидроз);
- общая слабость и головокружение, потеря сознания;
- запах ацетона изо рта;
- учащение сердечного ритма (тахикардия);
- нарушение зрения;
- повышенная восприимчивость к инфекциям.
Группы риска по сахарному диабету:
- Возраст от 40 лет;
- Избыточный вес; (абдоминальное ожирение)
- Генетическая предрасположенность к СД.
Интерпретировать результаты анализа крови на сахар могут эндокринолог, гастроэнтеролог, терапевт, хирург, педиатр и другие узкие специалисты или врачи общей практики.
Важно! Нормы различаются в зависимости от реактивов и оборудования, используемого в каждой конкретной лаборатории. Поэтому при интерпретации результатов необходимо пользоваться стандартами, принятыми именно в той лаборатории, где сдавался анализ. Также необходимо обращать внимание на единицы измерения.
Нормы лаборатории Инвитро1:
Нормы в лаборатории Хеликс1:
Нормы глюкозы, согласно справочнику Л.Даниловой, 20142:
Референсные значения, взятые из справочника А.Кишкуна, 20073:
Важно! Интерпретация результатов всегда проводится комплексно. Поставить точный диагноз на основании только одного анализа невозможно.
- Сахарный диабет:
- 7,0 ммоль/л и выше натощак;
- 11,1 ммоль/л и выше через 2 часа после приема пищи.
- Гестационный диабет при беременности
- Нарушения работы эндокринной системы и поджелудочной железы;
- Гормональный сбой;
- Панкреатит (воспаление поджелудочной железы) в хронической или острой форме;
- Онкология поджелудочной железы;
- Дисфункция внутренних органов: печени, почек, надпочечников;
- Хроническая почечная недостаточность;
- Гипертиреоз (гиперсекреция йодированных гормонов);
- Синдром Иценко-Кушинга (повышенная выработка надпочечниками гормона кортизола);
- Акромегалия (дисфункция передней доли гипофиза).
Провоцирующие факторы:
- стресс в результате сильной травмы, сложной операции, инфаркта или инсульта, болевого шока;
- несбалансированный рацион (преобладание в меню продуктов, содержащих большое количество углеводов);
- прием лекарственных препаратов: диуретиков, антидепрессантов, кортикостероидов, гормонов, салицилатов, препаратов лития, дилантина, эпинефрина и т.д.
Согласно недавним исследованиям, повышенный уровень глюкозы в крови увеличивает риск развития рака печени у людей с преддиабетом и диабетом4.
- Нарушение работы поджелудочной железы;
- Гипотиреоз (недостаточное производство гормонов щитовидной железы);
- Инсулинома (чаще доброкачественное новообразование, которое способно секретировать инсулин);
- Заболевания печени, почек, надпочечников, в т.ч. злокачественные;
- недостаточность надпочечников (болезнь Аддисона);
- Гипопитуитаризм (нарушение секреции гормонов гипофизом);
- Гликогенозы (группа наследственных заболеваний, обусловленных нарушением процесса синтеза и распада гликогена вследствие имеющихся дефектов различных ферментов).
Провоцирующие факторы:
- длительное голодание, соблюдение строгой диеты или поста;
- нарушение работы желудочно-кишечного тракта, вегетативные расстройства, постоперационные состояния;
- передозировка инсулина или других сахароснижающих препаратов;
- интоксикация (отравление) мышьяком;
- злоупотребление алкогольными напитками;
- тяжелая физическая нагрузка;
- лихорадочные состояния;
- прием лекарственных препаратов: стероидов, амфетамина и т.д.
Биоматериалом для исследования служит венозная или капиллярная кровь, забор которой осуществляется по стандартным алгоритмам.
- Забор крови выполняется с утра (8.00 – 11.00) и строго натощак. Последний прием пищи должен быть не менее чем за 8-14 часов до процедуры;
- Накануне нельзя злоупотреблять сладостями, жирными и жареными блюдами;
- Также за день до теста необходимо исключить употребление алкоголя, энергетических напитков;
- За 3-4 часа до забора крови не рекомендуется курить;
- В день обследования нужно оградить себя от любых физических и психоэмоциональных нагрузок.
В домашних условиях возможно проведение экспресс-теста с помощью глюкометра.
Капля капиллярной крови из пальца помещается на тест-полоску, которая устанавливается в устройство, которое считывает информацию и обрабатывает результат в течение нескольких минут. Такой вид диагностики наиболее удобен пациентам с установленным сахарным диабетом, поскольку позволяет самостоятельно контролировать уровень сахара в крови в любое время и в любом месте.
Альтернативный способ контроля глюкозы в крови – обнаружение ацетона в выдыхаемом воздухе с помощью портативного устройства с одноразовыми сенсорными слайдами. Однако такой метод показывает ложноположительные результаты у курильщиков, так как ацетон также является продуктом сгорания табачного дыма5.
Источники:
- 1. Данные лабораторий Инвитро и Хеликс.
- 2. Л.А.Данилова, д.м.н., проф. Анализы крови, мочи и других биологических жидкостей человека в различные возрастные периоды, – СпецЛит, 2014г.
- 3. А.А.Кишкун, д.м.н., проф. Руководство по лабораторным методам диагностики, – ГЭОТАР-Медиа, 2007г.
- 4. Han H., Zhang T. Blood glucose concentration and risk of liver cancer: systematic review and meta-analysis of prospective studies. – Oncotarget. 2017 Jul 25;8(30)
- 5. Miriam E Tucker. A Breathalyzer for Diabetes? Acetone in Breath Reflects Blood Glucose. – Medscape, Nov, 2016.
Источник: diagnos.ru




