Объем раствора азотной кислоты
Какой объем раствора азотной кислоты (HNO3) концентрированного с массовой долей равной 60 % и плотностью раствора 1,37 г/см3 необходимо взять для приготовления 800 см3 раствора с молярной концентрацией вещества, равной 2 моль/л?
Решение задачи
Найдем сколько концентрированной азотной кислоты (HNO3) (в граммах) потребуется для приготовления 800 см3 (или 0,8 л объем раствора азотной кислоты) раствора с молярной концентрацией 2 моль/л. Для расчета будем использовать формулу нахождения молярной концентрации раствора:
![]()
где:
CM – молярная концентрация раствора;
n – химическое количество растворенного вещества;
M – молярная масса растворенного вещества;
m – масса растворенного вещества;
V – объем раствора азотной кислоты.
Напомню, что под молярной концентрацией понимают количество (число моль) данного вещества, содержащегося в единице объема раствора. Молярную концентрацию выражают в моль/л или используют сокращение «M».
Из вышеуказанной формулы выразим и рассчитаем массу растворенного вещества:
![]()
Учитывая, что молярная масса азотной кислоты (HNO3) равна 63 г/моль (смотри таблицу Менделеева), получаем:
m (HNO3 (конц.)) = 2 моль/л ∙ 63 г/моль ∙ 0,8 л = 100,8 (г).
Используя формулу нахождения массовой доли растворенного вещества:
![]()
выразим массу раствора азотной кислоты (HNO3):
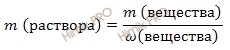
Получаем:
m (раствора HNO3 (конц.)) = 100,8 г/ 0,6 = 168 (г).
Если раствор 60-процентный, то массовая доля азотной кислоты (HNO3) в нем 0,6.
Вычислим объем раствора азотной кислоты (HNO3) концентрированного, который потребуется для приготовления 0,8 л раствора с молярной концентрацией 2 моль/л. Будем использовать формулу, устанавливающую связь между объемом раствора азотной кислоты и массой раствора:
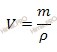
Получаем, объем раствора азотной кислоты:
V (раствора HNO3 (конц.)) = 168 г /1,37 г/мл = 122,63 (мл).
Ответ:
объем раствора азотной кислоты концентрированного 122,63 миллилитра.
Похожие задачи
Основные формулы для решения задач по химии
05-Авг-2012 | комментариев 450 | Лолита Окольнова
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)

обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов). Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Несколько миллионов. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества. Обозначается как M
Есть еще молекулярная масса — Mr
Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 гмоль.
Вторая необходимая формула для решения задач —
формула массы вещества:
![]()
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
![]()
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=mM
n=V22.4 (лмоль)
Масса вещества m (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (лмоль)
или вот еще удобная табличка:

Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
В ОГЭ и ЕГЭ по химии задач , в которых нужно было бы найти только объем массу кол-во моль нет — это обычно ЧАСТЬ решения задачи. Однако, чтобы легко решать более сложные задачи, нужно тренироваться на таких вот небольших упражнениях.
Находим количество вещества по массе
1 Какое количество вещества алюминия содержится в образце металла массой 10.8 г?2 Какое количество вещества содержится в оксиде серы (VI) массой 12 г?
3 Определите количество моль брома, содержащееся в массе 12.8 г.
Находим массу по количеству вещества:
4. Определите массу карбоната натрия количеством вещества 0.25 моль.Объем по количеству вещества:
5. Какой объем будет иметь азот при н.у., если его количество вещества 1.34 моль?6. Какой объем занимают при н.у. 2 моль любого газа?
Ответы:/p>
- 0.4 моль
- 0.15 моль
- 0.08 моль
- 26.5 г
- 30 л
- 44.8 л
Категории:
|
Обсуждение: “Основные формулы для решения задач по химии”
(Правила комментирования)
Для решения задачи применим правило стаканчиков, найдем массу первого раствора HNO3 c мас долей 0,65 или 65%
Плотность воды ρ(Н2О) = 1 г/мл, то масса воды равна 1200 г
В стаканчиках записываем процентную концентрацию растворов, подстаканчиками – их массы
| | | | | |
| 65% | + | 0 % | = | 10% |
| | | | | |
_______ ________ ________
х г 1200 г (1200+х) г
Затем перемножаем массы на проценты и составляем алгебраическое уравнение
65х +1200*0=10(1200+х)
65х=12000+10х
55х=12000
х=218,18 г – это масса раствора азотной к-ты с массовой долей 0,65
Находим объем этого раствора:
V=m/ρ = 218,18 г/1,35 г/мл = 161,615 мл
Ответ: 161,615 мл ≈161,6 мл
Для решения задачи применим правило стаканчиков, найдем массу первого раствора HNO3 c мас долей 0,65 или 65%
Плотность воды ρ(Н2О) = 1 г/мл, то масса воды равна 1200 г
В стаканчиках записываем процентную концентрацию растворов, подстаканчиками – их массы
| | | | | |
| 65% | + | 0 % | = | 10% |
| | | | | |
_______ ________ ________
х г 1200 г (1200+х) г
Затем перемножаем массы на проценты и составляем алгебраическое уравнение
65х +1200*0=10(1200+х)
65х=12000+10х
55х=12000
х=218,18 г – это масса раствора азотной к-ты с массовой долей 0,65
Находим объем этого раствора:
V=m/ρ = 218,18 г/1,35 г/мл = 161,615 мл
Ответ: 161,615 мл ≈161,6 мл
Frankly I think that you did so many individual calculations that you lost track of what you were doing. Obviously the amount (moles or grams) of concentrated acid used equals the amount of acid in the dilute solution. Let’s use the subscript $mathrm{i}$ for the initial concentrated solution and the subscript $mathrm{f}$ for the subscript for the final solution.
$$c_mathrm{i}times V_mathrm{i} = c_mathrm{f}times V_mathrm{f}tag{1}$$
Rearranging
$$V_mathrm{i} = frac{c_mathrm{f}times V_mathrm{f}}{c_mathrm{i}}tag{2}$$
Now $V_mathrm{f}$ has units of $pu{cm^3}$, which is fine for a volume measurement. But $c_mathrm{f}$ has units of $pu{mol cdot dm^3}$ but the concentrated acid is given as $63%$ by weight. So we need to convert the concentration acid to $pu{mol cdot dm^3}$ so that the units cancel.
$$c_mathrm{i} = frac{0.63 times pu{1.4 g/cm^3} times pu{1000 cm^3/dm^3}}{pu{63 g/mol}} = pu{14.0 mol/dm^3}tag{3}$$
Now going back to equation 2
$$V_mathrm{i}
= frac{c_mathrm{f}times V_mathrm{f}}{c_mathrm{i}}
= frac{pu{0.2 mol/dm^3}times pu{500 cm^3}}{pu{14.0 mol/dm^3}}
= pu{7.1 cm^3}tag{4}$$
