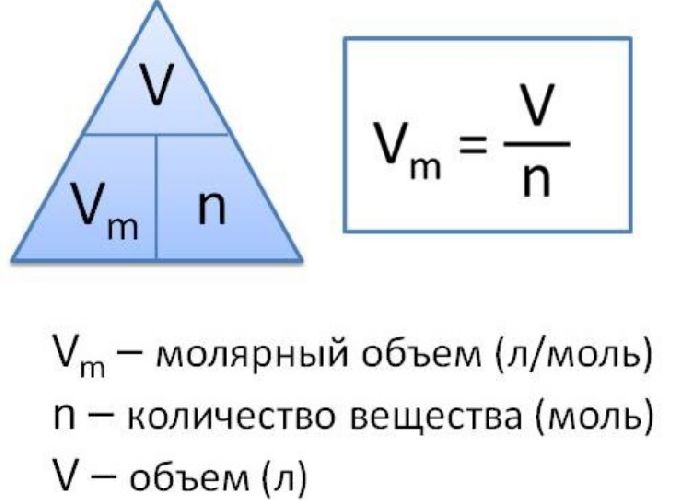
Моля́рный объём Vm — отношение объёма вещества к его количеству, численно равен объёму одного моля вещества. Термин «молярный объём» может быть применён к простым веществам, химическим соединениям и смесям. В общем случае он зависит от температуры, давления и агрегатного состояния вещества. Молярный объём также можно получить делением молярной массы M вещества на его плотность ρ: таким образом, Vm = V/n = M/ρ. Молярный объём характеризует плотность упаковки молекул в данном веществе. Для простых веществ иногда используется термин атомный объём[1].
В Международной системе единиц (СИ) единицей измерения молярного объёма является кубический метр на моль (русское обозначение: м3/моль; международное: m3/mol).
Молярный объём смеси[править | править код]
Для смеси веществ, при расчёте молярного объёма, количеством вещества считают сумму количеств всех веществ, составляющих смесь. Если известна плотность смеси ρc, мольные доли компонентов xi и их молярные массы Mi, молярный объём смеси можно найти как отношение средней молярной массы смеси (суммы молярных масс её компонентов, умноженных на их мольные доли) к плотности смеси.
Молярный объём газов[править | править код]
Согласно закону Авогадро, одинаковые количества газов при одинаковых условиях занимают одинаковый объём. Молярный объём идеального газа рассчитывается по формуле, выводящейся из уравнения состояния идеального газа
,
где T — термодинамическая температура, P — давление, R = 8,314 462 618 153 24 (точно) м3⋅Па⋅К−1⋅моль−1 — универсальная газовая постоянная.
При стандартных условиях (T = 273,15 K (0 °C), P = 101 325 Па) молярный объём идеального газа Vm = 22,413 969 545… л/моль[2][3]. Молярные объёмы идеального газа при других давлениях и температурах, часто принимаемых в качестве стандартных:
- Vm = 24,465 403 697… л/моль (T = 298,15 K (25 °C), P = 101 325 Па),
- Vm = 22,710 954 641… л/моль (T = 273,15 K (0 °C), P = 100 000 Па)[4],
- Vm = 24,789 570 296… л/моль (T = 298,15 K (25 °C), P = 100 000 Па).
| Газ | Vm, л/моль | Газ | Vm, л/моль |
|---|---|---|---|
| He | 22,426 | CO | 22,408 |
| Ne | 22,428 | CO2 | 22,262 |
| Ar | 22,394 | N2O | 22,260 |
| Kr | 22,388 | SO2 | 21,889 |
| Xe | 22,266 | CH4 | 22,376 |
| H2 | 22,430 | C2H6 | 22,176 |
| O2 | 22,393 | C2H4 | 22,255 |
| N2 | 22,404 | C2H2 | 22,157 |
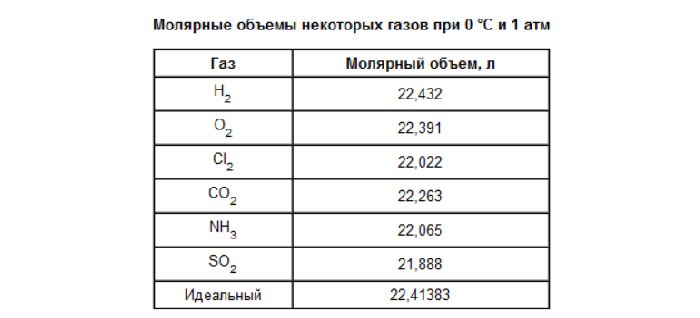
Молярные объёмы реальных газов в той или иной степени отличаются от молярного объёма идеального газа, однако во многих случаях для практических вычислений отклонениями от идеальности можно пренебречь. Различие молярных объёмов идеального и реального газа связано в первую очередь с силами притяжения между молекулами и с конечным объёмом молекулы реального газа; в связи с этим, уравнение состояния реального газа с большей точностью описывается не формулой Менделеева — Клапейрона (уравнением состояния идеального газа), а формулой Ван-дер-Ваальса:
В таблице справа приведены молярные объёмы некоторых реальных газов (T = 273,15 K (0 °C), P = 101 325 Па)[5]. Видно, что для газов с относительно большими молекулами (двуокись серы, углеводороды) молярный объём несколько меньше молярного объёма идеального газа (22,414 л/моль в указанных условиях); для газов с маленькими молекулами (гелий, неон, водород) молярный объём несколько больше «идеального».
С молярным объёмом идеального газа связана постоянная Лошмидта NL — количество молекул идеального газа в единице объёма при стандартных условиях:
Молярный объём кристаллов[править | править код]
Объём Vя элементарной ячейки кристалла можно вычислить из параметров кристаллической структуры, которые определяются с помощью рентгеноструктурного анализа. Объём ячейки связан с молярным объёмом следующим образом:
- Vm = VяNA/Z,
где Z — количество формульных единиц в элементарной ячейке.
Значения молярного объёма химических элементов[править | править код]
Ниже приведены значения молярного (атомного) объёма простых веществ в см3/моль (10−6 м3/моль, 10−3 л/моль) при нормальных условиях либо (для элементов, газообразных при н.у.) при температуре конденсации и нормальном давлении.
| Группа | I A (1) | II A (2) | III B (3) | IV B (4) | V B (5) | VI B (6) | VII B (7) | VIII B (8) | VIII B (9) | VIII B (10) | I B (11) | II B (12) | III A (13) | IV A (14) | V A (15) | VI A (16) | VII A (17) | VIII A (18) |
| Период | ||||||||||||||||||
| 1 | H 14,0 |
He 31,8 |
||||||||||||||||
| 2 | Li 13,1 |
Be 5 |
B 4,6 |
C 5,3 |
N 17,3 |
O 14 |
F 17,1 |
Ne 16,8 |
||||||||||
| 3 | Na 23,7 |
Mg 14 |
Al 10 |
Si 12,1 |
P 17 |
S 15,5 |
Cl 18,7 |
Ar 24,2 |
||||||||||
| 4 | K 45,3 |
Ca 29,9 |
Sc 15 |
Ti 10,6 |
V 8,35 |
Cr 7,23 |
Mn 7,39 |
Fe 7,1 |
Co 6,7 |
Ni 6,6 |
Cu 7,1 |
Zn 9,2 |
Ga 11,8 |
Ge 13,6 |
As 13,1 |
Se 16,5 |
Br 23,5 |
Kr 32,2 |
| 5 | Rb 55,9 |
Sr 33,7 |
Y 19,8 |
Zr 14,1 |
Nb 10,8 |
Mo 9,4 |
Tc 8,5 |
Ru 8,3 |
Rh 8,3 |
Pd 8,9 |
Ag 10,3 |
Cd 13,1 |
In 15,7 |
Sn 16,3 |
Sb 18,4 |
Te 20,5 |
I 25,7 |
Xe 42,9 |
| 6 | Cs 70 |
Ba 39 |
* | Hf 13,6 |
Ta 10,9 |
W 9,53 |
Re 8,85 |
Os 8,43 |
Ir 8,54 |
Pt 9,1 |
Au 10,2 |
Hg 14,8 |
Tl 17,2 |
Pb 18,3 |
Bi 21,3 |
Po 22,7 |
At н/д |
Rn н/д |
| 7 | Fr н/д |
Ra 45 |
** | Rf н/д |
Db н/д |
Sg н/д |
Bh н/д |
Hs н/д |
Mt н/д |
Ds н/д |
Rg н/д |
Cn н/д |
Nh н/д |
Fl н/д |
Mc н/д |
Lv н/д |
Ts н/д |
Og н/д |
| Лантаноиды | * | La 22,5 |
Ce 21 |
Pr 20,8 |
Nd 20,6 |
Pm 19,96 |
Sm 19,9 |
Eu 28,9 |
Gd 19,9 |
Tb 19,2 |
Dy 19 |
Ho 18,7 |
Er 18,4 |
Tm 18,1 |
Yb 24,8 |
Lu 17,8 |
||
| Актиноиды | ** | Ac 22,54 |
Th 19,8 |
Pa 15 |
U 12,5 |
Np 21,1 |
Pu 12,12 |
Am 20,8 |
Cm 18,28 |
Bk 16,8 |
Cf 16,5 |
Es н/д |
Fm н/д |
Md н/д |
No н/д |
Lr н/д |
||
См. также[править | править код]
- Число Авогадро
- Удельный объём
- Молярная масса
- Молярная теплоёмкость
Примечания[править | править код]
- ↑ Для молекулярных кристаллов простых веществ молярный объём, определяемый через 1 моль молекул, не равен атомному объёму, поскольку количество атомов не равно количеству молекул. В этих случаях необходимо уточнять, относится ли указанная величина к молекулярному или к атомному молярному объёму. Так, атомный молярный объём иода (кристаллы, состоящие из двухатомных молекул I2) вдвое меньше молекулярного молярного объёма.
- ↑ CODATA Value: molar volume of ideal gas (273.15 K, 101.325 kPa). Дата обращения: 17 ноября 2022.
- ↑ После изменения определений основных единиц СИ в 2019 году универсальная газовая константа стала не измеряемой, а определяемой (точно фиксированной) величиной, будучи произведением точно фиксированных величин — постоянной Больцмана и постоянной Авогадро. Это же относится и к стандартному молярному объёму.
- ↑ CODATA Value: molar volume of ideal gas (273.15 K, 100 kPa). Дата обращения: 17 ноября 2022.
- ↑ 1 2 Battino R. The Ostwald coefficient of gas solubility (англ.) // Fluid Phase Equilibria. — 1984. — Vol. 15, no. 3. — P. 231—240. — ISSN 0378-3812. — doi:10.1016/0378-3812(84)87009-0. [исправить]; Table 2.
как вычислить объем вещества зная количество моль
Ученик
(196),
закрыт
12 лет назад
ураган Катрина
Мудрец
(10167)
12 лет назад
Если речь идёт про объём газа, то всё просто. Особенно если температура и давление стандартные. Тогда объём 1 моля газа, равен 22,4 л/моль
А вот просто объём вещества – это только если нам известен объём определённой массы или количества вещества. Даже зная массу молекулы мы это не вычислим–ведь они бывают разной конфигурации, и если есть дополнительные допустим водородные связи, то это повлияет на объём.
Источник: PV = vRT,(это для газа), где R=8,3
Как найти объем одного моля
Чтобы найти объем одного моля вещества в твердом или жидком состоянии, найдите его молярную массу и поделите на плотность. Один моль любого газа в нормальных условиях имеет объем 22,4 л. В том случае если условия изменяются, рассчитайте объем одного моля при помощи уравнения Клапейрона-Менделеева.

Вам понадобится
- периодическая таблица Менделеева, таблица плотности веществ, манометр и термометр.
Инструкция
Определение объема одного моля жидкости или твердого тела
Определите химическую формулу твердого тела или жидкости, которая изучается. Затем, с помощью периодической таблицы Менделеева найдите атомные массы элементов, которые входят в формулу. Если один элемент входит в формулу несколько раз, умножьте его атомную массу на это число. Сложите атомные массы всех элементов и получите молекулярную массу вещества, из которого состоит твердое тело или жидкость. Она будет численно равна молярной массе, измеренной в граммах на моль.
По таблице плотности веществ найдите эту величину для материала изучаемого тела или жидкости. После этого поделите молярную массу на плотность данного вещества, измеренную в г/см³ V=M/ρ. В результате получите объем одного моля в см³. Если химическая формула вещества осталась неизвестной, определить объем одного его моля будет невозможно.
Определение объема одного моля газа
Если газ находится в так называемых нормальных условиях, при давлении 760 мм рт. ст. и 0ºС, то объем одного его моля, не зависимо от химической формулы равен 22,4 л (закон Авогадро, определяющий молярный объем газа). Чтобы перевести его в см³ умножьте на 1000, а в м³ – поделите на это же число.
Если же газ не находится в нормальных условиях, измерьте с помощью манометра его давление в паскалях и температуру в градусах Кельвина, для чего к измеренной термометром температуре в градусах Цельсия прибавьте число 273.
Из уравнения Клапейрона-Менделеева P•V= υ•R•T, выразите отношение объема газа на его количество вещества. Это и будет объем одного моля, которые равен произведению температуры газа на универсальную газовую постоянную, которая равна 8,31, поделенному на давление газа V/υ=R•T/P. Результат получите в м³ на моль. Чтобы перевести значение в см³, полученное число умножьте на 1000000.
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Молярный объем

4.2
Средняя оценка: 4.2
Всего получено оценок: 260.
4.2
Средняя оценка: 4.2
Всего получено оценок: 260.
При изучении химических веществ важными понятиями являются такие величины, как молярная масса, плотность вещества, молярный объем. Так, что же такое молярный объем, и в чем его отличие для веществ в разном агрегатном состоянии?
Молярный объем: общая информация
Чтобы вычислить молярный объем химического вещества необходимо молярную массу этого вещества разделить на его плотность. Таким образом, молярный объем вычисляется по формуле:
Vm=M/p,
где Vm – молярный объем вещества, М – молярная масса, p – плотность. В Международной системе СИ эта величина измеряется в кубический метр на моль (м 3 /моль).
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа.
Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм 3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм 3 /м.
Молярный объем при нормальных условиях можно вывести, используя уравнение состояния для идеального газа, которое называется уравнением Клайперона-Менделеева:
P*V=n*R*T,
где R – универсальная газовая постоянная, R=8.314 Дж/моль*К=0,0821 л*атм/моль К
Объем одного моля газа V=RT/P=8.314*273.15/101.325=22.413 л/моль, где Т и Р – значение температуры (К) и давления при нормальных условиях.
Закон Авогадро
В 1811 году А. Авогадро выдвинул гипотезу, что в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковой число молекул. Позже гипотеза подтвердилась и стала законом, носящим имя великого итальянского ученого.
Закон становится понятен, если вспомнить, что в газообразном виде расстояние между частицами несопоставимо больше, чем размеры самих частиц.
Таким образом, из закона Авогадро можно сделать следующие выводы:
- В равных объёмах любых газов, взятых при одной и той же температуре и при одном и том же давлении, содержится одно и то же число молекул.
- 1 моль совершенно различных газов при одинаковых условиях занимает одинаковый объем.
- Один моль любого газа при нормальных условиях занимает объем 22,41 л.
Следствие из закона Авогадро и понятие молярного объема основаны на том, что моль любого вещества содержит одинаковое число частиц (для газов – молекул), равное постоянной Авогадро.
Чтобы узнать число молей растворенного вещества содержится в одном литре раствора, необходимо определить молярную концентрацию вещества по формуле c=n/V, где n – количество растворенного вещества, выражаемое в молях, V – объем раствора, выражаемый в литрах С – молярность.
Что мы узнали?
В школьной программе по химии 8 класса изучается тема «Молярный объем». В одном моле газа всегда содержится одинаковый объем, равный 22,41 кубический метр/моль. Этот объем называется молярным объемом газа.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Александр Котков
10/10
-
Артак Саркисян
10/10
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 260.
А какая ваша оценка?
Молярная масса
Вы знаете, что одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но у каждого вещества его структурная единица имеет собственную массу. Поэтому и массы одинаковых химических количеств различных веществ тоже будут различны.
Молярная масса — это масса порции вещества химическим количеством 1 моль.
Молярная масса вещества Х обозначается символом M(Х). Она равна отношению массы данной порции вещества m(Х) (в г или кг) к его химическому количеству n(Х) (в моль):
В Международной системе единиц молярная масса выражается в кг/моль. В химии чаще используется дольная единица — г/моль.
Определим молярную массу углерода. Масса углерода химическим количеством 1 моль равна 0,012 кг, или 12 г. Отсюда:
Молярная масса любого вещества, если она выражена в г/моль, численно равна его относительной молекулярной (формульной) массе.
Например:
На рисунке 47 показаны образцы веществ (H2O, CaCO3, Zn), химическое количество которых одно и то же — 1 моль. Как видите, массы разных веществ химическим количеством 1 моль различны.
Молярная масса является важной характеристикой каждого отдельного вещества. Она отражает зависимость между массой и химическим количеством вещества. Зная одну из этих величин, можно определить вторую — массу по химическому количеству:
и, наоборот, химическое количество по массе:
а также число структурных единиц:
Взаимосвязь между этими тремя характеристиками вещества в любом его агрегатном состоянии можно выразить простой схемой:
Формула и алгоритм нахождения объёма
Сегодня мы научимся одному немаловажному умению в химии – находить объём различных растворов и прочих веществ. Это знание необходимо потому, что оно поможет нам в решении многих задач как в тетради, так и в жизни. Нужно лишь знать устоявшуюся формулу.
Важно понимать, что формула нахождения объёма может быть разной в зависимости от того вещества, объём которого нам предстоит найти, а точнее, от агрегатного состояния этого вещества. Для нахождения объёма газа и жидкости используются разные, непохожие друг на друга формулы.
Чёткая и правильная формула для расчёта объёма жидкости выглядит следующим образом: С=n/V.
В этом случае:
- C – молярная масса раствора (моль на литр).
- n – количество вещества (моль).
- V – объём вещества-жидкости (литры).
Из этого следует что V=n/c.
Cуществует и вторая формула для нахождения объёма жидкости при другой задаче и других данных: V=m/p.
Здесь, соответственно:
- V – объём и измеряется он в миллилитрах.
- m – масса, измеряется в граммах.
- p – плотность, измеряется в граммах, делённых на миллилитры.
В случае если, кроме объёма, требуется также найти массу, это можно сделать, зная формулу и количество нужного вещества. При помощи формулы вещества находим его молярную массу путём сложения атомной массы всех элементов, которые входят в его состав.
Для примера возьмём M (AuSo2) и при расчётах у нас должно выйти 197+32+16 * 2 = 261 г/моль. После проведённых расчётов находим массу по формуле m=n*M, где, следовательно:
- m – масса.
- n – количество вещества, которое измеряется в молях (моль).
- M – молярная масса вещества: граммы, делённые на моль.
Количество вещества, как правило, даётся в задаче. Если же нет, то, скорее всего, допущена опечатка или ошибка в условии, и вам стоит обратиться за помощью и объяснениями к учителю, а не пытаться самим вывести несуществующую величину. Основные формулы и алгоритмы решения приведены в данной статье.
Также существует формула для нахождения объёма газа, и выглядит она так – V=n*Vm:
- V – объём газа (литры).
- n – количество вещества (моль).
- Vm – молярный объём газа (литры/моль).
Но есть своего рода исключение. Оно состоит в том, что при нормальных условиях, то есть при определённом давлении и температуре, объём газа является постоянной величиной, равной 22,3 л/моль.
Есть и третий вариант. Если в самом задании будет присутствовать уравнение реакции, тогда ход решения должен проходить иначе. Из уравнения, которое у вас имеется, можно найти количество каждого вещества, оно будет равняться коэффициенту. К примеру, Ch4 + 2O2 = CO2 + H2O. Из этого уравнения следует, что 1 моль метана и 2 моль кислорода при взаимодействии дают 1 моль углерода и 1 моль воды. Даже если учесть тот факт, что в условии имеется количество вещества лишь одного-единственного компонента, не составит труда найти количество всех остальных веществ. Если количество метана составит 0,3 моль, значит, n(Сh4) будет равняться 0,6 моль, n(CO2) = 0,3 моль, n(H2O) = 0.3 моль.
б) Газовые законы объем газа
Кроме вышеуказанной формулы для решения расчетных химических задач, нередко приходится использовать газовые законы, известные из курса физики.
— Закон Бойля-Мариотта
При постоянной температуре объем данного количества газа обратно пропорционален давлению, под которым он находится:
pV = const
— Закон Гей-Люссака
При постоянном давлении изменение объема газа прямо пропорционально температуре:
V/T = const
— Объединенный газовый закон Бойля-Мариотта и Гей-Люссака
pV/T = const
Помимо этого, если известна масса или количество газа, его объем можно вычислить, используя уравнение Менделеева-Клапейрона:
pV = nRT;
pV = n/M ×RT,
где n–число молей вещества, m–масса (г), Ь – молярная масса газа (г/моль), R – универсальная газовая постоянная равная 8,31 Дж/(моль×К).
Молярный объем кристаллов
Объем Vя элементарной ячейки кристалла вычисляют с помощью характеристик кристаллической структуры, которые определяют на основании результатов рентгеноструктурного анализа.
Зависимость между объемом ячейки и молярным объемом:
Vm=VяNA/Z
где Z — определяет, сколько формульных единиц в элементарной ячейке.
Молярный объем
В отличие от твердых и жидких веществ все газообразные вещества химическим количеством 1 моль занимают одинаковый объем (при одинаковых условиях). Эта величина называется молярным объемом и обозначается Vm.
Подобно молярной массе, молярный объем газа равен отношению объема данного газообразного вещества V(Х) к его химическому количеству n(Х):
Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С и давление 101,325 кПа.
Установлено, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 дм3/моль. Другими словами, молярный объем любого газа при нормальных условиях:
Молярный объем — это объем, равный 22,4 дм3, который занимает 1 моль любого газа при нормальных условиях.
Пример 1. Вычислите химическое количество SiO2, масса которого равна 240 г.
Спойлер
[свернуть]
Пример 2. Определите массу серной кислоты H2SO4, химическое количество которой 2,5 моль.
Спойлер
[свернуть]
Пример 3. Сколько молекул CO2 и сколько атомов кислорода содержится в углекислом газе массой 110 г?
Спойлер
[свернуть]
Пример 4. Какой объем занимает кислород химическим количеством 5 моль при нормальных условиях?
Спойлер
[свернуть]
Краткие выводы урока:
- Масса вещества химическим количеством 1 моль называется его молярной массой. Она равна отношению массы данной порции вещества к его химическому количеству.
- Объем газообразных веществ химическим количеством 1 моль при нормальных условиях одинаков и равен 22,4 дм3.
- Величина, равная 22,4 дм3/моль, называется молярным объемом газов.
Надеюсь урок 9 «» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «».