Ребята, как мне нравится ваша реакция на мои статьи! Это что-то! Раньше я даже не подозревала, что буду получать удовольствие от написания статей, а еще большее удовольствие – от вашей реакции на них. В цирк ходить не нужно. Правда, пишут в комментариях мало, боятся попасться мне на зубок. Правильно боятся. Нехороший комментарий включает во мне дух воина-победителя, который издает боевой крик “Давай играть, как будто я голодная гиена, а ты – кость!” Дальше я за себя не отвечаю… Моим почитателям лучше не знать, чем такая игра заканчивается. А недруги до сих пор раны зализывают и, давясь слезами, фанатично читают мои статьи, издавая нервное икание.
Пишут мало, зато звонят много. И утром звонят, и днем звонят, и вечером звонят. Многие вполне нормальные вопросы задают, знакомятся и получают на свои вопросы вполне нормальные ответы. Но есть такие… Я же говорю, в цирк можно не ходить – развлекают прямо дома, за чашечкой кофе, бесплатно. Настоящее реалити-шоу! Народ не знает, что у меня на телефоне стоит программа-диктофон. Пишет все разговоры. И номер телефона тоже высвечивается. Обязательно помещу эти разговоры на YouTube и дам ссылку на Яндекс Дзен. Читайте мои статьи, и вы тоже услышите много чего интересного! Кстати, тех, кто дочитает статью до конца, ждет очень интересный подарок “На закуску”!
А теперь – к основной теме статьи. Я обещала рассказать хайповый прикол 28-го задания ЕГЭ? Выполняю обещание. Только не спрашивайте, откуда я это знаю – сорока на хвосте принесла и на ушко нашептала. Согласно “Спецификации контрольных измерительных материалов для проведения в 2019 году единого государственного экзамена по ХИМИИ” (серьезный документ ФИПИ), 28-е задание в проверяемые элементы содержания включает “Расчеты объемных отношений газов при химических реакциях. Расчеты по термохимическим уравнениям”. Сегодня речь пойдет только о реакциях с газами (термохимию рассмотрим позже). До 2018 года задачи 28-го задания были несложными. Давайте вспомним:
Задание 28
Рассчитайте объем воздуха, необходимый для сжигания 1,4 л этилена. Считать объемную долю кислорода в воздухе равной 21%.
Задачу решаем стандартно, по Четырем Заповедям.
1) Первая Заповедь. Выписать данные задачи в разделе “Дано”
2) Вторая Заповедь. Написать уравнение реакции
3) Третья Заповедь. Сделать предварительные расчеты по данным условия задачи и по уравнению реакции. По уравнению реакции определяем объем кислорода.
4) Четвертая заповедь. Составить алгоритм решения задачи. Объем воздуха рассчитываем по формуле объемной доли кислорода в воздухе
Как вы убедились, задача абсолютно легкая. Такого же уровня сложности и все остальные задания 28-й позиции. Но… мы наблюдаем тенденцию ежегодного усложнения заданий ЕГЭ. Я считаю, это абсолютно правильно! Химию сдают будущие медики, которым мы с вами доверим самое дорогое, что у нас есть – наши жизни. Думаю, никто из нас не захочет иметь дело с туповатым врачом, все ищут доктора получше. Потому медицинские ВУЗы стараются отбирать толковых учеников. Как это сделать? На простых заданиях невозможно определить достойный уровень знаний. Сложные задачи – хороший индикатор! Тот, кто хорошо решает задачи по химии, становится отличным врачом-диагностом (доказано на армии моих самых любимых учеников). Для повышения уровня знаний и мастерства будущих медиков (и не только) раскрываю великую тайну – новые приколы 28-го задания ЕГЭ. Почему множественное число? Потому что их, как минимум, четыре:
1) Расчеты по уравнениям реакции горения смеси газов, состав которой нужно определить предварительно
2) Определение объемного состав смеси по продуктам сжигания (задачи на уравнения с двумя неизвестными)
3) Определение состава смеси газообразных продуктов, если в условии избыток-недостаток, степень превращения или выход реакции
4) Задачи на изменение объема газовой смеси в процессе реакции
Каждый алгоритмический прием (прикол, фишку) я опишу в отдельной статье, с подробным глубоким анализом соответствующих задач. Сегодня мы разложим по полочкам первое гипотетическое нововведение “Расчеты по уравнениям реакции горения смеси газов, состав которой нужно определить предварительно”. Итак, поехали!
Прежде чем вы приступите к изучению новых алгоритмических приемов 28-го задания, настоятельно рекомендую внимательно прочитать статью “Секретная шпаргалка по химии. 4.2. Состав смеси газов”, в котороя я рассказала о газовых смесях, плотности газа (абсолютной и относительной), средней молярной массе смеси газов, разложила по полочкам алгоритмы решения задач на определение средней молярной массы и плотности газа по компонентам газовой смеси и наоборот.
Задание 28*(1)
Рассчитайте объем воздуха, необходимый для сжигания 20 л смеси СО и Н2 (н.у.). Плотность этой смеси по аммиаку – 1,2.
Решаем задачу с применением Четырех Заповедей (шагов). Каждое выполненное действие обводится зеленым овалом.
1) Первая Заповедь. Выписать данные задачи в разделе “Дано”.
2) Вторая заповедь. Написать уравнение реакции.
В задаче протекает две реакции. При написании реакций, не забываем делать отступ над каждой – для дальнейших расчетов.
3) Третья заповедь. Сделать предварительные расчеты
В задачах со смесями газов, предварительные расчеты связаны с определением состава смеси и объема каждого газа в смеси. Состав смеси газов определяем стандартно, по формуле расчета средней молярной массы. вначале рассчитываем значение средней молярной массы по относительной плотности
Затем, по основной формуле составляем уравнение и решаем его
Определяем объем каждого газа в смеси по расчитанным объемным долям и делаем расчеты по уравнению реакции
4) Четвертая заповедь. Составить алгоритм решения задачи.
Алгоритм решения составляем по вопросу задачи: “Рассчитайте объем воздуха…” Объем воздуха расчитывают по объему кислорода и объемной доле кислорода в воздухе. Вначале определяем общий объем кислорода, который был затрачен на сжигание газов
Затем, по формуле объемной доли определяем объем воздуха
Решим еще несколько задач с новым алгоритмическим приемом “Расчеты по уравнениям реакции горения смеси газов, состав которой нужно определить предварительно”.
Задание 28*(2)
Плотность по водороду смеси метана и угарного газа равна 10. Вычислите объем кислорода (н.у.), который израсходуется на сжигание 5 моль исходной смеси.
Задание 28*(3)
Рассчитайте объем воздуха (н.у.), необходимый для сжигания 4 л эквимолярной смеси метана и угарного газа. Вычислите плотность исходной смеси по аммиаку.
Задание 28*(4)
Вычислите плотность по водороду смеси пропана и метана, если известно, что смесь содержит 40% метана по объему. Какой объем кислорода израсходуется на сжигание 20 л смеси?
Обещанный подарок “На закуску” – задача на газы моего самого любимого автора И.Ю. Белавина. Решайте и наслаждайтесь! “Мама, вытри слезы, а иначе быть беде. Глупые вопросы – что я делаю и где? Пропадаю я – Белавина решаю я!”
И.Ю. Белавин, 2005, задача 206
Избыток кислорода смешали с триметиламином, подожгли, и продукты сгорания привели к нормальным условиям. Определите объемные составы исходной и конечной газовых смесей (в литрах), если известно, что масса исходной газовой смеси оказалась на 8,1 г, а объем на 63,7 % больше массы и объема конечной газовой смеси соответственно. (Ответ: Исходная смесь – V((CH3)3N) = 2,24л; V(О2) = 13,6 л. Конечная смесь – V(СО2) = 6,72 л; V(N2) = 1,12 л; V(О2) = 1,84 л.)
Если вы так ничего и не поняли, не отчаивайтесь. Приходите ко мне на занятия – и вы подготовитесь к любой форме экзамена (ЕГЭ, ДВИ, олимпиада) и сдадите его с максимально высоким баллом!
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий, теоретического материала и познакомитесь с моими учениками.
Полный каталог статей репетитора Богуновой В.Г. вы найдете на странице сайта Статьи репетитора
Подписывайтесь видео-канал Репетитор по химии и биологии. Ежедневно появляются новые вебинары, видео-уроки, видео-консультации, видео-решения заданий ЕГЭ.
Репетитор по химии и биологии кбн В.Богунова
Калькулятор позволяет рассчитать необходимый объем кислорода (О2) и воздуха при сжигании природного газа:
-
- приведенный к нормальным условиям (по стехиометрическим уравнениям);
- приведенный к рабочим условиям (исходя из температуры воздуха).
Калькулятор объема воздуха необходимого для сжигания газа
Общие данные
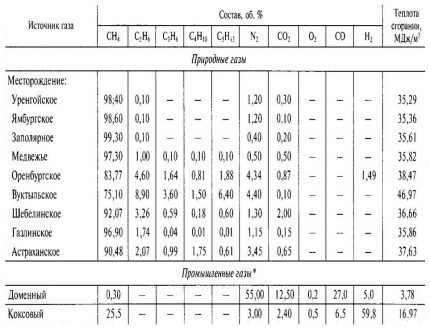
Теоретический объем воздуха на сжигание природного газа зависит от его химического состава. Химический состав газа для сетей газораспределения определяется согласно данным газораспределительных организации (обычно паспорта на газ размещены на официальных сайтах этих организаций).
Объем кислорода необходимого для сжигании природного газа (алканов, парафинов, также насыщенных углеводородов) определяется согласно химическим уравнениями:
-
-
-
-
- CH4+2O2=>CO2+2H2O;
- C2H6+3.5O2=>2CO2+3H2O;
- C3H8+5O2=>3CO2+4H2O;
- и т.д,
-
-
-
где красным (стехиометрические коэффициенты) выделено количество молекул кислорода необходимых для сжигании 1 молекулы природного газа. Так как согласно закону Авогадро в равных объёмах различных газов, взятых при одинаковых температурах и давлениях, содержится одно и то же количество молекул, то это соотношение верно и к объема веществ в уравнениях.
В составе воздуха кислород занимает 21 % объема. Исходя из этого условия определяется количество необходимого воздуха для горения.
Калькулятор рассчитывает рабочий объем воздуха на горений при рабочей температуре. Часто на практике для повышения КПД теплогенерирующих установках (больших мощностей) предварительно подогревают дутьевой воздух.
Коэффициент избытка воздуха в калькуляторе по умолчанию принят равным 1.05. Коэффициент избытка воздуха — это отношение фактически подаваемого количества воздуха к теоретически необходимому. Избыток воздуха необходим для исключения неполноты сгорания топлива. Коэффициент избытка воздуха зависит от конструкции газовой горелки и топки теплогенерирующего устройства: чем они совершеннее, тем ближе коэффициент к 1. При эксплуатации (в процессе пуско-наладочных работ) необходимо следить, чтобы коэффициент избытка воздуха не был меньше 1, так как это приводит к неполному сгоранию газа. Увеличение коэффициента избытка воздуха ведет к снижению к.п.д. теплогенерирующего устройства.
Более подробно методика расчет состава дымовых газов в зависимости от вида и состав топлива приведена в нормативном методе «ТЕПЛОВОЙ РАСЧЕТ КОТЛОВ (НОРМАТИВНЫЙ МЕТОД)».
Литература
-
- ТЕПЛОВОЙ РАСЧЕТ КОТЛОВ (НОРМАТИВНЫЙ МЕТОД). Издание третье, переработанное и дополненное, Санкт-Петербург, 1998 г.
Примечание.
В комментарии приветствуются пожелания, замечания и рекомендации по улучшению программы.
Поделиться ссылкой:
От качества процесса горения зависит эффективность работы всевозможного газового оборудования. На что прямо влияет количество воздуха для сжигания природного газа, вычислить которое совсем несложно. Почему бы не позаботиться об эффективности расхода топлива и повышении КПД оборудования, выполнив необходимые расчеты самостоятельно, ведь верно?
Но как это правильно сделать и где взять данные для вычислений? Чтобы разобраться в этой теме, давайте рассмотрим в рамках нашей статьи теорию расхода воздуха на сжигание газа, познакомимся с наиболее простыми формулами для вычисления необходимого объема воздуха. А также поговорим о практической пользе этих вычислений.
Содержание статьи:
- Теория расхода воздуха на сжигание газа
- Формулы и примеры выполнения расчета
- Способ #1 — вычисление с использованием формулы
- Способ #2 — расчет с помощью усредненных данных
- Практическое значение расчета расхода воздуха
- Профилактика поломок и понижения КПД оборудования
- Польза расчетов при обустройстве котельной
- Выводы и полезное видео по теме
Теория расхода воздуха на сжигание газа
Процедура получения тепловой энергии напрямую влияет на длительность эксплуатации, периодичность работ по обслуживанию газоиспользующего оборудования. Следует понимать, что оптимальная газовоздушная смесь является залогом безопасности. Поговорим детальнее о расходе воздуха на сжигание газа.
Для сгорания одной молекулы метана, который является основной составляющей природного газа, требуется ровно 2 молекулы кислорода. Если перевести в понятные объемы, то для того, чтобы окислить кубический метр указанного топлива придется использовать в 2 раза больше кислорода.
Но в реальных условиях все сложней. Так как в качестве окислителя для выполнения химико-физического процесса горения применяется воздух, в составе, которого кислород, необходимый для поддержания горения, составляет всего пятую часть. А, если точно, то 20,93% — именно такое процентное соотношение принято использовать для всевозможных технических расчетов. То есть воздуха понадобится в 9,52 раза больше.
При любом техническом расчете количества газа за основу берут все 100% этого топлива. Хотя его основного вещества — метана (СН4) может быть в составе не более 75%
Узнать указанную цифру получится, выполнив 2 действия:
- Деление 100/21. Эта операция позволяет выяснить, что воздуха в любом объеме в 4,76 раза больше, чем кислорода.
- Умножение 4,76 на 2, что равняется 9,52 — именно во сколько раз больше понадобится израсходовать воздуха для сжигания любого объема природного газа.
Но есть одна важная оговорка: вычисленное количество воздуха необходимое для эффективного горения газа, является теоретическим расходом. А на практике его понадобится. Причина в том, что расчет проводился для идеальных условий, а в реальности почти всегда существует ряд факторов, которые вносят значительные коррективы.
К ним относятся:
- состав и качество реагентов (воздуха, газа);
- вид оборудования, используемого для подвода энергоносителя;
- состояния оборудования;
- способа подачи газа, воздуха, а также ряд других моментов.
Если нужна особая точность, то перечисленные выше особенности иногда возможно учесть. К примеру, точный состав газа получится выяснить в ближайшем представительстве службы газа. Но, когда особая точность не нужна, то полученное значение 9,52 просто умножают на, так называемый, коэффициент избытка воздуха. Значение которого обычно лежит в пределах 1,1 — 1,4.
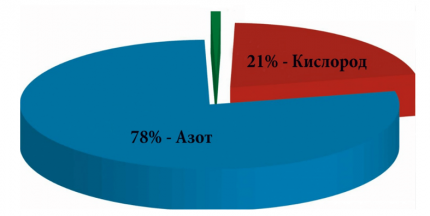
Кислород является окислителем газа. То есть он сам не горит, но активно поддерживает этот процесс с участием указанного топлива. Но поскольку кислорода в составе воздуха не более 20,93%, то считается, что для процедуры сгорания газа его требуется почти в 5 раз больше
Когда расчет должен быть максимально точным, тогда следует количество действительно используемого воздуха разделить на его теоретический расход. Но в большинстве случаев проще использовать усредненное значение коэффициента избытка воздуха. Значение которого следует умножить на 9,52 и в результате получится узнать точное количество расходуемого воздуха, нужного для обеспечения процедуры сгорания газа.
Так если он равен:
- 1,1 — воздушной массы понадобится в 10,472 раза больше;
- 1,4 — воздуха потребуется использовать в 13,328 раз больше.
То есть для сжигания каждого кубического метра энергоносителя понадобится до 13,328 м³ воздуха.
Формулы и примеры выполнения расчета
Необходимое значение в каждом конкретном случае можно получить, воспользовавшись специальной формулой или усредненными показателями. Об этих способах поговорим детальнее.
Способ #1 — вычисление с использованием формулы
Которая гласит, что часовой объем воздуха (Vч ), необходимый для сгорания, будет равен:
Vч = 1,1 х Кизб.в х Vт х Vг/ч х (273 + t)/273,
Где:
- Кизб.в — коэффициент избытка воздуха;
- Vт — теоретически необходимое количество воздуха;
- Vг/ч — часовой расход газа оборудованием;
- t — значения температуры в помещении, где размещено газовое оборудование.
Необходимый для вычислений часовой расход газа указан в паспорте любого газового прибора.
То есть, если такое значение равняется 10, а:
- температура в помещении, к примеру, 18 °С;
- коэффициент избытка воздуха — 1,1.
Тогда выполняем, указанные выше математические действия, а именно:
1,1 х 1,1 х 9,52 х 10 х (273 + 18) / 273 = 122,1
В результате выясняется, что в этом конкретном случае для сжигания газа, каждый час нужно будет 122,1 м³ воздуха.

Расчет количества воздуха необходим для обеспечения эффективной и безопасной работы любого газового оборудования, включая плиты, колонки и котлы отопления, которые используются в быту
Способ #2 — расчет с помощью усредненных данных
Если нет желания выполнять подобный расчет воздуха на горение нужного количества газа, тогда можно прислушаться к рекомендациям многих производителей, специалистов.
Которые гласят, что процесс будет эффективным, если на каждый киловатт мощности ежечасно подводить не меньше 1,6 м³ воздуха.

Если способ расчета с использованием формулы покажется сложным, то можно воспользоваться менее точным и просто усредненным, но зато очень простым, а поэтому доступным. Так как все, что нужно сделать это умножить мощность нужного газового прибора на 1,6, что позволит получить приблизительный объем воздуха, который каждый час придется подводить для полного сгорания газа
То есть выполнить вычисление получится всего за одно действие. Для чего взятое из паспорта значение мощности газового прибора следует умножить на указанные 1,6. В качестве результата получится нужное для эффективного горения количество воздуха.
К примеру, если мощность газового котла составляет 40 кВт, тогда это значение следует умножить на 1,6:
40 х 1,6 = 64
Получится 64 м³ воздуха, которые ежечасно необходимо будет подводить к газовому прибору.
Практическое значение расчета расхода воздуха
Навыки выполнения подобных расчетов могут понадобится для повышения КПД газового оборудования, а также устранения причин его неправильной работы.
Профилактика поломок и понижения КПД оборудования
К примеру, знание оптимального количество окислителя понадобится, когда поверхности дымоходов (внутренние), элементов конструкции оборудования (теплообменники, горелки, прочие) быстро покрываются наслоениями сажи, других продуктов сгорания.
Если устранение загрязнений должного эффекта не дает, как и любые другие меры (настройка, замена частей, узлов агрегатов). Что свидетельствует о наличии так называемого, недогара энергоносителя, который происходит из-за недостаточного количества воздуха.

Процедура горения газа считается сложной реакцией. В результате, если окислителя, то есть воздуха, не будет в достаточном количестве, то это будет сказываться на состоянии, работоспособности и исправности всего газового оборудования. И в ряде случаев неполадки получится устранить только после выявления и корректировки количества воздуха, участвующего в реакции
А также знание необходимого расхода воздуха потребуется в следующих ситуациях:
- Выявлен перерасход газа, который не получается устранить с помощью регулировок, других манипуляций. Так как причиной может быть механический недожег. То есть процесс при котором подводится слишком большое количество воздуха, что тоже приводит к неполному сгоранию газа.
- Замечено частое изменение цвета «голубого» топлива во время горения — к примеру, на оранжевый, белый, красный, желтый. Это более сложные случаи, чем предыдущие, так как причиной может быть, как избыток воздуха, так и его недостаточное количество.
- Неустойчивого процесса горения газа. Например, если задействованы не все рабочие отверстия конфорки, горелки газового котла и т. д. А чистка перечисленных элементов конструкции не привела к улучшению, так как как в таких ситуациях точно придется подводить воздуха на порядок больше.
Несмотря на наличие различных причин расчет выполняется одинаково, согласно методике, изложенной выше.
Польза расчетов при обустройстве котельной
Вычисления количества воздуха, необходимого для эффективного окисления газа, необходимы в случаях обустройства топочной, установки, замены газового оборудования и других подобных.

Всегда следует помнить о том, что теоретические расчеты хороши только, когда их правильность подтверждена практикой. А в случае с количеством воздуха — представителями горгазов с газоанализаторами
И расчеты выполняются, но ситуация в каждом указанном случае усложняется тем, что для получения всех необходимых данных необходимо выполнить еще ряд вычислений.
К которым относятся расчеты:
- суммарного расхода воздуха — в помещение с газовым оборудованием необходимо поставлять воздух не только для процесса горения, но и для его проветривания (в СНиП II-35-76 четко сказано, что в помещениях, используемых в качестве топочных, ежечасно должны сменяться 3 объема воздуха);
- сечения вытяжного канала;
- сечения (-ий) отверстия (-ий) входных каналов;
- естественной тяги в предусмотренном вытяжном канале;
- фактической скорости воздушных масс в сечениях будущих воздуховодов;
- потерь давления на всевозможные местные сопротивления;
- размера окна, положенного в помещении с газовым оборудованием.
Кроме правильного обустройства вентиляции котельной, может понадобиться выполнение еще ряда процедур, к примеру, выполнение аэродинамического расчета.

При выполнении расчета следует помнить о том, что любые действия с газом представляют собой существенную опасность. Поэтому лучше доверить их выполнение специалистам
После чего вся полученная информация должна стать основой проекта замены, установки оборудования, перепланировки, который подается в местную газовую службу на утверждение. Где при выявлении ошибок документ могут отправить обратно составителю.
То есть комплекс процедур по исчислению всех необходимых значений достаточно сложен. Поэтому в случае с установкой, заменой, переносом оборудования с задачей справятся только немногие. Большинству владельцев помещений будет проще обратиться за помощью к специалистам. Которые не только выполнят необходимые математические действия, но и адаптируют расчеты к требованиям законодательства по обустройству топочных, систем вентиляции, дымоудаления, всех прочих. Которые изложены в СНиП II-35-76, а также в СНиП 2.04.08-87 и ряде других менее востребованных профильных документов.
Если в каком-то конкретном случае проект составлять не нужно, то расчеты, выполненные специалистом, исключат угрозу жизни, здоровью самого владельца газового оборудования, его близким и людям, проживающим рядом.
Кроме того, позволят избежать действий, трактующихся законодательством, как самовольное подключение к каким-либо газопроводам. За которые ст. 7.19 КоАП РФ предусматривает санкции в виде штрафа, размер которого 10-15 тыс. рублей. К примеру, так может произойти, если владелец помещения после выполнения расчетов, внесет в конструкцию системы отопления изменения.

Не нужно забывать то, что неудачный расчет количества воздуха или любой другой может сделать человека правонарушителем. За что придется расплачиваться, как минимум финансово. К примеру, если действия или бездействие приведут к нарушению правил, призванных обеспечивать безопасное использование любого газового оборудования, то в качестве штрафа придется расстаться с суммой денег в размере 1-30 тыс. рублей. О чем сказано в ст. 9.23 КоАП
После вычислений не стоит принимать необдуманного решения по замене газового оборудования, особенно с отличающейся мощностью. Если же так произошло, тогда стоит уведомить представителей газовой службы о выполненных действиях. Что поможет избежать штрафов.
А также не нужно воплощать сделанные теоретические расчеты ценой нарушений правил, норм изложенных в СНиП II-35-76, который регулирует сферу обустройства помещений, предназначенных для использования газового оборудования. Так как согласно ст. 9.23 КоАП даже за самые мелкие нарушения придется выложить 1-2 тыс. рублей.
Выводы и полезное видео по теме
Приложенный ниже видеоматериал позволит выявлять недостаток воздуха при горении газа без каких-либо расчетов, то есть визуально.
Рассчитать количество воздуха, необходимого для эффективного горения любого объема газа можно за считанные минуты. И владельцам недвижимости, оборудованной газовым оборудованием, следует об этом помнить. Так как в критический момент, когда котел или любой другой прибор будет работать неправильно, умение вычислять количество воздуха, нужное для эффективного горения, поможет выявить и устранить неполадку. Что, кроме того, повысит безопасность.
Хотите дополнить изложенный выше материал полезными сведениями и рекомендациями? Или у вас остались вопросы по расчету? Задавайте их в блоке комментариев, пишите свои замечания, принимайте участие в обсуждении.
Химия
Анонимный вопрос
25 ноября 2018 · 32,9 K
ОтветитьУточнить
Ирина С.6,1 K
Книги, звери и еда – это хобби навсегда. · 27 нояб 2018
Запишем уравнение горения пропана
С3H8+5*O2->3CO2+4*H2O
Из уравнения видно, что для сжигания 1 моль пропана требуется 5 моль кислорода. Поскольку оба вещества являются газами, то 56 л пропана составляет 56/22.4=2.5 моль, а требуемое количество кислорода составляет 2.5*5 = 12.5 моль, которое будет занимать 12.5*22.4=280 л.
16,8 K
Комментировать ответ…Комментировать…
Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос
Оленька
Ученик
(209),
закрыт
9 лет назад
я
Мастер
(1860)
12 лет назад
Уравнение СН4 + 2О2 = СО2 +2Н2О
Для сжигания 1 м3 метана требуется 2 м3 кислорода, а для сжигания 1*0,95=0,95 м3 метана необходимо 0,95м3*2=1,9 м3 кислорода. Кислорода в воздухе содержится 20% или 0,2, поэтому потребуется 1,9м3/0,2=9,5 м3 кислорода
