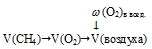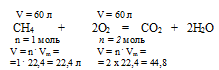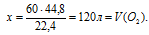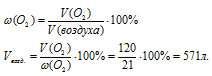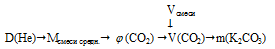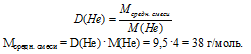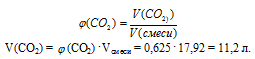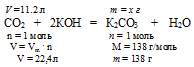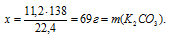помогите понять как решать такие задачи по химии
Профи
(860),
закрыт
9 лет назад
rafael ahmetov
Высший разум
(122431)
9 лет назад
Полагаю, что задача простейшая, “без подковырок”, и состав газа приведен в объемных процентах. Тогда смесь содержит 2*0,7=1,4 л этана и по 2*0,15=0,3 л пропана и этилена.
Уравнения сгорания:
С2Н6 + 3,5 О2 —–> 2 СО2 + 3 Н2О,
С3Н8 + 5 О2 —–> 3 СО2 + 4 Н2О,
С2Н4 + 3 О2 —–> 2 СО2 + 2 Н2О.
Мы видим, что на сжигание 1 моль этана нужно 3,5 моль кислорода, на сжигание 1 моль пропана – 5 моль кислорода, и на сжигание 1 моля этилена – 3 моля кислорода. Если газы рассматривать как идеальные, то при нормальных условиях объемные соотношение равны мольным.
Тогда на сжигание 1 л этана нужно 3,5 л кислорода, на сжигание 1 л пропана – 5 л кислорода, и на сжигание 1 л этилена – 3 л кислорода.
Суммарный объем кислорода 1,4*3,5+0,3*5+0,3*3=7,3 л.
$$$LEAD$$$
Мыслитель
(7041)
9 лет назад
Вначале пишется уравнение реакции полного сгорания газа, затем освежается в памяти определение понятия “моль” и числа Авогадро. Дальше остаётся лишь математическое вычисление.
В
воздухе содержатся различные газы: азот, кислород, углекислый газ, благородные
газы, водяные пары и другие.
Для
того, чтобы количественно выразить состав смеси газов, используют величину,
которую называют «объёмной долей газов в смеси».
Объёмная
доля газа – это отношение объёма данного газа к общему объёму
смеси.
Объёмная
доля обозначается буквой φ (фи). Объёмная доля газа показывает, какую
часть общего объёма смеси занимает данный газ.
Доказано,
в 100 л воздуха 78 л азота, 21 л кислорода, 0,03 л углекислого газа и 0,97 л
благородных газов. Если нужно найти объёмные доли этих газов в воздухе, то
следует объём каждого газа разделить на объём воздуха. Получается, что в
воздухе содержится 78 % азота, 21 % кислорода, 0,03 % углекислого газа и 0,97 %
благородных газов. Сумма всех объёмных долей газов в смеси равна 1, или 100 %.
В
воздухе, который мы выдыхаем, содержится только 16 % кислорода, а содержание
углекислого газа увеличивается до 4 %. Поэтому помещения,
в которых много людей, нужно постоянно проветривать.
В
задачах чаще необходимо искать объём газа по известной объёмной доле этого
газа. Например, найдём объём кислорода в 300 л воздуха. Зная, что объёмная доля
кислорода в воздухе равна 21 %, нужно 300 умножить на 0,21, и мы получим 63 л.
Таким образом, в 300 л воздуха содержится 63 л кислорода.
Учитывая
то, что объёмная доля аргона в воздухе равна 0,9 %, найдём объём воздуха,
который необходим для получения 7 л аргона. В условии задачи даны объём аргона
и его объёмная доля в водухе. Найти нужно объём
воздуха. Для этого 7 л разделим на 0,009.
Найдём
объёмную долю каждого газа, если смешали 4 л кислорода и 5 л углекислого газа.
Объём смеси равен сумме объёмов двух газов – кислорода и углекислого газа.
Чтобы
найти объёмную долю кислорода в смеси, нужно 4 л разделить на 9 л. Получаем
0,44, или 44 %. Для того, чтобы определить процентное содержание углекислого
газа в смеси, необходимо от 100 % вычесть 44 %. Получим 56 %.
Ребята, как мне нравится ваша реакция на мои статьи! Это что-то! Раньше я даже не подозревала, что буду получать удовольствие от написания статей, а еще большее удовольствие – от вашей реакции на них. В цирк ходить не нужно. Правда, пишут в комментариях мало, боятся попасться мне на зубок. Правильно боятся. Нехороший комментарий включает во мне дух воина-победителя, который издает боевой крик “Давай играть, как будто я голодная гиена, а ты – кость!” Дальше я за себя не отвечаю… Моим почитателям лучше не знать, чем такая игра заканчивается. А недруги до сих пор раны зализывают и, давясь слезами, фанатично читают мои статьи, издавая нервное икание.
Пишут мало, зато звонят много. И утром звонят, и днем звонят, и вечером звонят. Многие вполне нормальные вопросы задают, знакомятся и получают на свои вопросы вполне нормальные ответы. Но есть такие… Я же говорю, в цирк можно не ходить – развлекают прямо дома, за чашечкой кофе, бесплатно. Настоящее реалити-шоу! Народ не знает, что у меня на телефоне стоит программа-диктофон. Пишет все разговоры. И номер телефона тоже высвечивается. Обязательно помещу эти разговоры на YouTube и дам ссылку на Яндекс Дзен. Читайте мои статьи, и вы тоже услышите много чего интересного! Кстати, тех, кто дочитает статью до конца, ждет очень интересный подарок “На закуску”!
А теперь – к основной теме статьи. Я обещала рассказать хайповый прикол 28-го задания ЕГЭ? Выполняю обещание. Только не спрашивайте, откуда я это знаю – сорока на хвосте принесла и на ушко нашептала. Согласно “Спецификации контрольных измерительных материалов для проведения в 2019 году единого государственного экзамена по ХИМИИ” (серьезный документ ФИПИ), 28-е задание в проверяемые элементы содержания включает “Расчеты объемных отношений газов при химических реакциях. Расчеты по термохимическим уравнениям”. Сегодня речь пойдет только о реакциях с газами (термохимию рассмотрим позже). До 2018 года задачи 28-го задания были несложными. Давайте вспомним:
Задание 28
Рассчитайте объем воздуха, необходимый для сжигания 1,4 л этилена. Считать объемную долю кислорода в воздухе равной 21%.
Задачу решаем стандартно, по Четырем Заповедям.
1) Первая Заповедь. Выписать данные задачи в разделе “Дано”
2) Вторая Заповедь. Написать уравнение реакции
3) Третья Заповедь. Сделать предварительные расчеты по данным условия задачи и по уравнению реакции. По уравнению реакции определяем объем кислорода.
4) Четвертая заповедь. Составить алгоритм решения задачи. Объем воздуха рассчитываем по формуле объемной доли кислорода в воздухе
Как вы убедились, задача абсолютно легкая. Такого же уровня сложности и все остальные задания 28-й позиции. Но… мы наблюдаем тенденцию ежегодного усложнения заданий ЕГЭ. Я считаю, это абсолютно правильно! Химию сдают будущие медики, которым мы с вами доверим самое дорогое, что у нас есть – наши жизни. Думаю, никто из нас не захочет иметь дело с туповатым врачом, все ищут доктора получше. Потому медицинские ВУЗы стараются отбирать толковых учеников. Как это сделать? На простых заданиях невозможно определить достойный уровень знаний. Сложные задачи – хороший индикатор! Тот, кто хорошо решает задачи по химии, становится отличным врачом-диагностом (доказано на армии моих самых любимых учеников). Для повышения уровня знаний и мастерства будущих медиков (и не только) раскрываю великую тайну – новые приколы 28-го задания ЕГЭ. Почему множественное число? Потому что их, как минимум, четыре:
1) Расчеты по уравнениям реакции горения смеси газов, состав которой нужно определить предварительно
2) Определение объемного состав смеси по продуктам сжигания (задачи на уравнения с двумя неизвестными)
3) Определение состава смеси газообразных продуктов, если в условии избыток-недостаток, степень превращения или выход реакции
4) Задачи на изменение объема газовой смеси в процессе реакции
Каждый алгоритмический прием (прикол, фишку) я опишу в отдельной статье, с подробным глубоким анализом соответствующих задач. Сегодня мы разложим по полочкам первое гипотетическое нововведение “Расчеты по уравнениям реакции горения смеси газов, состав которой нужно определить предварительно”. Итак, поехали!
Прежде чем вы приступите к изучению новых алгоритмических приемов 28-го задания, настоятельно рекомендую внимательно прочитать статью “Секретная шпаргалка по химии. 4.2. Состав смеси газов”, в котороя я рассказала о газовых смесях, плотности газа (абсолютной и относительной), средней молярной массе смеси газов, разложила по полочкам алгоритмы решения задач на определение средней молярной массы и плотности газа по компонентам газовой смеси и наоборот.
Задание 28*(1)
Рассчитайте объем воздуха, необходимый для сжигания 20 л смеси СО и Н2 (н.у.). Плотность этой смеси по аммиаку – 1,2.
Решаем задачу с применением Четырех Заповедей (шагов). Каждое выполненное действие обводится зеленым овалом.
1) Первая Заповедь. Выписать данные задачи в разделе “Дано”.
2) Вторая заповедь. Написать уравнение реакции.
В задаче протекает две реакции. При написании реакций, не забываем делать отступ над каждой – для дальнейших расчетов.
3) Третья заповедь. Сделать предварительные расчеты
В задачах со смесями газов, предварительные расчеты связаны с определением состава смеси и объема каждого газа в смеси. Состав смеси газов определяем стандартно, по формуле расчета средней молярной массы. вначале рассчитываем значение средней молярной массы по относительной плотности
Затем, по основной формуле составляем уравнение и решаем его
Определяем объем каждого газа в смеси по расчитанным объемным долям и делаем расчеты по уравнению реакции
4) Четвертая заповедь. Составить алгоритм решения задачи.
Алгоритм решения составляем по вопросу задачи: “Рассчитайте объем воздуха…” Объем воздуха расчитывают по объему кислорода и объемной доле кислорода в воздухе. Вначале определяем общий объем кислорода, который был затрачен на сжигание газов
Затем, по формуле объемной доли определяем объем воздуха
Решим еще несколько задач с новым алгоритмическим приемом “Расчеты по уравнениям реакции горения смеси газов, состав которой нужно определить предварительно”.
Задание 28*(2)
Плотность по водороду смеси метана и угарного газа равна 10. Вычислите объем кислорода (н.у.), который израсходуется на сжигание 5 моль исходной смеси.
Задание 28*(3)
Рассчитайте объем воздуха (н.у.), необходимый для сжигания 4 л эквимолярной смеси метана и угарного газа. Вычислите плотность исходной смеси по аммиаку.
Задание 28*(4)
Вычислите плотность по водороду смеси пропана и метана, если известно, что смесь содержит 40% метана по объему. Какой объем кислорода израсходуется на сжигание 20 л смеси?
Обещанный подарок “На закуску” – задача на газы моего самого любимого автора И.Ю. Белавина. Решайте и наслаждайтесь! “Мама, вытри слезы, а иначе быть беде. Глупые вопросы – что я делаю и где? Пропадаю я – Белавина решаю я!”
И.Ю. Белавин, 2005, задача 206
Избыток кислорода смешали с триметиламином, подожгли, и продукты сгорания привели к нормальным условиям. Определите объемные составы исходной и конечной газовых смесей (в литрах), если известно, что масса исходной газовой смеси оказалась на 8,1 г, а объем на 63,7 % больше массы и объема конечной газовой смеси соответственно. (Ответ: Исходная смесь – V((CH3)3N) = 2,24л; V(О2) = 13,6 л. Конечная смесь – V(СО2) = 6,72 л; V(N2) = 1,12 л; V(О2) = 1,84 л.)
Если вы так ничего и не поняли, не отчаивайтесь. Приходите ко мне на занятия – и вы подготовитесь к любой форме экзамена (ЕГЭ, ДВИ, олимпиада) и сдадите его с максимально высоким баллом!
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий, теоретического материала и познакомитесь с моими учениками.
Полный каталог статей репетитора Богуновой В.Г. вы найдете на странице сайта Статьи репетитора
Подписывайтесь видео-канал Репетитор по химии и биологии. Ежедневно появляются новые вебинары, видео-уроки, видео-консультации, видео-решения заданий ЕГЭ.
Репетитор по химии и биологии кбн В.Богунова
Расчеты по химическим уравнениям с участием газовых смесей
Задача 8.
Определите объем воздуха (н.у.) необходимый для полного сгорания 60 л (н.у.) метана (СН4).
Дано:
объем (н.у.) сгоревшего метана: V(СН4) = 60 л.
Найти:
объем (н.у.) расходовавшегося воздуха: Vвозд. = ?
Решение:
Данных, представленных в условии, явно недостаточно для решения задачи. Нам необходимо дополнительно знать количественный состав воздуха1.
В данном случае в реакции горения метана принимает участие только кислород. Все остальные компоненты представляют собой неактивные примеси. Записываем уравнение реакции:
СН4 + 2О2 = СО2 + 2Н2О
Алгоритм решения можно представить следующим образом:
1. По уравнению горения определим объем кислорода, необходимого для сгорания 60 л метана.
Составим пропорцию:
для сгорания 60 л (СН4) необходимо х л (О2) (по условию)
для сгорания 22,4 л (СН4) необходимо 44,8 л (О2) (по уравнению)
Можно было также найти объем кислорода по закону объемных отношений.
2. Используя дополнительную информацию о содержании кислорода в воздухе, определяем объем воздуха:
Ответ: 571 л воздуха (н.у.) потребуется для полного сгорания 60 л (н.у.) метана.
Задача 9.
Смесь азота и углекислого газа объемом 17,92 л (н.у.) пропустили через избыток раствора гидроксида калия. Определите массу образовавшейся соли, если относительная плотность исходной смеси газов по гелию была 9,5.
Дано:
объем газовой смеси: Vсмеси = 17,92 л;
относительная плотность смеси газов по гелию: D(Не) = 9,5.
Найти:
массу образовавшейся соли: mсоли = ?
Решение:
В данной смеси газов с гидроксидом калия взаимодействует только углекислый газ. Азот же является неактивной примесью. При избытке КОН в результате реакции получается средняя соль К2СО3:
CО2 + 2КОН = К2СО3 + Н2О
Для определения массы образовавшейся соли нам необходимо по относительной плотности смеси газов найти количество СО2 в исходной смеси газов.
Алгоритм решения можно представить следующим образом:
1. Определим среднюю молярную массу смеси газов.
2. Определяем объемную долю СО2 в смеси.
Мсредн. смеси = М(СO2) . (СO2) + M(N2) . (N2)
(N2) = 1 – (СО2) (в долях от 1).
Мсредн. смеси = М(СO2) . (СO2) + M(N2) . (1 – (СО2))
Подставляем все известные значения:
38 = 44 . (СO2+ 28(1 – (СO2))
Решая это уравнение, получим (СO2) = 0,625.
3. Используя значение общего объема смеси газов, определяем объем (СО2).
4. По уравнению реакции определяем массу полученной соли:
Составим пропорцию:
11,2л СО2 дают х г К2СO3 (по данным условия)
22,4 л СО2 дают 138 г К2СО3 (по уравнению)
Ответ: = m(К2СО3) = 69 г.
Комментарии:
1 В условиях большинства задач с использованием воздуха его состав не указывается. Предполагается что решающий должен знать качественный и количественный состав воздуха либо хотя бы содержание в нем активного компонента, чаще всего кислорода.
Рассчитать объем кислорода.
Рассчитать объем кислорода (газа) при нормальных условиях, если известна его масса, можно по формуле: V = m · Vm / M = ν · Vm. Рассчитать объем кислорода (газа), если известна его масса, температура и давление, можно по формуле: V = m · R · T / (p · M) = ν · R · T / p.
Химическая формула кислорода O₂.
Расчет объема кислорода (газа)
Теория расчета объема газа
Пример: Рассчитайте объем для 1 кг кислорода, для 160 г кислорода, для 6 г кислорода
Пример: Рассчитайте объем для 2 моль кислорода, для 3 моль кислорода, для 5 моль кислорода
Рассчитать объем газа: азота, водорода, воздуха, гелия, озона, кислорода, углекислого газа, хлора
Рассчитать объем кислорода (газа) при нормальных условиях:
Рассчитать объем кислорода (газа):
Теория:
Рассчитать объем кислорода (газа) при нормальных условиях, если известна его масса, можно по формуле:
V = m · Vm / M = ν · Vm,
где
V – объем газа, л,
ν – количество вещества, моль,
Vm – молярный объем газа, л/моль, Vm = 22,4 л/моль,
ν = m / M,
m – масса газа, г,
М – молярная масса газа, г/моль,
M(О₂) = 2·16 = 32 г/моль,
Нормальные условия: 0 оС (или 273,15 К), 101,325 кПа или 1 атм.
Рассчитать объем кислорода (газа), если известна его масса, температура и давление, можно по формуле:
V = m · R · T / (p · M) = ν · R · T / p,
где
V – объем газа, л,
ν – количество вещества, моль,
ν = m / M,
m – масса газа, г,
М – молярная масса газа, г/моль,
M(О₂) = 2·16 = 32 г/моль,
R – универсальная газовая постоянная, R ≈ 8,314 Дж/(моль⋅К),
T – термодинамическая температура, К.
P – давление, кПа.
Пример: Рассчитайте объем для 1 кг кислорода, для 160 г кислорода, для 8 г кислорода:
Рассчитайте объем для 1 кг кислорода при нормальных условиях.
V = m · Vm / M = 1 000 грамм · 22,4 л/моль / 32 г/моль = 700 литров.
Рассчитайте объем для 1 кг кислорода при 30 градусах Цельсия (303,15 К), давлении 30 кПа.
V = m · R · T / p · M = 1 000 грамм · 8,314 Дж/(моль⋅К) · 303,15 К / (30 кПа · 32 г/моль) = 2 625,405 литров или 2,625405 м3.
Рассчитайте объем для 160 г кислорода при нормальных условиях.
V = m · Vm / M = 160 грамм · 22,4 л/моль / 32 г/моль = 112 литров.
Рассчитайте объем для 160 г кислорода при 30 градусах Цельсия (303,15 К), давлении 30 кПа.
V = m · R · T / p · M = 160 грамм · 8,314 Дж/(моль⋅К) · 303,15 К / (30 кПа · 32 г/моль) = 420,064 литров.
Рассчитайте объем для 8 г кислорода при нормальных условиях.
V = m · Vm / M = 8 грамм · 22,4 л/моль / 32 г/моль = 5,6 литров.
Рассчитайте объем для 8 г кислорода при 30 градусах Цельсия (303,15 К), давлении 30 кПа.
V = m · R · T / p · M = 8 грамм · 8,314 Дж/(моль⋅К) · 303,15 К / (30 кПа · 32 г/моль) = 21,003 литра.
Пример: Рассчитайте объем для 2 моль кислорода, для 3 моль кислорода, для 5 моль кислорода:
Рассчитайте объем для 2 моль кислорода при нормальных условиях.
V = ν · Vm = 2 моль · 22,4 г/моль = 44,8 литров.
Рассчитайте объем для 2 моль кислорода при 30 градусах Цельсия (303,15 К), давлении 30 кПа.
V = ν · R · T / p = 2 моль · 8,314 Дж/(моль⋅К) · 303,15 К / (30 кПа) = 168,025 литров.
Рассчитайте объем для 3 моль кислорода при нормальных условиях.
V = ν · Vm = 3 моль · 22,4 г/моль = 67,2 литров.
Рассчитайте объем для 3 моль кислорода при 30 градусах Цельсия (303,15 К), давлении 30 кПа.
V = ν · R · T / p = 3 моль · 8,314 Дж/(моль⋅К) · 303,15 К / (30 кПа) = 252,038 литра.
Рассчитайте объем для 5 моль кислорода при нормальных условиях.
V = ν · Vm = 5 моль · 22,4 г/моль = 112 литров.
Рассчитайте объем для 5 моль кислорода при 30 градусах Цельсия (303,15 К), давлении 30 кПа.
V = ν · R · T / p = 5 моль · 8,314 Дж/(моль⋅К) · 303,15 К / (30 кПа) = 420,064 литров.
Рассчитать объем газа: азота, водорода, воздуха, гелия, озона, кислорода, углекислого газа, хлора
Коэффициент востребованности
4 147