Нахождение объема раствора серной кислоты через молярную концентрацию
Какой объем 96-процентного раствора серной кислоты (H2SO4) плотностью 1,84 г/мл потребуется для приготовления 3 литров раствора с концентрацией 2 моль/л?
Решение задачи
Найдем сколько серной кислоты (H2SO4) (в г) потребуется для приготовления 3 л раствора с молярной концентрацией 2 моль/л. Для расчета будем использовать формулу нахождения молярной концентрации раствора:
![]()
где:
CM – молярная концентрация раствора;
n – химическое количество растворенного вещества;
M – молярная масса растворенного вещества;
m – масса растворенного вещества;
V – объем раствора.
Напомню, что под молярной концентрацией понимают количество (число моль) данного вещества, содержащегося в единице объема раствора. Молярную концентрацию выражают в моль/л или используют сокращение «M».
Из вышеуказанной формулы выразим и рассчитаем массу растворенного вещества:
![]()
Учитывая, что молярная масса серной кислоты (H2SO4) равна 98 г/моль, получаем:
m (H2SO4) = 2 моль/л ∙ 98 г/моль ∙ 3 л = 588 (г).
Используя формулу нахождения массовой доли растворенного вещества:
![]()
выразим массу раствора серной кислоты (H2SO4):
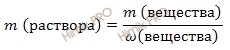
Получаем:
m (раствора H2SO4) = 588 г/ 0,96 = 612,5 (г).
Если раствор 96-процентный, то массовая доля серной кислоты (H2SO4) в нем 0,96.
Вычислим объем раствора серной кислоты (H2SO4), который потребуется для приготовления 3 л раствора с молярной концентрацией 2 моль/л. Будем использовать формулу, устанавливающую связь между объемом и массой раствора:
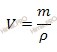
Получаем:
V (раствора H2SO4) = 612,5 г /1,84 г/мл = 332,88 (мл).
Ответ: объем раствора серной кислоты равен 332,88 мл.
Алгоритм расчета объема исходного раствора кислоты
1. Найти,
сколько моль эквивалентов кислоты
необходимо для приготовления заданного
раствора по формуле:
экв.
(кислоты)
= Vр-ра·СN
,
где:
Vр-ра
– объем раствора, в литрах, который надо
приготовить;
СN
– нормальная концентрация заданного
раствора.
2. Найти
массу данного количества эквивалентов
кислоты по формуле:
m
= экв.·МЭ
,
где:
МЭ
– молярная масса эквивалента кислоты.
МЭ(HCl)
= M/1
= 36.5 г/моль; МЭ(H2SO4)
= M/2
= 49 г/моль.
3. Найти, в какой
массе исходного раствора содержится
нужная Вам масса кислоты:
![]()
где:
– массовая доля кислоты в исходном
растворе.
4. Найти
объем исходного раствора по формуле:
![]() ,
,
где:
– плотность, определенная экспериментально
с помощью ареометра.
Определение точной концентрации кислоты методом титрования
Определение
концентрации раствора кислоты, основанное
на реакции нейтрализации, выполняется
следующим образом:
1. Чисто вымытую бюретку
установите вертикально в зажиме штатива
и ополосните ее несколькими миллилитрами
того раствора кислоты, который будет
затем наливаться в бюретку.
2. Налейте
в бюретку приготовленный раствор кислоты
и установите уровень жидкости на нулевом
делении, считая по нижнему мениску,
уберите воронку из бюретки. Следите,
чтобы кончик бюретки был заполнен
раствором и не содержал пузырьков
воздуха.
3. Ополосните
чистую пипетку раствором щелочи известной
концентрации, отмерьте ею 10 мл раствора
и вылейте его в коническую колбочку,
прибавив туда 1-2 капли индикатора
метилоранжа.
4. Поместите
колбочку с раствором щелочи под бюретку
и приливайте постепенно раствор кислоты
из бюретки в колбочку до нейтрализации
раствора щелочи, то есть до изменения
цвета раствора от желтого до слаборозового.
Прибавляйте раствор в колбу небольшими
порциями при непрерывном перемешивании.
Изменение окраски раствора должно
произойти от прибавления одной лишней
капли раствора кислоты. После этого
отмерьте уровень жидкости в бюретке,
считая по нижнему
мениску. Титрование повторите 3 раза.
Отклонение результатов отдельных
титрований не должно превышать 0.2 мл
(данные с большим отклонением в расчет
не принимать).
Результаты
занесите в таблицу:
|
№ опыта |
Объем |
Объем |
По
результатам титрования вычислите
нормальность кислоты. Для растворов
нормальной концентрации существует
соотношение, вытекающее из закона
эквивалентов:
![]() ,
,
где:
V1 –
объем раствора щелочи известной
концентрации:
![]() – нормальность раствора щелочи;
– нормальность раствора щелочи;
V2 –
объем исследуемого раствора кислоты;
![]() – нормальность исследуемого раствора
– нормальность исследуемого раствора
кислоты.
Из
приведенного равенства легко подсчитать
нормальную концентрацию исследуемого
раствора:
![]() .
.
Лабораторная работа «Изучение зависимости скорости химических реакций от различных факторов. Химическое равновесие»
Опыт
№ 1 Зависимость скорости химической
реакции от концентрации реагирующих
веществ
Налейте
в четыре стаканчика следующие растворы:
1)
10 мл 0.1 М раствора тиосульфата
натрия + 30 мл воды;
2)
20 мл 0.1 М раствора тиосульфата
натрия + 20 мл воды;
3)
30 мл 0.1 М раствора тиосульфата
натрия + 10 мл воды;
4)
40 мл 0.1 М раствора тиосульфата
натрия.
Последовательно
в каждый стаканчик прилейте по 10 мл
0.05 М раствора кислоты. Отметьте с
помощью секундомера промежуток времени
от момента сливания растворов до
появления мути, вызванной началом
выпадения в осадок серы, в соответствии
с уравнением:
Na2S2O3
+ H2SO4
Na2SO4
+ SO2
+ S
+ H2O.
Вычислите
относительную скорость реакции по
формуле:
![]() ,
,
где
– время (по секундомеру), в секундах.
Результаты
занесите в таблицу:
|
№ опыта |
Объем |
Объем натрия (мл) |
Объем воды (мл) |
Общий |
Молярная |
Время
в |
Относительная
реакции |
Найденную
зависимость скорости от концентрации
изобразите графически, отложив по оси
абсцисс концентрацию тиосульфата, а по
оси ординат – относительную скорость.
Сделайте вывод.
Опыт
№ 2 Зависимость скорости реакции от
температуры.
Налейте
в стаканчик 10 мл 0.1 М раствора
тиосульфата натрия. Прилейте к нему при
комнатной температуре 10 мл 0.05 М
раствора серной кислоты. Определите с
помощью секундомера время прохождения
реакции (аналогично опыту 1). Второй
опыт проведите аналогично, но при
температуре, на 10С
выше комнатной. Для этого стаканчики с
растворами нагрейте на водяной бане,
контролируя температуру воды термометром
(следует выдержать растворы не менее 5
минут).
Сделайте
вывод о влиянии температуры на скорость
реакции.
Опыт
№ 3 Влияние катализатора на скорость
химической реакции.
В
две пробирки налейте по 5 мл 3%‑ного
раствора перекиси водорода. В одну из
них поместите несколько кристалликов
оксида марганца(IV). Качественно сравните
скорость реакции разложения перекиси
в этих пробирках:
2H2O2
= 2H2O
+ O2.
Какую
роль играет оксид марганца(IV)?
Опыт
№ 4 Влияние величины поверхности на
скорость гетерогенной химической
реакции.
Уравновесьте
на весах маленький кусочек мрамора и
порошкообразный мрамор. Приготовьте
две пробирки с равными объемами растворов
соляной кислоты (2-3 мл). Одновременно
стряхните с бумажек кусочек мрамора в
одну пробирку, порошок – в другую.
Отметьте с помощью секундомера время
окончания реакций в обеих пробирках.
Сделайте вывод о влиянии величины
поверхности на скорость реакции.
Опыт № 5
Смещение химического равновесия.
Налейте
в стакан 15 мл 0.1 N
раствора хлорида железа(III) и такой же
объем 0.1 N
раствора роданида калия. Обратите
внимание на появление красной окраски
при смешении растворов. Напишите
уравнение реакции.
Полученный
раствор разделите поровну в 4 пробирки.
В первую пробирку добавьте несколько
капель концентрированного раствора
хлорида железа(III), в другую – несколько
капель концентрированного раствор
роданида калия. В третью пробирку
добавьте щепотку кристаллического
хлорида калия. Четвертую пробирку
оставьте для сравнения.
Дайте
объяснение различной интенсивности
окраски растворов в пробирках. Напишите
выражения константы химического
равновесия данной реакции.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Помогите найти объем кислоты)
Профи
(866),
закрыт
7 лет назад
jane
Высший разум
(406775)
7 лет назад
CaCO3+2HCl=CaCl2+CO2+H2O (1)
Са (ОН) 2+2HCl=CaCl2+2H2O (2)
n(CO2)=V/Vm=1,4/22,4=0,0625 моль
n(HCl)=2n(CO2) – по уравн. реакции (1) =0,125 моль
n(CaCO3)=n(СО2) – по уравнению реакции (1)
m(CaCO3)=n*M=0,0625*100=6,25 г
тогда масса смеси m=6,25/0,45=13,9 г
m(Ca(OH)2)=13,9-6,25=7,65 г
n(Ca(OH)2)=7,65/74=0,1 моль
n(HCl)=2n(Ca(OH)2- по ур. реакции (2) =0,2 моль
m(HCl)=n*M=(0,125+0,2)*36,5=11,86 г
V=11,86/1,2=9,9 мл
Основные формулы для решения задач по химии
05-Авг-2012 | комментариев 450 | Лолита Окольнова
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)

обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов). Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Несколько миллионов. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества. Обозначается как M
Есть еще молекулярная масса — Mr
Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 гмоль.
Вторая необходимая формула для решения задач —
формула массы вещества:
![]()
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
![]()
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=mM
n=V22.4 (лмоль)
Масса вещества m (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (лмоль)
или вот еще удобная табличка:

Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
В ОГЭ и ЕГЭ по химии задач , в которых нужно было бы найти только объем массу кол-во моль нет — это обычно ЧАСТЬ решения задачи. Однако, чтобы легко решать более сложные задачи, нужно тренироваться на таких вот небольших упражнениях.
Находим количество вещества по массе
1 Какое количество вещества алюминия содержится в образце металла массой 10.8 г?2 Какое количество вещества содержится в оксиде серы (VI) массой 12 г?
3 Определите количество моль брома, содержащееся в массе 12.8 г.
Находим массу по количеству вещества:
4. Определите массу карбоната натрия количеством вещества 0.25 моль.Объем по количеству вещества:
5. Какой объем будет иметь азот при н.у., если его количество вещества 1.34 моль?6. Какой объем занимают при н.у. 2 моль любого газа?
Ответы:/p>
- 0.4 моль
- 0.15 моль
- 0.08 моль
- 26.5 г
- 30 л
- 44.8 л
Категории:
|
Обсуждение: “Основные формулы для решения задач по химии”
(Правила комментирования)
Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
Для расчета массы (объема, количества вещества) продукта реакции, если данные по одному из веществ представлены в виде раствора с определенной массовой долей этого растворенного вещества, следует воспользоваться нижеследующим алгоритмом:
1) Прежде всего следует найти массу растворенного вещества. Возможны две ситуации:
* В условии даны масса раствора и массовая доля растворенного вещества (концентрация). В этом случае масса растворенного вещества рассчитывается по формуле:
* В условии даны объем раствора вещества, плотность этого раствора и массовая доля растворенного вещества в этом растворе. В таком случае следует воспользоваться формулой для расчета массы раствора:
После чего следует рассчитать массу растворенного вещества по формуле 1.
2) Рассчитать количество вещества (моль) участника реакции, масса которого стала известна из расчетов выше. Для этого воспользоваться формулой:
3) Записать уравнение реакции и убедиться в правильности расставленных коэффициентов.
4) Рассчитать количество моль интересующего участника реакции исходя из известного количества другого участника реакции, зная, что количества веществ любых двух участников реакции A и B относятся друг к другу как коэффициенты перед этими же веществами в уравнении реакции, то есть:
Если в условии требовалось рассчитать количество вещества, то действия на этом заканчиваются. Если же требуется найти его массу или объем, следует переходить к следующему пункту.
5) Зная количество вещества, определенное в п.4, мы можем рассчитать его массу по формуле:
Также, если вещество является газообразным и речь идет о нормальных условиях (н.у.), его объем может быть рассчитан по формуле:
Рассмотрим пару примеров расчетных задач по этой теме.
Пример 1
Рассчитайте массу осадка, который образуется при добавлении к 147 г 20%-ного раствора серной кислоты избытка раствора нитрата бария.
Решение:
1) Рассчитаем массу чистой серной кислоты:
m(H2SO4) = w(H2SO4) ∙ m(р-ра H2SO4)/100% = 147 г ∙ 20% /100% = 29,4 г
2) Рассчитаем количество вещества (моль) серной кислоты:
n(H2SO4) = m(H2SO4) / M(H2SO4) = 29,4 г/98 г/моль = 0,3 моль.
3) Запишем уравнение взаимодействия серной кислоты с нитратом бария:
H2SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3
4) В результате расчетов стало известно количество вещества серной кислоты. Осадок представляет собой сульфат бария. Зная, что:
n(BaSO4)/n(H2SO4) = k(BaSO4)/k(H2SO4), где n — количество вещества, а k — коэффициент в уравнении реакции,
можем записать:
n(BaSO4) = n(H2SO4) ∙ k(H2SO4)/k(BaSO4) = 0,3 моль ∙ 1/1 = 0,3 моль
5) Тогда масса осадка, т.е. сульфата бария, может быть рассчитана следующим образом:
m(BaSO4) = M(BaSO4) ∙ n(BaSO4) = 233 г/моль ∙ 0,3 моль = 69,9 г
Пример 2
Какой объем газа (н.у.) выделится при растворении необходимого количества сульфида железа (II) в 20%-ном растворе соляной кислоты с плотностью 1,1 г/мл и объемом 83 мл.
Решение:
1) Рассчитаем массу раствора соляной кислоты:
m(р-ра HCl) = V(р-ра HCl) ∙ ρ(р-ра HCl) = 83 мл ∙ 1,1 г/мл = 91,3 г
Далее рассчитаем массу чистого хлороводорода, входящего в состав кислоты:
m(HCl) = m(р-ра HCl) ∙ w(HCl)/100% = 91,3 г ∙ 20%/100% = 18,26 г
2) Рассчитаем количество вещества хлороводорода:
n(HCl) = m(HCl)/M(HCl) = 18,26 г/36,5 г/моль = 0,5 моль;
3) Запишем уравнение реакции сульфида железа (II) с соляной кислотой:
FeS + 2HCl = FeCl2 + H2S↑
4) Исходя из уравнения реакции следует, что количество прореагировавшей соляной кислоты с количеством выделившегося сероводорода связано соотношением:
n(HCl)/n(H2S) = 2/1, где 2 и 1 — коэффициенты перед HCl и и H2S соответственно
Следовательно:
n(H2S) = n(HCl)/2 = 0,5/2 = 0,25 моль
5) Объем любого газа, находящегося при нормальных условиях, можно рассчитать по формуле V(газа) = Vm ∙ n(газа), тогда:
V(H2S) = Vm ∙ n(H2S) = 22,4 л/моль ∙ 0,25 моль = 5,6 л
Автор: С.И. Широкопояс https://scienceforyou.ru/
