|
3 |
|
|
как рассчитать обьем (не площадь поверхности) колокола? То есть какой обьем СО2 можно заправить в колокол один раз в день, без тестов, подсчета пузырьков и распыления? Скажем, для аквариума 10 или 100л? Изменено 16.2.11 автор encaps |
|
|
16/02/2011 17:07:03 |
|
Свой на Aqa.ru 5271 |
|
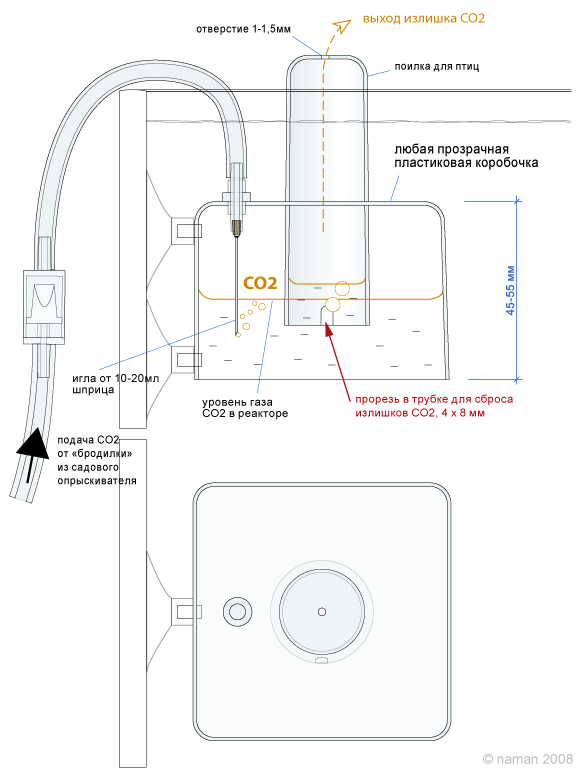
Не стоит заморачиваться этим вопросом, ИМХО. Слишком высокий колокол с объёмом “про запас” малоэффективен и по-любому, приходится делать периодическую дегазацию. Проверено на 15 литрах и на 120 литрах. В 30-литровом маленькая птичья поилка растворяется почти полностью, а вот коробка от дискет – растворяется едва наполовину, то ли там много лишнего, то ли пластик в ней не того цвета. Вот коробка для дискет:
Тоже надеялся, увеличив объём, обеспечить запас – нифига, полный облом. Получилось с точностью до наоборот. Ну и проверка большой бутылки на роль долгоиграющего колокола в 15-литровике также провалилась с треском (об этом сто лет назад делился ощущениями здесь же, на форуме). Вода у меня kH=11-15. Либо что-то делаю капитально не так (не к той стенке аквариума колокол прислоняю?). PS: Если врубаетесь в принцип действия и особенности считывания показаний дропчекера, сказанное мной не должно сильно удивить. |
|
|
16/02/2011 17:50:01 |
|
3 |
|
|
Crossover, |
|
|
16/02/2011 18:37:03 |
|
Tekhi – Юр, когда ты рассказывал про СО2-блондинку, ты обещал рассказать про то, как его через колокол подавать. Расскажешь?
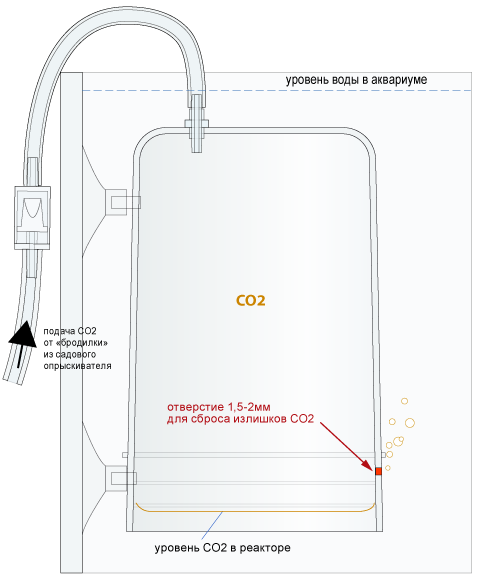
Ю.В. – Без проблем. Для начала- что есть колокол. Его еще называют колпачком. Колокол это пассивный реактор для углекислого газа циклического действия.
Tekhi – Что это значит?
Ю.В. – Это значит, что газ в него закачивается периодически из источника и постепенно сам растворяется. Не принудительно, как в активных реакторах, а сам, постепенно. С одной стороны это хорошо- не нужны дополнительные, часто сложные и дорогостоящие девайсы. С другой- не очень. Сильно концентрацию не поднимешь- до 15, максимум на мягкой воде до 20 мг/л.
Tekhi – Так это ж хорошо- передоза не получишь!
Ю.В. – Ну, да. Но и сильно форсированного травника не получишь. Впрочем, для среднеразогнанного, которых, как правило, большинство, этого достаточно.
Итак, считаем колокол. Мы не берем в расчет начальный период работы колокола, когда мы его только поставили и газа нужно много для выхода на “рабочий” режим. Будем считать уже для “рабочего режима”, когда нам нужно только компенсировать выработанный газ.
По моим наблюдениям, больше чем 5 мг/л за день среднефорсированный травник газу не выедает. Вот эти 5 мг/л и примем за “рабочую гипотезу”- нам их нужно компенсировать с помощью колокола.
Сразу хочу сказать, что этот расчет очень грубый- не учитывает ни выветривание газа, ни добавление его за счет естественных процессов в аквариуме- дыхания рыб и растений, гниения и т.д. Кроме того, он не учитывает исходные параметры аквариумной воды. Поэтому будем его считать за “отправную точку. А дальше ты уже сможешь корректировать свои действия- либо подавать меньше, не полный колпачок, либо подавать больше.
Tekhi – Ок.
Ю.В. – Для начала, проверим, не заработаем ли мы рН стресс при увеличении концентрации СО2 на 5 мг/л за примерно пол-часа (среднее время растворения СО2 из среднестатистического колпачка). Примем среднюю (у большинства) КН воды равную 4 градусам. По калькулятору СО2 при разных исходных рН увеличение концентрации на 5 мг/л приводит к снижению рН от 0,2 до 0,4. В пределах разумного.
Далее расчет ведем исходя из 10л аквариумной воды (именно воды, а не “грязного” объема аквариума).
Повышение концентрации на 5 мг/л обозначает, что в 10л воды мы должны подать 50 мг СО2. Его плотность при атмосферном давлении составляет чуть менее 2 мг/см3. Значит, для подъема концентрации СО2 в аквариуме на 5 мг, нам нужно подать 25 см3 СО2 в каждые 10л воды. Вообще, для удобства расчета, переведу эти цифры в формат “1 мг/л на 1 л”
Для того чтобы поднять концентрацию СО2 в воде на 1 мг/л нужно в среднем на каждый литр аквариумной воды подать 0,5 мл (см3) СО2 при атмосферном давлении.
Tekhi – “В среднем”, это потому что ты не учитывал параметры исходной воды?
Ю.В. – Да. Вот например у меня аквариум на 20л воды “чистыми”. Вода у меня не мягкая- КН 6 и я хочу за один раз утром поднять СО2 на 8 мг/л (это соответствует изменению рН на 0,3- вполне допустимо. Мне на эти 20л нужно
0,5х20х8=80 мл колокольчик))
Tekhi – А как сам колокол лучше делать? Какой формы?
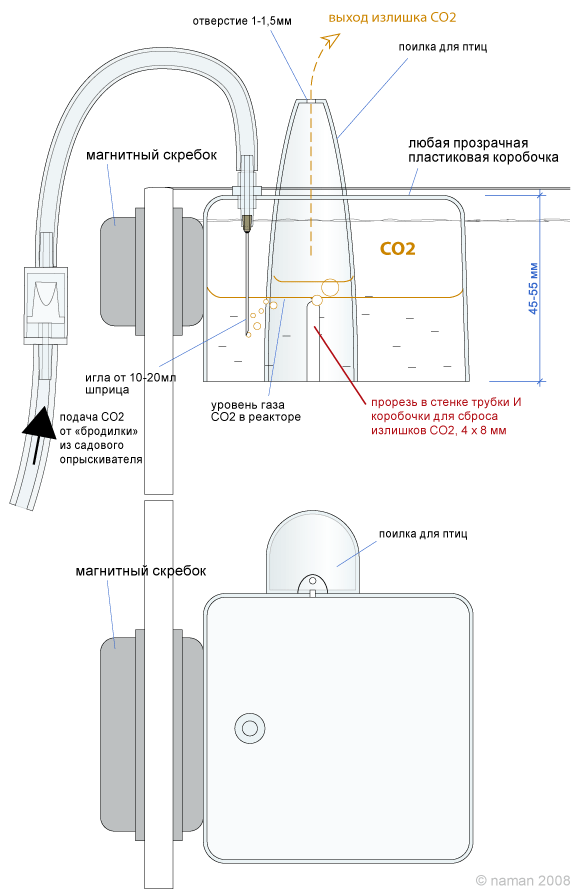
Ю.В. – Ну, для уменьшения скорости растворения газа во избежание резкого снижения рН, площадь зеркала должна быть минимальна. Этому требованию отвечает прямоугольник с большим коэффициентом соотношения длин сторон.
Tekhi – Вытянутый?
Ю.В. – Ну, можно сказать и так))
Для увеличения объема колокола у него должна быть приличная высота (необходимая для одно- или двухкратной в сутки подачи – по твоему желанию. Конечно, удобнее закачать один раз, с утра. Но, при мягкой воде лучше всеж делать это за два раза, с перерывом.
Для удобства контроля уровня газа, он должен быть прозрачным.
Для удобства монтажа, он должен быть на присосках или зажиме.
Для удобства сброса балластных газов (воздуха), всегда имеющегося в СО2 и скапливающегося в колоколе, в нем желателен дополнительный краник.
Ну и он должен быть достаточно эстетичным, чтоб не портить вид аквариума))
В итоге, я для себя принял за оптимум прямую призму из оргстекла.
Tekhi – Покажешь как делал?
Ю.В. – Конечно!
Вначале нарезаем оргстекло по необходимым размерам
Потом клеим его в коробочку.
Клеить лучше либо специальным полистирольным клеем на основе дихлорэтана, либо суперклеем, но обязательно гелевым.
В итоге, получилась такая коробочка
Ее размеры (внутренние, ДШВ) 12х1,5х4 см= 72 см3 Почти 80)) Как раз те, которые я чуть выше насчитал.
Tekhi – А почему стекло матовое?
Ю.В. – Я мелкой шкуркой заматовал заднее и боковые стекла- чтоб было лучше видно уровень газа.
Потом прожигаем отверстие для иголки (через которую газ подается) и высверливаем отверстие для краника сброса балластных газов. Вклеиваем их и приклеиваем присоски.
В общем все)) Осталось только в аквариум установить.
Tekhi – Класс! И что, такого колокола на день хватит?
Ю.В. – Повторяю, расчет был достаточно условный, по месту нужно будет корректировки вносить. Но, я думаю, что по-крупному я угадал))
Tekhi – А еще варианты колоколов покажешь?
Ю.В. – Да без проблем. Вот, например, тебе из коробочки от зубочисток)) Это 40мл, для 10-и литрового наника. В двух вариантах- на присосках и на прищепке))

Tekhi – А какой куда?
Ю.В. – На прищепке удобнее когда его нужно часто снимать и двигать. На присосках менее мобильный, но симпатичнее))
Tekhi – А почему нет краника для сброса воздуха балластного?
Ю.В. – Права)) Надо будет сделать.
Tekhi – А совсем простой, ну, чтоб хоть попробовать как оно будет покажешь?
Ю.В. – Ну, самый простой (проще уже некуда!) из обрезка бутылки с иглой, воткнутой в крышку))
Tekhi – Ясно.
Я правильно понимаю, что использование таких колоколов ограничено наноаквариумами только из-за их размеров?
Ю.В. – В общеем да. Можешь посчитать какого размера должен быть колокол для твоих 180л)) Кроме того, там где нужно СО2 растворять много, с высокими концентрациями, уже нужны активные реакторы или атомайзеры с диффузорами.
Tekhi – А почему в наники их нельзя?
Ю.В. – Ну, атомайзер в наник нельзя потому что для его работы нужен внешний фильтр. А диффузор можно. Но он, в отличие от колокола будет не в верхней, обычно малозаметной, части аквариума, а на виду. Кроме того, диффузор требует постоянного стабильного давления в источнике газа. А колоколу подходят и накопительные типа СО2-блондинки, газводы с иглой и т.д.
Tekhi – Юр, последний вопрос. В каком месте аквариума правильнее устанавливать колокол? Ну, чтоб растворялось лучше. Возле фильтра, на течении?
Ю.В. – Мутный вопрос, Ириш. С т.з. быстрого и более эффективного растворения, конечно лучше на течении. А вот насколько в каждый конкретный момент нужна это быстрота – вопрос. Иногда и не нужно быстрого растворения)))
Tekhi – Ясно. От потребностей, задач и по обстановке.
Спасибо, Юр. Буду пробовать при случае.
Лекция 7 -8.
Тема:
Химический эксперимент по неорганической
химии.
План
1. Техника и методика
демонстрационных опытов по получению
и сбору газов.
2.Техника и методика
демонстрационных опытов по изучению
термической нестойкости простых и
сложных веществ.
3. Техника и методика
проведения экспериментальных опытов
по изучению свойств кислот.
4. Техника и методика
демонстрационных опытов по изучению
электролитов.
5. Техника и методика
опытов по изучению закона сохранения
массы веществ.
6. Техника и методика
проведения занимательных опытов по
химии
по получению,
сбору газов и изучению их свойств.
Опыт
1. Получение
кислорода разложением калий перманганата.
Горение
углерода
в кислороде.
Оборудование:
лабораторный
штатив, пробирки, пробка с газоотводной
трубкой, кристаллизатор с водой, вата,
стеклянная пластинка.
Реактивы:
кристаллический калий перманганат,
древесный уголь.
Ход эксперимента.
Получение кислорода
нагреванием калий перманганата.
Сбор прибора.
Прибор для получения газа состоит из
пробирки и газоотводной трубки. Соберите
прибор. Для этого плотно закройте
пробирку пробкой с газоотводной трубкой,
как бы вкручивая ее.
Проверьте прибор
на герметичность. В невысокую посуду
налейте воды на половину ее объема.
Конец газоотводной трубки опустите в
воду и согрейте пробирку рукой. Если
соединение пробирки, пробки и газоотводной
трубки герметично, то за несколько
секунд из трубки появятся пузырьки
воздуха.
Насыпьте
в пробирку кристаллический порошок
калий перманганата слоем в 1,5-2 см.
Положите
в верхнюю часть пробирки рыхлый комочек
ваты для того, чтобы твердое вещества
во время опыта, распыляясь, не летело
вместе с кислородом. Вата не должна
соприкасаться со всей массой калий
перманганата, иначе при нагревании она
вспыхнет. Закройте пробирку пробкой с
согнутой на конце газоотводной трубкой
и закрепите ее в штативе с помощью лапки.
В кристаллизатор, наполовину заполненный
водой, переверните пробирку с водой
накрытую стеклянной пластинкой, согнутый
конец газоотводной трубки подведите
под пробирку и нагрейте пробирку с калий
перманганатом. Когда пробирка заполнится
кислородом, закройте ее и достаньте с
воды. Конец газоотводной трубки вынимайте
с воды, не прекращая нагревание.
2КМnO4→K2MnO4
+ MnO2
+ O2
Горение
углерода в кислороде.
Возьмите пинцетом
кусочек древесного угля и раскалите
его в пламени. Потом быстро внесите
уголек в стакан с кислородом.
С+
О2→СО2
Наблюдайте горение
уголька ярким пламенем.
Опыт
2.
Состав
воздуха
Оборудование:
стеклянный
колокол, кристаллизатор, крышка от тигля
или фарфоровая чашка, пробка, пробка со
стеклянной трубкой, химический стакан,
лучинка, стеклянная палочка, газоотводная
трубка.
Реактивы:
вода, фосфор,
известковая вода.
Ход
эксперимента:
Стеклянный
колокол размечают на шесть равных по
объему частей. Делают это следующим
образом: колокол закрывают резиновой
пробкой и наполняют водой, объем которой
измеряют переливанием ее в мерный
цилиндр. Далее рассчитывают число
миллилитров, равное 1/6 объема колокола.
Например, объем колокола равен 2,4 л,
значит, 1/6 его объема равна: 2,4л:6 = 0,4 л.
Теперь в колокол наливают найденное
количество миллилитров воды, делая
каждый раз пометку ее уровня при помощи
воскового карандаша или наклеиванием
цветных полосок бумаги, которые покрывают
парафином. Подготовленный стеклянный
колокол ставят в большой кристаллизатор,
открывают резиновую пробку и приливают
в кристаллизатор воды до первого деления.
Колокол вынимают из воды и на ее
поверхность опускают большую корковую
пробку, на которую кладут крышку от
тигля или фарфоровую чашечку с небольшим
количеством фосфора. Фосфора надо брать
столько, чтобы он соединился с кислородом,
находящимся в объеме колокола, примерно
0,25 г на 1 л объема колокола. При очень
большом количестве фосфора сразу
выделяется слишком много теплоты; воздух
сильно расширяется и часть его
пробулькивает через воду. Для поджигания
фосфора сильно накаляют конец стеклянной
палочки, которым дотрагиваются до
фосфора. Горло колокола быстро закрывают
резиновой пробкой (закрыть плотно, чтобы
не проходил воздух!). Колокол постепенно
наполняется белым дымом – фосфор(V)
оксидом, который затем растворяется в
воде. Минут через 10 – 15, когда рассеется
белый дым и охладятся газы под колоколом,
вода поднимется примерно на 1/5 объема
колокола.
Для
исследования оставшихся газов в чашку
наливают воды до ее уровня под колоколом,
что необходимо для предотвращения
затягивания при открывании пробки в
сосуд окружающего воздуха. Далее на
короткое время пробку вынимают, а
содержимое исследуют горящей лучинкой,
которая в нем гаснет. Для доказательства
того, что оставшийся газ – азот, быстрым
движением пробка заменяется другой со
вставленной в нее газоотводной трубкой,
конец которой опускают в стакан с
небольшим количеством известковой
воды. При подливании воды в кристаллизатор
газы, находящиеся под колоколом,
пробулькивают через известковую воду,
но никакого помутнения не наблюдается.
Опыт
3. Получение
водорода. Горение водорода.
Оборудование:
пробирки, горелка, предметное стекло,
тигельные щипцы.
Реактивы:
разбавленная сульфатная или хлоридная
кислота, цинк.
Ход
эксперимента.
В
пробирку на ¼ ее объема наливают
разбавленную кислоту и кладут 3-4 кусочка
цинка. Подождав до вытеснения из нее
воздуха, получающийся водород поджигают.
В оставшейся после реакции жидкости
доказывают присутствие растворенного
цинк сульфата или хлорида, что делают
путем выпаривания капель раствора на
стеклянной пластинке.
При
получении большого количества водорода
для изучения его свойств применяют
приборы, например, аппарат Киппа.
Испытание водорода
на чистоту.
Перед
поджиганием водорода у конца газоотводной
трубки прибора, из которого его получают,
или перед сбором его в цилиндр для
демонстрации горения необходимо
предварительно убедиться в его чистоте.
В противном случае при проведении опыта
может произойти сильный взрыв.
Для
испытания водорода на чистоту им
наполняют пробирку путем вытеснения
воздуха (держать вертикально вверх
дном), которую вдали от прибора подносят
к пламени горелки. Если слышится резкий
взрыв, то это означает, что водород
смешан с воздухом. В этом случае нельзя
поджигать водород непосредственно у
прибора, так как может произойти сильный
взрыв.
Необходимо повторно
испытать водород на чистоту.
Горение
водорода.
Получают и поджигают
проверенный на чистоту водород, пламя
направляют внутрь стакана. Наблюдают
запотевание стенок стакана.
Опыт
4. Получение
карбон (IV)оксида в лаборатории и изучение
его свойств.
Оборудование:
аппарат Киппа, пробирка, лучинка,
химические стаканы, индикаторная бумага,
два химических стакана, свечка.
Реактивы:
мрамор,
раствор
хлоридной кислоты,
вода, лакмус.
Ход
эксперимента.
В
аппарат Киппа кладут мрамор и наливают
раствор хлоридной кислоты (1: 1). Собирают
газ в пробирку или колбу, стоящую вниз
дном.
В
пробирку с собранным карбон (IV) оксидом
вносят горящую лучинку – она затухает.
Взаимодействие
карбон (IV) оксида с водой.
Описание порядка
выполнения опыта:
-
в
стакан наливают воду; -
при
помощи универсального индикатора
определяют рН раствора, водородный
показатель для дистиллированной воды
равен 6; -
пропускают
через воду поток углекислого газа; -
повторно
при помощи универсального индикатора
определяют рН раствора. Цвет индикатора
изменился, рН равен 4; -
при
растворении карбон (IV)
оксида в воде образуется карбонатная
кислота:
CO2
+ H2O
⇆
H2CO3
;
-
при
диссоциации угольной кислоты образуются
ионы гидрогена, которые придают раствору
кислую среду:
H2CO3
⇆
HCO3–
+ H+
HCO3–
⇆
CO32-
+ H+
Переливание
карбон (IV) оксида из стакана в стакан.
На
одном большом химическом стакане
восковым карандашом ставят цифру 1, на
другом – 2. Стакан 1 заполняют карбон
(IV) оксидом путем вытеснения воздуха.
Из стакана 1, словно жидкость, переливают
карбон (IV) оксид в стакан 2. Затем с помощью
горящей лучины убеждаются в том, что
карбон (IV) оксид находится в стакане 2.
Опыт
5. Получение
гидроген хлорида и изучение его свойств.
Оборудование:
колба Вюрца, газоотводная трубка, стакан,
капельная воронка, штатив,
газовая горелка, толстостенная склянка.
Реактивы:
натрий хлорид, концентрированная
сульфатная кислота, вода, синий лакмус,
аргентум (Ι) нитрат.
Ход эксперимента
Получение
гидроген хлорида.
Для
получения гидроген хлорида необходимо
собрать прибор, который состоит из колбы
Вюрца, закрепленной в лапке штатива,
которую закрывают капельной воронкой.
В колбу насыпают 15-20 г натрий хлорида.
Из капельной воронки приливают
концентрированную сульфатную кислоту.
Реакция начинается без нагревания. Для
ускорения ее колбу подогревают. Нужно
следить за тем, чтобы масса реагирующих
веществ несильно пенилась, иначе она
будет переброшена в приемник для
собирания газов. Гидроген хлорид, как
газ более тяжелый, чем воздух, собирают
в сосуд, расположенный отверстием вверх.
Газоотводную трубку опускают до дна
сосуда. Выделение белого тумана у выхода
сосуда показывает, что он заполнился
гидроген хлоридом. Когда необходимый
для опыта сосуд заполнится гидроген
хлоридом, то следует прекратить нагревание
колбы, а конец газоотводной трубки
опустить в колбу с водой, чтобы поглощать
выделяющийся газ. Газоотводную трубку
не следует опускать в воду, ее держат
близко над поверхностью воды, иначе в
случае прекращения выделения гидроген
хлорида вода может быть переброшена в
колбу.
Свойства
гидроген хлорида.
а)
Растворимость гидроген хлорида в воде
очень велика. При комнатных условиях в
1 объеме воды растворяется 500 объемов
гидроген хлорида. Для демонстрации
этого свойства цилиндр с гидроген
хлоридом опускают в чашку с водой. Вода
устремляется в него и почти полностью
его заполняет. Раствор разделяют на две
части. В одну приливают раствор синего
лакмуса или опускают лакмусовую бумажку.
В другую добавляют раствор аргентум
(Ι) нитрата, чтобы доказать наличие
хлоридов. Таким образом, будет
показано, что раствор гидроген хлорида
в воде – это хлоридная кислота.
б)
После выяснения сущности процесса
растворения гидроген хлорида учащимся
может быть продемонстрирован опыт
«фонтан». Для этого большую толстостенную
склянку заполняют гидроген хлоридом и
закрывают хорошо подобранной резиновой
пробкой с газоотводной трубкой,
которую опускают в сосуд с водой,
подкрашенной раствором синего
лакмуса. Конец трубки закрывают под
водой указательным пальцем и, не отнимая
палец, опрокидывают склянку дном вниз.
Встряхивают ее несколько раз так, чтобы
несколько капель воды из газоотводной
трубки попали в склянку (пальцем все
время плотно прижимать отверстие
трубки!). Теперь снова опрокидывают
склянку вверх дном и газоотводную трубку
опускают в сосуд с водой, подкрашенной
синим лакмусом. Под водой отнимают палец
от газоотводной трубки. Вследствие того
что в каплях воды, попавших в склянку
из газоотводной трубки, растворится
много гидроген хлорида, то в склянке
создается разрежение и жидкость под
атмосферным давлением образует фонтан
в колбе. Раствор становится красным.
Опыт можно проводить не только в склянке,
но и в круглодонной толстостенной колбе.
Для опыта нельзя брать тонкостенную
посуду, так как она может быть раздавлена
атмосферным давлением.
Опыт
6. Получение
аммиака в лаборатории. Растворение
аммиака в воде.
Оборудование:
плоскодонная колба, круглодонная колба,
пробирки, пробки с газоотводными
трубками, кристаллизатор, пробки,
горелка, зажим Мора, лабораторный штатив,
фарфоровая чашка.
Реактивы:
нашатырный спирт, аммоний хлорид, кальций
гидроксид, фенолфталеин, вода.
Ход эксперимента.
Получение аммиака.
Вариант 1. Получение
аммиака нагреванием нашатырного спирта.
В колбе нагревают
нашатырный спирт, он разлагается на
аммиак и воду. В пробку колбы вставляют
довольно длинную трубку, которая служит
не только для выхода аммиака, но и для
конденсации образующихся водяных паров.
Аммиак собирают в опрокинутый вверх
дном цилиндр или колбу.
Вариант 2.
Аммоний хлорид и
кальций гидроксид приблизительно в
одинаковых объемах перемешайте в
фарфоровой чашке. Полученную смесь
высыпьте в сухую пробирку (приблизительно
1/3 пробирки), закройте ее пробкой с
газоотводной трубкой и закрепите в
лапке штатива так, чтобы дно пробирки
было немного выше отверстия. На
газоотводную трубку прибора наденьте
сухую пробирку, перевернутую вверх
дном.
Пробирку со смесью
нагрейте сначала всю, а потом в том
месте, где находится смесь. Когда
пробирка, надетая на газоотводную
трубку, наполнится газом (его запах
будет слышно в воздухе возле прибора),
медленно снимите ее, не переворачивая,
закройте отверстие пробкой и сохраните
для следующего опыта.
Растворение аммиака
в воде.
Вариант 1.
Пробирку с аммиаком,
полученным в предыдущем опыте, опустите
отверстием вниз в кристаллизатор с
водой. Откройте пробку под водой. Вода
поднимется в пробирку. Когда перестанет
подниматься, закройте пробирку под
водой пробкой и выньте из кристаллизатора.
К полученному раствору добавьте несколько
капель фенолфталеина.
Вариант 2. Аммиачный
«фонтан».
Аммиаком заполните
круглодонную колбу. Плотно закройте ее
пробкой с газоотводной трубкой, пережатой
зажимом Мора. После этого колбу разместите
над кристаллизатором с водой, в которую
предварительно добавьте несколько
капель фенолфталеина. Конец газоотводной
трубки погрузите в воду и снимите с нее
зажим. Вода в виде «фонтана» поднимется
в колбу.
Опыт
7. Взаимодействие
аммоний гидроксида с хлоридной кислотой.
Дым без огня.
Оборудование:
Химические
стаканы, пипетки
Реактивы:
концентрированный раствор аммиака,
концентрированная хлоридная кислота.
Ход
эксперимента.
В
один химический стакан нальем несколько
капель концентрированного раствора
аммиака, а во второй – несколько капель
концентрированной хлоридной кислоты.
Стаканы поднесем друг к другу. При этом
появляется белый дым – образуются
кристаллики аммоний хлорида:
NH3
+ HCl
→NH4Cl
Опыт
8. Получение
сульфур (ΙV) оксида и изучение его свойств.
Оборудование:
колбы, горелки, цилиндры, лучинки,
кристаллизатор с водой, пробка с капельной
воронкой, стеклянная пластинка.
Реактивы:
натрий сульфит, концентрированная
сульфатная кислота.
Ход эксперимента.
Получение
сульфур (IV)
оксида.
Для опыта собирают
такой же прибор, как и для получения,
гидроген хлорида (см. опыт 2).
а).
Колбу с твердым натрий сульфитом
закрывают пробкой с капельной воронкой.
При подливании концентрированной
сульфатной кислоты выделяется сульфур(ΙV)
оксид. Реакция идет без нагревания.
б).
К меди (стружки, опилки или проволока)
подливают концентрированную сульфатную
кислоту и нагревают. Собирают сульфур(ΙV)
оксид вытеснением воздуха в сосуд,
стоящий вниз дном.
Растворение
SО2
в воде.
Поставить
цилиндр отверстием вверх и заполнить
его сульфур(ΙV) оксидом. Полноту заполнения
контролируют, как и с углекислым газом
– горящая лучина в оксиде гаснет. Цилиндр
закрывают стеклянной пластинкой и
отверстием вниз опускают в кристаллизатор
с водой. При покачивании цилиндра
постепенно в него заходит вода.
2NaHSО4+H2SО4→Na2SО4+2SО2↑+2H2О;
Cu+2H2SО4→CuSО4+SО2↑+2H2О
H2О+SО2→H2SО3