Молярная масса
Вы знаете, что одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но у каждого вещества его структурная единица имеет собственную массу. Поэтому и массы одинаковых химических количеств различных веществ тоже будут различны.
Молярная масса — это масса порции вещества химическим количеством 1 моль.
Молярная масса вещества Х обозначается символом M(Х). Она равна отношению массы данной порции вещества m(Х) (в г или кг) к его химическому количеству n(Х) (в моль):
В Международной системе единиц молярная масса выражается в кг/моль. В химии чаще используется дольная единица — г/моль.
Определим молярную массу углерода. Масса углерода химическим количеством 1 моль равна 0,012 кг, или 12 г. Отсюда:
Молярная масса любого вещества, если она выражена в г/моль, численно равна его относительной молекулярной (формульной) массе.
Например:
На рисунке 47 показаны образцы веществ (H2O, CaCO3, Zn), химическое количество которых одно и то же — 1 моль. Как видите, массы разных веществ химическим количеством 1 моль различны.
Молярная масса является важной характеристикой каждого отдельного вещества. Она отражает зависимость между массой и химическим количеством вещества. Зная одну из этих величин, можно определить вторую — массу по химическому количеству:
и, наоборот, химическое количество по массе:
а также число структурных единиц:
Взаимосвязь между этими тремя характеристиками вещества в любом его агрегатном состоянии можно выразить простой схемой:
Формула и алгоритм нахождения объёма
Сегодня мы научимся одному немаловажному умению в химии – находить объём различных растворов и прочих веществ. Это знание необходимо потому, что оно поможет нам в решении многих задач как в тетради, так и в жизни. Нужно лишь знать устоявшуюся формулу.
Важно понимать, что формула нахождения объёма может быть разной в зависимости от того вещества, объём которого нам предстоит найти, а точнее, от агрегатного состояния этого вещества. Для нахождения объёма газа и жидкости используются разные, непохожие друг на друга формулы.
Чёткая и правильная формула для расчёта объёма жидкости выглядит следующим образом: С=n/V.
В этом случае:
- C – молярная масса раствора (моль на литр).
- n – количество вещества (моль).
- V – объём вещества-жидкости (литры).
Из этого следует что V=n/c.
Cуществует и вторая формула для нахождения объёма жидкости при другой задаче и других данных: V=m/p.
Здесь, соответственно:
- V – объём и измеряется он в миллилитрах.
- m – масса, измеряется в граммах.
- p – плотность, измеряется в граммах, делённых на миллилитры.
В случае если, кроме объёма, требуется также найти массу, это можно сделать, зная формулу и количество нужного вещества. При помощи формулы вещества находим его молярную массу путём сложения атомной массы всех элементов, которые входят в его состав.
Для примера возьмём M (AuSo2) и при расчётах у нас должно выйти 197+32+16 * 2 = 261 г/моль. После проведённых расчётов находим массу по формуле m=n*M, где, следовательно:
- m – масса.
- n – количество вещества, которое измеряется в молях (моль).
- M – молярная масса вещества: граммы, делённые на моль.
Количество вещества, как правило, даётся в задаче. Если же нет, то, скорее всего, допущена опечатка или ошибка в условии, и вам стоит обратиться за помощью и объяснениями к учителю, а не пытаться самим вывести несуществующую величину. Основные формулы и алгоритмы решения приведены в данной статье.
Также существует формула для нахождения объёма газа, и выглядит она так – V=n*Vm:
- V – объём газа (литры).
- n – количество вещества (моль).
- Vm – молярный объём газа (литры/моль).
Но есть своего рода исключение. Оно состоит в том, что при нормальных условиях, то есть при определённом давлении и температуре, объём газа является постоянной величиной, равной 22,3 л/моль.
Есть и третий вариант. Если в самом задании будет присутствовать уравнение реакции, тогда ход решения должен проходить иначе. Из уравнения, которое у вас имеется, можно найти количество каждого вещества, оно будет равняться коэффициенту. К примеру, Ch4 + 2O2 = CO2 + H2O. Из этого уравнения следует, что 1 моль метана и 2 моль кислорода при взаимодействии дают 1 моль углерода и 1 моль воды. Даже если учесть тот факт, что в условии имеется количество вещества лишь одного-единственного компонента, не составит труда найти количество всех остальных веществ. Если количество метана составит 0,3 моль, значит, n(Сh4) будет равняться 0,6 моль, n(CO2) = 0,3 моль, n(H2O) = 0.3 моль.
б) Газовые законы объем газа
Кроме вышеуказанной формулы для решения расчетных химических задач, нередко приходится использовать газовые законы, известные из курса физики.
— Закон Бойля-Мариотта
При постоянной температуре объем данного количества газа обратно пропорционален давлению, под которым он находится:
pV = const
— Закон Гей-Люссака
При постоянном давлении изменение объема газа прямо пропорционально температуре:
V/T = const
— Объединенный газовый закон Бойля-Мариотта и Гей-Люссака
pV/T = const
Помимо этого, если известна масса или количество газа, его объем можно вычислить, используя уравнение Менделеева-Клапейрона:
pV = nRT;
pV = n/M ×RT,
где n–число молей вещества, m–масса (г), Ь – молярная масса газа (г/моль), R – универсальная газовая постоянная равная 8,31 Дж/(моль×К).
Молярный объем кристаллов
Объем Vя элементарной ячейки кристалла вычисляют с помощью характеристик кристаллической структуры, которые определяют на основании результатов рентгеноструктурного анализа.
Зависимость между объемом ячейки и молярным объемом:
Vm=VяNA/Z
где Z — определяет, сколько формульных единиц в элементарной ячейке.
Молярный объем
В отличие от твердых и жидких веществ все газообразные вещества химическим количеством 1 моль занимают одинаковый объем (при одинаковых условиях). Эта величина называется молярным объемом и обозначается Vm.
Подобно молярной массе, молярный объем газа равен отношению объема данного газообразного вещества V(Х) к его химическому количеству n(Х):
Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С и давление 101,325 кПа.
Установлено, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 дм3/моль. Другими словами, молярный объем любого газа при нормальных условиях:
Молярный объем — это объем, равный 22,4 дм3, который занимает 1 моль любого газа при нормальных условиях.
Пример 1. Вычислите химическое количество SiO2, масса которого равна 240 г.
Спойлер
[свернуть]
Пример 2. Определите массу серной кислоты H2SO4, химическое количество которой 2,5 моль.
Спойлер
[свернуть]
Пример 3. Сколько молекул CO2 и сколько атомов кислорода содержится в углекислом газе массой 110 г?
Спойлер
[свернуть]
Пример 4. Какой объем занимает кислород химическим количеством 5 моль при нормальных условиях?
Спойлер
[свернуть]
Краткие выводы урока:
- Масса вещества химическим количеством 1 моль называется его молярной массой. Она равна отношению массы данной порции вещества к его химическому количеству.
- Объем газообразных веществ химическим количеством 1 моль при нормальных условиях одинаков и равен 22,4 дм3.
- Величина, равная 22,4 дм3/моль, называется молярным объемом газов.
Надеюсь урок 9 «» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «».
Теги
Страницы работы
Содержание работы
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
ПО ТЕМАМ ЧАСТИ №1
«СТРОЕНИЕ И СВОЙСТВА ТВЁРДЫХ ТЕЛ. КВАНТОВЫЕ
СТАТИСТИКИ»
Тема 1. Строение стёрдых тел
Основные формулы
1. Объем элементарной ячейки в кристаллах:
а) кубической
сингонии
,
б) гексагональной
сингонии
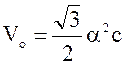
где и с – параметры решетки.
2.
Период решетки (расстояние между
ближайшими одноименными ионами)
а) объемоцентрированной
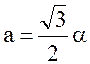
б) гранецентрированной
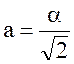
3.
Объем одного моля кристалла
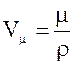
где m – масса моля кристалла, r – его плотность.
4.
Число элементарных ячеек в одном
моле кристалла
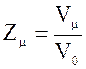
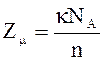
где k -одинаковое число атомов в
химической формуле соединения, NA – число Авогадро, n – число
одинаковых атомов, приходящихся на элементарную ячейку.
5.
Число элементарных ячеек в единице
объема кристалла
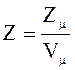
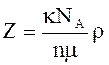
В качестве индексов узлов кристаллической решетки
принимается совокупность величин Х/а, У/в, Z/с,
обозначаемых [[m n p]].
6.
Индексы направления в
кристаллической решетке определяются наименьшими числами m, n, p,
пропорциональными индексам любого узла, через который проходит прямая:
m : n : p = Х/а : У/в : Z/с.
Индексы направления заключаются в одинарные скобки [m n p ].
7. Миллеровские индексы плоскости задаются с помощью
наименьших чисел h, k, l, обратных отрезкам u, v, w,
отсекаемых плоскостью на координатных осях. Индексы плоскости записываются в
круглых скобках (hkl).
9. Уравнение Вульфа-Брэггов для дифракции
рентгеновского излучения на кристаллах имеет вид:
,
где d – межплоскостное расстояние, Q – угол скольжения, k –
порядок дифракционного максимума.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача 1 .Сколько
атомов приходится на одну элементарную ячейку объемоцентрированной кубической
решетки?
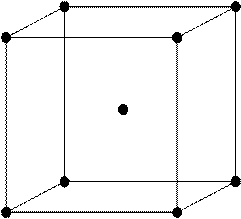 |
Рис. 1
Решение:
Элементарная ячейка
объемоцентрированной кубической решетки изображена на рис. 1. В этой ячейке
имеются узлы кристаллической решетки двух типов: узлы, находящиеся в вершинах
куба, и узел, находящийся на пересечении двух пространственных диагоналей куба.
Каждый узел в вершинах принадлежит одновременно восьми элементарным ячейкам.
Следовательно, на данную элементарную ячейку приходится 1/8 узла. Находящийся
на пересечении диагоналей узел целиком находится в ячейке. Так как вершин
восемь, то на одну элементарную ячейку в объемоцентрированной решетке
приходится всего атомов
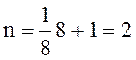
Задача 2. Определить
плотность кристалла стронция, если известно, что он имеет кристаллическую
решетку гранецентрированной кубической сингонии, а период решетки d =
0,43 нм.
Дано: d = 0,43 нм, А = 87,6 кг/катом. Определить r.
Решение: Плотность
кристалла стронция можно определить по формуле
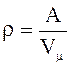
(1)
Выразим объем одного моля кристалла Vm через объем элементарной
ячейки V0,
воспользовавшись соотношением
Vm = V0 Zm.
Но Zm = NA/n, а V0 = a3, где а – параметр
решетки. Для гранецентрированной ячейки
а = Ö2 d и V0 = 2Ö2 d3.
На гранецентрированную ячейку приходится n = 4
атома. После подстановки указанных выше соотношений в формулу (1) окончательно
для плотности кристалла получим выражение
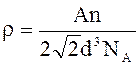
Подставим числовые значения:
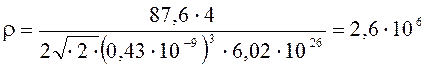
Задача
3. На грань кристалла каменной соли
падает параллельный пучок рентгеновских лучей с длиной волны 0, 147 нм.
Определить расстояние меэду атомными плоскостями кристалла, если дифракционный
максимум второго порядка наблюдается, когда лучи падают на кристалл под углом
31030/.
Дано: l= 0,147 нм = 1,47 10-10 м; j = 31030/ ; k = 2.
Определить d.
Решение: Запишем уравнение Вульфа-Брэггов
.
Угол q является дополнительным к углу j.
q= p/2 – j = 58030/.
Межплоскостное расстояние d определим из
выражения
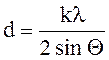
Подставим числовые значения:
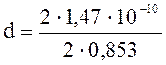
Тема 2. Тепловые свойства твердых тел
Основные формулы
1. Теплоемкость одного моля химически простых
твердых тел определяется по закону Дюлонга и Пти
,
где R – универсальная газовая постоянная.
2.
Теплоемкость одного моля химически
сложных тел определяется по закону Неймана – Коппа
,
где n – общее число частиц в химической формуле.
3.
Среднее значение квантового
осциллятора, приходящаяся на одну степень свободы, в квантовой теории
Эйнштейна:
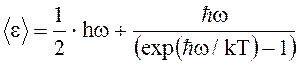
где –
нулевая энергия, – перечеркнутая постоянная
Планка, w – циклическая частота, k – постоянная Больцмана, Т – абсолютная температура.
4.
Внутренняя энергия одного моля
кристалла в квантовой теории теплоемкости Эйнштейна
Похожие материалы
- Задачи для самостоятельного решения по темам части № 1 «Строение и свойства твёрдых тел, квантовые статистики»
- Задания для самоподготовки к итоговому тестированию по темам части № 2 «Металлы, полупроводники, диэлектрики»
- Примеры решения задач по теме № 5 «Физика колебаний и волн»
Информация о работе
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание – внизу страницы.
Если кристалл кубической системы
обладает плотностью ρ (г/см3),
известен тип решетки (простая, объемно-
центрированная кубическая или
гранецентрированная[ кубическая), то
расчет производится следующим образом.
Число атомов, n необходимое
для построения данного куба (в таблице).
Масса куба определяется через массу
атомов (для металлов):
,
где А – атомная масса металла, N
– число Авогадро. Объем элементарной
ячейки определяется через плотность
ρ:
.
Длина ребра куба определяется по формуле:
(см, м).
|
Таблица. Важнейшие характеристики |
То же, % |
52,4 |
68,0 |
74,0 |
34,0 |
74,0 |
|
Плотность упаковки |
π/6 |
(π√3)/8 |
(π√2)/6 |
(π√3)/16 |
(π√2)/6 |
|
|
Атомный радиус |
а√2 |
(а√3)/4 |
(а√2)/4 |
(а√3)/8 |
а/2 |
|
|
Число атомов
В элементарной |
1 |
2 |
4 |
8 |
2 |
|
|
Координаци-онное |
6 |
8 |
12 |
4 |
12 |
|
|
Характеристики |
Простой куб |
Объемно-центрированный |
Гранецентриро-ванный |
Решетка алмаза |
Гексагональная |
Пример. Определить длину ребра куба
элементарной кристаллической ячейки
металлического свинца, имеющего решетку
типа ГЦК и плотность 11340 кг/м3 .
a
Решение:
-
Изобразим элементарную кристаллическую
ячейку и обозначим длину ребра куба
(а). -
Находим n– число
частиц, необходимое и достаточное для
построения ячейки:
-
По формуле определяем длину ребра
куба.
-
Определяем атомный радиус свинца, по
его величине делаем вывод о физических
свойствах Pb.
-
Зная плотность свинца и число n
можно определить объем элементарной
ячейки:
-
Можно оценить, сколько молей Pb
содержится в 1 м3 твердого свинца. -
Оценить сколько атомов содержится в 1
м3 Pb. -
Сколько весит один атом Pb.
-
Рассчитать плотность упаковки и сделать
вывод.
1.3. Расчет энергии кристаллической решетки.
Под энергией решетки U
понимают ту энергию, которая выделяется
при образовании кристаллов из частиц,
составляющих решетку и находящихся в
свободном состоянии (состояние идеального
газа) при той же температуре.
Для ионных кристаллов такими частицами
являются ионы, для атомных – атомы и
т.д..
Значение U вычисляют
разными способами. Рассмотрим способ
расчета на основе кругового процесса
Борна – Габера для NaCl:
,
где ∆H0обр
– энтальпия образования NaCl
из элементарных натрия и хлора,
кДж/моль.
∆H0субл.
– энтальпия сублимации металлического
натрия, кДж/моль.
INa
–энергия ионизации натрия, кДж/моль.
Eсвязи – энергия
диссоциации связи Cl –
Cl, кДж/моль.
ECl –
энергия сродства атомов хлора к электрону,
кДж/моль.
U – энергия кристаллической
решетки NaCl, кДж/моль.
Необходимые справочные данные приведены
в приложении.
Капустинский А.Ф. предложил уравнение
для расчета энергии моля кристалла
имеющего ионную решетку:
(кДж/моль)
z1 и z2
– валентность ионов.
r1 и r2
– радиусы ионов для координационного
числа 6,Å
∑n – число ионов
в молекуле.
Необходимые справочные данные приведены
в таблицах.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #













