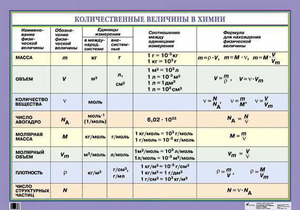
Молярная масса
Вы знаете, что одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но у каждого вещества его структурная единица имеет собственную массу. Поэтому и массы одинаковых химических количеств различных веществ тоже будут различны.
Молярная масса — это масса порции вещества химическим количеством 1 моль.
Молярная масса вещества Х обозначается символом M(Х). Она равна отношению массы данной порции вещества m(Х) (в г или кг) к его химическому количеству n(Х) (в моль):
В Международной системе единиц молярная масса выражается в кг/моль. В химии чаще используется дольная единица — г/моль.
Определим молярную массу углерода. Масса углерода химическим количеством 1 моль равна 0,012 кг, или 12 г. Отсюда:
Молярная масса любого вещества, если она выражена в г/моль, численно равна его относительной молекулярной (формульной) массе.
Например:
На рисунке 47 показаны образцы веществ (H2O, CaCO3, Zn), химическое количество которых одно и то же — 1 моль. Как видите, массы разных веществ химическим количеством 1 моль различны.
Молярная масса является важной характеристикой каждого отдельного вещества. Она отражает зависимость между массой и химическим количеством вещества. Зная одну из этих величин, можно определить вторую — массу по химическому количеству:
и, наоборот, химическое количество по массе:
а также число структурных единиц:
Взаимосвязь между этими тремя характеристиками вещества в любом его агрегатном состоянии можно выразить простой схемой:
Формула и алгоритм нахождения объёма
Сегодня мы научимся одному немаловажному умению в химии – находить объём различных растворов и прочих веществ. Это знание необходимо потому, что оно поможет нам в решении многих задач как в тетради, так и в жизни. Нужно лишь знать устоявшуюся формулу.
Важно понимать, что формула нахождения объёма может быть разной в зависимости от того вещества, объём которого нам предстоит найти, а точнее, от агрегатного состояния этого вещества. Для нахождения объёма газа и жидкости используются разные, непохожие друг на друга формулы.
Чёткая и правильная формула для расчёта объёма жидкости выглядит следующим образом: С=n/V.
В этом случае:
- C – молярная масса раствора (моль на литр).
- n – количество вещества (моль).
- V – объём вещества-жидкости (литры).
Из этого следует что V=n/c.
Cуществует и вторая формула для нахождения объёма жидкости при другой задаче и других данных: V=m/p.
Здесь, соответственно:
- V – объём и измеряется он в миллилитрах.
- m – масса, измеряется в граммах.
- p – плотность, измеряется в граммах, делённых на миллилитры.
В случае если, кроме объёма, требуется также найти массу, это можно сделать, зная формулу и количество нужного вещества. При помощи формулы вещества находим его молярную массу путём сложения атомной массы всех элементов, которые входят в его состав.
Для примера возьмём M (AuSo2) и при расчётах у нас должно выйти 197+32+16 * 2 = 261 г/моль. После проведённых расчётов находим массу по формуле m=n*M, где, следовательно:
- m – масса.
- n – количество вещества, которое измеряется в молях (моль).
- M – молярная масса вещества: граммы, делённые на моль.
Количество вещества, как правило, даётся в задаче. Если же нет, то, скорее всего, допущена опечатка или ошибка в условии, и вам стоит обратиться за помощью и объяснениями к учителю, а не пытаться самим вывести несуществующую величину. Основные формулы и алгоритмы решения приведены в данной статье.
Также существует формула для нахождения объёма газа, и выглядит она так – V=n*Vm:
- V – объём газа (литры).
- n – количество вещества (моль).
- Vm – молярный объём газа (литры/моль).
Но есть своего рода исключение. Оно состоит в том, что при нормальных условиях, то есть при определённом давлении и температуре, объём газа является постоянной величиной, равной 22,3 л/моль.
Есть и третий вариант. Если в самом задании будет присутствовать уравнение реакции, тогда ход решения должен проходить иначе. Из уравнения, которое у вас имеется, можно найти количество каждого вещества, оно будет равняться коэффициенту. К примеру, Ch4 + 2O2 = CO2 + H2O. Из этого уравнения следует, что 1 моль метана и 2 моль кислорода при взаимодействии дают 1 моль углерода и 1 моль воды. Даже если учесть тот факт, что в условии имеется количество вещества лишь одного-единственного компонента, не составит труда найти количество всех остальных веществ. Если количество метана составит 0,3 моль, значит, n(Сh4) будет равняться 0,6 моль, n(CO2) = 0,3 моль, n(H2O) = 0.3 моль.
б) Газовые законы объем газа
Кроме вышеуказанной формулы для решения расчетных химических задач, нередко приходится использовать газовые законы, известные из курса физики.
— Закон Бойля-Мариотта
При постоянной температуре объем данного количества газа обратно пропорционален давлению, под которым он находится:
pV = const
— Закон Гей-Люссака
При постоянном давлении изменение объема газа прямо пропорционально температуре:
V/T = const
— Объединенный газовый закон Бойля-Мариотта и Гей-Люссака
pV/T = const
Помимо этого, если известна масса или количество газа, его объем можно вычислить, используя уравнение Менделеева-Клапейрона:
pV = nRT;
pV = n/M ×RT,
где n–число молей вещества, m–масса (г), Ь – молярная масса газа (г/моль), R – универсальная газовая постоянная равная 8,31 Дж/(моль×К).
Молярный объем кристаллов
Объем Vя элементарной ячейки кристалла вычисляют с помощью характеристик кристаллической структуры, которые определяют на основании результатов рентгеноструктурного анализа.
Зависимость между объемом ячейки и молярным объемом:
Vm=VяNA/Z
где Z — определяет, сколько формульных единиц в элементарной ячейке.
Молярный объем
В отличие от твердых и жидких веществ все газообразные вещества химическим количеством 1 моль занимают одинаковый объем (при одинаковых условиях). Эта величина называется молярным объемом и обозначается Vm.
Подобно молярной массе, молярный объем газа равен отношению объема данного газообразного вещества V(Х) к его химическому количеству n(Х):
Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С и давление 101,325 кПа.
Установлено, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 дм3/моль. Другими словами, молярный объем любого газа при нормальных условиях:
Молярный объем — это объем, равный 22,4 дм3, который занимает 1 моль любого газа при нормальных условиях.
Пример 1. Вычислите химическое количество SiO2, масса которого равна 240 г.
Спойлер
[свернуть]
Пример 2. Определите массу серной кислоты H2SO4, химическое количество которой 2,5 моль.
Спойлер
[свернуть]
Пример 3. Сколько молекул CO2 и сколько атомов кислорода содержится в углекислом газе массой 110 г?
Спойлер
[свернуть]
Пример 4. Какой объем занимает кислород химическим количеством 5 моль при нормальных условиях?
Спойлер
[свернуть]
Краткие выводы урока:
- Масса вещества химическим количеством 1 моль называется его молярной массой. Она равна отношению массы данной порции вещества к его химическому количеству.
- Объем газообразных веществ химическим количеством 1 моль при нормальных условиях одинаков и равен 22,4 дм3.
- Величина, равная 22,4 дм3/моль, называется молярным объемом газов.
Надеюсь урок 9 «» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «».
Теги
Молярный объём
Vm
— это отношение объёма данной порции вещества к его количеству.
Численно молярный объём равен объёму (1) моль вещества.
Обрати внимание!
Молярный объём любого газа при нормальных условиях (давлении (101,3) кПа и температуре (0) °С) равен (22,4) дм³/моль.
Вычисление объёма газа по его количеству
Преобразуем формулу молярного объёма — выразим из неё
V
:
— объём газа равен произведению его количества на молярный объём.
Пример:
вычисли объём (н. у.) метана количеством (1,5) моль.
дм³.
Вычисление количества газа по его объёму
Выразим из формулы молярного объёма
n
:
— количество газа можно вычислить, если его объём разделить на молярный объём.
Пример:
вычисли количество водорода, соответствующее при н. у. его объёму (11,2) дм³.
моль.
Химия – одна из самых важных и разнообразных наук в нашей жизни. Это необязательно школьный предмет, ведь она окружает нас повсюду. В ней всё довольно запутано и порой даже противоречиво. Множество реакций протекает вокруг нас прямо сейчас, к примеру, приготовление пищи или же наложение компресса на рану. По сути, вся наша жизнь – это химическая реакция, поэтому химия очень важна.
Введение
Знать, что такое объём в химии – недостаточно. Важно понимать как и что происходит, как протекает химическая реакция. Это нужно не просто для того, чтобы сдать очередную контрольную в школе или институте, а для того чтобы быть элементарно грамотным и знать: как, что и где применять, как приготовить раствор, какие вещества смешивать нельзя, а какие можно, какие из них опасны и какие безопасны. Всё это определённо приносит нам пользу, и, более того, делает нас умнее.
Формула и алгоритм нахождения объёма
Сегодня мы научимся одному немаловажному умению в химии – находить объём различных растворов и прочих веществ. Это знание необходимо потому, что оно поможет нам в решении многих задач как в тетради, так и в жизни. Нужно лишь знать устоявшуюся формулу.
Важно понимать, что формула нахождения объёма может быть разной в зависимости от того вещества, объём которого нам предстоит найти, а точнее, от агрегатного состояния этого вещества. Для нахождения объёма газа и жидкости используются разные, непохожие друг на друга формулы.
Чёткая и правильная формула для расчёта объёма жидкости выглядит следующим образом: С=n/V.
В этом случае:
- C – молярная масса раствора (моль на литр).
- n – количество вещества (моль).
- V – объём вещества-жидкости (литры).
Из этого следует что V=n/c.
Cуществует и вторая формула для нахождения объёма жидкости при другой задаче и других данных: V=m/p.
Здесь, соответственно:
- V – объём и измеряется он в миллилитрах.
- m – масса, измеряется в граммах.
- p – плотность, измеряется в граммах, делённых на миллилитры.
В случае если, кроме объёма, требуется также найти массу, это можно сделать, зная формулу и количество нужного вещества. При помощи формулы вещества находим его молярную массу путём сложения атомной массы всех элементов, которые входят в его состав.
Для примера возьмём M (AuSo2) и при расчётах у нас должно выйти 197+32+16 * 2 = 261 г/моль. После проведённых расчётов находим массу по формуле m=n*M, где, следовательно:
- m – масса.
- n – количество вещества, которое измеряется в молях (моль).
- M – молярная масса вещества: граммы, делённые на моль.
Количество вещества, как правило, даётся в задаче. Если же нет, то, скорее всего, допущена опечатка или ошибка в условии, и вам стоит обратиться за помощью и объяснениями к учителю, а не пытаться самим вывести несуществующую величину. Основные формулы и алгоритмы решения приведены в данной статье.
Также существует формула для нахождения объёма газа, и выглядит она так – V=n*Vm:
- V – объём газа (литры).
- n – количество вещества (моль).
- Vm – молярный объём газа (литры/моль).
Но есть своего рода исключение. Оно состоит в том, что при нормальных условиях, то есть при определённом давлении и температуре, объём газа является постоянной величиной, равной 22,3 л/моль.
Есть и третий вариант. Если в самом задании будет присутствовать уравнение реакции, тогда ход решения должен проходить иначе. Из уравнения, которое у вас имеется, можно найти количество каждого вещества, оно будет равняться коэффициенту. К примеру, Ch4 + 2O2 = CO2 + H2O. Из этого уравнения следует, что 1 моль метана и 2 моль кислорода при взаимодействии дают 1 моль углерода и 1 моль воды. Даже если учесть тот факт, что в условии имеется количество вещества лишь одного-единственного компонента, не составит труда найти количество всех остальных веществ. Если количество метана составит 0,3 моль, значит, n(Сh4) будет равняться 0,6 моль, n(CO2) = 0,3 моль, n(H2O) = 0.3 моль.
Формула и алгоритм нахождения НЮ
Кроме того, нужно научиться находить так называемое НЮ в химии, ведь эти термины близко связаны и часто стоят рядом в какой-либо задачке.
НЮ в этом случае – количество вещества.
И как же нам его найти, спросите вы?
НЮ также находится довольно просто. Необходимо лишь применить логику и формулы, и все получится.
Для нахождения НЮ нам лишь нужно массу разделить на молярную массу. В виде формулы это будет выглядеть так: v=m/M.
Соответственно:
- m – масса.
- M – молярная масса.
Теперь вы знаете как в химии находится объём и масса вещества. И пускай выглядит это всё довольно непросто, но запоминание несложного алгоритма позволит вам легко ориентироваться в данных формулах и в последующем разбираться в химии, которая также представляет собой совокупность формул и алгоритмов, из которых в целом и состоит весь наш мир. Удачи и положительных результатов в ваших начинаниях!
Видео
Из этого видео вы узнаете, как решать задачи по химии в несколько действий.
,
Основные формулы для решения задач по химии
05-Авг-2012 | комментариев 450 | Лолита Окольнова
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов). Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Несколько миллионов. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества. Обозначается как M
Есть еще молекулярная масса — Mr
Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 гмоль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=mM
n=V22.4 (лмоль)
Масса вещества m (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (лмоль)
или вот еще удобная табличка:
Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
В ОГЭ и ЕГЭ по химии задач , в которых нужно было бы найти только объем массу кол-во моль нет — это обычно ЧАСТЬ решения задачи. Однако, чтобы легко решать более сложные задачи, нужно тренироваться на таких вот небольших упражнениях.
Находим количество вещества по массе
1 Какое количество вещества алюминия содержится в образце металла массой 10.8 г?2 Какое количество вещества содержится в оксиде серы (VI) массой 12 г?
3 Определите количество моль брома, содержащееся в массе 12.8 г.
Находим массу по количеству вещества:
4. Определите массу карбоната натрия количеством вещества 0.25 моль.Объем по количеству вещества:
5. Какой объем будет иметь азот при н.у., если его количество вещества 1.34 моль?6. Какой объем занимают при н.у. 2 моль любого газа?
Ответы:/p>
- 0.4 моль
- 0.15 моль
- 0.08 моль
- 26.5 г
- 30 л
- 44.8 л
Категории:
|
Обсуждение: “Основные формулы для решения задач по химии”
(Правила комментирования)
Молярный объём и молярная масса необходимы для решения задач по химии. Давайте вспомним, что
молярный объём показывает, какой объём в литрах занимает 1 моль любого газа.
В нормальных условиях (температура 0 градусов Цельсия и давление 1 атмосфера) молярный объём равен 22,4 литра. То есть 1 моль любого газа в нормальных условиях занимает объём 22,4 литра.
Молярная показывает, сколько весит в граммах 1 моль вещества.
Если молярный объём для всех газов одинаков, то молярная масса для всех веществ разная и рассчитывается она по данным из таблицы Менделеева. Попрактикуемся?
Пример 1.
Укажите молярную массу и молярный объём (н.у.) оксида азота (V).
Решение:
Формула оксида азота (V) N2O5. Определяем молярную массу. Для это смотрим в периодической таблице атомные массы азота и кислорода и вспоминаем, что молярная масса совпадает с молекулярной. Таблица нам говорит, что атомная масса азота 14, атомная масса кислорода 16. Отсюда молекулярная масса оксида азота (V): 2*14+5*16=118, это же значение имеет и молярная масса – 118 г/моль.
А вот молярный объём оксида азота (V) в нормальных условиях равен 22,4 л/моль, потому что молярный объём любого газа в нормальных условиях равен 22,4 л/моль.
Ответ: молярная масса оксида азота (V) 118 г/моль, молярный объём оксида азота (V) 22,4 л/моль.
Пример 2.
Произошла реакция между оксидом кальция и углекислым газом с образованием карбоната кальция. Известно, что в результате реакции образовалось 130 г карбоната кальция. Определите, сколько вступило в реакцию оксида кальция (в граммах) и углекислого газа (в литрах).
Решение:
Для начала запишем уравнение реакции. Оно выглядит так:
СаО + СО2 = СаСО3
Отметьте для себя, что согласно уравнению в реакцию вступает 1 моль оксида кальция и 1 моль углекислого газа, при образуется 1 моль карбоната кальция, то есть:
1 моль СаО + 1 моль СО2 = 1 моль СаСО3
Далее вернёмся к условию и посмотрим, что нам известно. А известно нам, что получилось 130 г карбоната кальция. Посчитаем молярную массу СаСО3 (воспользуемся данными из таблицы Менделеева): 40+12+3*16= 100 г/моль. Это означает, что 100 г вести 1 моль СаСО3. Тогда мы можем составить пропорцию:
100 г весит 1 моль СаСО3
130 г вести Х моль СаСО3
Отсюда следует, что Х=130 г*1 моль/100 г=1,3 моль. Таким образом, в результате нашей реакции образовалось 1,3 моль карбоната кальция. Вспомним, что мы писали выше.
По уравнению реакции мы увидели, что:
1 моль СаО + 1 моль СО2 = 1 моль СаСО3
Но только что мы рассчитали, что в реакции получилось 1,3 моль СаСО3. То есть в условиях задачи получается:
Х моль СаО + Х моль СО2 = 1,3 моль СаСО3
Отсюда очевидно, что в реакции приняло участие 1,3 моль СаО и 1,3 моль СО2. Но ответ нам нужен в граммах (для СаО) и литрах (для СО2). Поэтому рассчитаем молярную массу оксида кальция (из периодической таблицы): 40+16=56 г/моль. То есть 56 г весит 1 моль СаО. А у нас 1,3 моль СаО (мы это рассчитали ранее). Переведём это количество вещества в граммы: 56 г/моль*1,3 моль=72,8 г.
С объёмом углекислого газа всё проще. 1 моль углекислого газа в н.у. занимает 22,4 л. Отсюда 1,3 моль углекислого газа занимают 22,4л/моль*1,3 моль=29,12 л.
Ответ: в реакцию вступило 72,8 г оксида кальция и 29,12 л углекислого газа.
Пример 3.
Фосфор сгорел с образованием оксида фосфора (V). Известно, что фосфора взяли 15,5 г. Определите, сколько потребовалось для проведения реакции литров кислорода (н.у.) и сколько образовалось оксида фосфора (V).
Решение:
Как обычно и рекомендуют учебники химии, запишем уравнение реакции:
4Р + 5О2 = 2Р2О5.
Из реакции видно следующее:
4 моль Р + 5 моль О2 = 2 моль Р2О5. Отметим это.
Далее посчитаем, какое количество фосфора вступило в реакцию. Молярная масса фосфора 31 г/моль (из таблицы Менделеева). В условиях сказано, что в реакцию вступило 15,5 /моль. Тогда:
1 моль Р весит 31 г
Х моль Р весит 1,5 г
Отсюда Х=1 моль*15,5 г/31 г=0,5 моль. То есть в нашей реакции поучаствовало всего 0,5 моль фосфора.
Теперь вспомним, что по уравнению реакции:
4 моль Р + 5 моль О2 = 2 моль Р2О5
А в наших условиях получается так:
0,5 моль Р + Х моль О2 = Y моль Р2О5
Сначала узнаем, сколько же моль кислорода было у нас. Для этого составим пропорцию:
4 моль Р реагируют с 5 моль О2 (это из уравнения реакции)
0,5 моль Р реагируют с Х моль О2 (это у нас). Отсюда
Х=0,5 моль*5 моль/4 моль=0,625 моль. То есть в нашей реакции приняло участие 0,625 моль кислорода. Кислород – это газ, в нормальных условиях 1 моль любого газа занимает 22,4 л. Тогда 0,625 моль газа займут 0,625 моль*22,4 л/моль=14 л. Это одна часть ответа.
Снова вернёмся чуть выше, к уравнению реакции:
4 моль Р + 5 моль О2 = 2 моль Р2О5
и 0,5 моль Р + Х моль О2 = Y моль Р2О5
Х мы уже нашли. Теперь ищем Y и делаем так:
4 моль Р при сгорании образуют 2 моль Р2О5
0,5 моль Р при сгорании образуют Y моль Р2О5
Отсюда Y=0,5 моль*2 моль/4 моль=0,25 моль. То есть в нашей реакции образуется 0,25 моль оксида фосфора. Чтобы перевести это в граммы, найдём молярную массу оксида Р2О5 (из периодической таблицы): 2*31+5*16=152 г/моль. Отсюда масса образовавшегося оксида фосфора 0,25 моль*152 г/моль=38 г. Это вторая часть ответа.
Ответ: для проведения реакции понадобилось 14 л кислорода, в результате реакции образовалось 38 г оксида фосфора (V).
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме