Как определить размеры молекулы
Если за размер молекулы считать ее объем, то условный объем одной молекулы высчитывайте в веществе в жидком состоянии, поскольку в этом случае расстояние между молекулами наименьшее. В случае если за размер молекулы принимается ее условный диаметр, возьмите каплю масла, измерьте ее объем, капните на волу и измерив площадь пятна, высчитайте диаметр молекулы.
Вам понадобится
- машинное масло, вода, широкий сосуд, таблица плотности веществ.
Инструкция
Определение «объема» молекулыПоскольку понятие «объем молекулы» не соответствует физическим представлениям, это понятие вводится чисто условно. Скорее речь идет об объеме пространства, где может находиться одна молекула, а поскольку в жидкостях частицы упакованы наиболее плотно, берем вещество именно в этом агрегатном состоянии. Возьмите 18 мл чистой воды (это соответствует одному молю вещества) и поделите это число на количество молекул в одном моле. Получим 18/(6,022•10^23). Тогда условный объем одной молекулы воды составит приблизительно 3•10^(-23) см³.
Определение диаметра молекулыНайдите объем капли машинного масла. Для этого накапайте порядка 100 капель из капилляра в сосуд и измерьте массу масла в нем. После этого массу, выраженную в килограммах, поделите на плотность масла, которую можно узнать из таблицы плотности некоторых веществ. Как правило, она составляет 800 кг/м³. После чего полученный результат поделите на количество капель (в данном случае на 100). Если есть мерный цилиндр, то накапайте масло прямо в него, измерьте его объем в см³ и переведите в м³, для чего поделите на 1000000, затем на количество капель масла.
После того как объем капли стал известен, из того же капилляра капните одну каплю на поверхность воды, которая налита в широкий сосуд. Для ускорения реакции предварительно немного нагрейте воду приблизительно до 40 градусов Цельсия. Масло начнет растекаться, и в результате получится круглое пятно. Следите за тем, чтобы оно не касалось стенок сосуда! После того как пятно перестанет расширяться, с помощью линейки измерьте его диаметр и переведите его в метры.
После этого рассчитайте его площадь. Для этого диаметр возведите во вторую степень, поделите на 4 и умножьте на число 3,14. Затем объем капли поделите на площадь пятна, на которое она растеклась (d=V/S) – это и будет диаметр одной молекулы масла, поскольку считается, что оно растекается по воде до тех пор, пока толщина масляной пленки не станет равной одной молекуле.
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Определение размеров молекул
1 способ. Основан на том, что молекулы вещества, когда оно находится в твердом или жидком состоянии, можно считать плотно прилегающими друг к другу. В таком случае для грубой оценки можно считать, что объем V некоторой массы m вещества просто равен сумме объемов содержащихся в нем молекул. Тогда объем одной молекулы мы получим, разделив объем V на число молекул N.
Число молекул в теле массой m равно, как известно,  ,
,
где М — молярная масса вещества NA — число Авогадро.
Отсюда объем V0 одной молекулы определяется из равенства 
В это выражение входит отношение объема вещества к его массе.
Обратное же отношение 
есть плотность вещества,
так что 
Плотность практически любого вещества можно найти в доступных всем таблицах. Молярную массу легко определить, если известна химическая формула вещества.
Объем одной молекулы, если считать ее шариком, равен  ,
,
где r – радиус шарика.
Поэтому  ,
,
откуда мы и получаем выражение для радиуса молекулы:

Первый из этих двух корней — постоянная величина, равная ≈ 7,4 · 10-9 моль 1/3, поэтому формула для r принимает вид  .
.
Например, радиус молекулы воды, вычисленный по этой формуле, равен rВ ≈ 1,9 · 10-10 м.
Описанный способ определения радиусов молекул не может быть точным уже потому, что шарики нельзя уложить так, чтобы между ними не было промежутков, даже если они соприкасаются друг с другом. Кроме того, при такой «упаковке» молекул – шариков были бы невозможны молекулярные движения. Тем не менее, вычисления размеров молекул по формуле, приведенной выше, дают результаты, почти совпадающие с результатами других методов, несравненно более точных.
2 способ. Метод Ленгмюра и Дево. В данном методе исследуемая жидкость должна растворяться в спирте (эфире) и быть легче воды, не растворяясь в ней. При попадании капли раствора на поверхность воды спирт растворяется в воде, а исследуемая жидкость образует пятно площадью S и толщиной d (порядка диаметра молекул).
Если допустить, что молекула имеет форму шара, то объем одной молекулы равен:
 где d – молекулы.
где d – молекулы.
Необходимо определить диаметр молекулы d. В микропипетку набрать 0,5 мл раствора и, расположив ее над сосудом, отсчитать число капель n, содержащихся в этом объеме. Проделав опыт несколько раз, найти среднее значение числа капель в объеме 0,5 мл, а затем подсчитать объём исследуемой жидкости в капле:  , где n – число капель в объеме 0,5 мл, 1:400 – концентрация раствора.
, где n – число капель в объеме 0,5 мл, 1:400 – концентрация раствора.
В ванну налить воду толщиной 1 – 2 см. Насыпать тальк тонким слоем на лист бумаги, ударяя слегка пальцем по коробочке. Расположив лист бумаги выше и сбоку от ванны на расстоянии 10 – 20 см, тальк сдуть с бумаги. На поверхность воды в ванне из пипетки капнуть одну каплю раствора. Линейкой измерить, средний диаметр образовавшегося пятна D и подсчитываю его площадь. Опыт повторить 2- 3 раза, а затем подсчитать диаметр молекул d.
3 способ. Определение диаметра молекулы. Будем считать, что капля масла растекается по воде до тех пор, пока толщина масляной плёнки не станет равной одной молекуле, тогда диаметр одной молекулы можно определить по формуле: d=V/S, где V – объём капли масла, S – площадь масленого пятна.
Объём капли масла можно определить следующим образом: накапать 100 капель из капилляра в сосуд и измерить массу масла в нём. После этого массу, выраженную в килограммах, поделить на плотность масла, которую можно взять из таблицы плотности некоторых веществ (плотность масла растительного 800 кг/м3).
Затем полученный результат поделить на количество капель. Объём капли можно определить также с помощью мерного цилиндра: накапать масло в цилиндр, измерить его объём в см3 и перевести в м3, для чего поделить на 1000000, затем на количество капель масла. После того, как объём капли стал известен нужно капнуть одну каплю масла на поверхность воды, которая налита в широкий сосуд.
Для ускорения реакции предварительно немного нужно нагреть воду – приблизительно до 400С. Масло начнёт растекаться, и в результате получится круглое пятно. После того, как пятно перестанет расширяться, с помощью линейки измерить его диаметр и рассчитать площадь пятна по формуле: 
Практическое получение наночастиц
В современном мире в связи с общей тенденцией к миниатюризации большими темпами стала развиваться такая наука, как нанотехнология. Методы нанотехнологии позволяют получить принципиально новые устройства и материалы с характеристиками, значительно превосходящими их современный уровень, что весьма важно для интенсивного развития многих областей техники, биотехнологии, медицины, охраны окружающей среды и др.
Ход работы:
1) Определение объёма капли
 =14,13 мм3;
=14,13 мм3;
2) Определение объёма капли путём взвешивания.
1. На весы накапали 10 капель растительного масла, измерили массу
mk=0,2 г
- Масса 1 капли m1=0,2 г/10=0,02 г
- Определение объёма капли V=m1/q=0,01г/0,8 г/см3=13 мм3
3) Определяем площадь пятна Sмасла=ПR2=11304 мм2
(Приложение 1,2,3,4,5)
4) Площадь пятна нефти Sнефти=20*16=32000 мм2
(Приложение 6,7,8,9)
5) Определяем толщину плёнки h=V/S
Для масла h=13/11304=1,2*10-7=120 нм
Для нефтиh=13/32000=4*10-8 м=40 нм
Вывод: В лабораторных условиях можно получать нанопленки
Заключение
Мы измерили толщину наноплёнок масла и нефти, изучили физические свойства плёнок и методы их получения, также ознакомились с физическими методами исследования микро- и наномасшатабных объектов.
К сожалению, из таких жидкостей как кислоты(уксусная, ортофосфорная, борная), моющие средства и мыло у нас не получилось сделать наноплёнки, потому что все эти жидкости гидрофобные(боятся воды).Мы пытались получить пленки с помощью скотча, но электронные весы позволяют измерять массу с точностью до десятых долей грамма
Список использованной литературы
- Анциферов Л.И. Самодельные приборы для физического практикума в средней школе. М.: Просвещение, 1985.
- Блудов М.И. Беседы по физике. М.: Просвещение, 1984.
- Буров В.А. Практикум по физике в средней школе. М.: Просвещение, 1973.
Приложения


Основные положения МКТ. Масса и размер молекул. Количество вещества. Молекулярная физика
- Подробности
- Обновлено 07.10.2018 21:04
- Просмотров: 1191
МКТ – это просто!
«Ничто не существует, кроме атомов и пустого пространства …» – Демокрит
«Любое тело может делиться до бесконечности» – Аристотель
Основные положения молекулярно-кинетической теории (МКТ)
Цель МКТ – это объяснение строения и свойств различных макроскопических тел и тепловых явлений, в них протекающих, движением и взаимодействием частиц, из которых состоят тела.
Макроскопические тела – это большие тела, состоящие из огромного числа молекул.
Тепловые явления – явления, связанные с нагреванием и охлаждением тел.
Основные утверждения МКТ
1. Вещество состоит из частиц (молекул и атомов).
2. Между частицами есть промежутки.
3. Частицы беспорядочно и непрерывно движутся.
4. Частицы взаимодействуют друг с другом (притягиваются и отталкиваются).
Подтверждение МКТ:
1. экспериментальное
– механическое дробление вещества; растворение вещества в воде; сжатие и расширение газов; испарение; деформация тел; диффузия; опыт Бригмана: в сосуд заливается масло, сверху на масло давит поршень, при давлении 10 000 атм масло начинает просачиваться сквозь стенки стального сосуда;
– диффузия; броуновское движение частиц в жидкости под ударами молекул;
– плохая сжимаемость твердых и жидких тел; значительные усилия для разрыва твердых тел; слияние капель жидкости;
2. прямое
– фотографирование, определение размеров частиц.

Броуновское движение
Броуновское движение – это тепловое движение взвешенных частиц в жидкости (или газе).
Броуновское движение стало доказательством непрерывного и хаотичного (теплового) движения молекул вещества.
– открыто английским ботаником Р. Броуном в 1827 г.
– дано теоретическое объяснение на основе МКТ А. Эйнштейном в 1905 г.
– экспериментально подтверждено французским физиком Ж. Перреном.
Масса и размеры молекул
Размеры частиц
Диаметр любого атома составляет около ![]() см.
см.

Число молекул в веществе

где V – объем вещества, Vo – объем одной молекулы
Масса одной молекулы

где m – масса вещества,
N – число молекул в веществе
Единица измерения массы в СИ: [m]= 1 кг
В атомной физике массу обычно измеряют в атомных единицах массы (а.е.м.).
Условно принято считать за 1 а.е.м. :

Относительная молекулярная масса вещества
Для удобства расчетов вводится величина – относительная молекулярная масса вещества.
Массу молекулы любого вещества можно сравнить с 1/12 массы молекулы углерода.

где числитель – это масса молекулы, а знаменатель – 1/12 массы атома углерода
![]() – это величина безразмерная, т.е. не имеет единиц измерения
– это величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса химического элемента

где числитель – это масса атома, а знаменатель – 1/12 массы атома углерода
![]() – величина безразмерная, т.е. не имеет единиц измерения
– величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса каждого химического элемента дана в таблице Менделеева.
Другой способ определения относительной молекулярной массы вещества
Относительная молекулярная масса вещества равна сумме относительных атомных масс химических элементов, входящих в состав молекулы вещества.
Относительную атомную массу любого химического элемента берем из таблицы Менделеева!)
Количество вещества
Количество вещества (ν) определяет относительное число молекул в теле.

где N – число молекул в теле, а Na – постоянная Авогадро
Единица измерения количества вещества в системе СИ: [ν]= 1 моль
1 моль – это количество вещества, в котором содержится столько молекул (или атомов), сколько атомов содержится в углероде массой 0,012 кг.
Запомни!
В 1 моле любого вещества содержится одинаковое число атомов или молекул!
Но!
Одинаковые количества вещества для разных веществ имеют разную массу!
Постоянная Авогадро
Число атомов в 1 моле любого вещества называют числом Авогадро или постоянной Авогадро:

Молярная масса
Молярная масса (M) – это масса вещества, взятого в одном моле, или иначе – это масса одного моля вещества.

где
![]() – масса молекулы
– масса молекулы
![]() – постоянная Авогадро
– постоянная Авогадро
Единица измерения молярной массы: [M]=1 кг/моль.
Формулы для решения задач
Эти формулы получаются в результате подстановки вышерассмотренных формул.
Масса любого количества вещества

и формула для 7 класса

Количество вещества
![]()
Число молекул в веществе

Молярная масса

Масса одной молекулы

Связь между относительной молекулярной массой и молярной массой

Молекулярная физика. Термодинамика – Класс!ная физика
Основные положения МКТ. Масса и размер молекул. Количество вещества. —
Взаимодействие молекул. Строение твердых тел, жидкостей и газов. —
Идеальный газ. Основное уравнение МКТ. —
Температура. Тепловое равновесие. Абсолютная шкала температур. —
Уравнение состояния идеального газа. —
Изопроцессы. Газовые законы. —
Взаимные превращения жидкостей и газов. Влажность воздуха. —
Твердые тела. Кристаллические тела. Аморфные тела.
Кикоин А.К. Простой способ определения размеров молекул // Квант. — 1983. — № 9. — C.29-30.
По специальной договоренности с редколлегией и редакцией журнала “Квант”
В молекулярной физике главные «действующие лица» — это молекулы, невообразимо маленькие частицы, из которых состоят все на свете вещества. Ясно, что для изучения многих явлений важно знать, каковы они, молекулы. В частности каковы их размеры.
Когда говорят о молекулах, их обычно считают маленькими упругими твердыми шариками. Следовательно, знать размер молекул значит знать их радиус.
Несмотря на малость молекулярных размеров, физики сумели разработать множество способов их определения. В «Физике 9» рассказывается о двух из них. В одном используется свойство некоторых (очень немногих) жидкостей растекаться в виде пленки толщиной в одну молекулу. В другом размер частицы определяется с помощью сложного прибора — ионного проектора.
Существует, однако, очень простой, хотя и не самый точный, способ вычисления радиусов молекул (или атомов) Он основан на том, что молекулы вещества, когда оно находится в твердом или жидком состоянии, можно считать плотно прилегающими друг к другу. В таком случае для грубой оценки можно считать, что объем V некоторой массы m вещества просто равен сумме объемов содержащихся в нем молекул. Тогда объем одной молекулы мы получим, разделив объем V на число молекул N.
Число молекул в теле массой m равно, как известно, (~N_a frac{m}{M}), где М — молярная масса вещества NA — число Авогадро. Отсюда объем V0 одной молекулы определяется из равенства
(~V_0 = frac{V}{N} = frac{V M}{m N_A}) .
В это выражение входит отношение объема вещества к его массе. Обратное же отношение (~frac{m}{V} = rho) есть плотность вещества, так что
(~V_0 = frac{M}{rho N_A}) .
Плотность практически любого вещества можно найти в доступных всем таблицах. Молярную массу легко определить, если известна химическая формула вещества.
Объем одной молекулы, если считать ее шариком, равен (~frac{4}{3} pi r^3), где r – радиус шарика. Поэтому
(~frac{4}{3} pi r^3 = frac{M}{rho N_A}) .
откуда мы и получаем выражение для радиуса молекулы:
(~r = sqrt[3] {frac{3M}{4 pi rho N_A}} = sqrt[3] {frac{3}{4 pi N_A}} sqrt[3] {frac{M}{rho}}) .
Первый из этих двух корней — постоянная величина, равная ≈ 7,4 · 10-9 моль1/3, поэтому формула для r ринимает вид
(~r approx 7,4 cdot 10^{-9} sqrt[3] {frac{M}{rho}} (m)) .
Например, радиус молекулы воды, вычисленный по этой формуле, равен rВ ≈ 1,9 · 10-10 м.
Описанный способ определения радиусов молекул не может быть точным уже потому, что шарики нельзя уложить так, чтобы между ними не было промежутков, даже если они соприкасаются друг с другом. Кроме того, при такой «упаковке» молекул- шариков были бы невозможны молекулярные движения. Тем не менее вычисления размеров молекул по формуле, приведенной выше, дают результаты, почти совпадающие с результатами других методов, несравненно более точных.
Размеры атомов и молекул
Туннельные
микроскопы обеспечивают увеличение в
100 млн раз. Это позволяет измерять размеры
атомов с очень большой точностью. Так,
диаметр атома углерода оказался равным
1,4·10-8
см. Такой же порядок имеют и размеры
других атомов.
Размеры атомов и
молекул, найденные другими методами,
оказываются примерно такими же.
Эти
размеры так малы, что их невозможно себе
представить. Что вам может сказать,
например, число 2,3·10-8см
— размер молекулы водорода? В таких
случаях прибегают к помощи сравнений.
Если, например, вашу голову увеличить
до размеров средней звезды типа Солнца,
то молекула при этом увеличится до
размеров головы.
А
вот еще сравнение. Если представить
себе, что все размеры в мире возросли в
108
раз, то молекула водорода будет выглядеть
как шарик диаметром всего в 2,3 см (средних
размеров слива), а рост человека стал
бы равным 170 000 км, размер мухи — 10 000 км,
толщина волоса — 10км, размер красного
кровяного тельца (эритроцита) — 700 м.
Число молекул
При
столь малых размерах молекул число их
в любом макроскопическом теле чрезвычайно
велико. Подсчитаем приблизительное
число молекул в капле воды массой 1 г и,
следовательно, объемом 1 см3.
Диаметр молекулы воды равен приблизительно
3·10-8см.
Считая, что каждая молекула воды при
плотной упаковке молекул занимает объем
(3·10-8
см)3,
можно найти число молекул в капле,
разделив объем капли (1 см3)
на объем, приходящийся на одну молекулу:
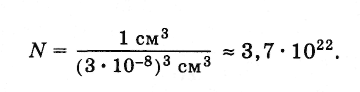
Представьте
себе, что поверхность земного шара
твердая и гладкая. На всей поверхности
вплотную друг к другу стоят люди. Число
людей при этом будет чуть меньше числа
молекул в 1 см3
воздуха при нормальном атмосферном
давлении и температуре 0 °С.
Надо
помнить основные положения
молекулярно-кинетической теории. Атомы
имеют размеры порядка 10-8см.
Изображения
атомов, полученные с помощью туннельного
микроскопа, не оставляют никаких сомнений
в их существовании,
§ 2.2. Масса молекул. Постоянная Авогадро
Массы молекул
очень малы, если выражать их в граммах
или килограммах, а число молекул в
макроскопических телах огромно. С очень
маленькими и очень большими числами
иметь дело неудобно. Ученые нашли
довольно простой способ избежать этого
неудобства и характеризовать массы
молекул и их число вполне обозримыми
числами, не выходящими далеко за пределы
сотни. Сейчас вы познакомитесь с тем,
как это делается.
Масса молекулы воды
В
предыдущем параграфе мы выяснили, что
в 1 г воды содержится 3,7·1022
молекул. Следовательно, масса одной
молекулы равна:
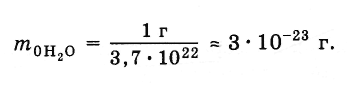
Массы такого же
порядка имеют и молекулы других веществ,
исключая огромные молекулы органических
соединений. Например, масса молекулы
гемоглобина превышает массу молекулы
воды в несколько десятков тысяч раз.
Относительная молекулярная масса
Так
как массы молекул очень малы, удобно
использовать не абсолютные значения
масс, а относительные. По международному
соглашению, принятому в 1961 г., массы всех
молекул сравнивают с
![]() массы атома углерода* (так называемая
массы атома углерода* (так называемая
углеродная шкала атомных масс). Главная
причина выбора углеродной шкалы атомных
масс состоит в том, что углерод входит
в огромное число различных органических
соединений. Этот выбор позволяет очень
точно сравнивать массы атомов тяжелых
элементов с массой атома углерода.
Множитель![]() введен для того, чтобы относительные
введен для того, чтобы относительные
массы атомов были близки к целым числам.
Относительная масса атома углерода
точно равна 12, а атома водорода примерно
равна единице.
*
Точнее, с
![]()
массы атома наиболее
распространенного изотопа углерода-12.
Относительной
молекулярной (или атомной) массой
вещества Мr
называют
отношение массы молекулы (или атома)
данного вещества к
![]()
массы
атома углерода т0С:

(2.2.1)
Относительные
атомные массы всех химических элементов
точно измерены. Складывая относительные
атомные массы, можно вычислить
относительную молекулярную массу.
Например, относительная молекулярная
масса воды Н2О
приближенно равна 18, так как относительные
атомные массы водорода и кислорода
примерно равны 1 и 16:2-1 + 16=18.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
