Молекулы вступают в реакцию в определённых соотношениях, и это описывают химические реакции. Например, из этого уравнения
2Н2 + О2 = 2Н2О
видно, что в реакции приняли участие 2 молекулы водорода и 1 молекула кислорода, образовав при этом 2 молекулы воды. Но молекула так малы, что увидеть их невозможно, и уж тем более нельзя взять их в руки. Поэтому в учебнике химии и появляется понятие моль – количество вещества, в котором содержится число Авогадро частиц (6,02*10 в двадцать третьей степени). Рядом с этим понятием стоит другое – молярная масса, то есть масса 1 моля частиц. Молярная масса совпадает с атомной или молекулярной, рассчитывается по таблице Менделеева и выражается в граммах на моль (г/моль).
Но мы прекрасно знаем, что не все вещества в обычных условиях находятся в твёрдом или жидком состоянии. Например, кислород, азот, хлор, неон – это газы. Резонно спросить: а как же их взвешивать? На этот случай химии для 8 класса припасено ещё одно понятие – молярный объём.
Что такое молярный объём
Тут следует запомнить, что в обычных условиях 1 моль любого газа занимает одинаковый объём. То есть молярный объём – это объём 1 моля любого газа. Сейчас советую на всякий случай вспомнить, что в 1 моле любого вещества (в том числе газа) содержится число Авогадро частиц. Старайтесь не забывать об этом факте.
Теперь надо обязательно упомянуть следующее. Все знают, что при изменении температуры и давления объём газов меняется. Так вот чтобы все расчёты вести правильно, то есть в одинаковых условиях, говорят о нормальных условиях: температуре 0 градусов Цельсия и давлении в 1 атмосферу (или 101,3 кПа). Это нужно просто запомнить:
нормальные условия в химии: температура – 0 градусов Цельсия, давление – 1 атм.
Экспериментально было доказано, что в нормальные условиях 1 моль любого газа занимает объем 22,4 литра.
То есть молярный объём любого газа в н.у. составляет 22,4 л/моль.
И это число тоже нужно запомнить! Оно даже важнее, чем сами нормальные условия, потому используется это число в решениях по химии намного чаще, чем н.у. (нормальные условия).
Как найти молярный объём
Очень просто. Если молярную массу для каждого вещества нужно рассчитывать по таблице Менделеева, то
молярный объём для всех газов одинаков.
Пример 1.
Молярная масса воды Н2О 18 г/моль (2*1+16, всё берем из периодической таблицы), молярная масса оксида кальция СаО 56 г/моль (40+16), молярная масса серной кислоты Н2SO4 98 г/моль (2*1+32+4*16).
Зато в нормальных условиях молярный объём кислорода О2 22,4 л/моль, молярный объём фтора P2 22,4 л/моль, молярный объём ксенона 22,4 г/моль. Приятно, не правда ли?
Другое дело, если речь идёт о химических реакциях. Но для начала просто потренируемся с цифрами.
Пример 2.
Определите объём, который занимают 10 моль кислорода в н.у.
Решение:
Молярный объём кислорода 22,4 л/моль, то есть 1 моль занимает 22,4 л. Следовательно, 10 моль будут занимать в 10 раз больше 22,4*10=224 литра. Это и есть ответ: 10 моль кислорода займут объём 224 литра.
Пример 3.
Известно, что неон в н.у. занял объём 5,6 литра. В каком количестве взят неон (в молях)?
Решение:
1 моль занимает объём 22,4 литра, а вот неизвестное число моль заняло объём 5,6 литра. Можно составить пропорцию:
1 моль – 22,4 литра
Х моль – 5,6 литра
Отсюда Х=1*5,6/22,4=0,25. Значит ответ такой: неон взяли в количестве 0,25 моль.
Пример 4.
Это уже расчёт по химической реакции, поэтому будьте внимательны. Итак, хлор прореагировал с водородом с образованием хлорида водорода:
Н2 + Cl2 = 2HCl
Для реакции взяли 11,2 литра водорода. Сколько понадобилось хлора (н.у.)?
Решение:
Посмотрим, сколько нам дано водорода по условию задачи. 1 моль водорода занимает объём 22,4 литра. Но у нас всего 11,2 литра водорода, то есть Х моль. Составим пропорцию:
1 моль – 22,4 литра
Х моль – 11,2 литра
Отсюда Х=1*11,2/22,4=0,5 моль водорода. Значит, по условию задачи у нас водорода 0,5 моль.
Из уравнения химической реакции Н2 + Cl2 = 2HCl видно, что нам нужно по 1 молю водорода и хлора (об этом говорят коэффициенты в уравнении). То есть, 1 моль водорода реагирует с 1 молем хлора. Но нам дали всего 0,5 моль водорода, сколько нам нужно хлора? Составим ещё одну пропорцию:
1 моль водорода реагирует с 1 молем хлора
0,5 моль водорода реагирует с Х молями хлора.
Отсюда получаем: Х=0,5*1/1=0,5 моль. Таким образом, нам нужно 0,5 моль хлора. А это количество занимает объём 22,4*0,5=11,2 литра.
Ответ: понадобилось 11,2 литра хлора.
В следующий раз мы научимся делать расчёты по реакциям, в которых участвуют и твёрдые вещества, и газы, то есть одновременно будем использовать молярную массу и молярный объём.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Молярный объем газа


4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
Для того, чтобы узнать состав любых газообразных веществ необходимо уметь оперировать такими понятиями, как молярный объем, молярная масса и плотность вещества. В данной статье рассмотрим, что такое молярный объем, и как его вычислить?
Количество вещества
Количественные расчеты проводят с целью, чтобы в реальности осуществить тот или иной процесс или узнать состав и строение определенного вещества. Эти расчеты неудобно производить с абсолютными значениями массы атомов или молекул из-за того, что они очень малы. Относительные атомные массы также в большинстве случаев невозможно использовать, так как они не связаны с общепринятыми мерами массы или объема вещества. Поэтому введено понятие количество вещества, которое обозначается греческой буквой v (ню) или n. Количество вещества пропорционально числу содержащихся в веществе структурных единиц (молекул, атомных частиц).
Единицей количества вещества является моль.
моль – это такое количество вещества, которое содержит столько же структурных единиц, сколько атомов содержится в 12 г изотопа углерода.
Масса 1 атома равна 12 а. е. м., поэтому число атомов в 12 г изотопа углерода равно:
Na= 12г/12*1,66057*10в степени-24г=6,0221*10 в степени 23
Физическая величина Na называется постоянной Авогадро. Один моль любого вещества содержит 6,02*10 в степени 23 частиц.

Молярный объем газа
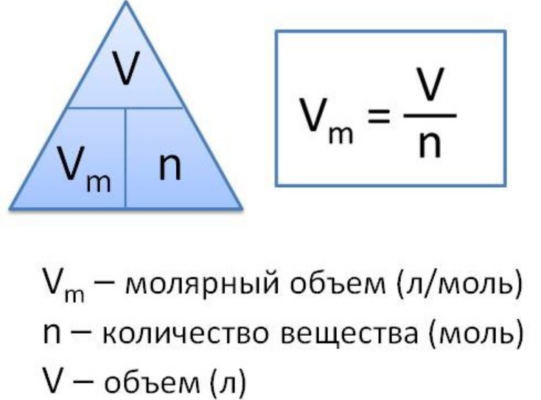
Молярный объем газа – это отношение объема вещества к количеству этого вещества. Эту величину вычисляют при делении молярной массы вещества на его плотность по следующей формуле:
Vm=M/p,
где Vm – молярный объем, М – молярная масса, а p – плотность вещества.
В международной системе Си измерение молярного объема газообразных веществ осуществляется в кубических метрах на моль (м3 /моль)
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа. Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм3 /м.

Таблица «молярный объем газов»
В следующей таблице представлен объем некоторых газов:
| Газ | Молярный объем, л |
| H2 | 22,432 |
| O2 | 22,391 |
| Cl2 | 22,022 |
| CO2 | 22,263 |
| NH3 | 22,065 |
| SO2 | 21,888 |
| Идеальный | 22,41383 |

Что мы узнали?
Молярный объем газа, изучаемый по химии (8 класс) наряду с молярной массой и плотностью являются необходимыми величинами для определения состава того или иного химического вещества. Особенностью молярного газа является то, что в одном моле газа всегда содержится одинаковый объем. Этот объем называется молярным объемом газа.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Аэлита Коробка
5/5
-

Александр Котков
5/5
-

Настя Бабич
5/5
-

Александр Котков
5/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
А какая ваша оценка?
Моля́рный объём Vm — отношение объёма вещества к его количеству, численно равен объёму одного моля вещества. Термин «молярный объём» может быть применён к простым веществам, химическим соединениям и смесям. В общем случае он зависит от температуры, давления и агрегатного состояния вещества. Молярный объём также можно получить делением молярной массы M вещества на его плотность ρ: таким образом, Vm = V/n = M/ρ. Молярный объём характеризует плотность упаковки молекул в данном веществе. Для простых веществ иногда используется термин атомный объём[1].
В Международной системе единиц (СИ) единицей измерения молярного объёма является кубический метр на моль (русское обозначение: м3/моль; международное: m3/mol).
Молярный объём смеси[править | править код]
Для смеси веществ, при расчёте молярного объёма, количеством вещества считают сумму количеств всех веществ, составляющих смесь. Если известна плотность смеси ρc, мольные доли компонентов xi и их молярные массы Mi, молярный объём смеси можно найти как отношение средней молярной массы смеси (суммы молярных масс её компонентов, умноженных на их мольные доли) к плотности смеси.
Молярный объём газов[править | править код]
Согласно закону Авогадро, одинаковые количества газов при одинаковых условиях занимают одинаковый объём. Молярный объём идеального газа рассчитывается по формуле, выводящейся из уравнения состояния идеального газа
,
где T — термодинамическая температура, P — давление, R = 8,314 462 618 153 24 (точно) м3⋅Па⋅К−1⋅моль−1 — универсальная газовая постоянная.
При стандартных условиях (T = 273,15 K (0 °C), P = 101 325 Па) молярный объём идеального газа Vm = 22,413 969 545… л/моль[2][3]. Молярные объёмы идеального газа при других давлениях и температурах, часто принимаемых в качестве стандартных:
- Vm = 24,465 403 697… л/моль (T = 298,15 K (25 °C), P = 101 325 Па),
- Vm = 22,710 954 641… л/моль (T = 273,15 K (0 °C), P = 100 000 Па)[4],
- Vm = 24,789 570 296… л/моль (T = 298,15 K (25 °C), P = 100 000 Па).
| Газ | Vm, л/моль | Газ | Vm, л/моль |
|---|---|---|---|
| He | 22,426 | CO | 22,408 |
| Ne | 22,428 | CO2 | 22,262 |
| Ar | 22,394 | N2O | 22,260 |
| Kr | 22,388 | SO2 | 21,889 |
| Xe | 22,266 | CH4 | 22,376 |
| H2 | 22,430 | C2H6 | 22,176 |
| O2 | 22,393 | C2H4 | 22,255 |
| N2 | 22,404 | C2H2 | 22,157 |
Молярные объёмы реальных газов в той или иной степени отличаются от молярного объёма идеального газа, однако во многих случаях для практических вычислений отклонениями от идеальности можно пренебречь. Различие молярных объёмов идеального и реального газа связано в первую очередь с силами притяжения между молекулами и с конечным объёмом молекулы реального газа; в связи с этим, уравнение состояния реального газа с большей точностью описывается не формулой Менделеева — Клапейрона (уравнением состояния идеального газа), а формулой Ван-дер-Ваальса:
В таблице справа приведены молярные объёмы некоторых реальных газов (T = 273,15 K (0 °C), P = 101 325 Па)[5]. Видно, что для газов с относительно большими молекулами (двуокись серы, углеводороды) молярный объём несколько меньше молярного объёма идеального газа (22,414 л/моль в указанных условиях); для газов с маленькими молекулами (гелий, неон, водород) молярный объём несколько больше «идеального».
С молярным объёмом идеального газа связана постоянная Лошмидта NL — количество молекул идеального газа в единице объёма при стандартных условиях:
Молярный объём кристаллов[править | править код]
Объём Vя элементарной ячейки кристалла можно вычислить из параметров кристаллической структуры, которые определяются с помощью рентгеноструктурного анализа. Объём ячейки связан с молярным объёмом следующим образом:
- Vm = VяNA/Z,
где Z — количество формульных единиц в элементарной ячейке.
Значения молярного объёма химических элементов[править | править код]
Ниже приведены значения молярного (атомного) объёма простых веществ в см3/моль (10−6 м3/моль, 10−3 л/моль) при нормальных условиях либо (для элементов, газообразных при н.у.) при температуре конденсации и нормальном давлении.
| Группа | I A (1) | II A (2) | III B (3) | IV B (4) | V B (5) | VI B (6) | VII B (7) | VIII B (8) | VIII B (9) | VIII B (10) | I B (11) | II B (12) | III A (13) | IV A (14) | V A (15) | VI A (16) | VII A (17) | VIII A (18) |
| Период | ||||||||||||||||||
| 1 | H 14,0 |
He 31,8 |
||||||||||||||||
| 2 | Li 13,1 |
Be 5 |
B 4,6 |
C 5,3 |
N 17,3 |
O 14 |
F 17,1 |
Ne 16,8 |
||||||||||
| 3 | Na 23,7 |
Mg 14 |
Al 10 |
Si 12,1 |
P 17 |
S 15,5 |
Cl 18,7 |
Ar 24,2 |
||||||||||
| 4 | K 45,3 |
Ca 29,9 |
Sc 15 |
Ti 10,6 |
V 8,35 |
Cr 7,23 |
Mn 7,39 |
Fe 7,1 |
Co 6,7 |
Ni 6,6 |
Cu 7,1 |
Zn 9,2 |
Ga 11,8 |
Ge 13,6 |
As 13,1 |
Se 16,5 |
Br 23,5 |
Kr 32,2 |
| 5 | Rb 55,9 |
Sr 33,7 |
Y 19,8 |
Zr 14,1 |
Nb 10,8 |
Mo 9,4 |
Tc 8,5 |
Ru 8,3 |
Rh 8,3 |
Pd 8,9 |
Ag 10,3 |
Cd 13,1 |
In 15,7 |
Sn 16,3 |
Sb 18,4 |
Te 20,5 |
I 25,7 |
Xe 42,9 |
| 6 | Cs 70 |
Ba 39 |
* | Hf 13,6 |
Ta 10,9 |
W 9,53 |
Re 8,85 |
Os 8,43 |
Ir 8,54 |
Pt 9,1 |
Au 10,2 |
Hg 14,8 |
Tl 17,2 |
Pb 18,3 |
Bi 21,3 |
Po 22,7 |
At н/д |
Rn н/д |
| 7 | Fr н/д |
Ra 45 |
** | Rf н/д |
Db н/д |
Sg н/д |
Bh н/д |
Hs н/д |
Mt н/д |
Ds н/д |
Rg н/д |
Cn н/д |
Nh н/д |
Fl н/д |
Mc н/д |
Lv н/д |
Ts н/д |
Og н/д |
| Лантаноиды | * | La 22,5 |
Ce 21 |
Pr 20,8 |
Nd 20,6 |
Pm 19,96 |
Sm 19,9 |
Eu 28,9 |
Gd 19,9 |
Tb 19,2 |
Dy 19 |
Ho 18,7 |
Er 18,4 |
Tm 18,1 |
Yb 24,8 |
Lu 17,8 |
||
| Актиноиды | ** | Ac 22,54 |
Th 19,8 |
Pa 15 |
U 12,5 |
Np 21,1 |
Pu 12,12 |
Am 20,8 |
Cm 18,28 |
Bk 16,8 |
Cf 16,5 |
Es н/д |
Fm н/д |
Md н/д |
No н/д |
Lr н/д |
||
См. также[править | править код]
- Число Авогадро
- Удельный объём
- Молярная масса
- Молярная теплоёмкость
Примечания[править | править код]
- ↑ Для молекулярных кристаллов простых веществ молярный объём, определяемый через 1 моль молекул, не равен атомному объёму, поскольку количество атомов не равно количеству молекул. В этих случаях необходимо уточнять, относится ли указанная величина к молекулярному или к атомному молярному объёму. Так, атомный молярный объём иода (кристаллы, состоящие из двухатомных молекул I2) вдвое меньше молекулярного молярного объёма.
- ↑ CODATA Value: molar volume of ideal gas (273.15 K, 101.325 kPa). Дата обращения: 17 ноября 2022.
- ↑ После изменения определений основных единиц СИ в 2019 году универсальная газовая константа стала не измеряемой, а определяемой (точно фиксированной) величиной, будучи произведением точно фиксированных величин — постоянной Больцмана и постоянной Авогадро. Это же относится и к стандартному молярному объёму.
- ↑ CODATA Value: molar volume of ideal gas (273.15 K, 100 kPa). Дата обращения: 17 ноября 2022.
- ↑ 1 2 Battino R. The Ostwald coefficient of gas solubility (англ.) // Fluid Phase Equilibria. — 1984. — Vol. 15, no. 3. — P. 231—240. — ISSN 0378-3812. — doi:10.1016/0378-3812(84)87009-0. [исправить]; Table 2.
Рассчитать объем водорода.
Рассчитать объем водорода (газа) при нормальных условиях, если известна его масса, можно по формуле: V = m · Vm / M = ν · Vm. Рассчитать объем водорода (газа), если известна его масса, температура и давление, можно по формуле: V = m · R · T / (p · M) = ν · R · T / p.
Химическая формула водорода H₂.
Расчет объема водорода (газа)
Теория расчета объема газа
Пример: Рассчитайте объем для 20 г водорода
Рассчитать объем газа: азота, водорода, гелия
Рассчитать объем водорода (газа) при нормальных условиях:
Рассчитать объем водорода (газа):
Теория:
Рассчитать объем водорода (газа) при нормальных условиях, если известна его масса, можно по формуле:
V = m · Vm / M = ν · Vm,
где
V – объем газа, л,
ν – количество вещества, моль,
Vm – молярный объем газа, л/моль, Vm = 22,4 л/моль,
ν = m / M,
m – масса газа, г,
М – молярная масса газа, г/моль,
M(Н₂) = 2·1,008 = 2,016 г/моль,
Нормальные условия: 0 оС (или 273,15 К), 101,325 кПа или 1 атм.
Рассчитать объем водорода (газа), если известна его масса, температура и давление, можно по формуле:
V = m · R · T / (p · M) = ν · R · T / p,
где
V – объем газа, л,
ν – количество вещества, моль,
ν = m / M,
m – масса газа, г,
М – молярная масса газа, г/моль,
M(Н₂) = 2·1,008 = 2,016 г/моль,
R – универсальная газовая постоянная, R ≈ 8,314 Дж/(моль⋅К),
T – термодинамическая температура, К.
P – давление, кПа.
Пример: Рассчитайте объем для 20 г водорода:
Рассчитайте объем для 20 г водорода при нормальных условиях.
V = m · Vm / M = 20 грамм · 22,4 л/моль / 2,016 г/моль = 222,222 литра.
Рассчитайте объем для 20 г водорода при 30 градусах Цельсия (303,15 К), давлении 30 кПа.
V = m · R · T / p · M = 20 грамм · 8,314 Дж/(моль⋅К) · 303,15 К / (30 кПа · 2,016 г/моль) = 833,462 литра.
Рассчитать объем газа: азота, водорода, гелия
Коэффициент востребованности
1 629
Содержание
- 1 Какова масса одного моля H2??
- 2 Сколько молей в H2?
- 3 Как найти один моль H2?
- 4 Какова масса H2?
- 5 Какова масса 2 молей Н2?
- 6 Какова масса 5 молей H2?
- 7 Каков объем 1 моля H2 при нормальных условиях?
- 8 Как найти массу одного моля водорода?
- 9 Какова масса 1 молекулы водорода?
- 10 Какова масса H2 в кг?
- 11 Сколько граммов Н2 содержится в 4 молях Н2?
- 12 Сколько граммов в H2?
- 13 Какова масса 1 моль 14n?
- 14 Какова масса 75 молей газообразного водорода H2?
- 15 Какова масса 4 молей газообразного водорода?
- 16 Сколько граммов Н2 содержится в 3 молях Н2?
- 17 Как найти объем H2?
- 18 Какова масса 22,4 л H2 при нормальных условиях?
- 19 Каков объем 1 моля газа по НТП?
- 20 Что такое моль водорода?
- 21 Какова масса молекулы H2 в граммах?
- 22 Сколько атомов водорода содержится в 1 моль Н?
- 23 Какова атомная масса одного моля O г моля?
- 24 Является ли молярная масса водорода равной 1 или 2?
- 25 Сколько молей в 1 кг водорода?
- 26 Какова масса 1 атома водорода в кг?
- 27 Чему равны 2 моля H2 в граммах?
- 28 Какова атомная масса фтора?
- 29 Какова масса 1 моля газообразного азота N2)?
- 30 Какова масса 1 моля ионов хлора?
- 31 Сколько молей в 10 граммах h2?
- 32 Сколько граммов в 1 моль хлорида аммония?
- 33 Какова молярная масса водорода?
- 34 Какой термин одинаков для 1 моля O2 и H2O?
- 35 Молярная масса / молекулярная масса H2: газообразный водород
- 36 Концепция крота – часть 1 | Атомы и молекулы | Не запоминай
- 37 8 | Сравните 1 моль H2, 1 моль O2 и 1 моль F2. Что имеет наибольшее количество молекул?
- 38 Рассчитайте массу отдельного атома или молекулы
Смотрите также, как тяжело в школе lpn
2,01588 грамма
Сколько молей в H2?
Н2 – есть 2 родинки атомов водорода (1 моль элементарного водорода). Итого: 2 моля атомов.
Как найти один моль H2?
Используйте массу газообразного водорода для прямого расчета молей газа; разделите вес водорода на его молярную массу 2 г/моль. Например, 250 граммов (г) газообразного водорода соответствует 250 г/2 г/моль = 125 молей.
Какова масса H2?
1,00794 H2, представляет собой элементарный газ с атомной массой 1.00794.
Какова масса 2 молей Н2?
Ответ 2.01588.
Какова масса 5 молей Н2?
Молярная масса водорода составляет 1,008 г/моль. Формула газообразного водорода — H2, что означает, что он состоит из двух атомов водорода, поэтому его молярная масса составляет 2,016 г/моль. 5 моль H2 x 2,016 г/моль = 10,08 г.
Каков объем 1 моля H2 при нормальных условиях?
22,4 л. Как обсуждалось в предыдущем разделе, эксперимент позволяет определить давление, объем и температуру H2(g). Закон Авогадро определяет, что объем одного моля любого газа при нормальных условиях равен 22,4 л.
Как найти массу одного моля водорода?
Масса 1 моля атомов водорода = Масса 1 атома водорода × NA , где NA=L=6,0225×1023⋅моль−1.
Какова масса 1 молекулы водорода?
2,016 а.е.м.
Масса молекулы водорода составляет 2,016 а.е.м.
Какова масса Н2 в кг?
2.016 Определение и молекулярная масса (молярная масса) некоторых обычных веществ
| вещество | Молекулярная масса [кг/кмоль] [г/моль] [фунт/фунт-моль] |
|---|---|
| н – гексан | 86.178 |
| Соляная кислота | 36.47 |
| Водород, H2 | 2.016 |
| Хлористый водород | 36.461 |
Сколько граммов Н2 содержится в 4 молях Н2?
Сколько граммов в H2?
1 моль равен 1 молю H2, или 2,01588 грамма.
Какова масса 1 моль 14n?
Масса атома азота = количество молей × атомная масса. Итак, масса азота = 1 × 14 = 14 г. Масса одного моля атомов азота равна 14 г.
Какова масса 75 молей газообразного водорода H2?
4 : 1 моль H2 = 2 г. 5 : 75 моль H2 = 75 × 1 моль H2 = 75 × 2 г = 150 г.
Какова масса 4 молей газообразного водорода?
Масса 4 молей газообразного водорода равна 8,064 г.
Сколько граммов Н2 содержится в 3 молях Н2?
Следовательно 6,00 грамм используется газообразный водород.
Как найти объем H2?
Какова масса 22,4 л Н2 при СТП?
1. 09 мг`
Каков объем 1 моля газа в НТП?
22,4 л Стандартный молярный объем идеального газа принимается равным 22,414 л/моль на СТП. По гипотезе Авогадро один грамм-моль газа при НТП занимает 22,4 л.
См. также, что такое диапазон допуска
Что такое моль водорода?
2,016 грамма Количество любого вещества в граммах, численно равное его атомному или молекулярному весу в а.е.м., определяется как один моль этого вещества. Согласно этому определению, один моль водорода равен 2,016 грамма, один моль метана составляет 16,043 грамма, а один моль воды — 18,015 грамма.
Какова масса молекулы H2 в граммах?
1,00794 г/моль Молярная масса
| Элемент/молекула | Молярная масса (М) |
|---|---|
| Водород (Н) | 1,00794 г/моль |
| Углерод (С) | 12,0107 г/моль |
| Железо (Fe) | 55,845 г/моль |
| Уран | 238,02891 г/моль |
Сколько атомов водорода содержится в 1 моль Н?
8 Химическая единица моля. Определение числа Авогадро 6,022 × 1023/моль — это количество атомов или молекул на один грамм атомного веса. На один грамм атомной массы водорода с атомной массой один грамм приходится один моль водорода 6,022 × 1023 атомов водорода.
Какова атомная масса одного моля O г моль?
15,998 грамм Моль вещества и молекулярная масса
Масса кислорода, равная одному молю кислорода, равна 15,998 грамма а масса одного моля водорода равна 1,008 г. Если суммировать количества каждого элемента в молекуле воды в граммах = 15,998 г/моль + 2 (1,008 г/моль), мы получим молярную массу воды = 18,014 г/моль.
Молярная масса водорода равна 1 или 2?
Следовательно, масса молекулы водорода 2 а.е.м., кислорода 32 а.е.м. и азота 28 а.е.м. Теперь давайте поговорим о том, что подразумевается под МОЛЬ вещества… также называемого грамм-моль.
Сколько молей в 1 кг водорода?
Атомная масса водорода 1 г/моль. Чтобы составить 1 килограмм или 1000 г элемента водорода, 1000 молей требуется водород. Каждый моль имеет число атомов или атомов Авогадро. Таким образом, 1 кг элемента водорода или 1000 молей водорода имеют атомы (или в 1000 раз больше числа Авогадро).
Какова масса 1 атома водорода в кг?
Итак, 1 атом водорода весит 1,008/(6,023×10^23) г = 0,167×10^(-23) г = 1,67×10^(-27) кг .
Сколько 2 моль H2 в граммах?
Также указано, что нет. молей молекулы водорода равно 2. 2 = Масса2. Итак, масса 2 молей водорода равна 4 грамма.
Какова атомная масса фтора?
18.998403 ю
См. также, что было существенным недостатком закона о социальном обеспечении?
Какова масса 1 моля газообразного азота N2)?
Масса одного моля атомов азота равна 14 г.
Какова масса 1 моля ионов хлора?
35,453 г/моль
Сколько молей в 10 граммах h2?
5 грамм-моль.
Сколько граммов в 1 моль хлорида аммония?
53,49 г/моль Молярная масса хлорида аммония, NH4ClNH4Cl, составляет 53,49 г/моль. Это означает, что 1 моль вещества весит…
Какова молярная масса водорода?
1,00784 ед.
Какой термин одинаков для 1 моля О2 и Н2О?
Но общее между одним молем O2 и одним молем H2O состоит в том, что оба содержат одинаковое количество частиц, которое составляет 6,02*10^23. Этот номер называется постоянная Авогадро.



