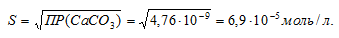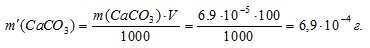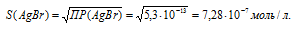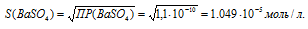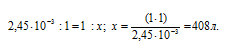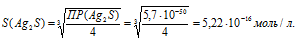Решение задач по хими на вычисления с использованием значения произведения растворимости соли
Задача 563.
Исходя из произведения растворимости карбоната кальция, найти массу СаСО3, содержащуюся в 100 мл его насыщенного раствора.
Решение:
ПР(СаСО3) = 4,76 . 10-9.
Обозначим искомую растворимость соли СаСО3 через S моль/л. Тогда в насыщенном растворе соли содержится по S моль/л ионов Ca2+ и CO32-.
Выражение произведения растворимости карбоната кальция можно записать как:
ПР(СаСО3) = [Ca2+] . [CO32-] = S . S = S2.
Отсюда
Теперь рассчитаем массу СаСО3 в 1 л насыщенного раствора его:
m(СаСО3) = S . M(СаСО3) = (6,9 . 10-5) . 100 = 6,9 . 10-2.
Находим массу СаСО3 в 100 мл насыщенного раствора его:
Ответ: 6,9 . 10-4 г.
Задача 564.
Найти массу серебра, находящегося в виде ионов в 1 л насыщенного раствора АgВг.
Решение:
ПР(АgВг) = 5,3 . 10-13.
Обозначим искомую растворимость соли АgВг. через S моль/л. Тогда в насыщенном растворе соли содержится по S моль/л ионов Ag+ и Br–.
Выражение произведения растворимости бромида серебра можно записать как:
ПР(AgBr = = [Ag+] . [Br–] = S . S = S2.
Отсюда
Рассчитаем массу АgВг в 1л раствора, учитывая, что M(Ag+) = 107,688 г/моль, получим:
m(Ag+) = S . M(Ag+) = (7,28 . 10-7) . 107,688 = 7,85 . 10-5 г.
Ответ: 7,85 . 10-5 г.
Задача 565.
Вычислить объем воды, необходимый для растворения при 25°С 1 г ВаSO4.
Решение:
ПР(ВаSO4) = 1 . 10-10.
Уравнение диссоциации ВаSO4 имеет вид:
ВаSO4 ⇔ Ba2+ + SO42-.
Обозначим искомую растворимость соли ВаSO4 через S моль/л. Тогда в насыщенном растворе соли содержится по S моль/л ионов Ba2+ и SO42-.
Выражение произведения растворимости сульфата бария можно записать как:
ПР(AgBr) = [Ba2+] . [SO42-] = S . S = S2.
Отсюда
Рассчитаем массу ВаSO4 в 1л раствора, учитывая, что M(ВаSO4) = 233,39 г/моль, получим:
m(ВаSO4) = S . M(ВаSO4) = (1,049 . 10-5) . 233,39 = 2,45 . 10-3 г.
Находим объём воды, в котором растворится 1 г ВаSO4 для получения насыщенного раствора его из пропорции:
Ответ: 408 л.
Задача 566.
В каком объеме насыщенного раствора Ag2S содержится 1 мг растворенной соли?
Решение:
M(Ag2S) = 247,796 г/моль.
Обозначим искомую растворимость соли Ag2S через S моль/л. Тогда в насыщенном растворе соли содержится 2S моль ионов Ag+ и 1 моль ионов S2-.
Выражение произведения растворимости сульфида серебра можно записать как
ПР(Ag2S) = [Ag+]2 . [S2-] = 2S2 . S = 4S3.
Отсюда
Рассчитаем массу Ag2S в 1л раствора, учитывая, что M(Ag2S) = 247,796 г/моль, получим:
m(Ag2S) = S . M(Ag2S) = (5,22 . 10-16) . 247,796 = 1,3 . 1013 г или 1,3 . 1010 мг.
Находим объём воды, в котором можно растворить 1 мг сульфида серебра из пропорции:
Ответ: 7,69 . 10-11 л.
Растворимость (Р, χ или ks) – это характеристика насыщенного раствора, которая показывает, какая масса (или объем для газов) растворенного вещества может максимально раствориться в 100 г растворителя. Размерность растворимости — г/ 100 г воды. Поскольку мы определяем массу соли, которая приходится на 100 г воды, в формулу растворимости добавляем множитель 100:
здесь mр.в. – масса растворенного вещества, г
mр-ля – масса растворителя, г
Иногда используют обозначение коэффициент растворимости kS.
Задачи на растворимость, как правило, вызывают сложности, так как эта физическая величина для школьников не очень привычна.
Как же решать задачи на растворимость? Я использую два способа. Давайте их рассмотрим на фрагменте задачи из реального ЕГЭ по химии 2019 года, где впервые появились задачи с упоминанием растворимости.
«Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 400 мл воды.»
Первый способ.
Растворимость не показывает реальное количество соли или количество воды. Это всего лишь способ выражения концентрации в насыщенных растворах, величина, которая показывает, как соотносятся масса растворенного вещества и масса воды (или другого растворенного вещества)! Например, в условии задачи растворимость карбоната натрия 31,8 г на 100 г воды означает, что для растворения каждых 31,8 г соли необходимо 100 г воды. Зато из этих данных можно определить массовую долю растворенного вещества. Рассмотрим этот эталонный раствор, в котором содержится 31,8 г соли и 100 г воды. Массовая доля соли в таком растворе составляет:
ωр.в. = mр.в./mр-ра = 31,8 г/131,8 г = 0,2413 или 24,13%
Но в нашем, реальном растворе, который получается при растворении карбоната натрия в 400 г воды, массовая доля соли такая же!
Зная массу воды и массовую долю соли, мы без труда составим уравнение и определим массу соли в реальном растворе:
ωр.в. = mр.в./(mр.в. + mр-ра)
0,2413 = mр.в./(mр.в. + 400)
mр.в. = 127,2 г
Получается, масса нитрата натрия в реальном растворе равна 127,2 г.
Второй способ.
Используя все тот же эталонный раствор, мы можем составить пропорцию, чтобы определить массу соли в реальном растворе.
На 100 г воды приходится 31,8 г соли (по условию)
на 400 г воды будет приходиться х г соли (в реальном растворе)
Определяем х из пропорции:
х = 400 г · 31,8 г/100 г = 127,2 г нитрата натрия.
Но будьте осторожны! Пропорции можно составить далеко не для всех величин. Но соотносить массу воды и массу растворенного вещества при неизменной концентрации (массовой доле) растворенного вещества можно и иногда очень удобно. Также пропорциональны масса раствора и масса растворенного вещества, масса воды и масса раствора и т.д.
Задача 1. Массовая доля вещества в насыщенном растворе равна 24% при некоторой температуре. Определите коэффициент растворимости этого вещества при данной температуре.
Решение:
Для определения растворимости вещества примем массу раствора равной 100 г. Тогда масса соли равна:
mр.в. = mр-ра⋅ωр.в. = 100⋅0,24 = 24 г
Масса воды равна:
mводы = mр-ра – mр.в. = 100 — 24 = 76 г
Определяем растворимость:
χ = mр.в./mр-ля⋅100 = 24/76⋅100 = 31,6 г вещества на 100 г воды.
Ответ: χ = 31,6 г
Еще несколько аналогичных задач:
2. Массовая доля соли в насыщенном растворе при некоторой температуре равна 28,5%. Определите коэффициент растворимости вещества при этой температуре.
Решение:
Примем массу раствора равной 100 г. Тогда масса соли равна:
mр.в. = mр-ра⋅ωр.в. = 100⋅0,285 = 28,5 г
Масса воды равна:
mводы = mр-ра – mр.в. = 100 — 28,5 = 71,5 г
Определяем растворимость:
χ = mр.в./mр-ля⋅100 = 28,5/71,5⋅100 = 39,86 г вещества на 100 г воды.
Ответ: χ = 39,86 г вещества на 100 г воды.
3. Определите коэффициент растворимости нитрата калия при некоторой температуре, если массовая доля соли при этой температуре равна 0,48.
4. Какая масса воды и соли потребуется для приготовления 500 г насыщенного при некоторой температуре раствора нитрата калия, если его коэффициент растворимости при этой температуре равен 63,9 г соли в 100 г воды?
5. Коэффициент растворимости хлорида натрия при некоторой температуре составляет 36 г соли в 100 г воды. Определите молярную концентрацию насыщенного раствора этой соли, если плотность раствора 1,2 г/мл.
Ответ: 5,49М
6. Какая масса соли и 5% раствора её потребуется для приготовления 450г насыщенного при некоторой температуре раствора сульфата калия, если его коэффициент растворимости при этой температуре равен 439г/1000г воды?
7. Какая масса нитрата бария выделится из раствора, насыщенного при 100ºС и охлаждённого до 0ºС, если во взятом растворе было 150мл воды? Коэффициент растворимости нитрата бария при температурах 0ºС и 100ºС равен соответственно 50г и 342г в 100г воды.
8. Коэффициент растворимости хлорида калия при 90ºС равен 500г/л воды. Сколько граммов этого вещества можно растворить в 500г воды при 90ºС и какова его массовая доля в насыщенном растворе при этой температуре?
9. В 500г воды растворено при нагревании 300г хлорида аммония. Какая масса хлорида аммония выделится из раствора при его охлаждении до 50ºС, если коэффициент растворимости соли при этой температуре равен 50г/л воды?
Рассмотрим несколько примеров решения задач на растворимость из реальных ЕГЭ по химии.
10. Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 400 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора сульфата железа(III). К раствору во второй колбе добавили 300 г раствора азотной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из второй колбы, оказался в 2 раза больше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю нитрата натрия в конечном растворе во второй колбе.
Первый этап.
Определяем массу карбоната натрия, который растворится в 400 мл воды:
На 100 г воды приходится 31,8 г соли (по условию)
на 400 г воды будет приходиться х г соли (в реальном растворе)
Определяем х из пропорции:
х = 400 г · 31,8 г/100 г = 127,2 г нитрата натрия.
n(Na2CO3) = m(Na2CO3)/M = 127,2 г/106 г/моль = 1,2 моль
Массовая доля карбоната натрия в этом растворе:
ω(Na2CO3) = m(Na2CO3)/mр-ра = 127,2 г/(127,2 г + 400 г) = 0,2413 или 24,13%
Далее раствор карбоната натрия разделили на две порции. Как решать задачи с порциями (частями)? Очень просто. Во всем исходном растворе и в порциях (частях), которые мы отделили от основного раствора, кое-что не меняется. Давайте порассуждаем, что именно.
Меняется ли масса раствора? Без сомнения, мы же разделяем раствор на части.
Меняется ли масса растворенного вещества? Также без сомнения — часть вещества попадет в одну порцию, часть в другую.
А меняется ли массовая доля растворенного вещества? Или соотношение массы растворенного вещества и воды, или другое соотношение? Конечно, не изменяется, ведь раствор — это гомогенная система, в которой вещество распределено равномерно.
Второй этап.
В первой колбе протекает реакция:
3Na2CO3 + Fe2(SO4)3 + 3H2O = 2Fe(OH)3 + 3CO2 + 3Na2SO4
Это типичный пример реакции необратимого гидролиза.
Во второй колбе протекает реакция:
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O
Пусть в первой колбе выделилось х моль углекислого газа. Количество вещества газов соотносится также, как объемы газов. Поэтому можно сказать, что во второй колбе выделится 2х моль углекислого газа.
Получается, что в первой колбе в реакцию вступает х моль карбоната натрия, а во второй колбе 2х моль карбоната натрия. Общее количество вещества карбоната натрия известно, получаем уравнение:
х + 2х = 1,2
Отсюда х = 0,4 моль.
Во второй колбе количество и масса карбоната натрия:
n2(Na2CO3) = 2х = 0,8 моль
m2(Na2CO3) = n2(Na2CO3)·M = 0,8 моль·106 г/моль = 84,8 г
Масса раствора карбоната во второй колбе (массовая доля соли в исходном растворе и в двух колбах не изменяется):
mр-ра,2(Na2CO3) = m2(Na2CO3)/ω = 84,8 г / 0,2413 = 351,47 г
Масса углекислого газа, который выделился во второй реакции:
m2(CO2) = n2(CO2)·M(СО2) = 0,8 моль·44 г/моль = 35,2 г
Масса нитрата натрия во второй колбе:
m2(NaNO3) = n2(NaNO3)·M(NaNO3) = 1,6 моль·85 г/моль = 136 г
Масса конечного раствора во второй колбе:
mр-ра,2 = mр-ра,2(Na2CO3) + mр-ра(HNO3) — m(CO2) = 351,47 г + 300 г — 35,2 г = 616,27 г
Массовая доля нитрата натрия в конечно растворе во второй колбе:
ω2(NaNO3) = m2(NaNO3)/mр-ра,2 = 136 г/616,27 г = 0,2207 или 22,07%
Ответ: ω(NaNO3) = 22,07%
11. Растворимость безводного сульфида натрия при некоторой температуре составляет 15,6 г на 100 г воды. При этой температуре приготовили 289 г насыщенного раствора сульфида натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида алюминия. К раствору во второй колбе добавили 100 г соляной кислоты, также взятой в избытке. При этом объём газа, выделившийся из второй колбы, оказался в 1,5 раза больше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю хлорида натрия в конечном растворе во второй колбе.
3Na2S + 2AlCl3 + 6H2O = 2Al(OH)3 + 3H2S + 6NaCl
Na2S + 2HCl = 2NaCl + H2S
Ответ: ω(NaCl) = 13,336%
12. Растворимость безводного хлорида алюминия при некоторой температуре составляет 53,4 г на 100 г воды. При этой температуре приготовили 306,8 г насыщенного раствора хлорида алюминия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора карбоната калия. К раствору во второй колбе добавили 300 г раствора аммиака, также взятого в избытке. При этом, масса осадка, выпавшего во второй колбе, оказалась в 3 раза больше массы осадка, выпавшего в первой колбе. Определите массовую долю хлорида аммония в конечном растворе во второй колбе.
2AlCl3 + 3K2CO3 + 3H2O = 2Al(OH)3 + 3CO2 + 6KCl
AlCl3 + 3NH3∙H2O = Al(OH)3 + 3NH4Cl
Ответ: ω(NH4Cl) = 19,9255%
13. Растворимость безводного карбоната аммония при некоторой температуре составляет 96 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната аммония к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток твёрдого гидроксида натрия и нагрели. К раствору во второй колбе добавили 250 г соляной кислоты, также взятой в избытке. При этом объём газа, выделившийся из второй колбы, оказался в 3 раза меньше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю соли в конечном растворе во второй колбе.
(NH4)2CO3 + 2NaOH = 2NH3 + 2H2O + Na2CO3
(NH4)2CO3 + 2HCl = 2NH4Cl + CO2 + H2O
Ответ: ω(NH4Cl) = 26,62%
14. Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. Насыщенный раствор, приготовленный при этой температуре добавлением необходимого количества карбоната натрия к 200 мл воды, разделили на две части. К первой части прилили избыток соляной кислоты. При этом выделилось 4,48 л (н.у.) газа. Ко второй части насыщенного раствора добавили 222 г 25%-ного раствора хлорида кальция. Определите массовую долю хлорида кальция в полученном растворе.
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
Na2CO3 + CaCl2 = CaCO3 + 2NaCl
Ответ: ω(CaCl2) = 3,1%
15. Растворимость безводного сульфата железа(II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили 326 г насыщенного раствора сульфата железа(II). Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида бария. При этом образовалось 46,6 г осадка. К раствору во второй колбе добавили 50 г 34%-ного раствора аммиака. Определите массовую долю аммиака в конечном растворе во второй колбе.
FeSO4 + BaCl2 = BaSO4 + FeCl2
FeSO4 + 2NH3∙H2O = Fe(OH)2 + (NH4)2SO4
Ответ: ω(NH3) = 3,11%
16. Растворимость безводного сульфата алюминия при некоторой температуре составляет 34,2 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата алюминия к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора аммиака. При этом образовалось 15,6 г осадка. К раствору во второй колбе добавили 320 г 25%-ного раствора гидроксида натрия. Определите массовую долю сульфата натрия в конечном растворе во второй колбе.
Al2(SO4)3 + 6NH3∙H2O = 2Al(OH)3 + 3(NH4)2SO4
Al2(SO4)3 + 8NaOH = 2Na[Al(OH)4] + 3Na2SO4
Ответ: ω(Na2SO4) = 14,48%
17. Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. Приготовленный при этой температуре насыщенный раствор карбоната натрия массой 395,4 г разделили на две части. К первой части прилили избыток раствора нитрата кальция. При этом образовалось 50 г осадка. Ко второй части насыщенного раствора добавили 252 г 30%-ного раствора азотной кислоты. Определите массовую долю азотной кислоты в образовавшемся растворе.
Na2CO3 + Ca(NO3)2 = CaCO3 + 2NaNO3
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O
Ответ: ω(HNO3) = 6,14%
18. Растворимость безводного сульфата железа(II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата железа(II) к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора гидроксида натрия. При этом образовалось 18 г осадка. К раствору во второй колбе добавили 870 г 15%-ного раствора нитрата бария. Определите массовую долю нитрата бария в конечном растворе во второй колбе.
FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
FeSO4 + Ba(NO3)2 = BaSO4 + Fe(NO3)2
Ответ: ω(Ba(NO3)2) = 5,24%
19. Растворимость безводного сульфида натрия при некоторой температуре составляет 15,6 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфида натрия к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора соляной кислоты. При этом выделилось 4,48 л (н.у.) газа. К раствору во второй колбе добавили 450 г 15%-ного раствора хлорида меди(II). Определите массовую долю хлорида меди(II) в конечном растворе во второй колбе.
Na2S + 2HCl = H2S + 2NaCl
Na2S + CuCl2 = CuS + 2NaCl
Ответ: ω(CuCl2) = 4,54%
21. Растворимость безводного хлорида кальция при некоторой температуре составляет 55,5 г на 100 г воды. Насыщенный раствор, приготовленный при этой температуре добавлением необходимого количества хлорида кальция к 160 мл воды, разлили на две колбы. В первую колбу добавили избыток раствора карбоната натрия. При этом выпал осадок массой 30 г. Во вторую колбу добавили 595 г 40%-ного раствора нитрата серебра. Определите массовую долю нитрата серебра в растворе, образовавшемся во второй колбе.
CaCl2 + Na2CO3 = CaCO3 + 2NaCl
CaCl2 + 2AgNO3 = 2AgCl + Ca(NO3)2
Ответ: ω(AgNO3) = 11,2%
22. Растворимость безводного гидрокарбоната натрия при некоторой температуре составляет 12,6 г на 100 г воды. При этой температуре приготовили 450,4 г насыщенного раствора гидрокарбоната натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора гидроксида бария. При этом образовалось 39,4 г осадка. К раствору во второй колбе добавили 245 г 20%-ного раствора серной кислоты. При этом образовалась средняя соль. Определите массовую долю серной кислоты в конечном растворе во второй колбе.
NaHCO3 + Ba(OH)2 = BaCO3 + NaOH + H2O
2NaHCO3 + H2SO4 = Na2SO4 + 2CO2 + 2H2O
Ответ: ω(H2SO4) = 5,57%
23. Растворимость хлорида алюминия при некоторой температуре составляет 53,4 г на 100 г воды. Приготовленный при этой температуре насыщенный раствор хлорида алюминия массой 767 г разлили по двум колбам. В первую колбу добавили избыток раствора нитрата серебра, при этом выпало 344,4 г осадка. Во вторую колбу добавили 960 г 40%-ного раствора гидроксида натрия. Вычислите массовую долю хлорида натрия в растворе, образовавшемся во второй колбе.
AlCl3 + 3AgNO3 = 3AgCl + Al(NO3)3
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
Ответ: ω(NaCl) = 14,83%
24. Растворимость безводного сульфата железа(II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата железа(II) к 400 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора аммиака. При этом образовалось 27 г осадка. К раствору во второй колбе добавили 780 г 20%-ного раствора хлорида бария. Определите массовую долю хлорида бария в конечном растворе во второй колбе.
FeSO4 + 2NH3∙H2O = Fe(OH)2 + (NH4)2SO4
FeSO4 + BaCl2 = BaSO4 + FeCl2
Ответ: ω(BaCl2) = 5,255%
25. Растворимость безводного хлорида кальция при некоторой температуре составляет 55,5 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество хлорида кальция к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора нитрата серебра. При этом образовалось 143,5 г осадка. К раствору во второй колбе добавили 1272 г 10%-ного раствора карбоната натрия. Определите массовую долю карбоната натрия в конечном растворе во второй колбе.
CaCl2 + 2AgNO3 = 2AgCl + Ca(NO3)2
CaCl2 + Na2CO3 = CaCO3 + 2NaCl
Ответ: ω(Na2CO3) = 1,43%
26. Растворимость безводного сульфита натрия при некоторой температуре составляет 25,2 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфита натрия к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток концентрированной азотной кислоты. При этом выделился бурый газ. К раствору во второй колбе добавили 300 г раствора соляной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из второй колбы, оказался равен объёму газа, выделившемуся из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю хлорида натрия в конечном растворе во второй колбе.
Na2SO3 + 2HNO3 = Na2SO4 + 2NO2 + H2O
Na2SO3 + 2HCl = 2NaCl + SO2 + H2O
Ответ: ω(NaCl) = 8,92%
27. Растворимость безводного сульфита натрия при некоторой температуре составляет 25,2 г на 100 г воды. При этой температуре приготовили 250,4 г насыщенного раствора сульфита натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора сульфата алюминия. К раствору во второй колбе добавили 200 г разбавленного раствора серной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из второй колбы, оказался в 3 раза меньше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю соли в конечном растворе во второй колбе. (Учитывать образование только средних солей).
3Na2SO3 + Al2(SO4)3 + 3H2O = 3SO2 + 2Al(OH)3 + 3Na2SO4
Na2SO3 + H2SO4 = Na2SO4 + SO2 + H2O
Ответ: ω(Na2SO4) = 5,54%
Растворимость. Произведение растворимости
Растворение
вещества в заданном количестве
растворителя происходит до состояния
насыщения.
Насыщенный раствор
–
раствор, находящийся в динамическом
равновесии с растворяющимся веществом.
Молярная концентрация растворенного
вещества в насыщенном растворе называется
растворимостью
этого вещества при данной температуре
Р(х) = См(х).
При растворении электролита, например,
соли, в раствор переходят не молекулы,
а ионы. В этом случае в насыщенном
растворе равновесие устанавливается
между солью в кристаллическом состоянии
и ионами, перешедшими в раствор:
СаСО3(кр)
=
Ca2++
СО32-.
Константа равновесия
этого процесса:
Крав.
=
[Ca2+]
•
[СО32-]/
[СаСО3(кр)]
Концентрация
СаСО3(кр)
является величиной постоянной, тогда
Крав.
• [СаСО3(кр)]
=
[Ca2+]
•
[СО32-]
=
ПР или ПР
=
(P(x))2.
ПР – называется
произведением растворимости
труднорастворимого электролита (ТРЭ).
При постоянной
температуре в насыщенном растворе
электролита произведение концентраций
ионов с учетом стехиометрических
коэффициентов в уравнении диссоциации
есть величина постоянная при. Значения
ПР для известных ТРЭ помещены в справочник.
Для
ТРЭ типа А2В3
=
2А+3
+
3В2-
выражение для произведения растворимости
имеет вид:
ПР
=
[Аа+]2
•
[Вв-]3
=
[2Р(х)]2
•
[3Р(х)]3
= 108
Р(х)5.
Исходя из значений
ПР можно количественно оценить условия
образования и растворения осадков,
рассчитать растворимость Р(х) и молярную
концентрацию ионов электролита в его
насыщенном растворе (см. таблицу ниже).
При увеличении
концентрации одного из ионов ТРЭ в его
насыщенном растворе (например, путем
введения хорошо растворимого электролита,
содержащего тот же ион) произведение
концентраций ионов электролита (ПК)
становится больше ПР. При этом равновесие
между твердой фазой и раствором смещается
в сторону образования осадка.
Условием
образования осадка является превышение
произведения концентраций ионов
малорастворимого
электролита
над его произведением растворимости,
т.е.
ПК
> ПР.
Например,
если в насыщенный раствор AgCI
добавить сильный
электролит KCI,
то
появление в растворе одноименного иона
(CI–)
приводит к смещению равновесия в сторону
образования
осадка (←).
Когда устанавится
новое равновесие, при котором произведение
концентраций ионов электролита вновь
становится равным ПР, то в растворе
появится осадок,
концентрация ионов Ag+
будет меньше, а концентрация ионов CI–
– больше, чем было до добавления KCI.
AgCI↓
<=> AgCI <=> Ag+
+ CI–
Осадок нас.р-р
раствор
Напротив, если в
насыщенном растворе электролита
уменьшить концентрацию одного из ионов
(например, связав его каким-либо другим
ионом), произведение концентраций ионов
будет меньше значения ПР, раствор станет
ненасыщенным, а равновесие между жидкой
фазой и осадком сместится в сторону
растворения осадка (→).
Условием
растворения
осадка малорастворимого электролита
является недонасыщение раствора, т.е
при условии, когда произведение
концентраций его ионов меньше значения
ПР
т.е.
ПК
< ПР.
Пример
1.
Растворимость Аg3РО4
в воде при
20°C равна
0.0065 г/л.
Рассчитайте значение ПР (Аg3РО4).
Решение.
Растворимость Аg3РО4
или молярная концентрация соли в
насыщенном
растворе, равна:
т
(Аg3РО4)
0.0065
Р
(Аg3РО4)
= ——————————— = ——————
=
l,6
•l0-5
моль/л
М
(Аg3РО4)
• V(z)
418,58 • 1
Диссоциации
фосфата серебра идет по уравнению:
Аg3РО4
=
3Ag+
+
РО43–.
Видно,
что из
1
моля соли образуется
3
моля ионов
Ag+
и
1
моль ионов
Р043–,
поэтому [Р043–]
=
P(x), a [Ag+]
=
3Р(х).
Отсюда находим ПР:
ПР
=
[Ag+]3
•
[РО43–]
=
(3Р)3
•
Р
= (4,8 •10-5)
3
•l,6•10–5
=
1,77
•10–18.
Пример
2.
Произведение растворимости йодида
свинца при 20°С равно
8•10–9.
Вычислить
растворимость соли (в моль/л и в г/л) при
указанной
температуре.
Решение.
Обозначим искомую растворимость через
Р
(моль/л). Тогда в насыщенном растворе
РbI2
содержится
Р
моль/л ионов Рb2+
и
2Р
моль/ л ионов
I–.Отсюда
ПР(РbI2)
=
[Рb2+]
[I–]2
= Р(2Р)2
=
4 Р3
и
Р
= (
ПР(РbI2)/4
)1/3
=
(
8
•
10-9/
4)1/3
= 1,3
10-3
моль/л.
Молярная
масса РbI2
равна
461
г/моль, поэтому растворимость РbI2,
выраженная в г/л, составит 1,3
10-3
моль/ л • 461 г/ моль = 0,6
г/л.
Пример
3.
Во сколько раз растворимость оксалата
кальция СаС2О4
в
0,1
М
растворе оксалата аммония
(NH4)2С2О4
меньше, чем в воде? Диссоциацию оксалата
аммония на ионы считать полной.
Решение.
Вычислим сначала растворимость оксалата
кальция в воде. Обозначив концентрацию
соли в насыщенном растворе через
Р
(моль/ л), можем записать:
ПР(СаС2О4)
=
[Са2+]
[С2О42-]
= Р2
.
Отсюда,
используя значение ПР(СаС2О4)=
2 10-9,
Р
=
(ПР(СаС2О4)1/2
=
( 2
10-9
)1/2
=
4,5 •
10-5
моль/л.
Теперь
найдем растворимость той же соли в
0,1
М раствора (NH4)2С2О4;
обозначим ее через
Р‘.
Концентрация ионов Са2+
в насыщенном растворе тоже будет равна
Р’,
а концентрация ионов С2О42-составит
(0,1 + Р’).
Поскольку
Р‘<<0,1,
то
величиной
Р’
по сравнению с
0,1М
можно пренебречь и считать, что [С2О42-]
= 0,1
моль/л. Тогда можно записать:
ПР(СаС2О4)
= 2
•10-9
= Р’
•
0,1
и
Р’
= 2 •
10-9/
0,1
=
2 •
10-8
моль/л.
Таким
образом, в присутствии (NH4)2С2О4
растворимость СаС2О4
уменьшилась в
4,5•10-5
/
(2•10-8)
раз,т. е. приблизительно в
2200
раз.
Пример
4.
Смешаны равные объемы
0,01
М. растворов хлорида кальция и сульфата
натрия. Образуется ли осадок сульфата
кальция?
Решение.
Найдем произведение концентраций ионов
Са2+
и
SO42-
и сравним его с произведением растворимости
сульфата кальция. Исходные молярные
концентрации растворов
CaCl2
и
Na2S04
одинаковы и равны
0,01
моль/л. Поскольку при смешении исходных
растворов общий объем раствора вдвое
возрастет, то концентрации ионов [Са2+]
и
[SО42-]
вдвое уменьшатся по сравнению с исходными.
Таким
образом, [Са2+]
=
[SО42-]
=
0,005 = 5 •
10–3
моль/л.
Находим
произведение концентраций ионов ПК
= [Са2+]
[SО42-]
=
(5 •
10–3)2
= 2,5 •
10–5.
ПР(CaSO4)
=
1,3•10–4.
Найденное значение произведения
концентрации ионов меньше этой величины;
следовательно, раствор
будет
ненасыщенным относительно сульфата
кальция, и осадок не образуется.
Для решения
задач на ПР , ПК, растворимость можно
воспользоваться таблицей, приведенной
ниже.
|
Параметры го раствора |
Тип электролита |
|||
|
АВ |
А2В |
А3В |
А2В32А+3В |
|
|
См (эл-та), моль/л |
Р |
Р |
Р |
Р |
|
См (А), моль/л |
Р |
2 Р |
3 Р |
2 Р |
|
См (В), моль/л |
Р |
Р |
Р |
3 Р |
|
Масса эл-та, г/л |
М(АВ) Р |
М(А2В) |
М(А3В) |
М(А2В3) |
|
Масса (А)эл-та, |
М(А) Р |
2М(А) Р |
3М(А) Р |
2М(А) Р |
|
Масса (В), г/л |
М(В) Р |
М(В) Р |
М(В) Р |
3М(В) Р |
|
ПР электролита |
Из справочника |
Из справочника |
Из справочника |
Из справочника |
|
ПР электролита |
Р2 |
4Р3 |
27Р4 |
108Р5 |
|
Р |
(ПР)1/2 |
(ПР/4)1/3 |
(ПР/27)1/4 |
(ПР/108)1/5 |
ЗАДАЧИ
-
Вычислить
произведение растворимости РbВr2
при 25°С,
если
растворимость соли при этой температуре
равна 1,32
•
10-2
моль/л. -
В
500
мл воды при 18°С растворяется
0,0166
г
Ag2CrО4
.Чему
равно произведение растворимости этой
соли? -
Для
растворения
1,16
г РbI2
потребовалось
2
л воды. Найти
произведение
растворимости соли. -
Исходя
из произведения растворимости карбоната
кальция,
найти
массу СаСО3,
которая содержится в
100
мл его насыщенного
раствора. -
Вычислить
объем воды, необходимый для растворения
при
25°С
1
г
BaSО4. -
Рассчитайте
молярную концентрацию ионов свинца
(Pb2+)
в
насыщенном
растворе иодида свинца. ПР
(PbJ2)
= 10-8. -
Рассчитайте
ПР соли
NiC2O4,
если в
100
мл насыщенного раствора этой соли
содержится
0,001174
г ионов никеля. -
Для
растворения
0,72
г карбоната кальция потребовалось
15
л
воды.
Вычислите ПР карбоната кальция, считая,
что объем раствора равен
объему
растворителя. -
Рассчитайте,
в каком объеме насыщенного раствора
хлорида
свинца
(II)
содержится
0,1
г ионов свинца, ПР
(PbCl2)
= l,6•10-5. -
Рассчитайте
массу кальция в виде ионов Са+2
которая находится
в
500
мл насыщенного раствора сульфата
кальция, ПР (СаSО4)
= 1,3 •
10-4. -
Рассчитайте
массу кальция в виде ионов Са+2
которая находится
в
500
мл насыщенного раствора сульфата
кальция, ПР (СаSО4)
= 1,3 •
10-4. -
Сколько
литров воды потребуется для растворения
0,1
г хлорида
серебра
для получения насыщенного раствора,
ПР
(AgCl) = 1
•
10–10
. -
Выпадет
ли осадок сульфата кальция, если к
200
мл
0,002
молярного раствора хлорида кальция
добавить
2000
мл
0,00001
молярного
раствора
сульфата калия, ПР(СаSО4)
=
10–4. -
14.
Рассчитайте, в каком объеме насыщенного
раствора содержится
0.1
г иодида серебра,
ПP(AgI)=8,3•10-17. -
15.В
насыщенном растворе хромата серебра
молярная концентрация
иона
СrО-2
равна
0.0001
моль/л. Рассчитайте ПР хромата серебра
и молярную концентрацию иона серебра
в этом растворе.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #