
Как решать задачи по химии? Как проводить простейшие расчеты по уравнениям химических реакций? Сколько выделяется газа, образуется воды, выпадает осадка или сколько получается конечного продукта реакций? Сейчас мы постараемся разобрать все нюансы и ответить на эти вопросы, которые очень часто возникают при изучении химии.
Решение задач в химии является неотъемлемой частью в изучении этой сложной, но очень интересной науки.
Алгоритм решения задач по химии
- Прочитать условия задачи (если они есть). Да, об этом все знают — как же решить задачу без условий — но все же, для полноты инструкции, мы не могли не указать этот пункт.
- Записать данные задачи. На этом пункте мы не будем заострять внимание, так как требования различных учебных заведений, учителей и преподавателей могут значительно отличаться.
- Записать уравнение реакции. Теперь начинается самое интересное! Здесь нужно быть внимательным! Обязательно необходимо верно расставить коэффициенты перед формулами веществ. Если вы забудете это сделать, то все наши усилия буду напрасны.
- Провести соответствующие расчеты по химическому уравнению. Далее рассмотрим, как же сделать эти самые расчеты.
Для этого у нас есть два пути, как решить задачу по химии. Условно, назовем их правильным (используя понятия количества вещества) и неправильным (используя пропорции). Конечно же, мы бы рекомендовали решать задачи правильным путем. Так как у неправильного пути имеется очень много противников. Как правило, учителя считают, что ученики, решающие задачи через пропорции, не понимают самой сути протекания процессов химических реакций и решают задачи просто математически.
Расчет по уравнениям химических реакций с использованием понятия количества вещества
Суть данного метода, состоит в том, что вещества реагируют друг с другом в строгом соотношении. И уравнение реакции, которое мы записали ранее, дает нам это соотношение. Коэффициенты перед формулами веществ дают нам нужные данные для расчетов.
Для примера, запишем простую реакцию нейтрализации серной кислоты и гидроксида натрия.
H_{2}SO_{4} + NaOH → Na_{2}SO_{4} + H_{2}O
Расставим коэффициенты:
H_{2}SO_{4} + 2NaOH → Na_{2}SO_{4} + 2H_{2}O
Исходя из этого уравнения, мы видим, что одна молекула серной кислоты взаимодействует с двумя молекулами гидроксида натрия. И в результате этой реакции получается одна молекула сульфата натрия и две молекулы воды.
Сейчас мы немного отступим от разбора задач, чтобы познакомиться с основными понятиями, которые пригодятся нам в решении задач по химии.
Рассчитывать количество молекул, например в 98 граммах серной кислоты — это не самое удобное занятие. Числа будут получаться огромными ( ≈ 6,022140857⋅1023 молекул в 98 граммах серной кислоты) . Для этого в химии ввели понятие количества вещества (моль) и молярная масса.
1 Моль (единица измерения количества вещества) — это такое количество атомов, молекул или каких либо еще структурных единиц, которое содержится в 12 граммах изотопа углерода-12. Позднее выяснилось, что в 12 граммах вещества углерод-12 содержится 6,022140857⋅1023 атомов. Соответственно, можно сказать, что 1 моль, это такая масса вещества, в которой содержится 6,022140857⋅1023 атомов (или молекул) этого вещества.
Но ведь молекулы и атомы имеют различный состав и различное строение. Разные атомы содержат разное количество протонов и нейтронов. Соответственно 1 моль для разных веществ будет иметь разную массу, имея при это одинаковое количество молекул ( атомов). Эта масса называется молярной.
Молярная масса — это масса 1 моля вещества.
Используя данные понятия, можно сказать, что 1 моль серной кислоты реагирует с 2 молями гидроксида натрия, и в результате получается 1 моль сульфата натрия и 2 моль воды. Давайте запишем эти данные под уравнением реакции для наглядности.
begin{matrix}H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль end{matrix}
Следом запишем молярные массы для этих веществ
begin{matrix} H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г end{matrix}
Теперь, зная массу одного из веществ, мы можем рассчитать, сколько нам необходимо второго вещества для полного протекания реакции, и сколько образуется конечных продуктов.
Для примера, решим по этому же уравнению несколько задач.
Задача. Сколько грамм гидроксида натрия (NaOH) необходимо для того, чтобы 49 грамм серной кислоты (H2SO4) прореагировало полностью?
Итак, наши действия: записываем уравнение химической реакции, расставляем коэффициенты. Для наглядности, запишем данные задачи над уравнением реакции. Неизвестную величину примем за Х. Под уравнением записываем молярные массы, и количество молей веществ, согласно уравнению реакции:
begin{matrix}49 : г & & X : г & & & & \ H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г end{matrix}
Записывать данные под каждым веществом — не обязательно. Достаточно это будет сделать для интересующих нас веществ, из условия задачи. Запись выше дана для примера.
Примерно так должны выглядеть данные, записанные по условиям задачи. Не претендуем на единственно правильное оформление, требования у всех разные. Но так, как нам кажется, смотрится все довольно наглядно и информативно.
Первое наше действие — пересчитываем массу известного вещества в моли. Для этого разделим известную массу вещества (49 грамм) на молярную массу:
4998=0,5 моль серной кислоты
Как уже упоминалось ранее, по уравнению реакции 1 моль серной кислоты реагирует с 2 моль гидроксида натрия. Соответственно с 0,5 моль серной кислоты прореагирует 1 моль гидроксида натрия.
n(NaOH)=0.5*2=1 моль гидроксида натрия
Найдем массу гидроксида натрия, умножив количество вещества на молярную массу:
1 моль * 40 г/моль = 40 грамм гидроксида натрия.
Ответ: 40 грамм NaOH
Как видите, в решении задачи по уравнению реакции нет ничего сложного. Задача решается в 2-3 действия, с которыми справятся ученики начальных классов. Вам необходимо всего лишь запомнить несколько понятий.
Решение задач по химии через пропорцию
Ну и расскажем про второй способ вычислений по уравнениям химических реакций — вычисления через пропорцию. Этот способ может показаться немного легче, так как в некоторых случаях можно пропустить стадию перевода массы вещества в его количество. Чтобы было более понятно, объясню на том же примере.
Так же, как и в прошлом примере, запишем уравнение реакции, расставим коэффициенты и запишем над уравнением и под уравнением известные данные.
Для этого способа, нам так же понадобится записать под уравнением реакции, следом за молярной массой, массу вещества, соответствующую его количеству по уравнению. Если проще, то просто перемножить две строки под уравнением реакции, количество моль и молярную массу. Должно получиться так:
begin{matrix}49 : г & & X : г & & & & \ H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г \ 98 : г & & 80 : г & & 142 : г & & 36 : г end{matrix}
А теперь внимание, начинается магия! Нас интересует строка данных над уравнением, и самая нижняя строка под уравнением. Составим из этих данных пропорцию.
frac{49}{98} = frac{X}{80}
Далее находим неизвестное значение Х из пропорции и радуемся полученному значению:
Х=49*80/98=40 грамм
Как видим, получается тот же результат. Прежде всего, при решении задач в химии, главное все же — понимание химических процессов. Тогда решение задачи не станет для вас проблемой!
РАСЧЕТЫ ПО ХИМИЧЕСКИМ УРАВНЕНИЯМ, или Как вычислить массу вещества (или объем газа) по известному количеству вещества одного из вступающих в реакцию или образующихся в результате нее веществ
Расчеты по химическим уравнениям являются одними из самых широко используемых в химии.
Это самый простой тип расчетных задач, в основе которых лежит химическое уравнение.
Содержание
Особенности задач с расчетами по химическим уравнениям
Основной алгоритм расчетов с использованием химических уравнений
Расчеты по химическим уравнениям: примеры
Особенности задач с расчетами по химическим уравнениям
В задачах с расчетами по химическим уравнениям речь идет о каком-либо химическом превращении (например, разложении) одного какого-то вещества или химическом взаимодействии двух или нескольких веществ. Причем:
- Масса или объем одного из них известны. Требуется найти массу или объем продукта реакции – вещества (или одного из веществ), образующегося в результате взаимодействия.
- Либо, наоборот, известны масса или объем образовавшегося вещества, требуется найти массу или объем исходного вещества.
- Либо известны масса или объем одного из реагентов, необходимо вычислить массу или объем второго реагента.
Прежде, чем приступить к вычислениям, важно составить уравнение реакции взаимодействия и правильно расставить коэффициенты.
Необходимо помнить, что коэффициенты, стоящие перед формулами веществ в уравнении реакции, показывают, в каких эквивалентных (достаточных, необходимых, пропорциональных) количествах реагируют вещества. Эти количества называют «количествами вещества по уравнению реакции» и записывают под формулами соответствующих веществ в уравнении.
Те количества вещества, которые находят, используя данные задачи, называют «количествами вещества по условию задачи» и в уравнение не записывают.
В ходе решения сравнивают «количества вещества по уравнению реакции» для того, чтобы узнать, в каком соотношении находятся вещества, о которых идет речь в задаче. Используя данные об этом соотношении, определяют «количества вещества по условию задачи». А затем, применяя основную расчетную формулу, вычисляют искомые массу или объем вещества.
Основной алгоритм расчетов с использованием химических уравнений
Основные шаги, которые необходимо сделать при решении задач с использованием химических уравнений, можно отобразить в виде схемы:


Расчеты по химическим уравнениям: примеры
Приведем несколько примеров с расчетами по химическим уравнениям.
Пример 1. В избытке воды растворили 11,5 г металлического натрия. Какой объем водорода выделился при этом?
- Так как в задаче говорится о химическом процессе: натрий реагирует с водой, — то запишем уравнение реакции.
- Над формулами веществ в уравнении реакции расставим данные условия задачи.
- Под формулами веществ в уравнении реакции расставим количества вещества (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярную массу натрия (смотрим по таблице Менделеева) и молярный объем для водорода (так как требуется найти объем этого газа, а не массу).
- В условии говорится, что натрий реагирует с избытком воды. Это означает только то, что её будет достаточно для взаимодействия с металлом.

Пример 2. Кальций массой 2 г прореагировал с кислородом. Какая масса кислорода вступила в реакцию?
- Так как в задаче говорится о химическом процессе: кальций реагирует с кислородом, — то запишем уравнение реакции.
- Над формулами веществ в уравнении реакции расставим данные условия задачи.
- Под формулами веществ в уравнении реакции расставим количества вещества (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярные массы (смотрим и считаем по таблице Менделеева).

Пример 3. Смесь, состоящую из 3 г магния и 3,9 г цинка, сплавили с серой, которая находилась в избытке. Рассчитайте массу полученной смеси сульфидов металлов.
- В составе смеси два металла: магний и цинк. Однако каждый из них прореагирует с серой самостоятельно. Поэтому запишем два уравнения реакции и решим фактически две задачи в одной.
- Над формулами веществ в уравнениях реакций расставим данные условия задачи.
- Под формулами веществ в уравнениях реакций расставим количества веществ (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярные массы (смотрим и считаем по таблице Менделеева).
- Поскольку требуется найти массу смеси образовавшихся сульфидов, то рассчитаем массу каждого из них из соответствующего уравнения. Укажем это в уравнениях над формулами сульфидов.
- Избыток серы говорит только о том, что ее будет достаточно для полного реагирования как магния, так и цинка.

Итак, при расчетах по химическим уравнениям важно правильно записать уравнение реакции и расставить коэффициенты.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.

Комментарии преподавателя
Соотношение количеств веществ, участвующих в реакции
Коэффициенты в уравнении реакции показывают не только число молекул каждого вещества, но и соотношение количеств веществ, участвующих в реакции. Так, по уравнению реакции: 2H2 + O2 = 2H2O – можно утверждать, что для образования определенного количества воды (например, 2 моль) необходимо столько же моль простого вещества водорода (2 моль) и в два раза меньше моль простого вещества кислорода (1 моль). Приведем примеры подобных расчетов.
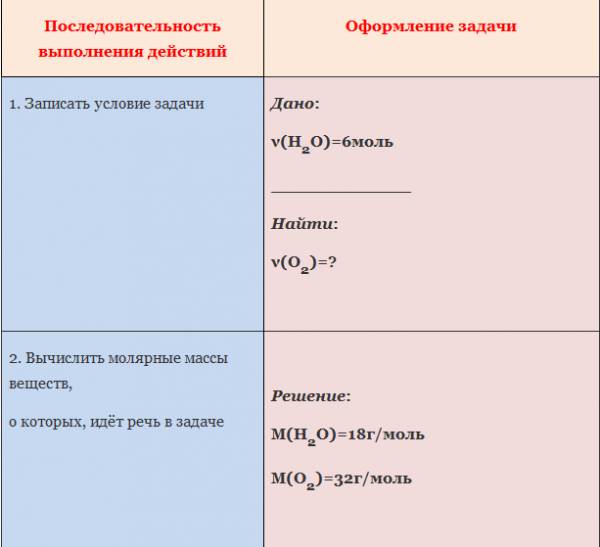
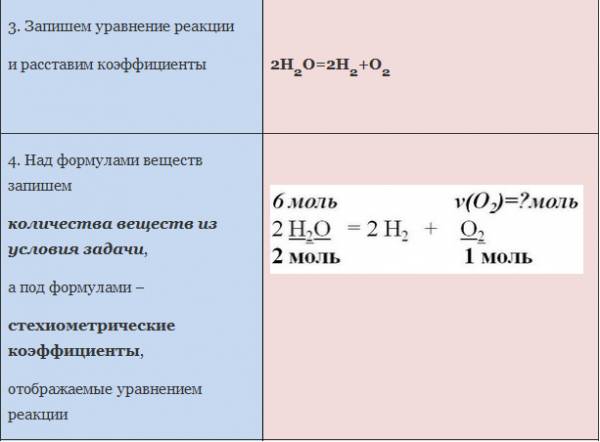
ЗАДАЧА 1. Определим количество вещества кислорода, образующегося в результате разложения 4 моль воды.
АЛГОРИТМ решения задачи:
1. Составить уравнение реакции
2. Составить пропорцию, определив количества веществ по уравнению реакции и по условию задачи (обозначить неизвестное количество вещества за х моль).
3. Составить уравнение (из пропорции).
4. Решить уравнение, найти х.

Рис. 1. Оформление краткого условия и решения задачи 1
ЗАДАЧА 2. Какое количество кислорода потребуется для полного сжигания 3 моль меди?
Воспользуемся алгоритмом решения задач с использованием уравнения химической реакции.

Рис. 2. Оформление краткого условия и решения задачи 2.
I. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите количество вещества оксида алюминия, образовавшегося в результате взаимодействия алюминия количеством вещества 0,27 моль с достаточным количеством кислорода (4Al +3O2=2Al2O3).
2. Вычислите количество вещества оксида натрия, образовавшегося в результате взаимодействия натрия количеством вещества 2,3 моль с достаточным количеством кислорода (4Na+O2=2Na2O).
Алгоритм №1
Вычисление количества вещества по известному количеству вещества, участвующего в реакции.
Пример. Вычислите количество вещества кислорода, выделившегося в результате разложения воды количеством вещества 6 моль.

II. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите массу серы, необходимую для получения оксида серы (IV) количеством вещества 4 моль (S+O2=SO2).
2. Вычислите массу лития, необходимого для получения хлорида лития количеством вещества 0,6 моль (2Li+Cl2=2LiCl).
Внимательно изучите алгоритм и запишите в тетрадь
Алгоритм №2
Вычисление массы вещества по известному количеству другого вещества, участвующего в реакции.
Пример: Вычислите массу алюминия, необходимого для получения оксида алюминия количеством вещества 8 моль.
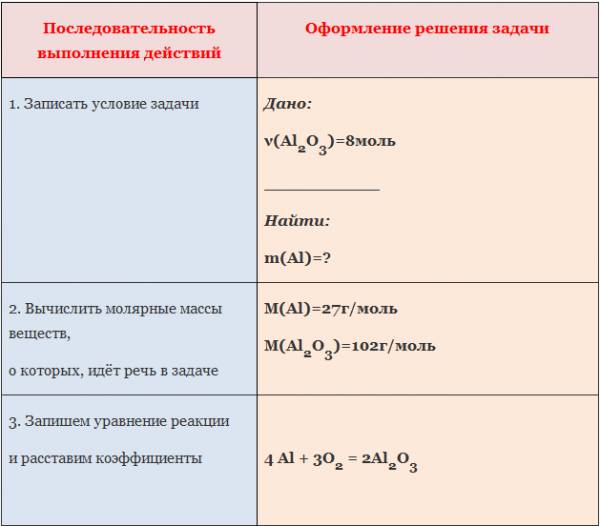


III. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите количество вещества сульфида натрия, если в реакцию с натрием вступает сера массой 12,8 г (2Na+S=Na2S).
2. Вычислите количество вещества образующейся меди, если в реакцию с водородом вступает оксид меди (II) массой 64 г (CuO + H2 = Cu + H2O).
Внимательно изучите алгоритм и запишите в тетрадь
Алгоритм №3
Вычисление количества вещества по известной массе другого вещества, участвующего в реакции.
Пример. Вычислите количество вещества оксида меди (I), если в реакцию с кислородом вступает медь массой 19,2г.
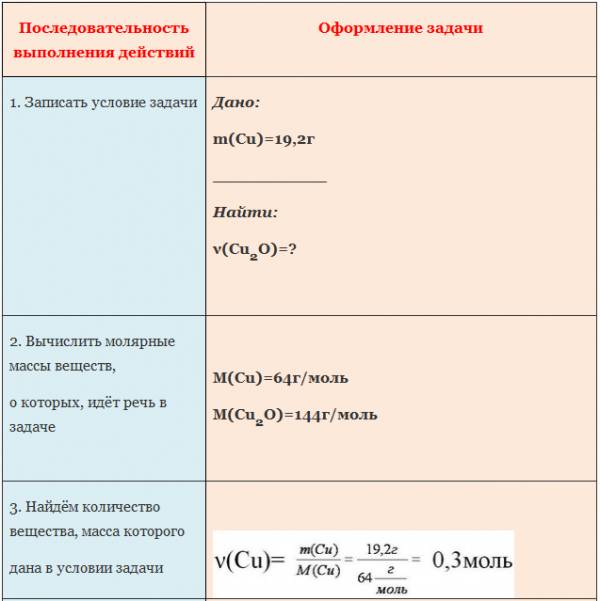
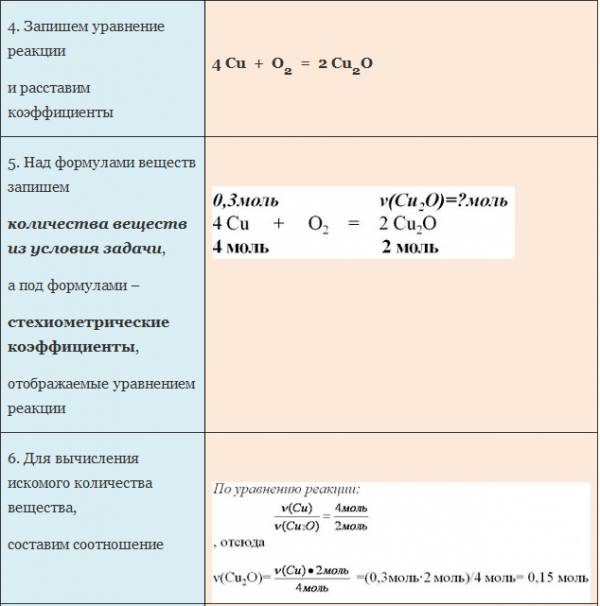
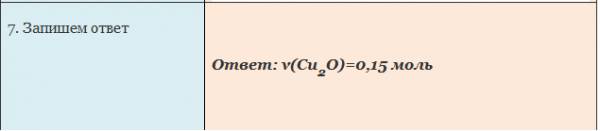
Внимательно изучите алгоритм и запишите в тетрадь
IV. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите массу кислорода, необходимую для реакции с железом массой 112 г
(3Fe + 4O2=Fe3O4).
Алгоритм №4
Вычисление массы вещества по известной массе другого вещества, участвующего в реакции
Пример. Вычислите массу кислорода, необходимую для сгорания фосфора, массой 0,31г.
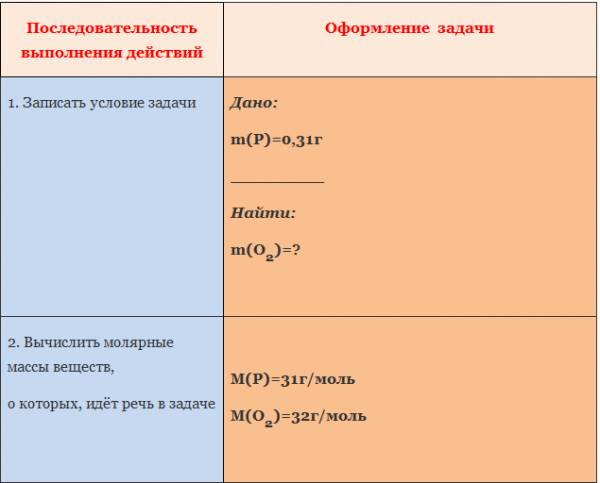
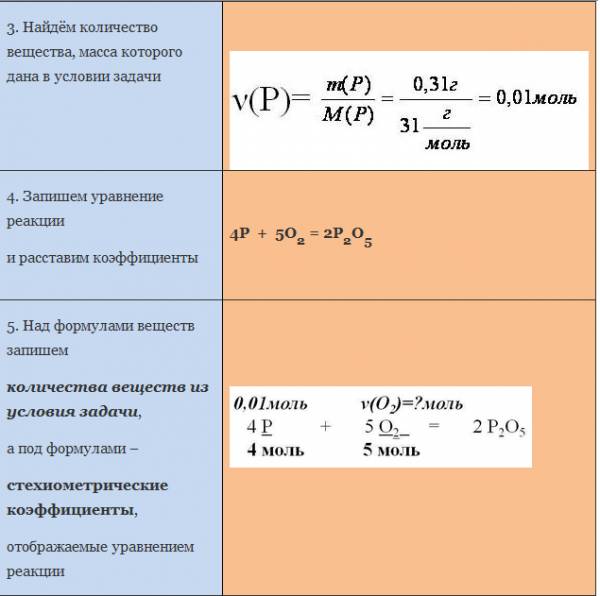
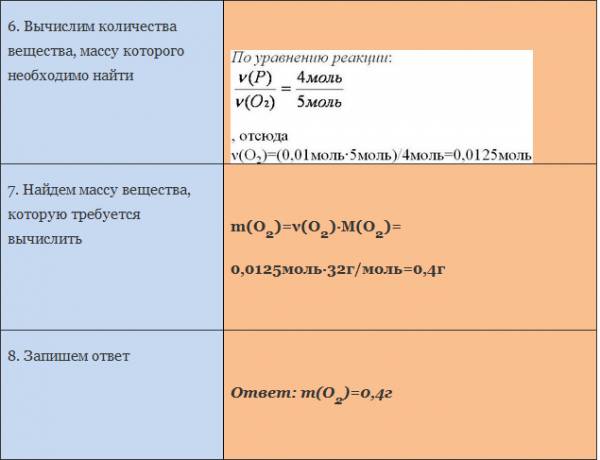
*******************************
Мольные соотношения участников реакции
Рассмотрим уравнение реакции образования воды из простых веществ:
2H2 + O2 = 2H2O
Можно сказать, что из двух молекул водорода и одной молекулы кислорода образуется две молекулы воды. С другой стороны, эта же запись говорит о том, что для образования каждых двух молей воды нужно взять два моля водорода один моль кислорода.
Мольное соотношение участников реакции помогает производить важные для химического синтеза расчеты. Рассмотрим примеры таких расчетов.
ЗАДАЧА 1. Определим массу воды, образовавшуюся в результате сгорания водорода в 3,2 г кислорода.
Чтобы решить эту задачу, сначала необходимо составить уравнение химической реакции и записать над ним данные условия задачи.
Если бы мы знали количество вещества вступившего в реакцию кислорода, то смогли бы определить количество вещества воды. А затем, рассчитали бы массу воды, зная ее количество вещества и молярную массу. Чтобы найти количество вещества кислорода, нужно массу кислорода разделить на его молярную массу.
Молярная масса численно равна относительной молекулярной массе. Для кислорода это значение составляет 32. Подставим в формулу: количество вещества кислорода равно отношению 3,2 г к 32 г/моль. Получилось 0,1 моль.
Для нахождения количества вещества воды оставим пропорцию, используя мольное соотношение участников реакции:
на 0,1 моль кислорода приходится неизвестное количество вещества воды, а на 1 моль кислорода приходится 2 моля воды.
Отсюда количество вещества воды равно 0,2 моль.
Чтобы определить массу воды, нужно найденное значение количества воды умножить на ее молярную массу, т.е. умножаем 0,2 моль на 18 г/моль, получаем 3,6 г воды.
Рис. 1. Оформление записи краткого условия и решения Задачи 1
Помимо массы, можно рассчитывать объем газообразного участника реакции (при н.у.), используя известную вам формулу, в соответствие с которой объем газа при н.у. равен произведению количества вещества газа на молярный объем. Рассмотрим пример решения задачи.
ЗАДАЧА 2. Рассчитаем объем кислорода (при н.у.), выделившийся при разложении 27г воды.
Запишем уравнение реакции и данные условия задачи. Чтобы найти объем выделившегося кислорода, нужно найти сначала количество вещества воды через массу, затем по уравнению реакции определить количество вещества кислорода, после чего можно рассчитать его объем при н.у.
Количество вещества воды равно отношению массы воды к ее молярной массе. Получаем значение 1,5 моль.
Составим пропорцию: из 1,5 моля воды образуется неизвестное количество кислорода, из 2 молей воды образуется 1 моль кислорода. Отсюда количество кислорода равно 0,75 моля. Рассчитаем объем кислорода при н.у. Он равен произведению количества кислорода на молярный объем. Молярный объем любого газообразного вещества при н.у. равен 22,4 л/моль. Подставив числовые значения в формулу, получим объем кислорода, равный 16,8 л.
Рис. 2. Оформление записи краткого условия и решения Задачи 2
Зная алгоритм решения подобных задач, можно рассчитать массу, объем или количество вещества одного из участников реакции по массе, объему или количеству вещества другого участника реакции.
ИСТОЧНИКИ
исчтоник конспекта – http://interneturok.ru/ru/school/chemistry/8-klass/bvewestva-i-ih-prevraweniyab/raschety-massy-veschestva-po-uravneniyu-himicheskoy-reaktsii
источник видео – http://www.youtube.com/watch?v=wZbj-o5J5Vs
источник видео – http://www.youtube.com/watch?v=8sPwPk7a7p0
источник видео – http://www.youtube.com/watch?v=ygaarSGQDwE
источник видео – http://www.youtube.com/watch?v=Gv-jZX0wZxE
http://himiknoginsk.ucoz.ru/index/raschety_po_khimicheskim_uravnenijam/0-144
ЕГЭ по химии 2018 был сложным, уровень задач вплотную приблизился к конкурсным заданиям 90-х в столичных медицинских ВУЗах, 20% выпускников не преодолели даже минимальный порог. Но… “нам не стpашен ни вал девятый, ни холод вечной меpзлоты!” Мы поставили цель – стать врачами, и мы добьемся этой цели, не смотря на все трудности! В конце статьи я обязательно раскрою секрет установки на успех. А пока – грызем гранит знаний.
Сегодня мы поучимся выполнять один из самых важных шагов практической химии – расчеты по уравнениям реакций. Этим занимается Стехиометрия – раздел химии, который изучает количественные соотношения между веществами, вступившими в реакцию и образовавшимися в ходе нее.
Как же родилась Стехиометрия? Алхимики начали обозначать химические элементы символами. Позже для записи веществ стали использовать химические формулы. В 1615 г. Жан Бегун, автор первого учебника химии “Начала Химии” предложил использовать химические уравнения. В конце XVIII в. философ И. Кант произнес знаменитые слова: «В каждой естественной науке заключено столько истины, сколько в ней математики». Эти слова произвели огромное впечатление на ученика Канта – немецкого химика И.В. Рихтера, который доказал наличие математической зависимости в химических реакциях. В 1793 г. Рихтер опубликовал работу «Начала стехиометрии, или способ измерения химических элементов». Кстати, первые количественные уравнения химических реакций и термин “стехиометрия” ввел именно Рихтер.
В 1803 г. английский химик Джон Дальтон по результатам экспериментов сформулировал закон простых кратных отношений, который лег в основу расчетов по уравнениям химических реакций
“Если два элемента образуют друг с другом несколько химических соединений, то весовые количества одного элемента, приходящиеся в этих соединениях на одно и то же весовое количество другого элемента, относятся между собой как небольшие целые числа”
Современная формулировка: “Количества веществ реагентов и продуктов относятся друг к другу как коэффициенты в уравнении химической реакции”
Обобщим основные Критерии Расчетов по уравнениям реакций:
1) Расчеты по уравнениям реакций проводят на основании закона простых кратных отношений
2) Основная расчетная величина – количество вещества (моль). НЕЛЬЗЯ использовать для расчетов значения масс!
3) Если участники процесса – исключительно газы, можно проводить расчеты в любых объемных единицах на основании закона объемных отношений Гей-Люссака
Решим несложные задачи, используя Четыре Заповеди и основные Критерии Расчетов. Каждое действие обводится зеленым овалом.
Задача 1
Вычислите массу лития, вступившего в реакцию с 64 г кислорода.
1) Первая Заповедь. Выписать данные задачи в разделе “Дано”.
2) Вторая Заповедь. Написать уравнение реакции.
Небольшой экскурс в теорию химии. Литий – металл I(A)-группы (щелочные металлы). Все щелочные металлы реагируют с кислородом уже при комнатной температуре, в связи с чем их хранят под слоем керосина. Запомните: с образованием оксида, с киcлородом реагирует только литий, остальные щелочные металлы при аналогичных условиях образуют пероксиды Ме2О2 и надпероксиды МеО2. Пишем несложное уравнение реакций и расставляем коэффициенты.
3. Третья Заповедь. Сделать предварительные расчеты по данным условия задачи
В условии задачи представлены данные только по кислороду. Составляем досье, в котором обязательно должны быть представлены три величины – масса (или объем), молярная масса, количество вещества (моль).
4. Четвертая заповедь. Составить алгоритм решения задачи.
Формулизируем вопрос задачи “Вычислите массу лития”, т.е. записываем формулу расчета массы, которая для нас, как для химиков, должна быть представлена произведением количества вещества на молярную массу. Анализируем компоненты формулы: молярную массу лития определяем по таблице Менделеева, количество вещества лития рассчитываем по уравнению реакции.
Расчеты по уравнению реакции выполняем на основании закона кратных отношений по схеме: точку расчета (количество вещества кислорода) делим на коэффициент при этом веществе, умножаем на коэффициент при искомом веществе и получаем результат. Выписывать отдельно пропорцию для расчетов не обязательно. Это – Легкие Расчеты по уравнениям реакций, которые не противоречат закону кратных отношений, но значительно упрощают решение задач по химии.
Задача 2
Сколько граммов оксида магния получится при разложении 252 г карбоната магния МgСО3?
Немного теории. Все нерастворимые карбонаты, а также карбонаты лития и аммония, разлагаются при нагревании: карбонаты металлов разлагаются до оксида металла и углекислого газа, карбонат аммония при разложении образует аммиак, углекислый газ и воду.
Последовательность действия, выполняемых при решении задачи:
1) Выписать данные в разделе “Дано”
2) Написать уравнение реакции
3) Сделать предварительные расчеты
4) Составить алгоритм решения
5) Выполнить анализ и расчеты по главной формуле алгоритма
Задача 3
Сколько меди можно получить из 160 г ее оксида при восстановлении водородом?
Немного теории. Железо и остальные металлы правее него в ряду активности металлов можно восстановить водородом из их оксидов.
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Cr→Zn→Fe→Cd→Co→Ni→Sn→Pb→(H)→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
Последовательность действия, выполняемых при решении задачи:
1) Выписать данные в разделе “Дано”
2) Написать уравнение реакции
3) Сделать предварительные расчеты
4) Составить алгоритм решения
5) Выполнить анализ и расчеты по главной формуле алгоритма
Секретная установка на успех
Утром, встав с постели, повторяем три раза, четко произнося каждое слово: “Я обязательно сдам ЕГЭ по химии на 95+, если буду заниматься: системно, добросовестно, ежедневно!” Этот прием работает на 100%! Проверено моими учениками.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии http://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7(903) 186-74-55. Приходите ко мне на курс, на Мастер-классы “Решение задач по химии” – и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте, или на Facebook. Я обязательно отвечу вам.
Репетитор по химии и биологии кбн В.Богунова
ХИМИЯ: Алгоритмы решения типовых задач
Алгоритмы решения типовых задач по химии: последовательность выполнения действий, запись условий задачи обозначениями, оформление решения задачи, запись уравнений реакции, вычисления и ответ. Представлены алгоритмы решения 9-ти типовых задач.
Алгоритм № 1.
Вычисление массы вещества по известной массе другого вещества, участвующего в реакции.
ЗАДАЧА: Вычислите массу кислорода, выделившегося в результате разложения порции воды массой 9 грамм.
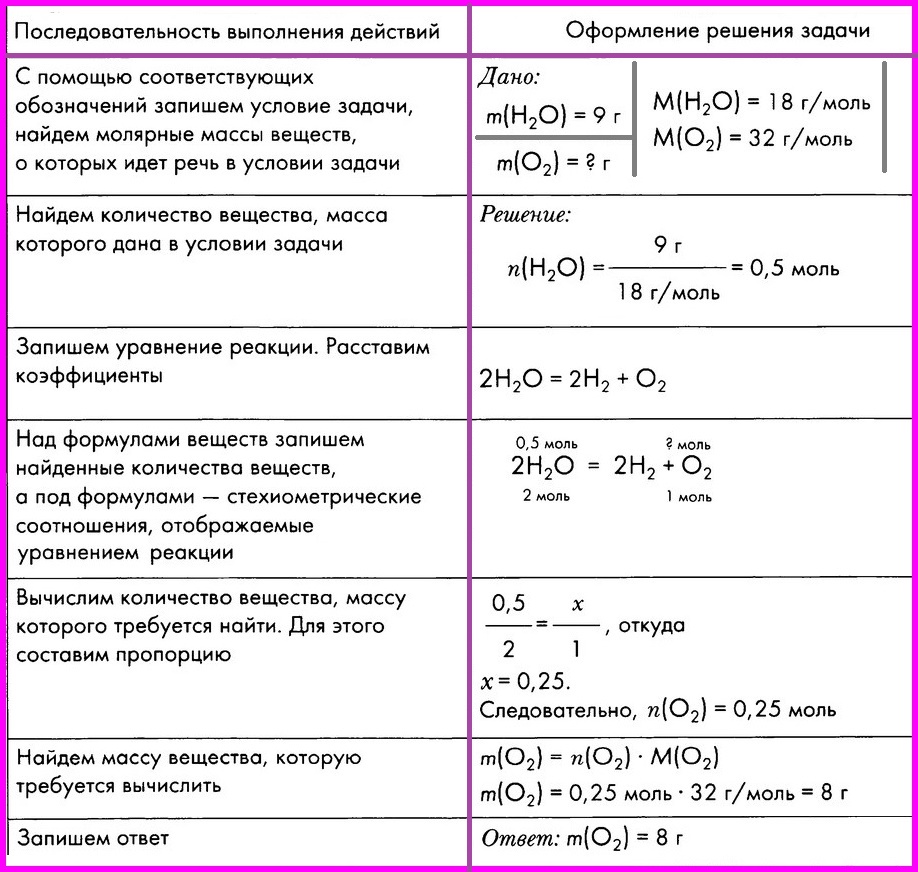
Алгоритм № 2.
Вычисление объема вещества по известной массе другого вещества, участвующего в реакции.
ЗАДАЧА: Вычислите объем кислорода (н.у.), выделившегося в результате разложения
порции воды массой 9 г.

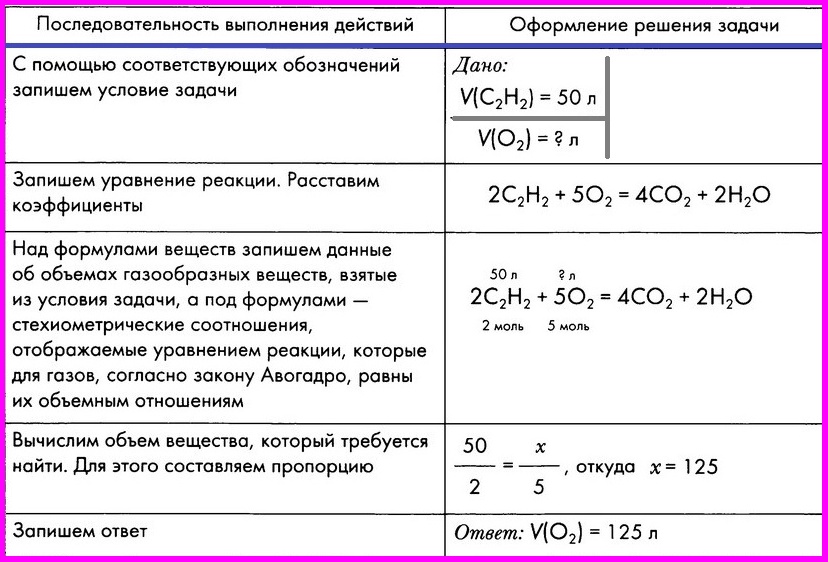
Алгоритм № 3.
Расчет по химическому уравнению объемных отношений газов
ЗАДАЧА: Вычислите объем кислорода, необходимого для сжигания порции ацетилена объемом 50 л.
Алгоритм № 4.
Вычисление относительной плотности газа по другому газу
ЗАДАЧА: Вычислите плотность кислорода а) по водороду; 6) по воздуху.

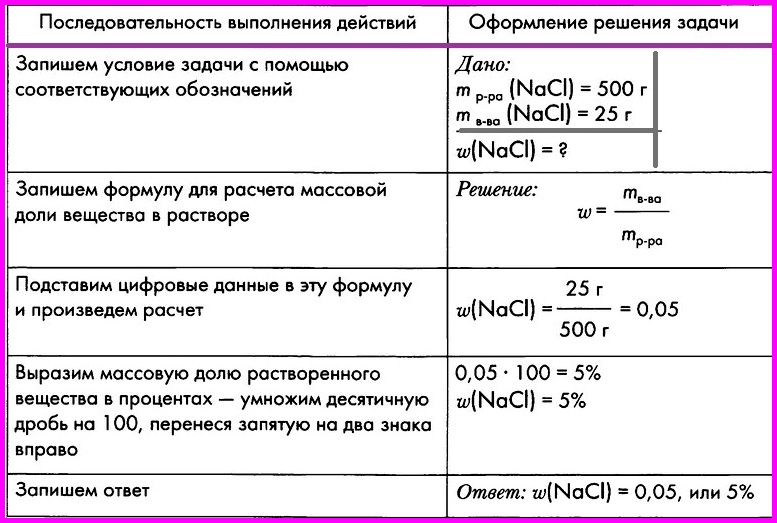
Алгоритм № 5.
Вычисление массовой доли вещества в растворе
ЗАДАЧА: При выпаривании раствора массой 500 г образовалось 25 г кристаллической соли — хлорида натрия. Вычислите массовую долю соли в исходном растворе.
Алгоритм № 6.
Вычисление массы вещества в растворе по массе раствора и массовой доле растворенного вещества.
ЗАДАЧА: Вычислите массу гидроксида натрия, необходимого для приготовления 400 г 20%-ного раствора гидроксида натрия.

Алгоритм № 7.
Расчеты по термохимическим уравнениям. Вычисление количества теплоты по известной массе вещества.
ЗАДАЧА: По термохимическому уравнению 2Сu + O2 = 2СuO + 310 кДж вычислите количество теплоты, выделившейся в результате окисления порции меди массой 16 г.

Алгоритм № 8.
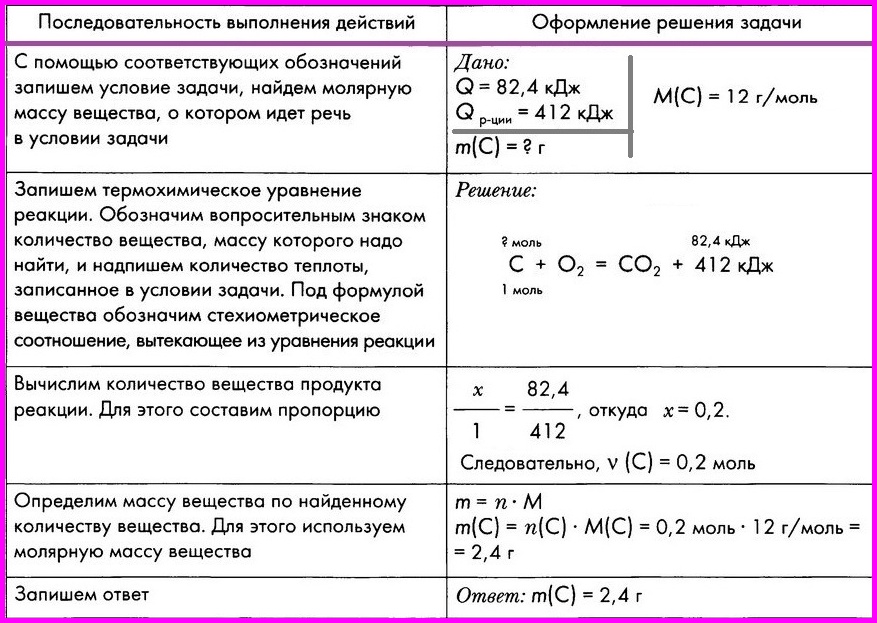
Расчеты по термохимическим уравнениям. Вычисление массы вещества по известному количеству теплоты.
ЗАДАЧА: По термохимическому уравнению С + O2 = СO2 + 412 кДж вычислите массу сгоревшего угля, если количество теплоты, выделившееся в результате реакции, составляет 82,4 кДж.
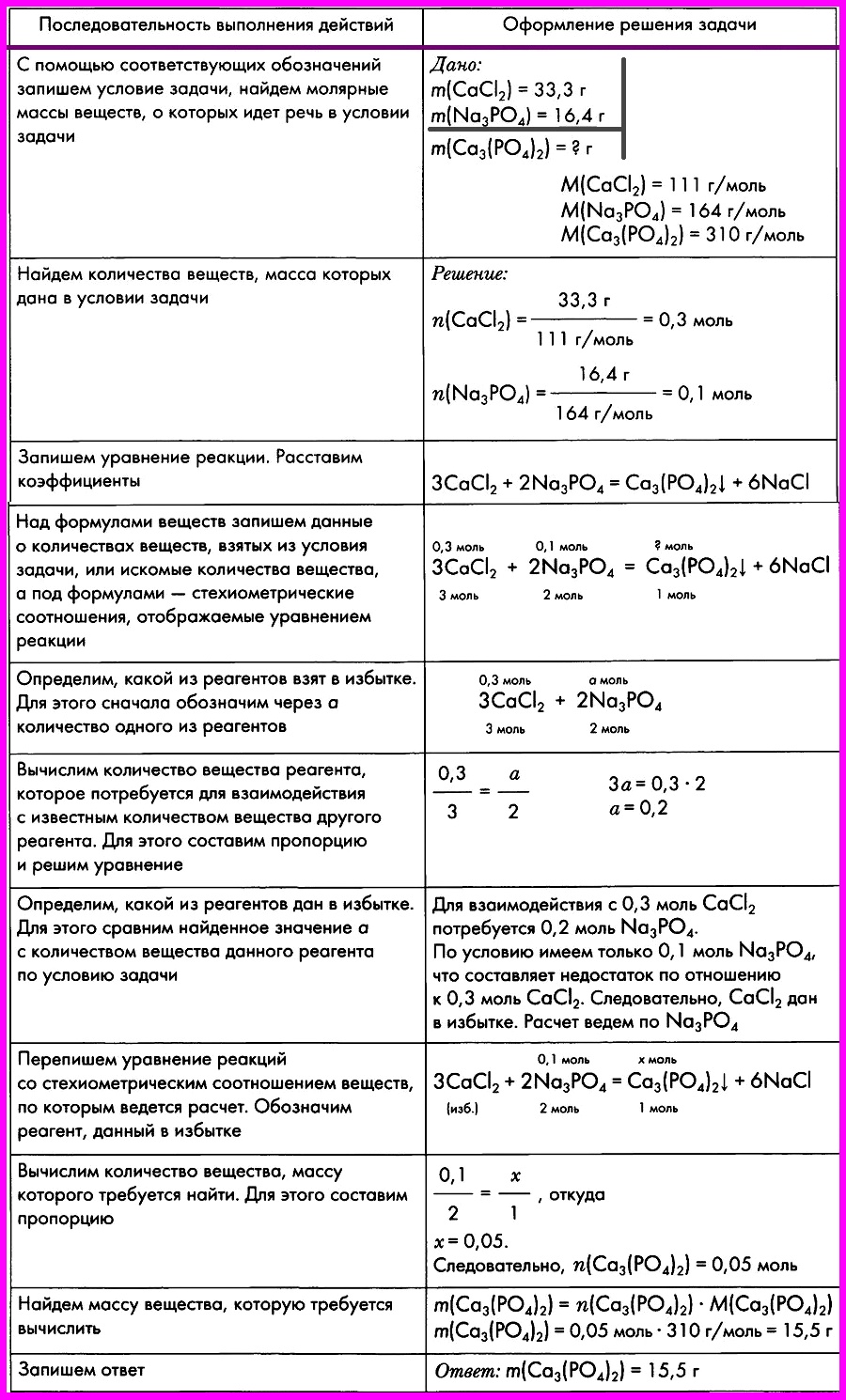
Алгоритм № 9.
Расчеты по химическим уравнениям, если одно из реагирующих веществ дано в избытке.
ЗАДАЧА: Смешали два раствора, один из которых содержал 33,3 г хлорида кальция, а другой — 16,4 г фосфата натрия. Вычислите массу образовавшегося фосфата кальция.
Вы смотрели Справочник по химии «Алгоритмы решения типовых задач». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии


